基于甘蔗糖蜜的黑曲霉产β-Ffase酶的单因素条件研究
2023-06-09雷光鸿樊红日李莉娇
雷光鸿,樊红日,李 元,陈 亮,李莉娇,尹 丽*
(1广西工业职业技术学院轻工化工学院,广西南宁 530003;2广西大学轻工与食品工程学院,广西南宁 530004)
0 引言
低聚果糖(FOS)合成过程中的关键酶是β-呋喃果糖苷酶(β-Ffase),葡萄糖和果糖分子的同时存在,调控好该过程中主要的底物分子蔗糖的浓度,将有助于酶将其聚合生成低聚果糖,在提高转化效率的情况下,促进了产物FOS的产生[1]。目前有关微生物催化生产低聚果糖的相关报道较少,Shin等[2]在研究利用蔗糖生产低聚果糖之后,评估3种不同的金黄色葡萄球菌菌株使用糖蜜作为蔗糖等效物生产低聚果糖的能力,并且在55℃和pH 5.5条件下培育24 h后实现了FOS的生产,但是FOS的产率低。黑曲霉具有良好的特性,本文研究了黑曲霉菌株的不同发酵条件(糖蜜添加量、氮源、孢子接种量、温度和pH等单因素条件)对黑曲霉菌株产β-Ffase酶酶活和菌丝体浓度(DCW)的影响,得到利用糖蜜产β-Ffase酶的优化条件。
1 材料与方法
1.1 菌株与原料
黑曲霉Aspergillus niger,编号:ATCC 20611,下简称黑曲霉,冻干管保藏菌种,购于美国模式培养物集存库(American Type Culture Collection);甘蔗糖蜜:由广西南宁糖业股份有限公司明阳糖厂提供。
1.2 试验方法
1.2.1 培养基的配制
YM培养基:麦芽糖提取物3.0 g/L,葡萄糖10.0 g/L,酵母提取物3.0 g/L,蛋白胨5.0 g/L,115℃灭菌30 min,作为黑曲霉活化(种子)培养基。
FM培养基:蔗糖20.0 g/L,酵母提取物15.0 g/L,MgSO4·7H2O 0.5 g/L,KCl 0.5 g/L,NaNO32.0 g/L,K2HPO45.0 g/L,用0.1 mol/L HCl调pH至5.5,121℃灭菌20 min,作为黑曲霉发酵产酶培养基。
1.2.2 黑曲霉菌丝体的制备
先将黑曲霉ATCC 20611菌株经YM培养基活化,在通过发酵培养基诱导产酶后,分离出成熟的菌丝体并将其保存在柠檬酸-磷酸氢二钠缓冲液中。
1.2.3 黑曲霉菌丝体酶活的测定
β-Ffase酶活的测定:1 U的β-Ffase定义为1 min酶催化蔗糖反应产生1 μmol的还原糖所需的酶量,参考Dorta等[3]的酶活测定方法并加以修改后具体如下:配制4 mL 25%的蔗糖溶液和6 mL pH 5.0的柠檬酸磷酸氢二钠缓冲液,混合,加入0.04 g黑曲霉菌体后,50℃条件下水浴震荡反应2 h后置于电炉上后加热沸腾10 min使酶失活。加入1 mL上述稀释适当倍数的上清液于25 mL的酶标管中,随后加入2 mL DNS试剂,置于沸水浴中计时2 min后,迅速放置于冰水中冷却,最后在酶标管中加入超纯水至25 mL,于540 nm波长下测定样品对的吸光值。根据制备的DNS标准曲线代入计算出菌丝体酶活。
1.2.4 DCW的测定
使用干重法测定发酵液菌丝体浓度。分别将离心管置于烘箱中烘干至恒重,随后置于干燥器中冷却至室温后称重(X1),黑曲霉发酵过程中每间隔12 h取5 mL发酵液样品于上述已经烘干处理后的离心管中,在7000 r/min的条件下离心10 min,弃上清液,加入10 mL生理盐水振荡混匀,随后同样在7000 r/min的条件下离心10 min后倒掉上清液,重复该步骤1次。随后将带有菌丝体沉淀的离心管置于烘箱烘干至恒重,再称重(X2),每个样品进行3次平行测定后取平均值。
式(1)中,DCW为β-Ffase酶菌丝体浓度,g/L;X2为干燥至恒重后菌丝体和离心管的总质量,g;X1为干燥至恒重后离心管的质量,g;V为发酵液体积,mL。
1.2.5 糖蜜预处理方法
量取500 mL糖蜜于烧杯中,以1∶1将糖蜜与蒸馏水在2 L大烧杯中混合,将2 mmol/L EDTA溶液加入甘蔗糖蜜溶液中,静置12 h,取上清液,在上清液中加入适量的活性炭(1.5% w/v),脱色,12000 r/min离心15 min,取上清液。
1.2.6 黑曲霉发酵产酶条件优化
根据参考文献[3-4]提供的培养条件,预处理后糖蜜添加量10%,氮源酵母粉添加量10 g/L,孢子接种量7.5 %,培养基pH 6.0,发酵温度35℃,200 r/min条件下培养48 h,β-Ffase酶活289.17 U/mL,细胞干重7.95 g/L。在此基础上,将新鲜的黑曲霉孢子接种于糖蜜发酵培养基中,进行培养基的优化,考察不同条件单因素对黑曲霉菌株产β-Ffase酶酶活和DCW的影响。
2 结果与分析
2.1 糖蜜添加量对菌株产β-Ffase的影响
预处理后的糖蜜,极大程度上保留甘蔗糖蜜中蔗糖含量,有效地除去了原糖蜜中胶体灰分等不利于微生物生长产酶的有害成分,另外,糖蜜本身就含有丰富的营养物质,生物素含量也很可观,是很好的发酵原料,可作为黑曲霉菌丝体发酵生长和产酶的发酵原料(廉价碳源替代品)。本研究进一步选取2.5%、5%、10%、15%和20%糖蜜添加量分析β-Ffase酶活和菌丝体DCW,将新鲜的黑曲霉孢子接种于糖蜜发酵培养基中,孢子接种量7.5%,氮源(酵母粉)添加量为10 g/L,培养基pH 6.0,发酵温度35℃,200 r/min条件下培养48 h,考察不同糖蜜添加量对黑曲霉发酵产酶及菌株生长的影响。实验结果由图1所示。

图1 糖蜜添加量对黑曲霉菌株生长和产酶的影响
由图1可知,不同糖蜜添加量对黑曲霉菌株产酶活性和菌丝体干重的影响呈现先上升后下降的趋势。当糖蜜添加量由2.5%增加到15%时,β-Ffase酶活由268.10 U/mL增长到382.01 U/mL;菌丝体DCW由4.68 g/L增长到7.93 g/L,该阶段黑曲霉菌株不断利用糖蜜中的营养成分,生长旺盛的同时持续产酶,糖蜜培养基可有效提高菌株的生长量和产酶效果,而当糖蜜添加量继续增大达到20%时,过多的糖蜜添加对菌丝体生长和产酶情况产生抑制作用,菌丝体酶活和DCW分别下降到338.86 U/mL和7.55 g/L,此后糖蜜量的增加不利于黑曲霉菌株生长和产酶。综合考虑,以15%糖蜜添加量作为发酵培养基中的碳源,更适合黑曲霉菌株的糖蜜发酵生长,用于后续实验。
2.2 温度对菌株产β-Ffase的影响
黑曲霉对发酵温度较敏感,之前有关黑曲霉菌株研究表明[5],黑曲霉菌株适合在25℃之间的环境下发酵生长产酶。当发酵培养温度过高或过低时,菌株代谢活性都会受到影响,从而抑制黑曲霉菌株的生长和酶的合成分泌。因此,为了使得菌株生长旺盛并获得较高的β-Ffase酶活性,需要探究黑曲霉菌株在糖蜜条件下生长的合适温度。实验以20℃、25℃、30℃、35℃和40℃来分析β-Ffase酶活和菌丝体DCW,将新鲜的黑曲霉孢子接种于糖蜜发酵培养基中,糖蜜添加量15%,氮源(酵母粉)添加量为10 g/L,孢子接种量7.5%,培养基pH 6.0,200 r/min条件下培养48 h,考察不同温度对黑曲霉发酵产酶及菌株生长的影响。实验结果如图2所示。
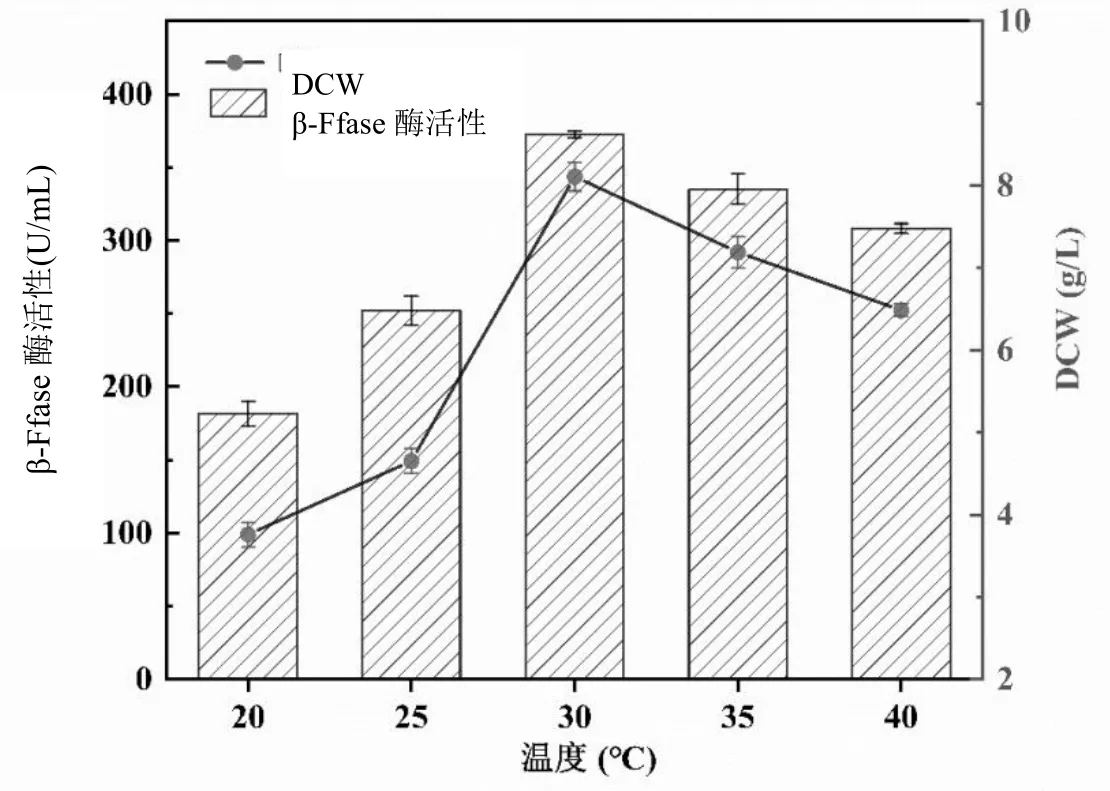
图2 温度对黑曲霉菌株生长和产酶的影响
从图2可知,随着温度的升高,黑曲霉菌丝体的DCW和β-Ffase酶活呈先升高再降低的趋势,由20℃上升到30℃之前,β-Ffase酶活和DCW随着温度的升高而增加,发酵温度为30℃时,黑曲霉菌株产酶活性达到最大,β-Ffase酶活为372.43 U/mL,DCW为8.11 g/L;当温度超过30℃后,黑曲霉菌株的酶活呈现下降趋势,温度升高到35℃时,菌株产酶活力有所下降,β-Ffase酶活降至335.18 U/mL;DCW为7.19 g/L,在40℃时,β-Ffase酶活只有308.15 U/mL,DCW为6.49 g/L。温度过高,酶的产生受到抑制,黑曲霉菌株生物量减少,β-Ffase酶活力降低,影响发酵周期及产酶效率。由此,选定30℃为黑曲霉菌株在糖蜜发酵条件下最适的产酶温度较为合适。
2.3 pH值对菌株产β-Ffase的影响
pH值是影响黑曲霉生长和代谢活性的重要因素之一,且黑曲霉菌株所分泌的果糖基转移酶多为酸性酶(pH 5.0左右),pH值通过影响甘蔗糖蜜培养环境下,菌丝体对有效成分溶解后利用进程,发酵过程中的氧化还原反应和β-Ffase酶活性,对菌丝体生长和酶的积累有较大影响[6]。以pH 4.0、4.5、5.0、5.5、6.0、6.5和7.0分析β-Ffase酶活和菌丝体DCW,将新鲜的黑曲霉孢子接种于糖蜜发酵培养基中,糖蜜添加量15%,氮源(酵母粉)添加量为10 g/L,孢子接种量7.5%,发酵温度30℃,200 r/min条件下培养48 h,考察不同pH值对黑曲霉发酵产酶及菌株生长的影响。实验结果如图3所示。
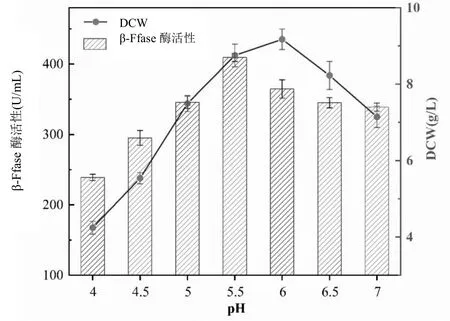
图3 pH对黑曲霉菌株生长和产酶的影响
由图3可见,糖蜜培养基中pH值对黑曲霉菌株生长和产酶有较大影响,在初始pH值由4不断增大的过程中,DCW和β-Ffase酶活呈现增加的趋势;当pH值为5.5时,β-Ffase酶活达到最大值,为409.30 U/mL,此时DCW为8.75 g/L,黑曲霉菌株生长良好,菌丝体适应在此偏酸性环境下繁殖和产酶;而随着pH值继续增加,pH值为6.0时菌株产酶活力有所下降,β-Ffase酶活降至364.60 U/mL,此时DCW为9.17 g/L;当pH值6.5时,β-Ffase酶活降至345.02 U/mL,此时DCW为8.23 g/L。糖蜜培养基环境中的氢离子浓度调节微生物的增殖和酶的合成,在中性至碱性环境下会分散质膜抑制酶活性和膜转运蛋白,抑制黑曲霉菌丝体生长和产酶[7],由此,黑曲霉菌株在糖蜜培养基中最适合的生长产酶pH值为5.5。
2.4 氮源对菌株产β-Ffase的影响
以5、10、15、20和25 g/L酵母粉添加量分析β-Ffase酶活和菌丝体DCW,将新鲜的黑曲霉孢子接种于糖蜜发酵培养基中,糖蜜添加量15%,孢子接种量7.5%,培养基pH 5.5,发酵温度30℃,200 r/min条件下培养48 h,考察酵母粉(氮源)添加量对黑曲霉发酵产酶及菌株生长的影响。实验结果如图4所示。
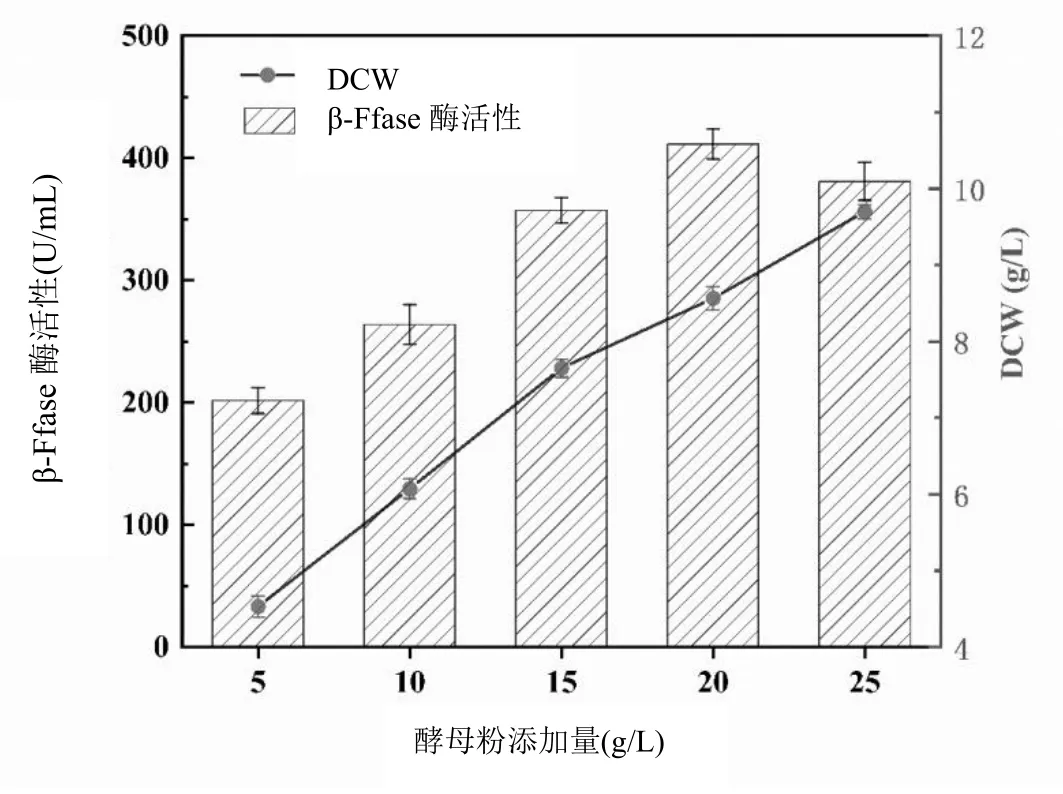
图4 酵母粉添加量对黑曲霉菌株生长和产酶的影响
从图4可知,随着酵母粉添加量增加,菌丝体酶活呈现上升趋势,当酵母粉的添加量为20 g/L时,β-Ffase酶活力最大,达到411.48 U/mL,菌丝体生长良好,DCW达到8.56 g/L。当酵母粉添加量达到25 g/L时,其菌丝体进一步生长,DCW达到9.69 g/L,而此时β-Ffase酶活却下降,为380.99 U/mL,过量的氮和磷可能导致菌株的快速生长但不利于细胞产酶,限制了β-Ffase酶活力[8]。菌丝过度生长,培养基中营养物质多用于其他生命活动而产酶量减少,酶活性开始下降,由此确定最适的酵母粉添加量为20 g/L。
2.5 孢子接种量对菌株产β-Ffase的影响
以2.5%、5%、7.5%、10%、12.5%和15%孢子接种量分析β-Ffase酶活和菌丝体DCW,将新鲜的黑曲霉孢子接种于糖蜜发酵培养基中,糖蜜添加量15%,氮源(酵母粉)添加量为20 g/L,培养基pH 5.5,发酵温度30℃,200 r/min条件下培养48 h,考察不同接种量对黑曲霉发酵产酶及菌株生长的影响。实验结果如图5所示。
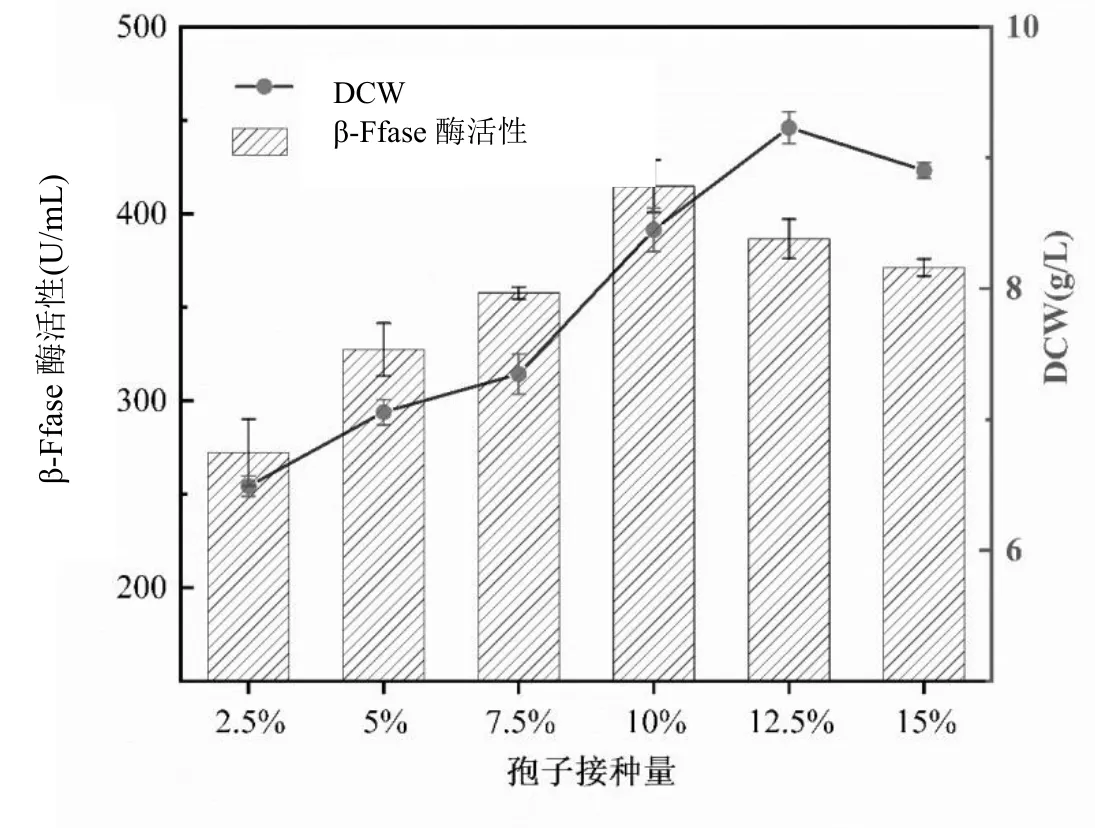
图5 孢子接种量对黑曲霉菌株生长产酶的影响
由图5可见当孢子接种量由2.5%增长到10%时,黑曲霉菌株的β-Ffase酶活和DCW均呈现上升趋势,该阶段菌丝体生物量处于增长时期,且黑曲霉菌株生物量过少而不能有效的利用糖蜜发酵液中的营养成分,使得发酵周期滞后,不利于菌株分泌β-Ffase酶,从而影响了黑曲霉发酵甘蔗糖蜜的效率和产酶效果,因此需进一步增大接种量,黑曲霉菌株在短时间内快速繁殖且产酶活性良好的效果[9]。
当孢子接种量达到10% 时,β-Ffase酶活达到最高为414.82 U/mL,菌丝体DCW达到8.45 g/L。此后,接种量继续增加时,β-Ffase酶活性出现下降趋势,菌丝体却在进一步生长。当接种量为12.5%时,β-Ffase酶活为386.67 U/mL,DCW达到9.23 g/L;因为孢子接种量过大,黑曲霉菌丝体迅速生长繁殖,糖蜜发酵液粘度增大而溶氧量不够,不利于黑曲霉菌株分泌β-Ffase,菌株产酶受抑制;当接种量为15%时,菌株已过量生长,糖蜜中的营养物质大量消耗,菌丝体生长受限,β-Ffase酶活降至371.27 U/mL,DCW为8.91 g/L;这与前人研究黑曲霉的生长和产酶曲线随着时间的推移,菌丝体的生长和产酶效率所呈现先增加而后减少的趋势相一致[6]。因此,选取10%接种量作为黑曲霉产酶的最适孢子接种量,更利于黑曲霉菌株在糖蜜条件下生长和产酶。
3 讨论与结论
实验结果表明,黑曲霉菌株产β-Ffase酶的优化发酵条件为:采用预处理的甘蔗糖蜜,添加量为15%、有机氮源酵母粉20 g/L、pH 5.5、孢子接种量10%、温度30℃;进一步加入0.3%表面活性剂吐温-80,促进β-Ffase酶活性的表达;在优化条件下连续培养黑曲霉,菌株生长和产酶情况如图6所示,菌株在此条件下生长良好。培养48 h后,与文献[3-4]提供的培养基条件相比较,β-Ffase酶活达到463.87 U/mL,提高了1.6倍,菌丝体DCW为11.77 g/L,提高了1.48倍,提高菌株产酶活性和促进菌株生长的效果。
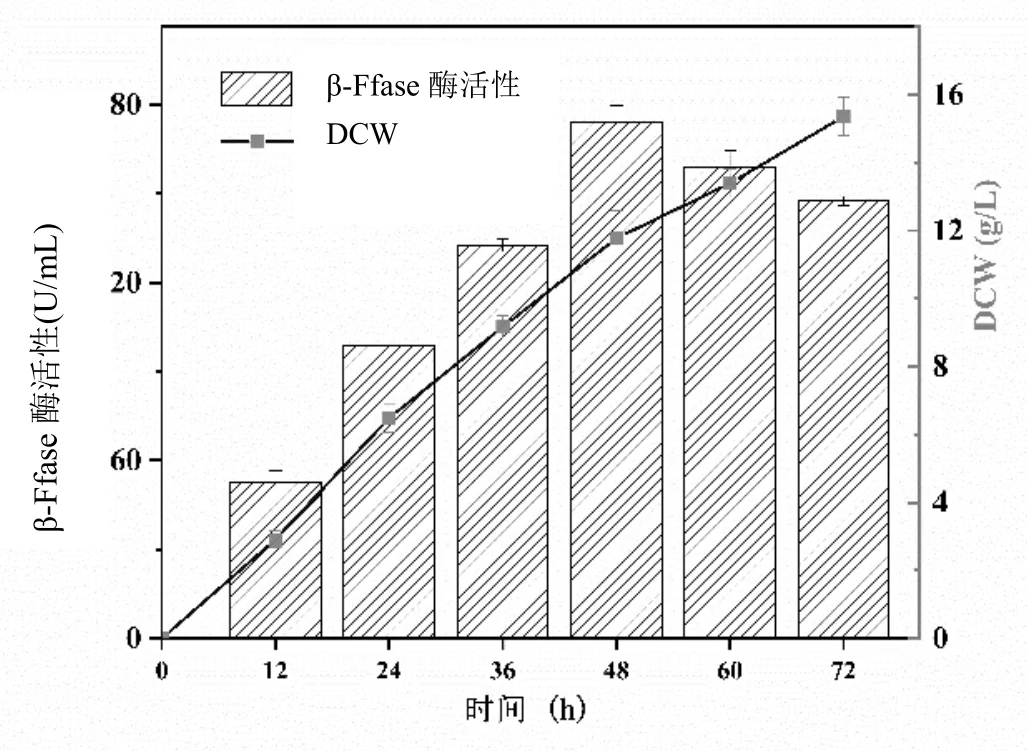
图6 糖蜜培养基优化条件下的发酵过程
本研究提出黑曲霉菌株产β-Ffase酶的发酵条件,这将有助于探究甘蔗糖蜜发酵生产低聚果糖,促进其工业化利用。研究发现具有高β-Ffase酶活性的黑曲霉菌株能够催化甘蔗糖蜜,高效地转化为FOS,该过程避免了昂贵的酶纯化程序的需要[10]。糖蜜作为催化底物,整个黑曲霉菌丝体作为生物催化剂,能大大降低工业上生产FOS的生产成本。因此,本研究中开发的用于FOS生产的黑曲霉菌株和生物工艺在FOS食品和饲料添加剂等生产中具有很高的应用潜力。
