真菌纤溶化合物1的遗传毒性评价
2023-06-08侍雯婧田逸君董雅春吴文惠张惠姝朱玉平
侍雯婧,田逸君,董雅春,吴文惠,张 添,张惠姝,朱玉平
(1.海军军医大学海军医学系卫生毒理学教研室,上海 200433;2.上海海洋大学食品学院海洋药物与健康食品研究中心,上海 201306;3.海军军医大学基础医学院实验教学中心,上海 200433)
正常生理情况下,血液循环的纤溶系统与凝固作用处于平衡状态,当血流速度低会形成低剪切力的漩涡区,进而引发形成附壁血栓、血小板机能亢进、血管内皮细胞受损等机体改变。这将打破纤溶与凝固的生理平衡,形成肺动脉血栓、心肌梗塞、脑栓塞及肢体动脉血栓等难治性心脑血管疾病[1],探索高效和特异性溶栓药物就成为治疗这些难治性疾病的热点之一。目前临床应用有非特异性和特异性溶栓药物两类,纤维蛋白非特异性血栓溶解药在溶解血栓的同时分解纤维蛋白原导致出血现象;纤维蛋白特异性溶栓药物在血栓存在下纤溶活性显著增加,但半衰期短[2]。两类药物均存在缺点或呈现不同程度的副作用,因此,开发溶栓药效优良和副作用小的新型溶栓药物就成为现代治疗血栓性心脑血管疾病的有效途径之一。
许多研究提示小分子溶栓药物不但具有优良的溶栓药效而且副作用更小[3]。从海洋微生物长孢葡萄穗霉菌FG216(Stachybotrys longisporaFG216)中发现的吡喃并异吲哚酮小分子溶栓先导化合物即真菌纤溶化合物1(fungi fibrinolytic compound 1,FGFC1)[4]具有明确的纤维蛋白原作用靶点,显著不同于具有纤维蛋白和纤维蛋白原等多个靶点的生物大分子溶栓药物尿激酶。FGFC1 可透过CACO-2 细胞单层膜的特性预示着可以口服给药,与生物大分子溶栓药物如重组人尿激酶原只能静脉给药比较具有明显优势,另外基于海洋生物来源的FGFC1分子活跃基团可修饰获得新型溶栓药物[5]。小分子溶栓药物FGFC1 对于研究纤溶酶原靶点溶栓原理具有重要意义,且作为海洋新药在治疗难治性心脑血管疾病方面具有应用价值[6]。
此前尚无研究对FGFC1 遗传毒性进行系统的评估,在本研究中,我们通过回复突变试验(Ames 试验)、体外培养中国仓鼠卵巢(Chinese hamster ovary,CHO)细胞染色体畸变试验和小鼠骨髓细胞微核试验对FGFC1的遗传毒性进行了研究,为FGFC1的临床前毒性评价提供了资料[7]。
1 材料与方法
1.1 受试物及主要试剂
受试物FGFC1 化学结构见图1。玻璃瓶装,规格为10 mL/支,纯度为98%,浅黄色透明液体,避光冷藏,由上海海洋大学提供。
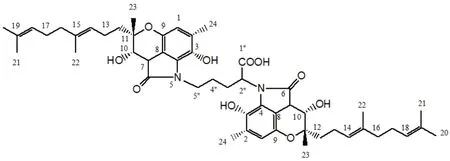
图1 FGFC1的化学结构式
Ames 试验和体外培养CHO 细胞染色体畸变试验中使用FGFC1溶液浓度为10 mg/mL,ICR小鼠骨髓细胞微核试验中使用FGFC1 溶液浓度为5 mg/mL。溶剂对照为5%碳酸氢钠溶液。大鼠肝微粒体酶S9 产自美国Moltix公司,保存于-80 ℃冰箱。
1.2 菌株和细胞
组氨酸缺陷型鼠疫沙门氏菌TA97、TA98、TA100、TA102、TA1535,由复旦大学公共卫生学院环境卫生教研室捐赠。实验前对其进行鉴定(包括R因子、组氨酸缺陷型和自发逆变量等),均符合规定标准。在(37±1) ℃和120 r/min 的摇动培养箱中孵育10 h,用于实验。CHO 细胞由复旦大学公共卫生学院毒理教研室捐赠。
1.3 动物
ICR 小鼠共60 只,每组10 只,雌雄各半,5~6 周龄, 体质量21.0~24.2 g, 动物质量合格证号2008001626070。
1.4 实验方法
根据《新药(西药)临床前研究指导原则汇编》[8-9]的设计要求,分别采用Ames 试验[10]、体外培养CHO细胞染色体畸变试验[11]和小鼠骨髓细胞微核试验[12]测定FGFC1的遗传毒性。检测终点覆盖基因突变、染色体畸变、细胞有丝分裂异常。
1.4.1 Ames 试验 根据《药物遗传毒性研究技术指导原则》的要求,TA97、TA98、TA100、TA102 及TA1535组氨酸缺陷型菌株由于FGFC1原液浓度限制,最高剂量设为1000 mg/皿,下面剂量依次为500、50、5、0.5 mg/皿,共5 个剂量组。此外,设空白对照、溶剂对照和阳性对照组,各阳性对照品剂量见表1[13]。采用标准平板掺入法,使细菌在加和不加代谢活化系统(S9 混合液)的条件下接触受试物(+S9 组在每个平皿的试验体系中加入0.5 mL的S9混合液,-S9组在每个平皿的试验体系中加入0.5 mL的PBS)。每皿均加入0.1 mL的不同浓度供试品溶液、溶剂对照溶液或阳性对照溶液,在各剂量组和对照组中设置了3 个平行皿。用最低限度琼脂培养基培养48 h后,首先用显微镜观察平皿上的菌苔,确定菌苔生长未受到FGFC1明显的细菌抑制或杀菌作用,然后人工计数每个平皿的回复突变菌落数量,记录并计算各组菌落数量的平均值和标准差,并与溶剂对照组比较。反复试验1次[7]。
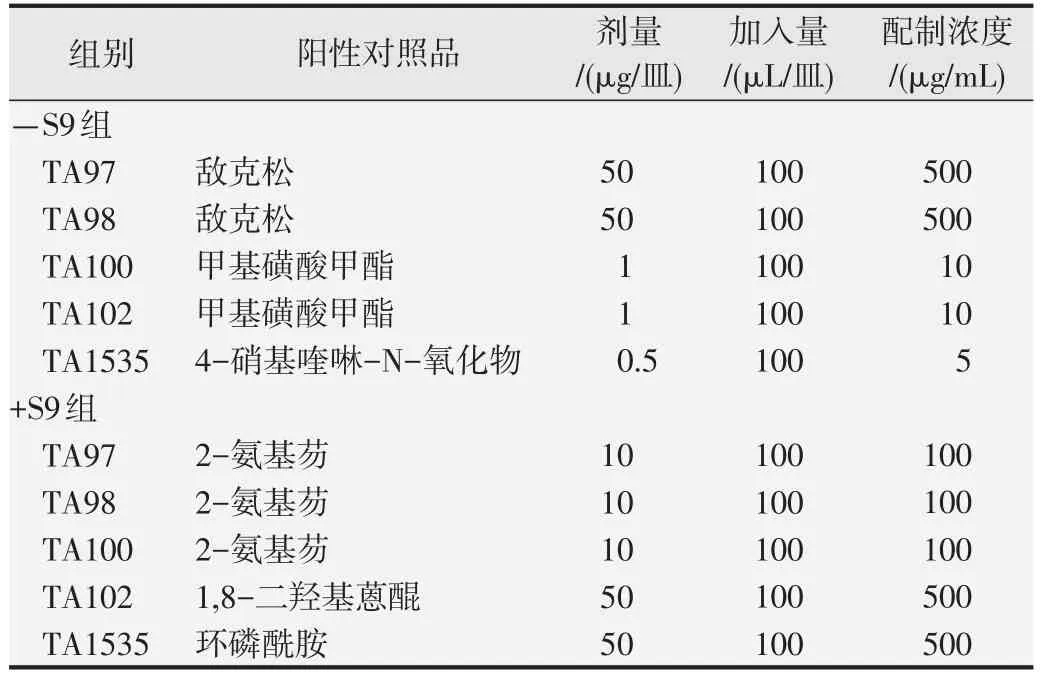
表1 Ames试验中各阳性对照品的剂量设置
1.4.2 体外培养CHO 细胞染色体畸变试验 在正式试验前进行1次或多次预试验以确定IC50浓度。本次实验IC50浓度250.41 mg/mL,故设低、中和高剂量组终浓度为62.5、125和250 mg/mL,阳性对照组的丝裂霉素C 和环磷酰胺的最终浓度分别为0.5 和60 μg/mL,将其他溶剂对照组(碳酸氢钠溶液)分别作为两个平行样品,反应体系为10 mL。+S9 组在每瓶的试验体系中加入0.5 mL的S9混合液作用4 h后倾倒细胞培养瓶中的所有培养基,洗涤后再加入10 mL完全1640培养基,继续培养至24 h;短时处理-S9 组培养4 h 后倾倒所有含有受试物的培养液体,然后再加入10 mL的完全培养基,继续培养至24 h;长时处理-S9 组不换液,细胞与受试物接触24 h后收集细胞。在培养瓶中加入低、中、高剂量相应浓度FGFC1溶液、溶剂对照溶液或阳性对照溶液,使细胞暴露于测试化学物质中直至收集细胞。收获细胞前用秋水仙碱(最终浓度为0.2 μg/mL)处理4 h,消化细胞,经离心后用低渗液(0.75%氯化钾溶液)处理,进而固定液(V甲醇∶V冰醋酸=3∶1)固定,最后将细胞滴在载玻片上,自然晾干,用Giemsa染色。每组制备2~3张玻片标本。
各组用显微镜观察完整并且分散良好的中期分裂相细胞的染色体,观察数量为200个细胞(阳性对照组分析至少100 个细胞)。记录染色体或染色单体的断裂、在缺损和其他类型的结构异常情况下(裂纹和核内复制一般不作为突变类型处理),计算突变率[13]。
1.4.3 小鼠骨髓细胞微核试验 小鼠检疫期结束后分别按低、中、高组给药,剂量分别为62.5、125.0、250.0 mg/kg,其中高剂量组设两组分别在药物作用24和48 h 后处死,同时设置了阳性对照组和溶剂对照组。取股骨骨髓制作骨髓涂片,每只动物制作2 张涂片,甲醇固定后用pH=6.8 的Giemsa 染色液染色。每只小鼠对约2000个骨髓嗜多染色红细胞(PCE)进行镜检,计数含微核的PCE 数(MNPCE),计算微核发生率,同时记录200 个PCE 计数过程中观察到的正染色红细胞(NCE)的数量,计算PCE/NCE值[13]。
1.4.4 剂量设计 对于易溶性无毒化合物,细菌实验的最高浓度应达到5 mg/皿[14]。由于受试物原液浓度限制,最高剂量只能达到1 mg/皿剂量,故本次Ames试验中,设每皿0.5、5、50、500 和1000 μg 共5 个剂量组。每皿均加入相应浓度的供试品溶液0.1 mL,另设空白对照、溶剂对照和阳性对照。
在染色体畸变试验中,毒性水平应高于50%细胞抑制率或细胞融合率[15]。通过预实验确定供试品的IC50为250.41 mg/mL。故设染色体畸变试验的低、中、高剂量组为62.5、125.0 和250.0 mg/mL,试验时在10 mL 的试验体系中分别加入0.1 mL 应用液,另设阳性对照组和溶剂对照组。
小鼠骨髓细胞微核试验采用尾静脉注射给药,小鼠急性毒性结果的1/2 半数致死量(LD50)为最高用量。由于受试物原液浓度限制,LD50大于最大给药剂量,故微核设总剂量分别为62.5、125.0、250.0 mg/kg(单次给药量设定为31.25、62.5、125 mg/kg,分上、下午2次注射给药),给药体积按25 mL/kg计算,同时设置阳性对照组和溶剂对照组。阳性对照组以40 mg/kg的剂量腹腔内注射环磷酰胺,给药体积按10 mL/kg计算,溶剂对照组的给药方法与受试组相同,按25 mL/kg计算给药体积,尾静脉注射碳酸氢钠溶液。
1.5 统计方法
Ames试验结果的评价以溶剂对照组的回复突变菌落数为基础,各剂量组与之进行比较。某剂量组回复突变菌落数为溶剂对照组的2 倍以上呈现再现性,或在一定的剂量范围内存在剂量-反应关系,则判断为阳性。体外培养CHO细胞染色体畸变试验和小鼠骨髓细胞微核试验的结果均采用卡方检验,以α=0.05为检验水准。
2 结 果
2.1 Ames试验结果
受试物各剂量组和对照组的平皿均可见背景菌苔生长。5 个菌株的自发回复突变菌落数以及阳性对照品诱发的回复突变菌落数均在历史参考范围内,并且各菌株阳性对照组的回复突变菌落与空白对照组相比数目显著增加,提示本试验系统符合要求[14,16]。在可做到的最高剂量1000 mg/皿的受试条件下,未观察到受试物的抑菌现象。各剂量组受试物在加或不加S9时对TA97、TA98、TA100、TA102 和TA1535 所诱发的回复突变菌落数均与自发的突变菌落数相近,未观察到明显的剂量-反应关系。Ames 试验计数的回复突变菌落数结果见表2和表3。
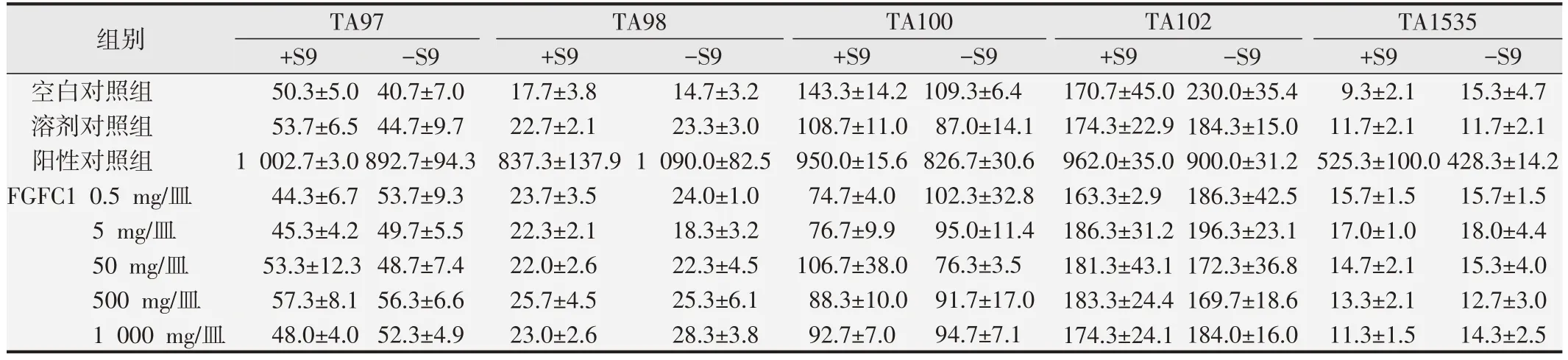
表2 FGFC1的Ames试验结果(个/皿,x±s,第1次)
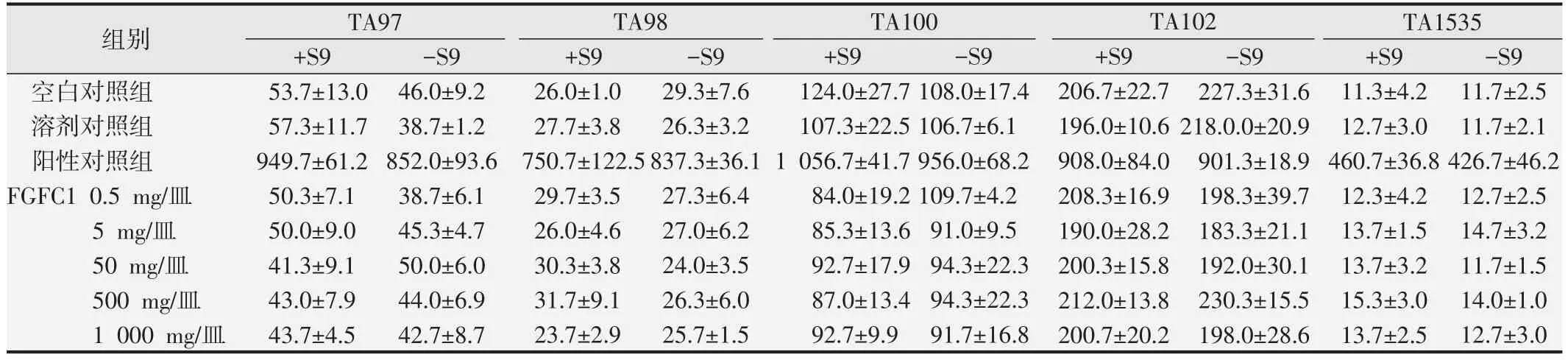
表3 FGFC1的Ames试验结果(个/皿,x±s,第2次)
2.2 体外培养CHO细胞染色体畸变试验结果
染色体分析结果显示,与溶剂对照组相比,阳性对照组可诱发受试细胞染色体畸变率显著增加(P<0.05),且畸变率均在历史数据范围内,验证了该系统的有效性[14,16];FGFC1浓度为62.5、125和250 mg/mL各剂量组细胞染色体畸变率均小于5%,与溶剂对照组结果比较差异均无统计学意义(P>0.05)。体外培养CHO 细胞染色体畸变试验计数结果见表4、表5 和表6。
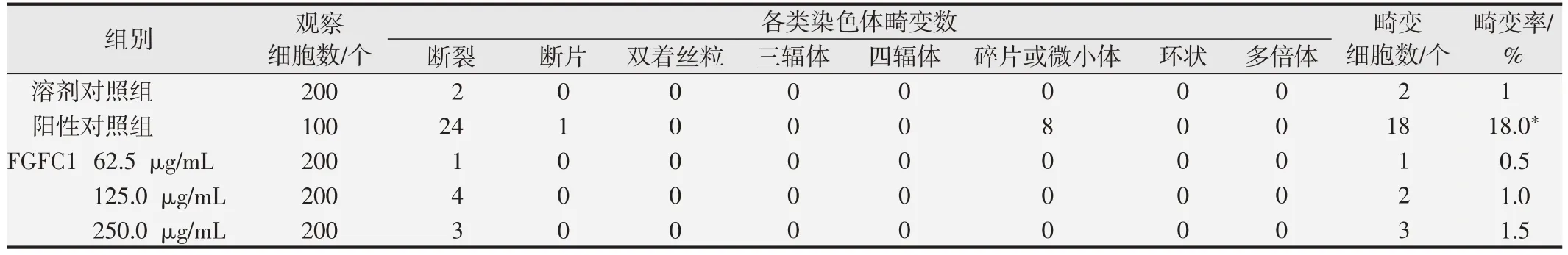
表4 FGFC1的体外培养CHO细胞染色体畸变试验结果(+S9,24 h)
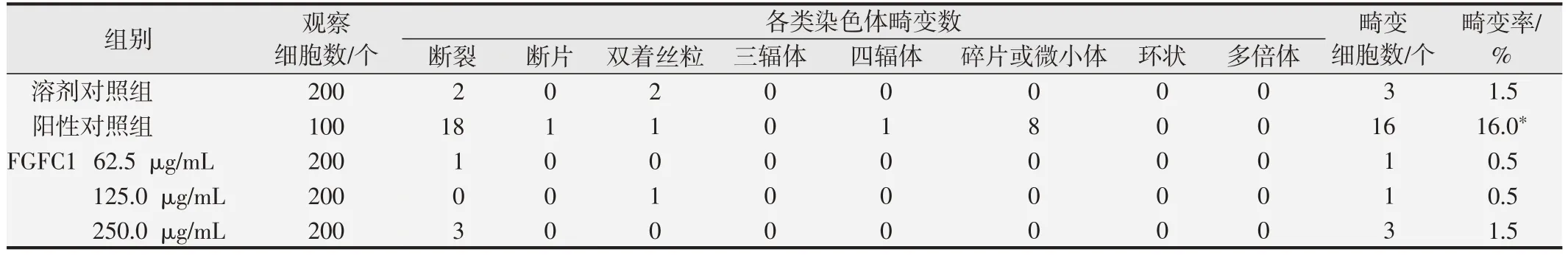
表5 FGFC1的体外培养CHO细胞染色体畸变试验结果(-S9,24 h)
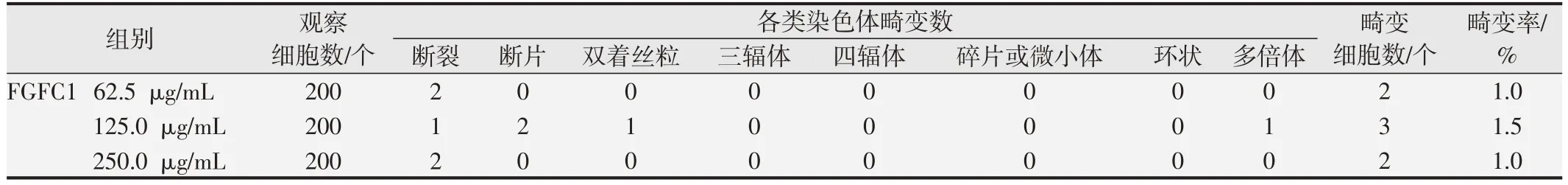
表6 FGFC1的体外培养CHO细胞染色体畸变试验结果(-S9,4 h)
2.3 小鼠骨髓细胞微核试验结果
试验结果经统计学分析表明,阳性对照组雌性和雄性小鼠骨髓PCE微核发生率分别为14.58‰和14.05‰,与溶剂对照组相比,差异均具有统计学意义(P<0.05),验证了本次试验系统的有效性。FGFC1 在62.5、125.0、和250.0 mg/kg剂量未观察到对小鼠骨髓细胞微核形成的抑制作用,小鼠骨髓PCE微核发生率与溶剂对照组相比差异均无统计意义(P>0.05)。结果见表7。
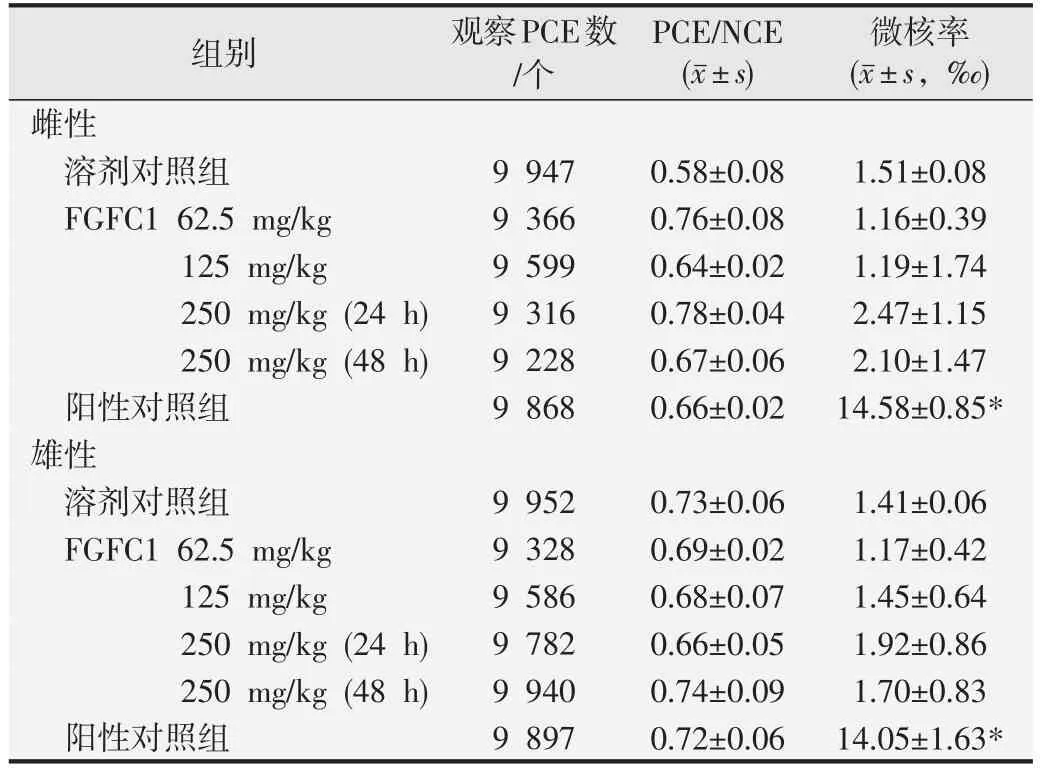
表7 FGFC1的小鼠骨髓嗜多染色红细胞微核试验结果(n=5)
3 讨论
FGFC1 是一种罕见的化合物,相对分子质量为869,从海洋真菌FG216 中分离出来[4]。FGFC1是一种无出血性风险的溶栓剂,在体内外均能降解纤维蛋白[14]。FGFC1 在Wistar 大鼠体内的药代动力学研究表明,FGFC1在大部分组织中分布迅速,但在大脑中不分布。FGFC1(10 mg/mL)用于治疗Wistar 大鼠时,可溶解大部分肺血栓[16]。在以前的研究中支持了化合物的纤溶活性降低出血风险的概念。具体来说,FGFC1促进了溶栓,而不诱导出血性活性。此外,FGFC1在体内和体外均能有效促进FITC-纤维蛋白的降解,而未增加纤维蛋白(原)溶解的风险。FGFC1 是一种治疗血栓形成的潜在药物[15]。鲜有文献报道FGFC1 的安全性研究,前期本GLP 实验室的结果表明,ICR 小鼠的LD50>250 mg/kg,两次急性毒性的结果表明,FGFC1显示低毒性。
本研究体外采用Ames 试验平板掺入法和CHO 细胞染色体畸变试验,体内采用ICR 小鼠骨髓微核试验,是研究遗传毒性的经典组合,能检测基因突变、染色体形态变化和染色体分离变化等多个遗传学终点,符合国际标准化要求[14-16]。每个实验均按照GLP批准机构的既定程序进行,以确保结果的可靠性。
此前未有文献对FGFC1遗传毒性方面的报道。本试验条件下,从Ames 试验、CHO 细胞体外染色体畸变试验和小鼠骨髓微核试验得到的结果表明,FGFC1无遗传毒性和潜在致癌性,是一种非遗传毒性药物。本研究提高了人们对接触FGFC1相关风险的认识,在FGFC1开发过程和治疗的用药风险中起着重要作用。
