剪接因子SF2/ASF在胰腺癌中的表达及其临床意义
2023-06-08杨华宇马秀梅
孟 琳,杨华宇,马秀梅,2,
(1.内蒙古医科大学,内蒙古 呼和浩特 010110;2.内蒙古医科大学附属医院,内蒙古呼和浩特 010050)
胰腺癌是目前全球第四大癌症死亡原因,近年来,胰腺癌的发病率呈上升趋势,约占肿瘤发病率的2%[1]。胰腺癌早期发病过程不具有特异性症状,缺乏早期诊断和治疗方法,受关注度相对较低[2]。因此,探讨胰腺癌发病原因,积极寻找新的诊断标志物和治疗靶点,对于降低胰腺癌患者死亡率和延长患者寿命至关重要。
剪接因子2/选择性剪接因子(splicing factor 2/alternative splicing factor,SF2/ASF)是一种高度保守的、由SRSF1基因编码的、参与组成性剪接和选择性剪接的RNA 结合蛋白,属于SR 蛋白家族(serine/arginine-rich protein,SRp)[3],被定义为癌蛋白,是第1 个被证实与肿瘤直接相关的剪接因子[4]。P53是一种抑癌基因,该基因的突变或缺失是导致许多肿瘤发生的原因,50%以上的恶性肿瘤都出现过P53突变[5],是病理学中衡量肿瘤预后的指标之一。Ki67是细胞增殖的核蛋白标记物,可表达于除G0 期以外的处于其它细胞周期的增殖细胞中[6],是判断恶性肿瘤预后的可靠标志物[7]。本实验通过采用生物信息学方法分析SRSF1基因在胰腺癌组织及癌旁正常组织中的表达差异,并使用免疫组织化学法检测人胰腺癌组织中SF2/ASF、突变型P53 以及Ki67 蛋白的表达情况,探讨SF2/ASF 与后两者的相关性,分析其表达与胰腺癌患者临床病理指标及预后的关系,为胰腺癌的早期诊断和治疗方法的选择提供新思路。
1 材料与方法
1.1 数据来源
GEPIA 数据库(http://gepia.cancer-pku.cn)是由北京大学团队研发,数据来源主要是TCGA 数据库。在首页输入SRSF1,在Expression DIY 功能中选择Profile,设定条件Dataste,选择PAAD,|log2(FC)| Cut off 值设置为1.0,q-value Cut off 值设置为0.01,在Differential Methods 中选择ANOVA,得出SRSF1基因在胰腺癌组织和癌旁正常组织中表达的散点图。在GEPIA数据库首页输入SRSF1,在Expression DIY 功能中选择Boxplot,设定条件Dataste Selection,选择PAAD,|log2(FC)| Cut off 值设置为1.0,q-value Cut off 值设置为0.01,Jitter Size 值设置为0.4,Matched Normal data 中选择Match TCGA normal and GTEx data,得出SRSF1基因在胰腺癌组织和癌旁正常组织中表达的箱形图。在GEPIA 数据库首页输入SRSF1,在Correlation 功能中设定Gene1:SRSF1,Gene2:Tp53或MKi67(Ki67 的编码基因),在Correlation Coefficient选择Pearson,在TCGA Tumor 中选择PAAD Tumor,点击PLOT,得出SRSF1基因与TP53和MKi67之间的相关性。
1.2 临床资料
选取2016年1月—2020年12月从内蒙古医科大学附属医院病理中心存档的胰腺癌术后切除组织及其对应的癌旁正常组织共60 例。男性患者30 例,女性患者30 例;年龄13~80 岁;组织病理分级(参考WHO 分级标准):高中分化44 例,低分化16 例;淋巴结转移14 例,无淋巴结转移46 例;远端脏器转移24 例,无远端脏器转移36例;TNM病理分期Ⅰ~Ⅱ期26例,Ⅲ~Ⅳ期34 例。选取其对应的癌旁正常组织作为对照组。标本均经10%福尔马林固定,常规石蜡包埋,4 μm 厚连续切片。所有标本经病理检查均明确诊断为胰腺导管腺癌。采用电话采访的方式对入选患者进行随访,随访开始时间为出院日期,随访结束时间为术后死亡时间或随访截止日期,即2022年9月1 日,随访时间范围为1~48 个月,中位随访时间为38 个月。患者术后第1 天至其最终死亡时间或到随访截止时间为总生存期(overall survival,OS)。本研究获得患者知情同意和内蒙古医科大学附属医院伦理委员会批准。
1.3 主要试剂及仪器
SF2/ASF 抗体购自美国Santa Cruz 公司,P53 抗体、Ki67 抗体、免疫组化SP 试剂盒和DAB 显色试剂盒均购自福州迈新生物技术有限公司。显微镜购于江南永新,型号为BM2000。
1.4 免疫组织化学检测及结果判定
1.4.1 免疫组化染色 将石蜡包埋的胰腺癌及癌旁正常组织切片浸入二甲苯中以去除石蜡,用乙醇梯度重新水化,滴加羊抗人单克隆抗体(1∶100 稀释),水浴锅孵育60 min,PBS 冲洗后,滴加二抗,室温下孵育10 min,PBS 再次冲洗后,滴加链霉素,室温下孵育10 min,随后滴加DAB工作液进行复染,经梯度脱水后光学显微镜下观察染色结果。
1.4.2 结果判定 对染色结果进行评分,评分过程由两位病理科医生各自独立操作,采用兼顾阳性细胞染色的强度及数量作为判定标准。①按染色深浅计分:无染色为0 分,淡黄色染色为1 分,棕黄色染色为2分,棕褐色染色为3 分;②按阳性表达细胞数计分:未见阳性表达细胞为0分,阳性细胞≤25%为1分,阳性细胞在(25%,50%]为2分,阳性细胞在(50%,75%]为3 分,阳性细胞>75%为4 分。③按两个结果评分相加作为最终判断,0~3分为阴性,4~7分为阳性。P53和Ki67的免疫组化结果显示阳性颗粒均定位于细胞核中,突变型P53 在细胞核内高表达是判断肿瘤独立预后指标;而Ki67 高表达则提示肿瘤细胞增殖活性强,侵袭性高,是临床上重要的判断预后的因素。本实验只单纯考虑阳性细胞核染色的数量为标准。P53 分级标准以阳性细胞数≤总数的5%为阴性,>5%为阳性。Ki67 分级以增殖指数(proliferation index,PI)为标准,即计数10 个随机高倍视野(×400)下1000 个肿瘤细胞中的阳性细胞数,PI=阳性细胞总数/1000×100%。
1.5 统计学方法
使用SPSS 20.0 软件进行统计分析。胰腺癌组织及癌旁正常组织中SF2/ASF 高表达率的比较使用配对卡方检验;SF2/ASF、突变型P53 和Ki67 之间的表达的相关性用Pearson 相关性分析;SF2/ASF的表达与临床病理学特征的关系使用卡方检验、连续性校正卡方检验或Fisher确切概率法分析;采用Kaplan-Meier 法绘制患者生存曲线,生存曲线的比较采用Log-rank 检验;预后分析采用Cox 比例风险回归模型,P<0.05 为差异有统计学意义。
2 结 果
2.1 SF2/ASF 在胰腺癌组织和癌旁正常组织中的表达差异
在GEPIA数据库中选择匹配TCGA和GTEx数据共包含胰腺癌组织179 例,癌旁正常组织171 例,分析结果显示,胰腺癌组织中SRSF1基因的表达水平显著高于癌旁正常组织(P<0.01,图1)。
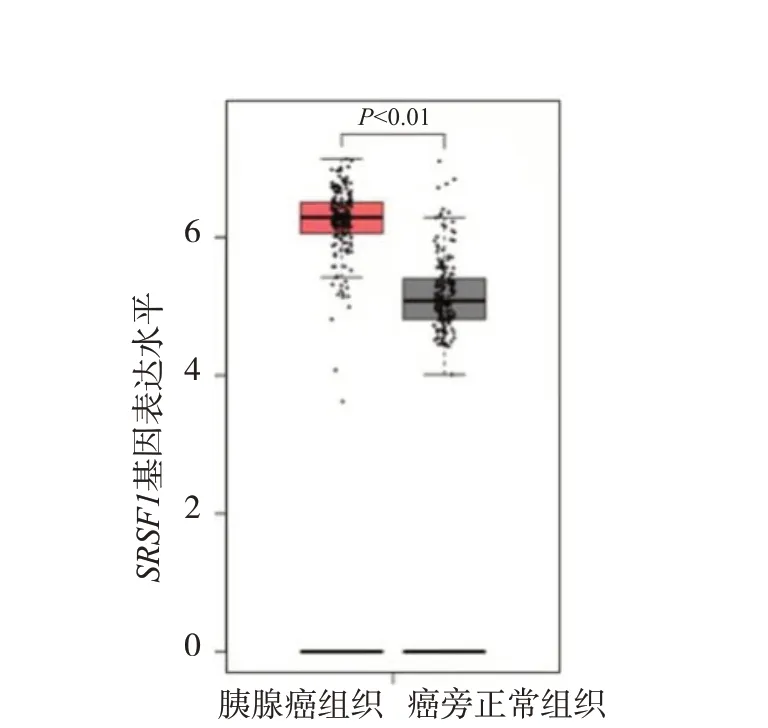
图1 SRSF1基因在胰腺癌组织和癌旁正常组织中的表达水平
2.2 胰腺癌组织中SF2/ASF 与P53 和Ki67 表达的相关性分析
在GEPIA 数据库中选择匹配TCGA 数据,设置相关系数为Pearson,结果见图2,可见在胰腺癌中SRSF1基因与TP53和MKi67的表达水平均呈正相关(r分别为0.28和0.32,均为P<0.01)。
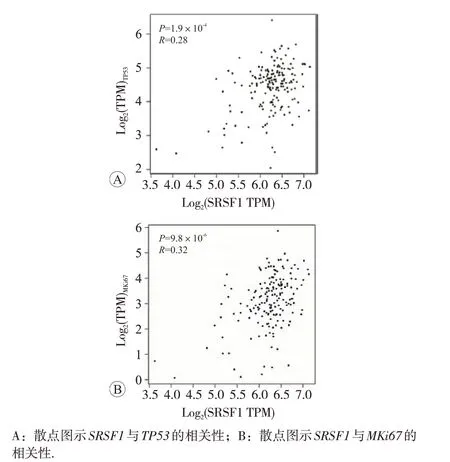
图2 SRSF1基因与TP53和Ki67的相关性
2.3 胰腺癌中SF2/ASF、突变型P53 和Ki67 蛋白的表达
免疫组化检测结果见图3 和表1,胰腺癌组织中SF2/ASF 和P53 蛋白的阳性表达率均高于癌旁正常组织,差异均有统计学意义(P<0.01)。胰腺癌组织中Ki67增殖指数为(32.4±19.9)%,而癌旁正常组织中为0(P<0.01)。

表1 胰腺癌和癌旁正常组织中SF2/ASF、突变型P53 蛋白的表达阳性率和Ki67增殖指数
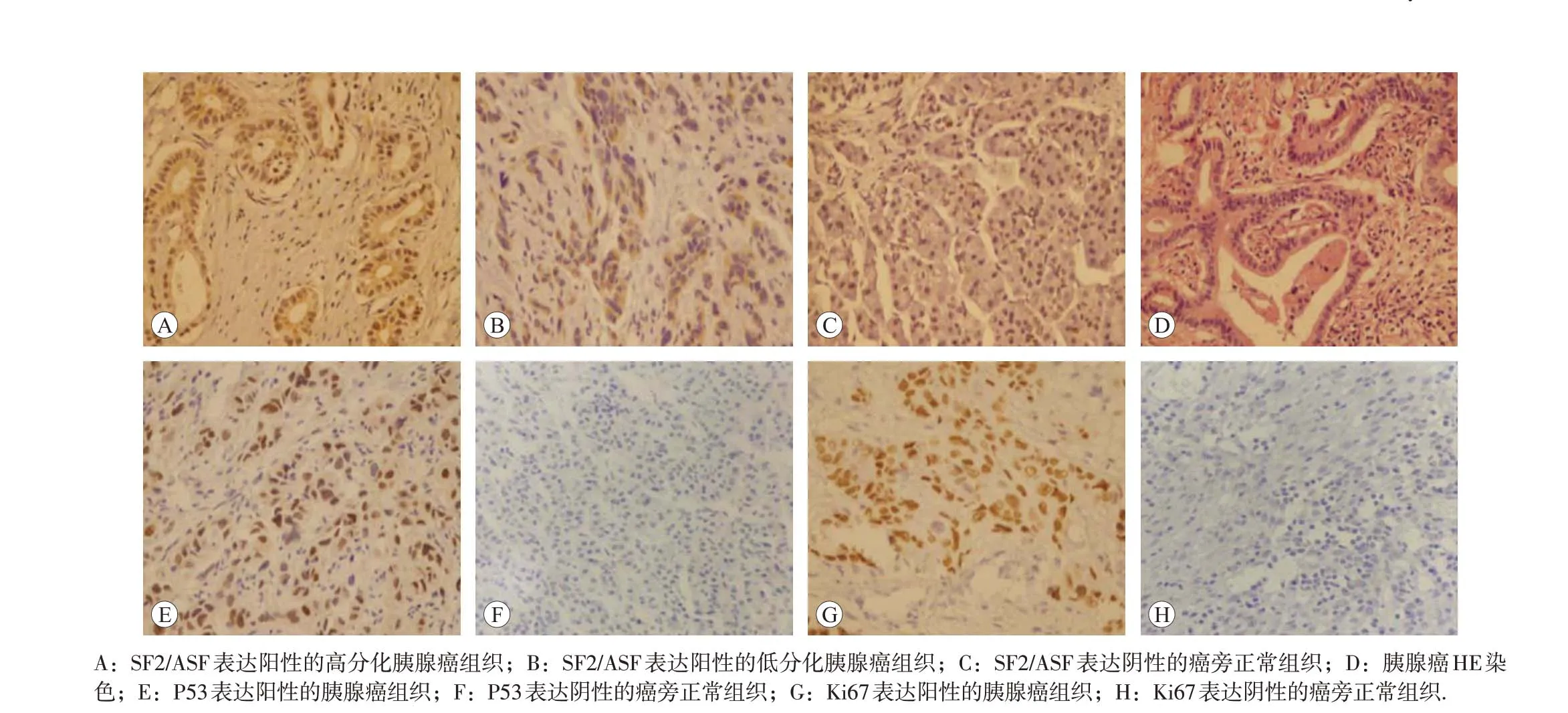
图3 SF2/ASF、突变型P53和Ki67蛋白在胰腺癌组织与癌旁正常组织中的表达情况(×400)
2.4 胰腺癌中SF2/ASF 与突变型P53 和Ki67 表达的相关性
卡方检验分析结果见表2,表明SF2/ASF 蛋白表达水平与突变型P53 呈负相关(r=-0.386,P<0.05),与Ki67增殖指数呈正相关(r=0.275,P<0.05)。

表2 胰腺癌中SF2/ASF与突变型P53和Ki67表达的关系
2.5 SF2/ASF表达与胰腺癌临床病理特征的关系
卡方检验分析结果见表3,可见SF2/ASF 高表达与胰腺癌分化程度、有无淋巴结转移和有无远端脏器转移有关(均为P<0.01),与胰腺癌发生部位和TNM 分期无明显相关关系(P>0.05)。

表3 SF2/ASF表达与胰腺癌临床病理学特征的关系
2.6 胰腺癌组织中SF2/ASF 的表达与患者生存率的关系
在对60 例胰腺癌患者的随访过程中,根据SF2/ASF 蛋白的表达情况将所有患者分为SF2/ASF 高表达组(34 例)和SF2/ASF 低表达组(26 例),绘制生存曲线,见图4。
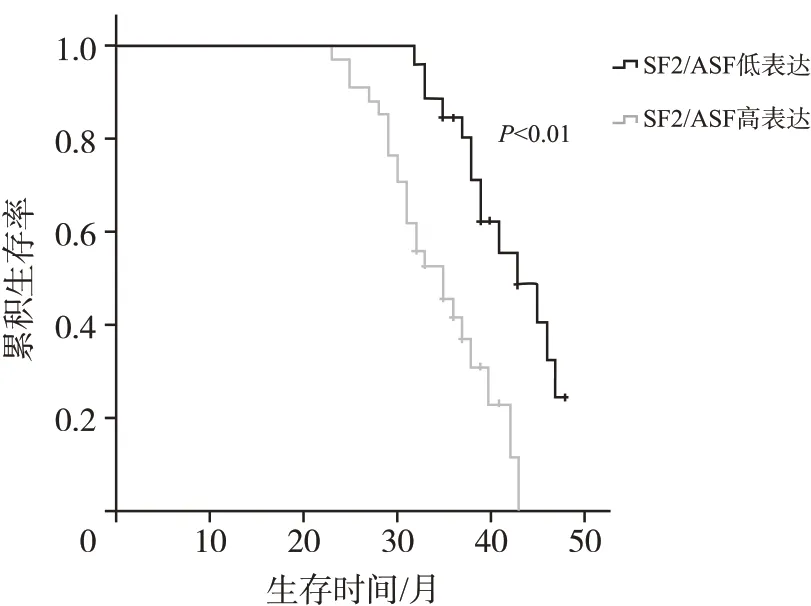
图4 SF2/ASF蛋白表达与胰腺癌患者生存率的关系
2.7 SF2/ASF表达与胰腺癌预后的关系
单因素Cox回归分析结果见表4,可见SF2/ASF阳性表达(HR=0.264,P<0.01)和年龄(HR=0.065,P<0.01)可能是患者OS 的影响因素。多因素Cox 回归分析表明,SF2/ASF 阳性表达(HR=0.336,P<0.01)和年龄(HR=1.057,P<0.01)是影响患者OS的独立危险因素。
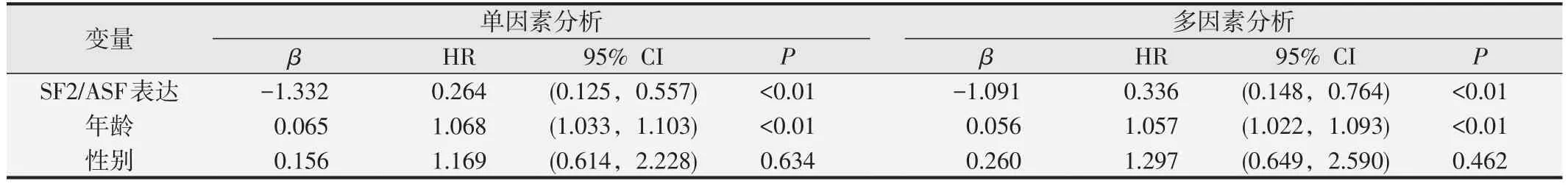
表4 Cox回归分析胰腺癌患者预后相关因素
3 讨论
胰腺癌是消化系统恶性程度最高的肿瘤之一。它侵袭性高,隐匿性强,约80%的患者在就诊时已处于局部晚期或发生远处转移[8],5年生存率仅为15%~20%[9]。由于该肿瘤对射线、药物不敏感等特点,导致常规的手术切除、放疗、化疗,乃至靶向药物及免疫治疗疗效特异性均不高[10],目前胰腺癌早期诊断和临床治疗的基础理论与方法都不理想,患者预后极差。目前,针对胰腺癌早期诊断和临床治疗的措施较少,提高胰腺癌患者总体生存率是人类面临的一个挑战。
研究表明剪接因子在多种肿瘤的发生发展中发挥重要的作用。目前发现一种由SRSF1基因编码的剪接因子SF2/ASF 能选择性剪接致癌或抑癌因子,调节因子活性,从而加快肿瘤细胞生物学行为[11]。研究发现,SF2/ASF 在人结肠癌、小肠癌、肾癌、宫颈癌、肺癌和儿童白血病等多种恶性肿瘤中呈现过表达状态[12-13],但经治疗缓解后则其表达水平降低,提示其参与了这些恶性肿瘤的发生发展过程。SF2/ASF 在建立转化表型、维持细胞生长、增殖和炎症中发挥重要作用[3,14],是一种潜在的肿瘤治疗靶点。目前,SF2/ASF 在人类多种癌症中异常表达[15],但有关其在胰腺癌中的表达研究尚未见相关报道。P53 是一种抑癌基因,分为野生型和突变型两类,在肿瘤生长过程中主要控制细胞周期、DNA 复制和细胞不受控制的分裂[16]。既往文献报道,约50%~60%的胰腺癌中存在突变型P53 的过度表达,其表达程度与患者预后有关[17-18]。Ki67 属于核抗原,表达与肿瘤细胞的增殖和生长密切相关[19],研究表明,Ki67 在有丝分裂中起到了维持DNA结构的作用,作为一种增殖标志物被广泛应用于常规病理研究,是评估患者预后的指标。P53和Ki67均参与调控胰腺癌生物学行为,并可作为标志物进行联合检测来评估胰腺癌的恶性程度及预后。
SF2/ASF 在肿瘤中表达及意义的相关性研究较少,为了进一步探讨SF2/ASF 在胰腺癌中的表达情况,本研究通过数据库分析,结果显示胰腺癌组织中SRSF1基因的表达水平显著高于癌旁正常组织,SRSF1的表达与TP53和MKi67具有相关性;免疫组化法观察SF2/ASF、突变型P53 和Ki67 蛋白在胰腺癌组织中的表达水平明显高于癌旁正常组织。为了明确SF2/ASF、突变型P53 和Ki67 三者之间的相关性,经卡方检验分析发现SF2/ASF 阳性表达与突变型P53 和Ki67 增殖指数均具有相关性,提示SF2/ASF 与突变型P53 蛋白在胰腺癌的发生发展中可能是相互协同作用,推测SF2/ASF 可能通过调节突变型P53 和Ki67 增殖指数而产生致癌作用。本研究卡方检验分析SF2/ASF 和突变型P53 的相关性与生信分析结果不同,可能与此数据库分析较为单薄,以及与本研究所选取的临床数据较少有关,有待进行后续进一步研究。为了探讨SF2/ASF 与胰腺癌临床病理指标的关系,经过进一步分析发现胰腺癌高、中分化组中SF2/ASF 的表达明显高于低分化组,淋巴转移组和远端脏器转移组中SF2/ASF 的表达显著高于未转移组,提示SF2/ASF 与胰腺癌的侵袭转移能力有关,可能对判断患者的预后有一定的作用。通过Cox 回归模型分析发现SF2/ASF高表达和患者年龄是影响胰腺癌患者OS 的独立危险因素,提示SF2/ASF 也可能作为胰腺癌预后评估的新指标。随着年龄的增长,胰腺癌患者的OS 较短,推测可能与伴随其他基础疾病、营养不良、身体和认知功能受损等原因有关。
综上所述,SF2/ASF 在胰腺癌组织中高表达,有望作为临床胰腺癌诊断和预后的一个新标志物,并对评判肿瘤分化程度、有无淋巴结转移以及远端脏器转移具有重要意义,可能为胰腺癌发生发展的分子机制提供新的理论和思路,为胰腺癌治疗提供新方案。但对于SF2/ASF 在胰腺癌中作用的认识仍较局限,后续应进行进一步的探索。
