北柴胡β-香树脂醇合酶基因家族成员鉴定及功能验证
2023-06-08毛艳萍李玉婵杨玉萍张翼冠侯大斌
毛艳萍,李玉婵,杨玉萍,3,李 欢,3,张翼冠,侯大斌,3*
1. 西南科技大学生命科学与工程学院,四川 绵阳 621000
2. 绵阳师范学院生命科学与技术学院,四川 绵阳 621000
3. 阿坝州西科道地中药材产业技术创新中心,四川 阿坝 624000
4. 四川省中医院转化研究医学中心,四川 成都 610041
北柴胡Bupleurumchinense DC.又名韭叶柴胡,是柴胡的优质来源,其主根粗大且分支较多,表面棕褐色,质地较硬,主要分布于我国的东北、西北、华东和华中地区,多生于树林边缘或灌丛下,其根是我国大宗药材柴胡主要药材来源,具有解热镇痛、护肝利胆、抗病毒、抗肿瘤、抗抑郁、调节免疫等药理作用[1-2]。柴胡皂苷是柴胡的主要活性成分,其合成与其他三萜皂苷一样,需要先通过甲羟戊酸(mevalonate,MVA)途径以及2-C-甲基-D-赤藓糖醇-4-磷酸(methylerythritol phosphate,MEP)途径产生2,3-氧化鲨烯,2,3-氧化鲨烯再被不同的氧化鲨烯环化酶(oxidosqualene cyclase,OSC)环化形成构型和功能各异的三萜骨架,三萜骨架最后再经过细胞色素单加氧酶(cytochrome P450 enzyme,P450)和糖基转移酶(uridine diphosphate glycosyltransferase,UGT)的后修饰,形成不同的三萜皂苷[3]。OSC 是决定形成三萜皂苷骨架的重要节点,β-香树脂醇合酶(β-amyrin synthase,β-AS)为环化酶OSC 的一员,可催化MVA及MEP 途径产生的2,3-氧化鲨烯形成柴胡皂苷的骨架β-香树脂醇,是形成柴胡皂苷骨架的关键分支节点酶。目前,现已从不同的21 个植物家族37 个种中克隆出超过60 个β-AS基因[4],但北柴胡β-AS基因家族筛选及功能验证的研究报道甚少。
本研究基于北柴胡转录组测序,对北柴胡β-AS基因进行全面的鉴定,了解其结构预测其功能,进一步利用大肠杆菌对BcBAS1进行了原核表达,并利用烟草瞬时转化研究其功能。为进一步揭示柴胡皂苷合成路径和调控机制奠定基础,为实现柴胡皂苷的生物合成提供思路。
1 材料与试剂
1.1 材料
供试材料经西南科技大学侯大斌教授鉴定为北柴胡B.chinense DC.品种,种植于四川省绵阳市西南科技大学药用植物研究实验室的试验田。本氏烟草种植于四川省绵阳市西南科技大学药用植物研究实验室温室中。
1.2 试剂
同源重组试剂盒(ClonExpress II One Step Cloning Kit)购于诺唯赞生物科技有限公司,各种限制性内切酶及抗生素均购于全式金生物,β-香树脂醇标准品购于上海源叶生物科技有限公司。大肠杆菌原核表达载体为pMALC5E,菌株为BL21(DE3)。烟草瞬时表达载体为pCAMBIA1300S,菌株为GV3101。
2 方法
2.1 北柴胡β-AS 基因家族鉴定
根据前期转录组RNA-Seq 测序数据[5],转录组获取的数据在GO、KEGG、KOG、NR、NT、SwissProt、Pfam 共7 个数据库(e-value≤1×10-5)进行Blast 比对初筛,利用NCBI 保守域数据库和Blast 比对,筛选具有保守结构域及完整CDS 的数据。确保每个序列均具有保守结构域且具有完整的CDS 区域,在此基础上剔除冗余,最终得到的序列被认定北柴胡β-AS基因家族成员。
2.2 北柴胡β-AS 基因生物信息学分析
利用在线软件ProtParam 对北柴胡β-AS基因的氨基酸数量、等电点、相对分子质量等理化性质进行分析计算。利用在线软件WoLF PSORT 预测北柴胡β-AS基因编码蛋白的亚细胞定位。蛋白质的二级结构和三级结构域分别用在线软件SOPMA和Phyre2 进行分析。蛋白质保守域基序利用在线软件MEME 分析,参数设置:Motif 设置为10 个,长度设置为100 氨基酸,其他设置为默认值。SMART 分析得到序列的蛋白结构域,并利用TBtools 软件将分析得到的结构域可视化。从NCBI中下载已验证功能的其他物种β-AS 氨基酸序列,利用MEGAx 软件,设置bootstrap 法的值为1000,用Neighbor-Joining Tree 进行进化树构建。利用DNAMAN 软件对β-AS基因序列进行多序列比对分析。
2.3 表达载体构建
以前期构建的T-BcBAS1 质粒为模板[6],扩增相关目的基因片段。原核表达载体构建基因片段扩增 引 物 为 F:5’-AAGGTACCGCATATGTCCATGTGGAGATTGAAAATCGGTGA-3’,R:5’-ATTACCTGCAGGGAATTCTTAATGGTGATGGTGATGATGGATGGTTGAAGATGGAAGTG-3’。烟草表达扩增目的片段的引物 F:5’-GCTTTCGCGAGCTCGGTACCATGTGGAGATTGAAAATCGGTG-3’及 R:5’-AGGTCGACTCTAGAGGATCCTTAGATGGTTGAAGATGGAAGTGC-3’。BamHI 和EcoRV 双 酶 切 载 体 pMALC5E , 载 体pCAMBIA1300S 用限制性内切酶KpnI 和BamHI 双酶切处理,线性化载体并回收。利用同源重组试剂盒连接目的片段与线性化的载体,连接产物转化大肠杆菌DH5α,通过菌落PCR 确定阳性克隆并测序。
2.4 重组蛋白表达
测序正确的pMALC5E-BcBAS1 质粒转化原核表达大肠杆菌BL21(DE3),以空载转化作为对照。挑取含正确的单克隆接种于Kana 抗性的10 mL LB液体培养基中,37 ℃振荡培养至A600=0.6~0.8。加入异丙基-β-D-硫代半乳糖苷至终浓度为 0.5 mmol/L,16 ℃、160 r/min 震荡培养16 h 诱导蛋白。培养结束,收集菌液,冰浴超声破碎仪170 Hz 破碎,至菌液澄清,12 000 r/min 离心10 min,收集上清液。利用Ni-NTA Resin 纯化蛋白,并用聚丙烯酰胺凝胶电泳(SDS-PAGE)检测蛋白纯化情况。
2.5 烟草过表达
烟草过表达载体pC1300S-BcBAS1 转化农杆菌GV3101,测序正确的农杆菌单克隆在LB 液体培养基中培养24 h,取1 mL 农杆菌菌液至20 mL 含有15 μmol/L AS 的LB 培养基中,28 ℃、200 r/min 震荡扩大培养,培养至农杆菌A600=0.5~0.6。5000 r/min离心10 min收集菌体,用浸染液(含10 mmol/L MgCl2,10 mmol/L MES,150 μmol/L AS,pH 5.6)重悬菌体至A600为1.0,用注射器针头烟草叶片背面轻轻点开一个小口,去掉针头注射农杆菌侵染叶片。培养2 d 后,取侵染区域的叶片进行代谢产物检测,以空载侵染及野生型叶片作为对照。
2.6 数据分析
用FPKM 值表示β-AS基因表达量,均一化处理后使用R 软件制作热图,将其表达量可视化。每个实验均设置3 个生物学重复,使用SPSS 20.0 软件进行数据分析及差异显著性分析(P<0.05)。
3 结果与分析
3.1 北柴胡β-AS 基因家族鉴定
根据7 个数据库的初筛,通过进一步的完整性筛选,剔除重复序列后,共获得北柴胡β-AS基因家族成员6 个,分别命名为BcBAS1~BcBAS6。对北柴胡β-AS 家族基因编码的蛋白进行理化性质分析(表1)表明,北柴胡β-AS基因编码蛋白平均长度为764.8 个氨基酸,最大的编码蛋白(BcBAS5)由784 个氨基酸组成,最小的编码蛋白(BcBAS4)由755 个氨基酸组成,蛋白相对分子质量范围86 880~90 490,等电点均大于5.89,BcBAS5 基因编码蛋白具有最大等电点6.22,BcBAS4基因编码蛋白具有最小等电点5.89。亚细胞预测结果显示,所有北柴胡β-AS 家族基因编码蛋白均预测在细胞质中。北柴胡β-AS 家族基因的理化性质符合β-AS的特性。

表1 北柴胡β-AS 基因基本信息Table 1 Basic information of β-AS from B. chinense
3.2 北柴胡β-AS 同源进化分析及序列比对
为了评估北柴胡β-AS 同源进化关系,本课题组加入了拟南芥、水稻、人参、甘草、燕麦等42 个已验证功能的β-AS 的氨基酸序列,与本研究鉴定的6个北柴胡β-AS 氨基酸序列,构建了进化树并对进行蛋白质序列进行了分析(图1)。进化树结果表明,所有的β-AS 基因可分为4 个亚家族BcBAS1、BcBAS2、BcBAS4、BcBAS5、BcBAS6均位于Class I,BcBAS3位于Class III。从进化距离来看,BcBAS2、BcBAS4与BcBAS6在同一个分支上,与岗梅β-AS基因IaAS2关系最近;BcBAS1和BcBAS5在一个分支上,与番茄β-AS基因有最近的亲缘关系;BcBAS3与其他北柴胡β-AS基因关系较远,与秋茄树的β-AS基因最接近。
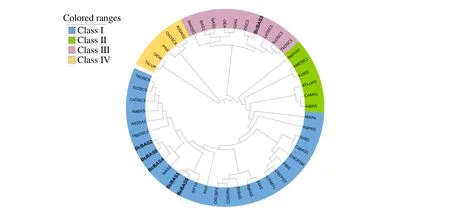
图1 北柴胡β-AS 和其他物种编码蛋白的进化关系Fig. 1 Evolution relationship of β-AS with other β-AS proteins
从各亚家族的功能来看,Class I 包含了27 个β-AS基因,主要为单功能β-AS,其产物仅有β-香树脂醇,或以β-香树脂醇为主,仅有少量的其他产物,由此推测BcBAS1、BcBAS2、BcBAS4、BcBAS5、BcBAS6有可能为单功能β-AS。Class II 和Class III分别包含了6、10 个β-AS基因,均为多功能β-AS,功能验证实验显示均能催化底物产生2 种以上产物,推测BcBAS3可能为多功能β-AS。Class IV 包含了5 个β-AS基因,所包含基因的催化产物既有单一的β-香树脂醇,也有同时催化产生了其他产物。北柴胡β-AS基因同源进化分析表明,北柴胡β-AS基因大多在同一亚家族,进化距离较近,在进化的过程中变异可能不大。
将北柴胡β-AS基因的保守区域序列与拟南芥[7]、北柴胡[8]、甘草[9]、人参[10]的氨基酸序列在DNAMAN 中进行多序列比对。结果表明(图2),北柴胡β-AS基因家族显示包含OSC 的典型保守区域,含1 个基质结合基序真核OSC 中高度保守的DCTAE 基序,含有1 个β-AS基因标志性基序MWCYCR,含多个加强酶的结构并稳定其碳阳离子中间体的基序QW[11-12]。北柴胡β-AS与其他近源物种一样,在漫长进化的过程保留了必要的功能区域。
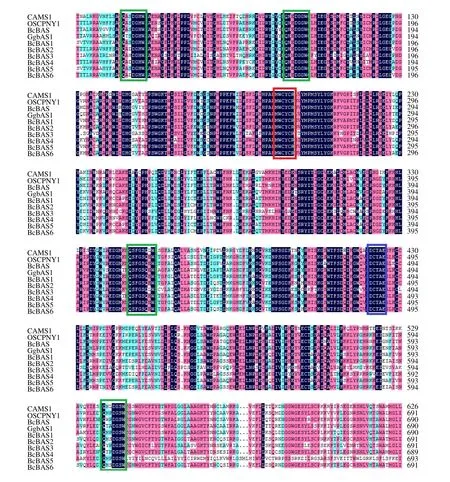
图2 北柴胡β-AS 基因与其他物种的β-AS 基因多序列比对Fig. 2 Comparison of deduced amino acid sequences of β-AS from B. chinense with β-AS from other plants
3.3 北柴胡β-AS 蛋白结构分析
为了进一步了解北柴胡β-AS 蛋白的特征,利用在线软件SMART和MEME对北柴胡β-AS蛋白分析。结果显示,北柴胡β-AS 蛋白所含保守结构的数量和位置大多相似(图3)。BcBAS3含有最多的基序,BcBAS5基序最少。所有北柴胡β-AS 蛋白都含有OSC的保守N-末端结构域和C-末端结构域,以及OSC 特定的氨基酸重复序列[13-14]。对北柴胡β-AS 蛋白进行二级结构和三级结构预测。二级结构分析表明(表2),北柴胡β-AS 蛋白α-螺旋所占比例最大,其次是无规则的卷曲,所占比例最低的是β-折叠,北柴胡β-AS的序列相似。三级结构表明(图4),二级结构进一步折叠较规律,形成的结构也相似,说明北柴胡β-AS编码蛋白可能具有相似的功能。
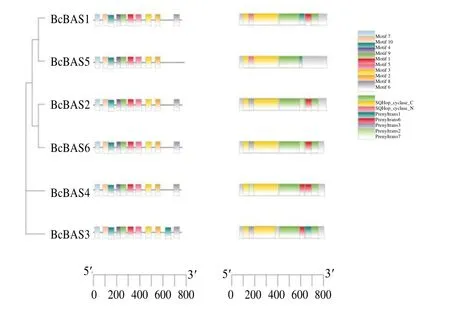
图3 北柴胡β-AS 蛋白保守结构域和motif 分析Fig. 3 Conserved putative motif analysis of β-AS domain proteins in B. chinense
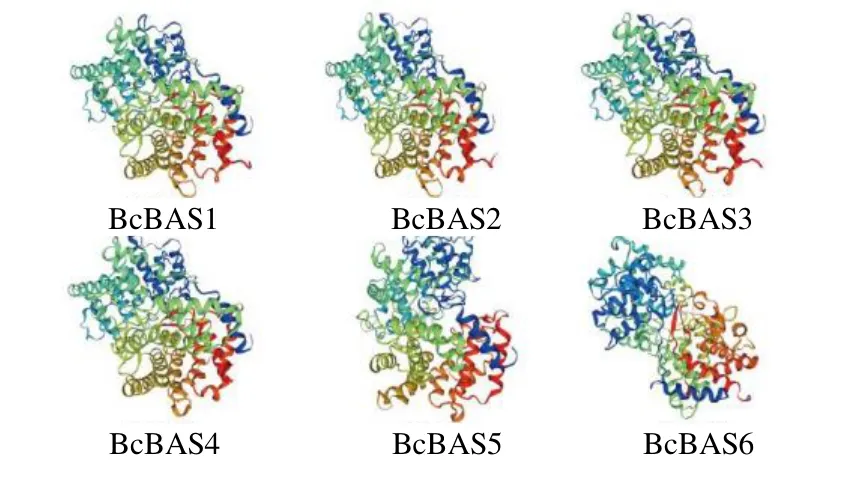
图4 北柴胡β-AS 蛋白三级结构预测Fig. 4 Prediction of tertiary structures of β-AS proteins
3.4 北柴胡β-AS 基因表达分析
为了了解北柴胡β-AS基因表达差异,从北柴胡茉莉酸甲酯(methyl jasmonate,MeJA)处理转录组数据筛选出β-AS基因表达数据绘制热图(图5)。数根据热图分析,北柴胡β-AS基因在根和叶中的表达模式,可将北柴胡β-AS基因分为3 个亚组。BcBAS5单独为一个亚组,在叶中的表达水平更高,表达量最高出现在24 h。BcBAS3、BcBAS6一个亚组,在根中的表达水平显著高于在叶中的表达水平,且在根中持续高表达,有一定的组织表达特异性。BcBAS1、BcBAS2和BcBAS4为一个亚组,该亚组也主要在根中表达,受MeJA 处理的响应更显著。结果表明,BcBAS1、BcBAS2、BcBAS3、BcBAS4和BcBAS6基因在根中的表达受到MeJA 处理显著的诱导,BcBAS5则表现出在叶中的表达受到MeJA 处理影响更显著。
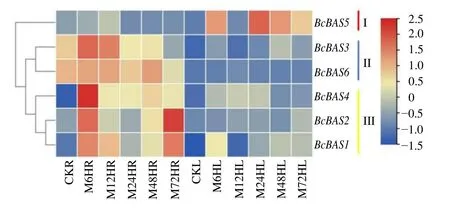
图5 北柴胡β-AS 基因表达分析Fig. 5 Expression analyses of β-AS gene in B. chinense
3.5 北柴胡BcBAS1 重组蛋白表达
本研究成功构建原核表达载体pMALC5E-BcBAS1(图6-A),SDS-PAGE 结果显示在120 000 附近有明显的蛋白条带(图6-B),蛋白条带大小约为119 000(MBP 标签42 000+目的蛋白87 000),为可溶性蛋白,目的蛋白大小与预期的一致。结果表明,在大肠杆菌BL21(DE3)中成功表达了BcBAS1可溶性蛋白。
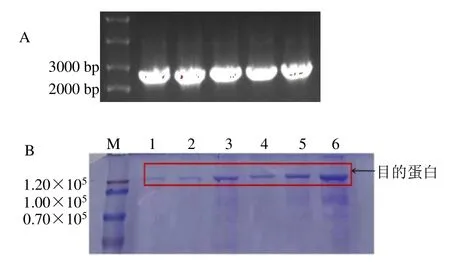
图6 BcBAS1 基因原核蛋白表达分析Fig. 6 SDS–PAGE analysis of expressed recombinant protein of BcBAS1
3.6 北柴胡BcBAS1 基因在烟草过表达
测序无误的烟草过表达载体 pC1300SBcBAS1 转入农杆菌GV3101,菌落PCR 显示载体转入成功(图7-A)。将pC1300S-BcBAS1 在烟草叶片中瞬时表达,以空载pCAMBIA1300S 转入烟草和野生型烟草作为对照,对β-香树脂醇含量进行测定。结果表明(图7-B),与对照的烟草叶片和野生烟草叶片相比,转入pC1300S-BcBAS1载体的转基因烟草叶片中β-香树脂醇含量显著增加,分别是空载对照和野生型的1.77 和1.70 倍。说明β-香树脂醇含量的增加是由BcBAS1基因调控产生,BcBAS1在异源烟草叶片中有效的行使β-AS 的催化功能,促进 β-香树脂醇的积累,BcBAS1基因为编码β-AS基因。
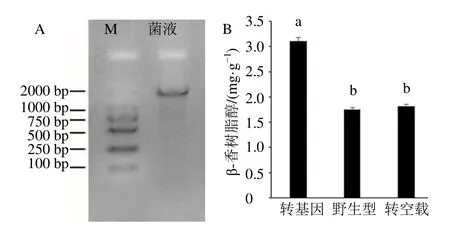
图7 BcBAS1 基因在烟草过表达分析Fig. 7 Overexpression analysis of BcBAS1 gene in tobacco
4 讨论
三萜化合物是一类重要的次生代谢物广泛存在于植物中,其合成调控过程复杂,涉及到多途径多个酶的参与。β-AS 负责齐墩果烷型三萜化合物的骨架构建,对植物三萜的合成类型具有决定性的重要作用,深入研究β-AS 可以帮助人们深入分析三萜化合物的生物合成途径以提高三萜化合物的积累,对β-AS 家族进行鉴定具有重要意义。北柴胡作为亚洲地区重要的中药资源植物,其β-AS基因家族研究仍是空白。本研究共筛选出6 条非冗余的编码区完整的北柴胡β-AS基因,根据已有报道其他植物中β-AS 约有760 个氨基酸,蛋白相对分子质量约为87 000,等电点范围5.70~6.30[4],本研究筛选的6条编码β-AS基因的相关理化性质与之前报道其他的β-AS基因一致。多序列比对表明,北柴胡β-AS均包含了1 个DCTAE、1 个MWCYCR 和多个QW基序,这个结果与已验证功能的北柴胡β-AS基因BcBAS(GenBank 登录号:MN186093)[8]在基序的种类和数量上极为相似,且在进化分析中与BcBAS亲缘关系较近,预测本研究筛选出的北柴胡β-AS也具有与BcBAS相似的功能。
不同植物的β-AS基因在不同组织中的表达存在差异性,苜蓿β-AS基因在不同组织中的表达分析表明其在芽分生组织和茎的转录水平最高[15];藤茶β-AS基因在叶片中表达量最高,茎次之,根中表达量最少[16];北柴胡β-AS基因在根、茎、叶、花、果中均有表达,大多数北柴胡β-AS基因在根中表达量显著高于其他组织[17-18]。本研究筛选的6 条β-AS基因中的5条β-AS基因在根中的表达量显著高于在叶中的表达量,与之前北柴胡研究中β-AS基因的表达部位一致。柴胡皂苷主要产生的部位是根,β-AS基因是柴胡皂苷合成通路基因,主要在根中显著表达,显示了其在根中旺盛的表达可能影响柴胡皂苷的合成。
已有研究表明,植物界很多物种的β-AS基因已被成功克隆并诱导了蛋白表达,如辽东楤木[19]、秦艽[20]、竹节人参[21]等,蛋白大小87 000~90 000。北柴胡β-AS基因BcBAS1主要在根中表达且对MeJA 响应显著,BcBAS1也是课题组前期北柴胡比较转录组研究中筛选出的唯一一个北柴胡β-AS差异基因,具有进一步研究价值。本研究成功对BcBAS1进行了原核蛋白表达,蛋白相对分子质量约87 000,与其他物种β-AS基因表达蛋白大小一致。利用本氏烟草通过烟草瞬时表达BcBAS1,转基因型烟草叶片中β-香树脂醇产量显著高于野生型和空载转化烟草叶片,进一步表明BcBAS1基因具有β-AS 的功能和活性,能促进异源烟草中β-香树脂醇的积累。由于烟草有丰富的代谢途径,能提供的代谢产物种类丰富,不仅能为基因验证提供前体,通过检测催化产物验证基因的功能,还能将烟草作为植物底盘进行次生代谢物的合成。人参皂苷、紫杉醇等三萜化合物的前体已在烟草中成功合成,这为其他三萜化合物以烟草为底盘进行路径解析及异源合成提供了可能[22-23]。
利益冲突所有作者均声明不存在利益冲突
