喜炎平注射液治疗急性扁桃体炎的多中心随机单盲安慰剂平行对照临床研究
2023-06-08张奇芬沈秋莉谢绍华焦深山李玲波赵东铭陈佑生0张湘华贾金广万俐佳孟庆伟冯悦静
丁 彦,张奇芬,沈秋莉,张 敏,谢绍华,李 军,焦深山,李玲波,赵东铭,陈佑生0,丁 震,张湘华,贾金广,万俐佳,许 萍,孟庆伟,冯悦静,张 伟*
1. 赣南医学院第一附属医院,江西 赣州 341000
2. 南昌市洪都中医院,江西 南昌 330000
3. 杭州市临平区妇幼保健院,浙江 杭州 311199
4. 赣州市人民医院,江西 赣州 341000
5. 宜春市人民医院,江西 宜春 336400
6. 九江市第一人民医院,江西 九江 332000
7. 南昌市第三医院,江西 南昌 330000
8. 柳州市工人医院,广西 柳州 545000
9. 洛阳市第一人民医院,河南 洛阳 471000
10. 淄博市中心医院,山东 淄博 255020
11. 合肥市第一人民医院,安徽 合肥 230000
12. 石家庄市人民医院,河北 石家庄 050000
13. 郑州人民医院,河南 郑州 450000
14. 荆州市中心医院,湖北 荆州 434000
15. 南昌大学第四附属医院,江西 南昌 330000
16. 上饶市人民医院,江西 上饶 334000
17. 郑州市第六人民医院,河南 郑州 450000
18. 南昌大学第一附属医院,江西 南昌 330006
急性扁桃体炎是腭扁桃体的一种非特异性急性炎症,属上呼吸道感染,主要致病菌为乙型溶血性链球菌,且多同时伴有程度不等的咽部黏膜和淋巴组织的急性炎症,多发于春秋季节,耳鼻咽喉科常见[1]。病情较轻但发病率高,有时可伴严重并发症,甚至可能为某些传染病前兆(如白喉、麻疹、腥红热等),需积极防治[2]。传统的治疗方法为应用抗生素对症治疗,虽有疗效,但常伴有恶心和胃肠不适等症状;且随着耐药性的增加和抗生素治疗效果的降低,增加了其临床治疗难度[3]。中医认为,急性扁桃体炎发热病例多为实证、热证,辨证多属风热外袭、肺经有热,或邪热传里、肺胃热盛;因而使用疏风清热、消肿解毒的中药治疗急性扁桃体炎可以达到治疗效果[1]:急性扁桃体炎临床治疗经验表明,中医药具有疗效显著、减少抗生素使用、缩短治疗时间等优势。
喜炎平注射液是从中药穿心莲中提取的水溶性穿心莲内酯经磺化后的水溶液制剂。研究表明,喜炎平注射液可通过多种途径抑制病毒和细菌增殖,减轻病原体感染引起的临床症状,并具备良好的抑制炎症及免疫调节作用[4-14]。对单纯和混合感染的急性扁桃体炎均有显著效果[15-17]:包括显著提高治疗有效率,提高扁桃体肿大复常率,有效缩短发热、咳嗽、咽痛等症状或体征的消失时间等。但目前严格设计的临床试验证据较少,且存在疗效判定标准不统一的问题,因而有必要对喜炎平注射液治疗急性扁桃体炎的有效性和安全性进行进一步评价,深入发掘其在治疗扁桃体炎中的优势特色。
1 资料与方法
1.1 一般资料
选取2017 年4 月16 日—2021 年5 月25 日在赣南医学院第一附属医院等18 家中心收治的急性扁桃体炎患者,采用多中心、随机、单盲、安慰剂平行对照设计,评价喜炎平注射液治疗急性扁桃体炎的有效性和安全性,组长单位为南昌大学第一附属医院。诊断标准参照《耳鼻咽喉头颈外科学》第8 版[18]。本试验依据《赫尔辛基宣言》和《药物临床试验质量管理规范》科学和道德原则指导,经南昌大学第一附属医院批准,获得伦理审查批件 [批件编号:(2016)医研伦审第(059)号],并依据喜炎平注射液药品说明书的功能主治、相关指南,进行试验设计。
1.2 样本量的确定
本研究的样本量在假设干预措施对急性扁桃体炎的疾病缓解时间均服从指数分布以及观察对象的数目服从泊松分布的前提下进行估计。采用样本量估算专用软件PASS11.0,按优效性设计估算:α=0.025(单侧),β=0.20,喜炎平组(试验组)和安慰剂组中位疾病缓解时间分别为34 h 和60 h,试验观察期为7 d,预计180 d 内完成入组。按照《药品注册管理办法》对确证性临床和中药注射剂再评价工作指导原则的要求,临床试验样本量参照III 期规模标准,试验组和安慰剂组按比例1∶1 分配。
1.3 纳入和排除标准
1.3.1 纳入标准 (1)性别不限,18~65 周岁;(2)临床症状、体征、实验室检查等确诊符合西医急性扁桃体炎诊断标准;(3)进行入选筛查时,所有症状出现不超过72 h;(4)依从性好,同意研究开始前签署书面的知情书。
1.3.2 排除标准 (1)既往对喜炎平注射液、穿心莲内酯类药物过敏者;(2)妊娠期和哺乳期妇女或研究期间不同意避孕者;(3)经研究者判断,既往或现在患有的疾病可能影响患者参加试验或影响研究的转归,这些疾病包括心肺疾病、恶性病、自身免疫性疾病、肝肾疾患、血液病、神经系统疾病、免疫系统疾病和内分泌疾病;(4)其他研究者认为不适合入选本试验者。
1.4 退出标准
研究者决定退出:(1)出现过敏反应或严重不良事件,根据医生判断应停止试验者;(2)试验过程中患者罹患其他疾病影响疗效和安全性判断者;(3)患者依从性差(试验用药依从性<80%,或>120%),或自动中途换药或加用本方案禁止使用的中西药物者;(4)中途破盲病例;(5)用药后受试者病情加重,按治疗无效病例处理;(6)随机化后,发现严重违反纳入标准或排除标准者。
患者自行退出:受试者向研究者提出退出试验要求或不再接受用药及实验室检查而失访者。
1.5 药物及干预措施
符合入选标准的患者用随机分层区组方法按照1∶1 的比例随机分入试验组、安慰剂组,并随机分配药物编号。本研究为单盲试验,仅对患者保持盲态。
试验组:常规治疗联合喜炎平注射液(批号2017012103、2018032403、2019042303、2020011503,江西青峰药业有限公司);安慰剂组:常规治疗联合喜炎平模拟注射液(0.9%氯化钠注射液,批号C17042201,四川科伦药业股份有限公司;批号1118022404、1119120502,安徽丰原药业股份有限公司)。喜炎平注射液或安慰剂用法用量:每天10~20 mL,以0.9%氯化钠注射液100~250 mL 稀释后静脉滴注(不得与其他药物在同一容器内混合使用),控制滴速30~40 滴/min,1 次/d。给药后,患者须在医学监护下60 min 以观察安全性。疗程≤7 d。常规治疗:一般应用抗生素(克林霉素、阿奇霉素等)及补液、维持电解质平衡等措施进行对症治疗。
1.6 剂量选择
本研究为上市后研究,根据喜炎平注射液的药品说明书,喜炎平注射液用于成人患者的剂量为静脉滴注250~500 mg/d,因此本研究规定患者单次剂量为250~500 mg 即10~20 mL(规格5 mL∶125 mg/支)。
1.7 评价指标
试验组和安慰剂组所有患者均须在从接受用药开始对急性扁桃体炎相关的症状(咳嗽、发冷/出汗、咽喉痛)进行评估,每日早、中、晚各记录1 次(同一时间段),记录持续至第(7±2)d 或直到全部症状缓解(“无”或者“轻度”),用于有效性分析。
1.7.1 主要指标 疾病持续时间,定义为从药物开始使用到全部临床症状(发热、咽痛等)得到缓解的时间,即达到“无”或者“轻度”。发热缓解定义为体温<37.5 ℃(腋下),且保持24 h 或以上;咽喉部体征缓解定义为咽痛和扁桃体内的脓性分泌物完全消失。
1.7.2 次要指标 (1)记录咽痛、发冷/出汗、热程(发热)各单项症状缓解时间;(2)记录统计继发并发症和抗菌药使用时间;(3)细菌清除率,取治疗前后留取患者痰液或咽拭子标本行细菌培养,若治疗后原感染部位的标本未培养出原感染的致病菌认为细菌学结果为清除。
1.8 安全性评价
观察和记录所有的不良事件和严重不良反应,全身体格检查、生命体征、实验室检查(血液学检查、血生化、尿常规、大便常规)、心电图的改变等。
1.9 统计学分析
有效性分析:对两组的主要指标及次要指标组间比较的统计分析分别基于全分析集(full analysis set,FAS)和符合方案集(per-protocol set,PPS)。对主要指标采用优效检验:使用Cox 比例风险模型计算试验药物效应,估计试验组与安慰剂组相比的风险比(hazard ratio,HR)及其95%置信区间(confidence interval,CI),若95%CI 的下限>1,则优效性成立。主要指标疾病持续时间比较时,采用Kaplan-Meier 法计算受试者治疗后各时间点的疾病缓解率,并计算疾病持续时间的25%、50%、75%分位数及其95%CI,绘制曲线图。所有使用过研究用药的患者均纳入安全性分析集(security set,SS),研究药物与不良事件的关系为肯定有关、很可能有关、可能有关的不良事件定义为不良反应。计量指标的组内治疗前后指标值的比较用配对t检验或秩和检验,组间比较用成组t检验或t′检验。计数指标采用四格表检验或确切概率法(Fisher 法)。等级指标组内比较采用Wilcoxon 秩和检验,组间比较采用Wilcoxon 秩和检验。数据分析采用SAS9.3 统计分析软件计算,所有的统计学检验均采用双侧检验,P≤0.05 被认为所检验的差异具有统计学意义(特别说明的除外)。
2 结果
2.1 研究流程与分析集
研究计划入组512 例,实际纳入463 例患者进行随机分组,试验组230 例,安慰剂组233 例;共458 例患者纳入FAS 集,试验组228 例,安慰剂组230 例;共414 例患者纳入PPS 集,试验组205 例,安慰剂组209 例,研究纳入患者流程见图1。
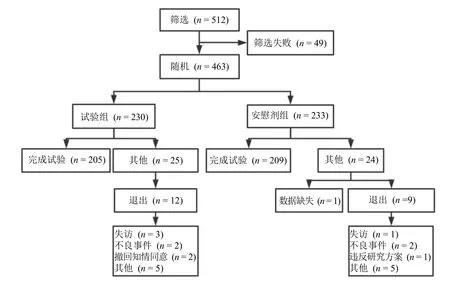
图1 纳入患者流程图Fig. 1 Flow chart of patients included in study
2.2 基线特征
FAS 集中,试验组与安慰剂组的人口统计学信息和基线特征差异均无统计学意义,具有可比性。试验组和安慰剂组男性分别占38.6%、43.9%,汉族分别占96.9%、96.7%,平均年龄分别为33.7(18,63)岁、31.5(17,64)岁。试验组和安慰剂组中,大部分患者无药物过敏史(94.7%vs95.2%)、药物治疗史(68.9%vs64.8%)及其他治疗史(99.1%vs99.1%),患有其他疾病及用药的患者比例较低(27.2%vs30.4%),主要为高血压、低钾血症、贫血等。两组患者入院症状、体征分布情况相似。入组患者常见的症状为咳嗽、咽喉痛,少部分患者有发热的表现。入组患者最高体温为39.7 ℃,试验组中平均体温为37.00 ℃,安慰剂组中平均体温为36.97 ℃。所有受试者均患有扁桃体炎、体格检查头部和神经系统检查均正常。
2.3 主要指标分析
FAS 分析集试验组和安慰剂组中最终分别有226例和227 例患者纳入分析(5 例患者首次给药前已缓解),通过Kaplan-Meier 分析7 d 每日累计疾病缓解率,结果见表1。从表1 可以看出,试验组治疗早期(1~4 d)疾病缓解率优于安慰剂组(P<0.05)。
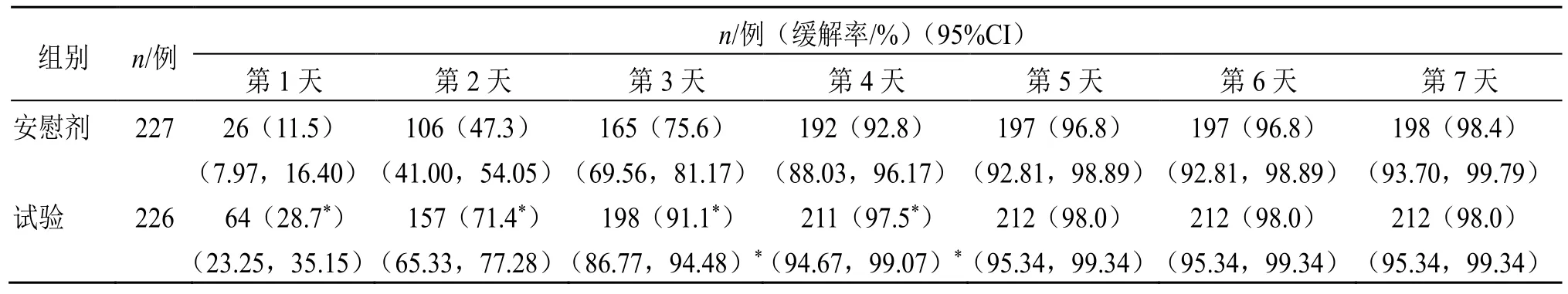
表1 急性扁桃体炎症状缓解时间Kaplan-Meier 分析 (FAS)Table 1 Kaplan-Meier analysis of symptom remission time of acute tonsillitis (FAS)
试验结束时试验组和安慰剂组疾病缓解率分别为93.81%(212/226)和87.22%(198/227)。对FAS集患者采用Log-Rank 检验两组缓解曲线,存在统计学差异(P<0.05),见图2。试验组中位扁桃体炎缓解时间为38.2(32.5,40.8)h,显著优于安慰剂组50.9(45.9,54.3)h,差异具有统计学意义(P<0.05),见表2。优效性结果显示,两组间HR及95%CI为1.750(1.432,2.138),说明试验组喜炎平注射液相比于安慰剂具有优效性。PPS 分析集的主要疗效指标结果与FAS 分析集相似。
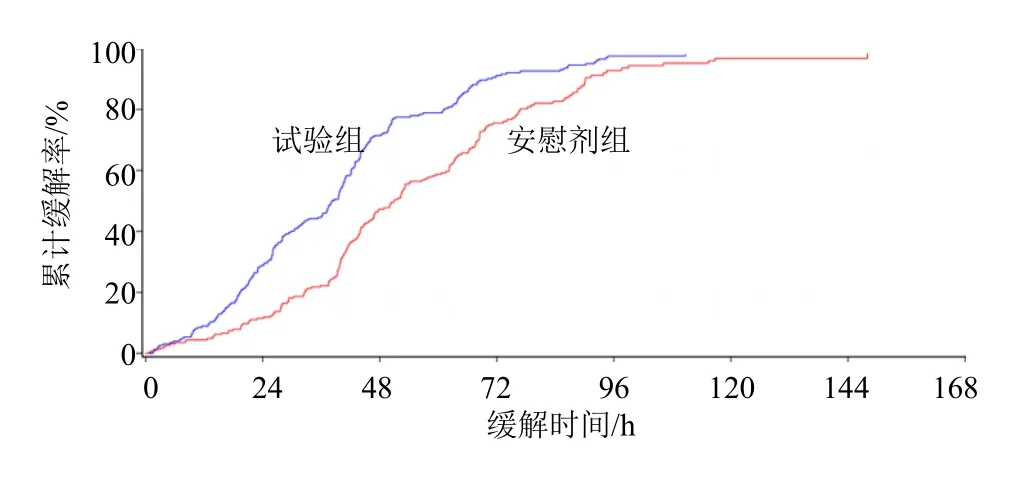
图2 急性扁桃体炎症状缓解时间曲线 (FAS)Fig. 2 Curve of symptom remission time of acute tonsillitis(FAS)
2.4 次要指标分析
2.4.1 各单项症状缓解时间 患者从研究用药开始对急性扁桃体炎相关症状进行评估,每日早、中、晚各记录1 次,FAS 集统计结果见表3。
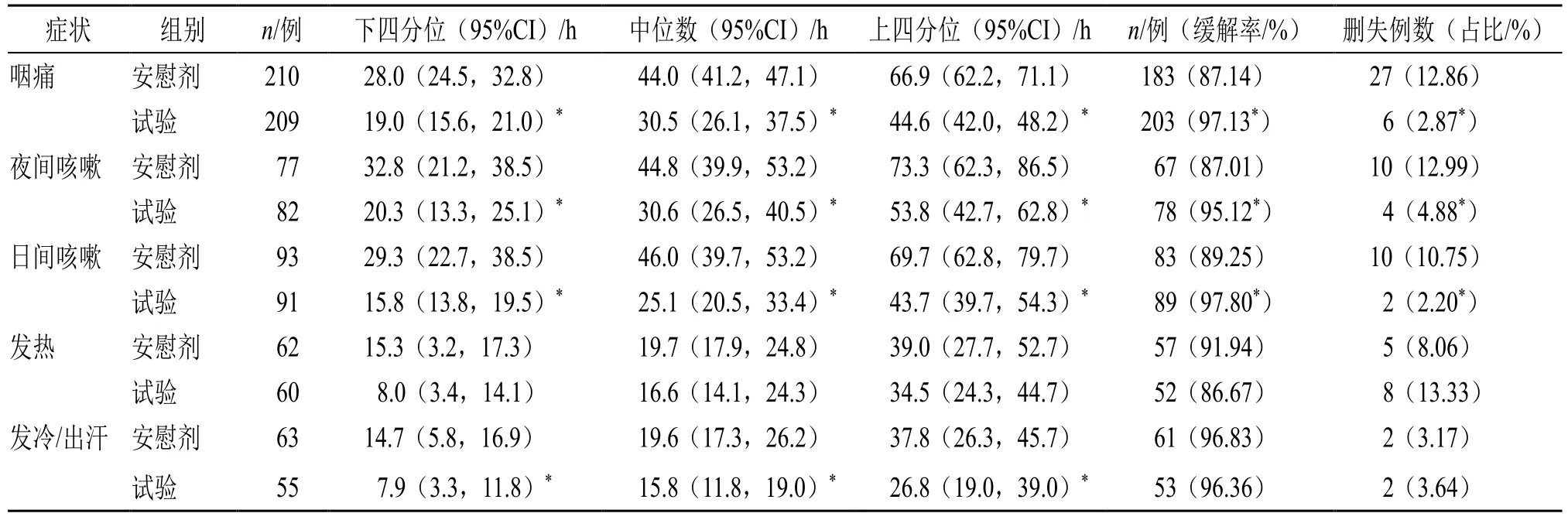
表3 各单项症状缓解时间 (FAS)Table 3 Each individual symptom remission time (FAS)
(1)咽痛:试验组中位咽痛缓解时间为30.5(26.1,37.5)h,显著优于安慰剂组的44.0(41.2,47.1)h,差异具有统计学意义(P<0.05)。
(2)夜间咳嗽:试验组中位缓解时间为30.6(26.5,40.5)h,安慰剂组为44.8(39.9,53.2)h,差异具有统计学意义(P=0.003<0.05)。
(3)日间咳嗽:试验组中位缓解时间为25.1(20.5,33.4)h,安慰剂组为46.0(39.7,53.2)h,差异具有统计学意义(P<0.05)。
(4)发冷/出汗:试验组中位发冷/出汗缓解时间为15.8(11.8,19.0)h,安慰剂组为19.6(17.3,26.2)h,差异具有统计学意义(P<0.05)。
(5)热程(发热):试验组中位发热缓解时间为16.6(14.1,24.3)h,安慰剂组为19.7(17.9,24.8)h,差异无统计学意义。PPS 分析集次要指标结果与FAS 分析集相似。
2.4.2 抗菌药使用时间 试验组和安慰剂组抗菌药物使用中位时间分别为4.0(4.0,5.0)d 和5.0(NE,NE)d(NE 表示不可估计),试验组在抗菌药物使用时间上有优势,但差异无统计学意义。
2.4.3 细菌清除率 对痰培养或咽拭子检查基线为阳性的36 例患者进行细菌清除情况分析,试验组细菌清除率70.00%(14/20),安慰剂组细菌清除率56.25%(9/16),差异无统计学意义。
2.4.4 继发并发症 试验组1 例患者发生继发病症(0.4%),按首选术语分类为肺部感染。安慰剂组无继发病症发生。
PPS 分析集上述次要指标结果与FAS 分析集相似。
2.5 安全性评价
SS 共纳入458 例患者(试验组228 例,安慰剂组230 例)。研究药物与不良事件的关系为肯定有关、很可能有关、可能有关的不良事件定义为不良反应。本研究中试验组和安慰剂组的总体不良事件发生率相似(25.9%vs23.5%),转归均为恢复;大多数患者者严重程度均为中轻度。主要不良事件为白细胞计数降低、中性粒细胞计数降低、中性粒细胞百分比降低、丙氨酸氨基转移酶升高等。安慰剂组发生中性粒细胞计数降低患者略高于试验组(1.8%vs4.8%),安慰剂组肝功能异常与试验组接近(1.3%vs0.9%)。试验组发生2 例严重不良事件(0.9%,2 例次),安慰剂组无严重不良事件。试验期间共发生9 例不良反应(2.0%,13 例次),不良反应发生类型有各类检查如丙氨酸氨基转移酶升高等,皮肤及其附件系统疾病如荨麻疹,胃肠系统疾病如恶心、呕吐等,发生类型基本与说明书报道一致。未发生与试验药物有关的严重不良反应,临床使用安全性良好。安慰剂组无不良反应发生。
3 讨论
急性扁桃体炎为腭扁桃体的急性非特异性炎症,常伴有不同程度的咽黏膜和淋巴组织炎症,是1 种常见的咽部疾病。喜炎平注射液在我国临床上应用广泛,是急性扁桃体炎最常用的治疗用药之一,但迄今为止仍没有高质量的随机对照试验确证其有效性和安全性。本研究是首个在常规治疗基础上联合喜炎平注射液治疗急性扁桃体炎的多中心、随机、单盲、安慰剂平行对照临床研究。
本研究发现,在基于《耳鼻咽喉头颈外科学》第8 版[18]选用相应的抗菌药物基础上,喜炎平注射液联合抗生素治疗可以使中位扁桃体炎缓解时间缩短12.7 h,试验组/安慰剂组的HR 及其95%CI 为1.750(1.432,2.138),其95%CI 下限>1,说明喜炎平注射液相比于安慰剂具有优效性。同时,常规治疗基础上联合喜炎平注射液治疗可显著缩短各单项症状缓解时间,咽痛、发冷/出汗的中位缓解时间分别可缩短13.5、3.8 h。此外,常规治疗基础上联合喜炎平注射液治疗可缩短热程(发热)中位缓解时间3 h,提高细菌清除率约15%,但是2 个指标差异不具有统计学意义。联合用药可缩短抗菌药物使用中位时间1 d(4 dvs5 d),但是该指标不具有显著差异,且联合用药时1 例患者发生继发病症(肺部感染),安慰剂组无继发病症发生。
安全性方面,试验组的不良反应发生率为3.9%(9/228),不良反应发生类型有各类检查,如丙氨酸氨基转移酶升高等;皮肤及其附件系统疾病,如荨麻疹;胃肠系统疾病,如恶心、呕吐等。发生类型基本与说明书报道一致。未发生与试验药物有关的严重不良反应,因不良反应脱落1 例,不良反应类型为心悸,停药后恢复,未采用对症处理措施。临床使用安全性良好。
因此,认为使用喜炎平注射液治疗急性扁桃体炎的收益-风险平衡是有利的。从这项研究中获得的重要信息可能会对未来急性扁桃体炎患者有益,有助于未来的患者选择更有效、更经济的治疗药物。
与既往研究一致,喜炎平注射液联合常规治疗可以使中位扁桃体炎缓解时间显著缩短,较安慰剂联合常规治疗急性扁桃体炎具有优效性。喜炎平注射液联合常规治疗在提高扁桃体炎缓解率,显著缩短咽痛、发冷/出汗缓解时间的同时,一定程度上可缩短热程(发热)中位缓解时间,提高细菌清除率,缩短抗菌药物使用中位时间。由中国中医科学院临床基础医学研究所牵头的前瞻性、大样本安全性研究结果显示,喜炎平注射液相关不良反应发生率为0.075%,均为一般常见不良反应,以皮疹、瘙痒、发热、寒战为主,经停药及对症处理后均治愈[18]。因此,对目前日益增多的混合感染及抗生素耐药的急性扁桃体炎患者,采用喜炎平注射液治疗有独特的优势,或可补充或替代抗生素的使用,达到增强治疗效果、减轻患者痛苦、调节患者身体防御机能、促进患者康复的临床效果。
本研究尚存在一些局限性或不足:(1)热程(发热)缓解及细菌清除率、痰培养或咽拭子检查基线为阳性受试者较少,因此该结果仅有提示意义,其准确性需要进一步研究证实;(2)未考虑基于中医证型对患者进行分组,未来需要更多研究进一步探索有效的最佳获益人群(证型、疾病严重程度等)。
4 注册信息
本项临床试验已在Clinical Trials.gov 注册,注册号为NCT03134443。
利益冲突所有作者均声明不存在利益冲突
