基于多途径联合效应的甘草防治脓毒血症活性成分筛选及作用机制研究
2023-06-08梁龙鑫任璐彤刘婷婷肖小河柏兆方
梁龙鑫,任璐彤,刘婷婷,高 源,徐 广,肖小河*,柏兆方
1. 江西中医药大学药学院,江西 南昌 330004
2. 解放军总医院 第五医学中心 肝病医学部,北京 100039
3. 内蒙古自治区人民医院 药学处,内蒙古 呼和浩特 010010
4. 遵义医科大学第三附属医院(遵义市第一人民医院),贵州 遵义 563002
5. 首都医科大学中医药学院,北京 100069
甘草始载于《神农本草经》,为豆科植物甘草GlycyrrhizauralensisFisch.、胀果甘草G.inflataBat.或光果甘草G.glabraL.的干燥根和根茎,味甘性平,具有清热解毒、补气益脾、祛痰、止咳、缓急止痛、调和诸药等功效,常用于临床,且素有“十方九草”之称[1]。此外,甘草作为我国传统的药食两用类中药,广泛应用于食品、保健品等多个领域。现代药理学研究表明,甘草具有保肝、抗炎[2]、抗病毒[3]、抗氧化[4]、抗纤维化[5]、抗肿瘤[6]等多种药理活性,目前已被开发为复方甘草片、甘草酸二铵胶囊等多种中成药制剂。
脓毒血症是一种感染性的炎症反应综合征,可导致多种器官功能性障碍,具有发病率高、病死率高等特点[7],其发病机制较为复杂,涉及炎症反应、氧化应激等系列机体反应,现阶段虽然常规用药如广谱抗菌类药物、糖皮质激素等,均可起到良好的治疗效果,但临床应用中往往存在一定的局限性,如抗生素在明确感染细菌种类的早期脓毒血症的防治中可发挥较好的治疗效果,但长期使用易产生耐药性[8];大剂量、短疗程的糖皮质激素治疗方案可能引起继发性感染[9]。脓毒血症发病迅速,病情凶险,临床亟需针对脓毒血症发病传变特点的药物以实现临床药物的精准用药。
甘草及其成分具有调节促炎及抗炎细胞因子水平、提高免疫细胞活性等免疫调节作用[10-17]。课题组基于前期工作基础,针对甘草展开了系列免疫活性研究[18-21]。本研究发现刺甘草查耳酮、甘草酸是甘草中较强的抗炎、抗氧化的活性成分,多种成分在体内通过调节多个靶点产生多个效应从而起到治疗疾病的作用,并对比研究了二者联合用药在脂多糖(lipopolysaccharide,LPS)诱导的脓毒血症模型中的作用效果,以期初步阐明甘草活性成分协同抗脓毒血症的药效特征,为甘草相关制剂的新药研发提供实验基础。
1 材料
1.1 动物
SPF 级C57BL/6 WT 雌性小鼠,6~8 周龄,体质量18~22 g,购自斯贝福生物技术有限公司,动物合格证号SCXK(京)2019-0010,饲养于解放军总医院第五医学中心动物实验室,温度21~24 ℃,12 h 光暗循环。动物实验经中国人民解放军总医院第五医学中心批准,符合《实验动物管理条例》要求,动物实验伦理批准号为IACUC-2021-0012。
1.2 药品与试剂
甘草苷、甘草素、甘草次酸、芹糖异甘草苷、芒柄花苷、光甘草定、刺甘草查耳酮、甘草酸、H2DCFDA探针、巨噬细胞集落刺激因子(macrophage colony stimulating factor,M-CSF)、NOD 样受体热蛋白结构域相关蛋白3(NOD-like receptor thermal protein domain associated protein 3,NLRP3)炎症小体抑制剂MCC950(批号分别为HY-N0376、HY-N0377、HYN0180、HY-N2497、HY-N0270、HY-N0393、HY-N0269、HY-N0184、HY-D0940、HY-P7085、HY-12815A)均购自美国MedChemExpress 公司,化合物质量分数均>98%;异甘草苷、甘草酸单铵(批号分别为T5S0331、T6384,质量分数>99%)购自TargetMol 公司;甘草提取物(批号DST20220215)购自成都乐美天医药科技有限公司;DMEM 培养基、胎牛血清、Opti-MEM 培养基(批号分别为11965092、C0232、2427634)均购自美国Gibco 公司;二甲基亚砜(dimethyl sulfoxide,DMSO)、PBS(批号分别为QN0746、SNM249)购自北京百奥莱博科技有限公司;Lamin B 抗体(批号17416)购自美国CST 公司;半胱氨酸天冬氨酸蛋白酶-1(cystein-asparate protease-1,Caspase-1)抗体(批号AG-20B-004)购自安诺伦(北京)生物科技有限公司;Ly-6G/Ly-6C 抗体、F4/80 抗体、CD11b 抗体(批号分别为108407、123108、101212)均购自Biolegend 公司;总超氧化物歧化酶(superoxide dismutase,SOD)活性检测(NBT 法)试剂盒(批号S0109)购自上海碧云天生物技术有限公司;细胞增殖与活性检测(CCK-8 法)试剂盒(批号ck04-500T)购自上海同仁药业股份有限公司;IL-1β、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA 检测试剂盒(批号分别为1210602、1217202)购自达科为生物技术有限公司;LPS、尼日利亚菌素、H2O2(批号分别为L2880、N7143、323381)购自美国Sigma-Aldrich 公司;抗小鼠IgG 二抗(批号115-035-003)购自美国Jackson Immuno Research 公司。
1.3 仪器
HERAcell VIOS 160i 型CO2培养箱、TGL-18M型低温高速离心机(美国Thermo Fisher Scientific 公司);SpectraMax iD5 型酶标仪(美国Promega 公司);PowerPac HC 型电泳仪、Trans-Blot 型转印槽(美国Bio-Rad 公司);FACSCantoTMII 型流式细胞仪(美国BD 公司)。
2 方法
2.1 小鼠骨髓来源巨噬细胞(bone marrow-derived macrophages,BMDM)的制备及培养
小鼠经乙醚麻醉后脱颈处死,使用75%乙醇浸泡消毒30 min,无菌操作台中分离小鼠胫骨,用37 ℃预热的DMEM 培养基(含10%胎牛血清、1%青霉素-链霉素)冲洗骨髓腔,使胫骨内容物均被冲出,收集混合液,加入50 ng/mL M-CSF,吹打混匀,放入培养基,置于5% CO2、37 ℃的培养箱中培养5~7 d 后,得到BMDM 细胞。
2.2 NLRP3 炎症小体激活模型筛选甘草中10 种活性成分
2.2.1 Western blotting 检测细胞上清液中Caspase-1 p20 及细胞裂解液中 Caspase-1 p45 蛋白表达BMDM 以1×106个/mL 接种于12 孔板中,培养24 h,待细胞贴壁完全后,更换为含50 μg/L LPS 的培养液,恒温培养4 h。弃上清,分别加入含40 μmol/L甘草苷、甘草素、异甘草苷、甘草次酸、芹糖异甘草苷、甘草酸单铵、芒柄花苷、光甘草定、刺甘草查耳酮、甘草酸的培养液,恒温培养1 h,加入NLRP3炎症小体激活剂尼日利亚菌素(7.5 μmol/L)刺激30 min,另设置不含药物的对照组,收集细胞及上清液。细胞上清液加入1/4 体积的三氯乙酸,于-20 ℃储存2 h 以上,待蛋白沉淀后,4 ℃、12 000 r/min离心15 min,弃上清,加入冰丙酮以清洗蛋白。弃去丙酮,加入1×Loading Buffer,混匀后制成上清蛋白样品。细胞加入裂解液提取蛋白,加入1×Loading Buffer,金属浴煮沸15 min 使蛋白变性,得到细胞裂解蛋白样品。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF 膜,封闭后加入一抗孵育,洗涤后加入二抗孵育,显影[22]。
2.2.2 细胞上清液中IL-1β 水平检测 按照ELISA试剂盒说明书检测细胞上清液中IL-1β 水平。
2.3 体外氧化应激模型筛选甘草中10 种活性成分
2.3.1 CCK-8 法检测 H2O2对细胞活性的影响BMDM 以1×106个/mL 接种于96 孔板中,培养24 h,待细胞贴壁完全后,分别加入0、50、100、200、400、600、800、1000 μmol/L 的H2O2,每组设3 个复孔,于培养箱中培养12 h。弃去上清液,避光加入CCK-8 试剂,孵育30 min,采用酶标仪测定吸光度(A)值。
2.3.2 ROS 水平的检测 BMDM 以1.2×106个/mL接种于6 孔板中,培养24 h,待细胞贴壁完全后,分别加入含40 μmol/L 甘草苷、甘草素、异甘草苷、甘草次酸、芹糖异甘草苷、甘草酸单铵、芒柄花苷、光甘草定、刺甘草查耳酮、甘草酸的培养液,恒温培养1 h 后,加入200 μmol/L H2O2培养16 h,另设置不含药物的对照组,清洗细胞,后加入H2DCFDA 探针,避光孵育30 min,使用流式细胞仪检测ROS 水平。
2.4 CCK-8 检测刺甘草查耳酮和甘草酸对细胞活性的影响
2.4.1 刺甘草查耳酮和甘草酸对BMDM 活性的影响 BMDM 以1×106个/mL 接种于96 孔板中,培养24 h,待细胞贴壁完全后,分别加入0、31.25、62.5、125、250、500、1000 μmol/L 甘草酸或0、5、10、20、40、60、80 μmol/L 刺甘草查耳酮,每组设3 个复孔,于培养箱中培养12、24 h,检测A值。
2.4.2 刺甘草查耳酮和甘草酸对 H2O2刺激的BMDM 活性的影响 BMDM 以1×106个/mL 接种于96 孔板中,培养24 h,待细胞贴壁完全后,分别加入200 μmol/L 甘草酸或40 μmol/L 刺甘草查耳酮,恒温培养1 h 后,加入400 μmol/L H2O2培养12 h,检测A值。
2.5 刺甘草查耳酮和甘草酸对细胞SOD 活性的影响
BMDM 以1.2×106个/mL 接种于6 孔板中,培养24 h,待细胞贴壁完全后,分别加入200 μmol/L甘草酸或40 μmol/L 刺甘草查耳酮,再加入400、600 μmol/L H2O2诱导氧化损伤,刺激12 h,按试剂盒说明书检测SOD 活性。
2.6 Western blotting 检测刺甘草查耳酮和甘草酸对细胞上清液中Caspase-1 p20 及细胞裂解液中Caspase-1 p45 蛋白表达的影响
BMDM 以1×106个/mL 接种于12 孔板中,培养24 h,待细胞贴壁完全后,更换为含50 μg/L LPS的培养液,恒温培养4 h。弃上清,分别加入含25、50、100、200 μmol/L 甘草酸或5、10、20、40 μmol/L刺甘草查耳酮的培养液,恒温培养1 h,加入7.5 μmol/L 尼日利亚菌素刺激30 min,另设置不含药物的对照组,收集细胞及上清液。采用Western blotting检测细胞上清液中Caspase-1 p20 及细胞裂解液中Caspase-1 p45 蛋白表达。
2.7 ELISA 检测刺甘草查耳酮和甘草酸对细胞上清液中IL-1β 水平的影响
取“2.6”项下细胞上清液,按照ELISA 试剂盒说明书检测细胞上清液中IL-1β 水平。
2.8 刺甘草查耳酮和甘草酸对LPS 诱导的脓毒血症致死模型小鼠生存率的影响
基于课题组前期研究[18]及预实验结果,将甘草酸与刺甘草查耳酮的基础给药剂量均设置为20 mg/kg。MCC950 作为NLRP3 炎症小体的抑制剂,可以延长LPS 诱导的脓毒血症小鼠的存活率[23-24],本实验将其作为阳性对照药,并根据课题组前期对炎症小体抑制的实验结果[18-19],MCC950 剂量为40 mg/kg。小鼠适应性喂养3 d 后,随机分为模型组,甘草酸低、高剂量(20、40 mg/kg)组,刺甘草查耳酮低、高剂量(20、40 mg/kg)组,甘草酸(20 mg/kg)-刺甘草查耳酮(20 mg/kg)组和MCC950(40 mg/kg)组,每组12 只。造模前小鼠禁食8 h,各给药组ip 相应药物,模型组ip 等体积的含5%DMSO 和5%聚山梨酯-80 的生理盐水溶液,预给药1 h 后,小鼠ip LPS(20 mg/kg)诱导脓毒性休克,持续观察小鼠死亡情况,每2 小时记录小鼠死亡只数,绘制生存率曲线。
2.9 刺甘草查耳酮和甘草酸对LPS 诱导的脓毒血症小鼠模型炎症因子水平的影响
小鼠适应性喂养3 d 后,随机分为对照组、模型组、MCC950(40 mg/kg)组、甘草提取物(1.3 g/kg)[25]组、刺甘草查耳酮(20 mg/kg)组、甘草酸(20 mg/kg)组和甘草酸(20 mg/kg)-刺甘草查耳酮(20 mg/kg)组,每组8 只。造模前小鼠禁食8 h,各给药组ig 甘草提取物或ip MCC950、刺甘草查耳酮、甘草酸,对照组和模型组ig 生理盐水或ip 含5% DMSO 和5%聚山梨酯-80 的生理盐水溶液,预给药1 h 后,造模小鼠ip LPS(20 mg/kg),对照组小鼠ip 等体积的生理盐水,3 h 后取材,收集腹腔灌洗液以及眼眶血。采用颈椎脱臼法处死小鼠,将在冰浴中预冷的PBS 注入小鼠腹腔内,轻揉小鼠腹部2 min,随后取出腹腔内的PBS,得到腹腔灌洗液。将腹腔灌洗液分出部分用于ELISA 试剂盒检测IL-1β 和TNF-α,其余用于提取渗出细胞。渗出细胞使用F4/80 抗体对巨噬细胞进行染色,用CD11b 抗体及Ly6C/Ly6G 抗体对中性粒细胞进行染色,使用流式细胞仪进行细胞计数。按试剂盒说明书测定外周血和腹腔灌洗液中IL-1β 和TNF-α 水平。
2.10 统计学分析
采用SPSS v23.0 和GraphPad Prism 9.0.0 软件对实验数据进行统计学分析,结果以±s表示,组间差异比较用单因素方差分析处理;生存曲线由GraphPad Prism 9.0.0 绘制,组间差异采用log-rank test。
3 结果
3.1 NLRP3 炎症小体激活模型筛选甘草活性成分
本研究建立了体外NLRP3 炎症小体激活模型,对甘草中10 种活性成分(甘草苷、甘草素、异甘草苷、甘草次酸、芹糖异甘草苷、甘草酸单铵、芒柄花苷、光甘草定、刺甘草查耳酮、甘草酸)抑制NLRP3 炎症小体激活的效应进行了筛选,结果表明,刺甘草查耳酮可显著抑制尼日利亚菌素诱导的细胞上清液中Caspase-1 p20 的蛋白表达(P<0.001,图1-A、B),对Caspase-1 p45 蛋白表达没有显著影响(图1-C),同时显著抑制IL-1β 分泌(P<0.05,图1-D),与课题组前期研究结果一致[17],故认为刺甘草查耳酮作为甘草中抑制NLRP3 炎症小体经典通路的标志性成分,拟将其选为后续联合使用的小分子之一。

图1 NLRP3 炎症小体激活模型筛选甘草活性成分 (±s, n = 3)Fig. 1 Screening of active components of Glycyrrhizae Radix et Rhizoma by NLRP3 inflammasome activation model (±s,n = 3)
3.2 体外氧化应激模型筛选甘草活性成分
采用H2O2建立体外氧化应激模型,首先对H2O2的细胞毒性进行了检测,结果显示H2O2的半数抑制浓度(half inhibitory concentration,IC50)值为491.6 μmol/L(图2-A),因此选用可诱导氧化应激产生且相对安全的浓度200 μmol/L 作为刺激浓度。如图2-B 所示,甘草中10 个活性成分均可显著抑制H2O2诱导的ROS 产生(P<0.05、0.01、0.001),其中甘草酸抑制效果最佳。因此,本实验将刺甘草查耳酮、甘草酸作为组分联合的研究对象进行下一步的研究。
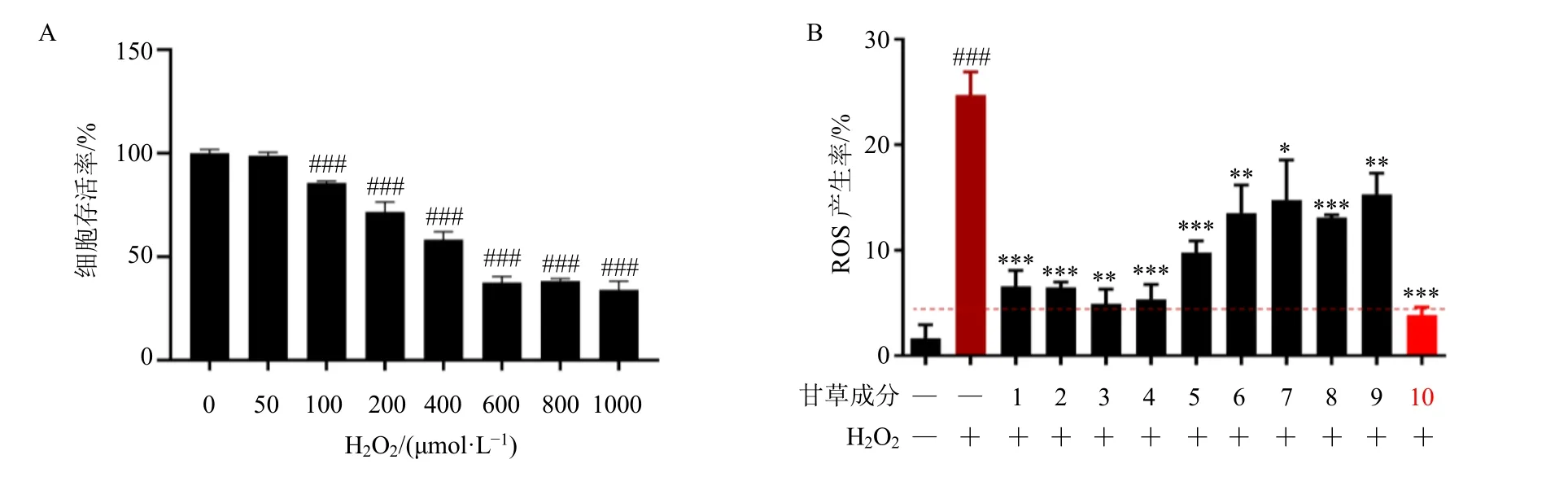
图2 体外氧化应激模型筛选甘草活性成分 (±s, n = 3)Fig. 2 Screening of active components of Glycyrrhizae Radix et Rhizoma by in vitro oxidative stress model (±s, n = 3)
3.3 刺甘草查耳酮、甘草酸的细胞毒性及抗氧化应激作用
根据上述实验结果,本研究筛选出了甘草10 个成分中抑制炎症小体激活及抗氧化应激作用最强的2 个活性成分——刺甘草查耳酮、甘草酸,接下来对二者的细胞毒性进行考察,发现24 h 内二者均未出现明显的细胞毒性(图3-A、B),刺甘草查耳酮和甘草酸可显著抑制H2O2刺激的细胞活性降低(P<0.05、0.01,图3-C)。研究表明,H2O2诱导细胞产生ROS 并进入氧化应激状态,SOD 活性降低[26-28]。如图3-D 所示,甘草酸显著上调H2O2诱导的细胞中SOD 活性(P<0.01、0.001),表明甘草酸具有恢复SOD 活性的效应。

图3 刺甘草查耳酮、甘草酸的细胞毒性和抗氧化应激作用 (±s, n = 3)Fig. 3 Cytotoxicity and anti-oxidative stress effect of echinatin and glycyrrhizic acid (±s, n = 3)
3.4 刺甘草查耳酮、甘草酸对NLRP3 炎症小体的影响
进而对不同浓度的刺甘草查耳酮、甘草酸抑制NLRP3 炎症小体的效应进行研究,如图4 所示,刺甘草查耳酮可剂量相关性地抑制尼日利亚菌素诱导的细胞上清液中Caspase-1 p20 蛋白表达以及炎症因子IL-1β 的释放(P<0.01、0.001),但各剂量的甘草酸对细胞上清液中Caspase-1 p20 的蛋白表达以及IL-1β 的释放均无明显作用,且二者对细胞裂解液中Caspase-1 p45 的蛋白表达均无明显影响。进一步地确定了刺甘草查耳酮、甘草酸抗炎、抗氧化应激的效果,下一步的实验中将对比研究刺甘草查耳酮-甘草酸组分联合在脓毒血症疾病模型的作用效果。

图4 刺甘草查耳酮、甘草酸对NLRP3 炎症小体的影响 (±s, n = 3)Fig. 4 Effects of echinatin and glycyrrhizic acid on NLRP3 inflammasome (±s, n = 3)
3.5 刺甘草查耳酮-甘草酸提高LPS 诱导的脓毒血症致死模型小鼠的生存率
研究表明,ip LPS 可诱导小鼠脓毒血症,机体产生激烈的免疫反应以对抗外来致病原,产生过激的炎症反应从而导致小鼠死亡[29]。如图5 所示,与模型组比较,刺甘草查耳酮、甘草酸均可延长小鼠的存活时间(P<0.05、0.001),降低72 h 内的死亡率;且刺甘草查耳酮-甘草酸联合更有优势,其治疗脓毒性休克的效果强于单独给予低、高剂量的甘草酸及低剂量的刺甘草查耳酮和阳性对照药物MCC950。

图5 刺甘草查耳酮、甘草酸对LPS 诱导的脓毒血症致死模型小鼠生存曲线的影响Fig. 5 Effects of echinatin and glycyrrhizic acid on survival curve of mice in LPS-induced sepsis death model
3.6 刺甘草查耳酮-甘草酸协同作用于LPS 诱导的脓毒血症模型
刺甘草查耳酮和甘草酸能够明显延长LPS诱导的脓毒血症模型小鼠的生存时间。进一步评价LPS诱导小鼠进入免疫风暴状态的情况下,体内免疫细胞和细胞因子的水平以及药物干预的有效性。根据腹腔内渗出的巨噬细胞(F4/80+)和中性粒细胞(CD11b+、Ly6G+)在总细胞的占比越高,则小鼠免疫越亢进[18]。为了评价多种活性成分协同治疗脓毒血症的效果,使用甘草酸、刺甘草查耳酮、甘草酸-刺甘草查耳酮联用以及甘草提取物对脓毒血症模型小鼠进行干预。如图6-A 所示,ip LPS 可增加巨噬细胞和中性粒细胞的产生和渗出,而药物干预后巨噬细胞和中性粒细胞的渗出较模型组显著减少(P<0.01、0.001),并且联合组与单药组有显著差异(P<0.001)。如图6-B、C 所示,刺甘草查耳酮和甘草酸可以显著降低外周血和腹腔灌洗液中炎症因子IL-1β 和TNF-α 水平(P<0.01、0.001),联合组的效果强于单独给药组(P<0.05、0.001)。综合以上结果,刺甘草查耳酮和甘草酸均可有效防治脓毒血症,并且刺甘草查耳酮-甘草酸的联合使用效果更佳。

图6 刺甘草查耳酮和甘草酸对LPS 诱导的脓毒症小鼠模型的影响 (±s, n = 8)Fig. 6 Effects of echinatin and glycyrrhizic acid on LPS-induced sepsis mice model (±s, n = 8)
4 讨论
脓毒血症的发生发展过程中常伴随着机体多重异常损伤,其中以过度的炎症反应以及较强的氧化应激反应为其主要的表现特征[30-32]。炎症反应和氧化应激在机体损伤中常发挥着协同的作用,炎症反应的发生常伴随着氧化应激,氧化应激可导致中性粒细胞炎症浸润扩大机体炎症反应的进程,随着炎症反应的不断扩大会进一步地加重机体氧化应激水平[33]。同样地,氧化应激在炎症小体的激活中发挥着重要的作用,是上游调控多种炎症小体激活的重要因素,如氧化应激诱导的ROS 的产生是NLRP3炎症小体的主要因素[34];氧化应激诱导的线粒体损伤也是激活黑素瘤缺乏因子2(absent in melanoma 2,AIM2)炎症小体的主要因素[35]。NLRP3 炎症小体是研究最多的炎症小体,其激活后通过形成多蛋白复合物,成熟并释放细胞因子,诱导细胞焦亡[36]。NLRP3 炎症小体过度激活可诱发和放大炎症反应,引起和加重一系列的细胞损伤、免疫失调进而损害机体各个系统[37-41],这对于脓毒血症的病程发展是十分重要的[42]。筛选发现靶向抗炎、抗氧化应激的药物活性成分,对于精准防治脓毒血症具有重要意义。
传统中药作为天然药物的宝库,多种中药及其单体已被证明可通过调控炎症小体及氧化应激等在许多疾病的治疗中起到良好的疗效,在相关疾病的新药开发中极具潜力。甘草组分构成繁杂,目前已从中鉴定出了400 多种成分,其中三萜类及黄酮类化合物(如甘草酸、甘草素、光甘草定、刺甘草查耳酮等)是含量最高的2 大类成分[43],多种成分已被证明具有治疗脓毒血症的作用[18-19,44-45]。本实验建立了LPS 诱导的NLRP3 炎症小体激活模型以及H2O2诱导的氧化应激模型,研究了甘草中10 种主要活性成分抗炎、抗氧化的作用效果,结果表明刺甘草查耳酮可显著抑制NLRP3 炎症小体激活,减少尼日利亚菌素诱导的细胞上清液中Caspase-1 p20蛋白表达,同时显著降低炎症因子IL-1β 和TNF-α的产生;此外,甘草中的多种成分均可抑制H2O2诱导的ROS 产生,其中甘草酸的抑制效果强于其他成分,表明刺甘草查耳酮、甘草酸可能是甘草中主要的抗炎、抗氧化的成分。进一步将刺甘草查耳酮-甘草酸联合应用于脓毒血症致死实验以及脓毒血症模型中,结果表明,刺甘草查耳酮-甘草酸可显著减低LPS 的致死率,显著降低脓毒血症模型小鼠体内巨噬细胞F4/80+和中性粒细胞CD11b+、Ly6G+比例,降低外周血和腹腔灌洗液中炎症因子IL-1β、TNF-α水平,且组分联合组效应均强于单独用药组,证明刺甘草查耳酮-甘草酸在防治脓毒血症的过程中发挥了多途径协同增效作用,其机制主要可能与抑制炎症小体激活及抗氧化相关。
多成分、多靶点、多效应是中药理论精髓,中药组分中的协同作用或是临床作用效果的主要原因[46]。本研究基于中药“组分-靶点-效应”,从免疫炎症反应及氧化应激的途径联合评价了甘草中多种活性成分的作用效应,并将其中抑制炎症小体效果有效成分(刺甘草查耳酮)与抗氧化效应强效成分(甘草酸)联合应用于脓毒血症模型中,证明了甘草活性成分协同治疗脓毒血症的联合增效作用,为脓毒血症联合治疗药物的研发提供了实验依据,为组分中药的开发及中药临床精准联合用药提供了新的研究思路。
利益冲突所有作者均声明不存在利益冲突
