新型Hsp90/HDAC双靶点抑制剂对乳腺癌细胞MDA-MB-231增殖、侵袭和迁移的影响及其机制
2023-06-07高笑吴清兰邓林宋军莹张丽栾业鹏张金平侯琳
高笑 吴清兰 邓林 宋军莹 张丽 栾业鹏 张金平 侯琳
(1 青岛大学基础医学院生物化学与分子生物学系,山东 青岛 266071; 2 青岛大学药学院; 3 中国人民解放军海军第971医院)
乳腺癌是全世界女性最常见的恶性肿瘤,尽管在诊断和治疗方面取得了重大进展,但晚期乳腺癌患者的预后仍然非常不理想[1-3]。由于乳腺癌具有高度异质性,单一靶点药物通常会出现敏感性差、毒副作用大、易产生耐药性等问题[4-5]。因此,新型双靶点小分子化合物的研发为解决这一问题提供了新的希望。
热休克蛋白90(Hsp90)是一种常见的分子伴侣蛋白,与肿瘤的增殖、侵袭、转移和凋亡等生物学行为密切相关,且在乳腺癌细胞中显著高表达[6-7]。另外,负责调控组蛋白乙酰化过程的去乙酰化酶(HDAC)也在乳腺癌的发展过程中起着非常重要的作用[8]。大量研究显示,HDAC抑制剂与Hsp90抑制剂联合用药对多种肿瘤的治疗有效[9-12],但目前在乳腺癌治疗中的研究未见报道。有研究发现新型Hsp90/HDAC双靶点抑制剂FXX-W-12-4对乳腺癌细胞具有显著的抑制作用[13]。在此基础上,本研究通过探讨FXX-W-12-4对乳腺癌细胞MDA-MB-231抗肿瘤的作用及机制,旨在为Hsp90/HDAC双靶点抑制剂的研发以及乳腺癌的治疗提供有益的参考价值。
1 材料与方法
1.1 主要材料
人乳腺癌细胞系MDA-MB-231由青岛大学基础医学院生物化学与分子生物学实验室提供;CCK-8试剂盒以及BCA蛋白质定量试剂盒(北京索莱宝生物科技有限公司);GAPDH抗体、ac-H3抗体以及Hsp70抗体(武汉爱博泰克生物科技有限公司);Akt抗体、p-Akt抗体、mTOR抗体、p-mTOR抗体(上海赛信通生物试剂有限公司)。
1.2 细胞培养
将细胞培养于含体积分数0.12胎牛血清及体积分数0.01青链霉素混合溶液的高糖DMEM培养基中,置于37 ℃、含体积分数0.05的CO2恒温培养箱中培养,待细胞生长至对数生长期且密度适宜时,用于后续实验。
1.3 实验方法
1.3.1CCK-8实验检测FXX-W-12-4对MDA-MB-231细胞活力的影响 取对数生长期的MDA-MB-231细胞,加入胰酶消化后接种至96孔板中,每孔约2 000个细胞。24 h后细胞贴壁且生长密度适宜时,将原培养液吸出,更换为含有不同浓度FXX-W-12-4(0、20、40、100、200、400、800 nmol/L)完全培养基。边缘孔中加入无菌的PBS,防止培养基蒸发。将96孔板放入37 ℃、含体积分数0.05 CO2的恒温培养箱中培养48 h后,每孔加入CCK-8试剂10 μL继续孵育2 h。用酶标仪测定波长450 nm处各孔吸光度值,并计算细胞活力及半致死浓度(IC50),作为后续实验中浓度设定的参考值。
1.3.2划痕实验检测FXX-W-12-4对MDA-MB-231细胞迁移能力的影响 将处于对数生长期的MDA-MB-231细胞接种于6孔板中,每孔约5 000个细胞。待细胞融合度达到80%~90%时,使用1 000 μL枪头垂直于培养板进行划痕。使用无菌PBS洗去刮下的悬浮细胞后,每孔加入2 mL不含血清的培养基。将6孔板放入培养箱当中继续培养12 h后,根据前面计算获得的IC50的参考值,加入FXX-W-12-4终浓度为0、100、200、300 nmol/L(分别为A、B、C、D组)的无血清培养基继续培养,各组细胞分别在培养第0、12、24、48 小时时用普通倒置显微镜拍照,并计算划痕面积。
1.3.3Transwell实验检测FXX-W-12-4对MDA-MB-231细胞侵袭能力的影响 取Transwell小室放入24孔板中,将Matrigel基质胶铺于Transwell上室中,置于培养箱中孵育1 h使其凝固。取对数生长期的MDA-MB-231细胞,胰酶消化后用无血清培养基重悬后,铺于Transwell上室中,每孔约20 000个细胞,同时上室加入200 μL无血清培养基,下室加入800 μL完全培养基。于上室与下室中同时加入FXX-W-12-4使其终浓度为0、100、200、300 nmol/L(分别为A、B、C、D组)。将24孔板置于37 ℃、含体积分数0.05 CO2的恒温培养箱中培养48 h后,取出小室。用棉签轻轻擦去上室中的细胞和基质胶,PBS轻轻冲洗3次。40 g/L的多聚甲醛固定后,采用0.1%的结晶紫染液染色下室中细胞,显微镜下观察,随机选取5个100倍的视野进行拍照,并计算细胞侵袭率。
1.3.4Western Blot实验法检测FXX-W-12-4对MDA-MB-231细胞中ac-H3、Hsp70、Akt、mTOR、p-Akt及p-mTOR蛋白质相对表达量的影响 将MDA-MB-231细胞采用终浓度分别为0、100、200、300 nmol/L的FXX-W-12-4(分别为A、B、C、D组)处理48 h,PBS清洗3次,洗去悬浮细胞和杂质。加入RIPA蛋白裂解液充分裂解细胞后提取细胞总蛋白,BCA法测蛋白浓度。蛋白样品于SDS-PAGE上电泳, PVDF转膜后,以50 g/L的脱脂奶粉溶液常温封闭2 h,TBST清洗3次,一抗4 ℃下孵育过夜,TBST清洗4次,二抗常温孵育1 h。用ECL发光液按说明书进行孵育,成像仪显影并进行拍照。以GAPDH的条带结果为内参,将目的蛋白的条带与内参条带进行比较,并计算目的蛋白的相对表达量。
1.4 统计学处理

2 结 果
2.1 FXX-W-12-4对MDA-MB-231细胞活力的影响及其IC50值
CCK-8实验检测结果显示,以终浓度为0、20、40、100、200、400、800 nmol/L的FXX-W-12-4处理MDA-MB-231细胞48 h后,MDA-MB-231细胞活力分别为(99.46±0.56)%、(91.38±0.79)%、(78.46±0.88)%、(74.59±0.93)%、(45.50±1.02)%、(41.69±0.79)%、(37.47±1.05)%。随着FXX-W-12-4浓度的递增,MDA-MB-231细胞的活力逐渐下降(F=2 663.00,P<0.05)。通过计算得出FXX-W-12-4作用MDA-MB-231细胞48 h后的IC50值为309.80 nmol/L。小于IC50值的浓度对细胞无毒性,因此选用0、100、200、300 nmol/L为后续实验的浓度。
2.2 各组MDA-MB-231细胞迁移能力的比较
重复测量设计的方差分析结果显示,组别、时间及其交互作用对MDA-MB-231细胞的迁移能力均具有显著性的影响(F组别=242.53,F时间=341.78,F组别*时间=152.14,P<0.05)。单独效应分析结果显示,随着时间的延长,A~D组MDA-MB-231细胞的迁移能力逐渐增强(F=34.14~153.46,P<0.05);与A组相比,B~D组细胞在第12、24、48小时时的迁移能力明显降低(F=86.47~212.59,P<0.05)。见表1。
2.3 各组MDA-MB-231细胞侵袭能力比较
Transwell实验的结果显示,A~D组的细胞侵袭率分别为(89.99±6.12)%、(62.84±2.34)%、(30.07±4.62)%、(12.24±2.27)%。随着FXX-W-12-4浓度的升高,MDA-MB-231细胞侵袭能力逐渐降低(F=68.67,P<0.05)。各组间两两比较差异具有显著统计学意义(t=4.14~11.92,P<0.05)。见图1。

表1 各组MDA-MB-231细胞迁移率比较
2.4 各组MDA-MB-231细胞中ac-H3、Hsp70及p-Akt、p-mTOR蛋白相对表达量比较
Western Blot实验检测结果显示,与A组相比较,B~D组ac-H3、Hsp70蛋白相对表达量随FXX-W-12-4浓度增加明显升高(F=645.60、1 017.00,P<0.05)。而p-Akt、p-mTOR蛋白相对表达量随FXX-W-12-4浓度的升高则明显降低(F=480.30、14.32,P<0.05);各组间两两比较差异均具有显著性(t=9.43~45.38,P<0.05)。见表2。
3 讨 论
乳腺癌作为女性常见的全身性恶性肿瘤,具有增殖能力强、易侵袭和易转移的特点,这是多数乳腺癌患者死亡的重要原因,且晚期患者5年生存率相对较低[14]。近年来,肿瘤靶向治疗已经成为治疗领域的热点方向,也为乳腺癌治疗带来了新的希望。与传统的手术、放化疗、激素治疗等方法相比较,靶向治疗可以精准地作用于肿瘤细胞而不影响正常细胞[15]。但是,单一靶点药物往往会出现治疗范围有限、副作用大、易产生耐药性等问题。多靶点药物可以同时作用于多个靶点,发挥多重抗肿瘤作用,显著减少单一靶点或联合用药的局限性。因此,多靶点小分子化合物的研发对肿瘤的治疗有重要意义。
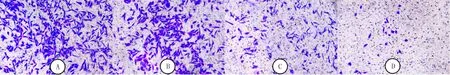
A~D分别为A~D组,结晶紫染色法,100倍

表2 各组MDA-MB-231细胞中ac-H3、Hsp70、p-Akt、p-mTOR蛋白相对表达量比较
Hsp90是细胞内一种重要的分子伴侣蛋白,它可以与其他蛋白结合并协助它们完成正确折叠、维持功能和降解[6-7]。然而,Hsp90的过度表达和功能紊乱会影响多个细胞信号通路和多种生物学行为,从而导致恶性肿瘤的发生和发展[16-17]。研究表明,Hsp90在乳腺癌中表达异常升高,并且与肿瘤的恶性程度和预后密切相关[18-19]。因此,Hsp90已经成为乳腺癌治疗中备受关注的靶点之一。另外,表观遗传修饰在乳腺癌的发生发展中也发挥着重要的作用[8]。其中,组蛋白的乙酰化和去乙酰化是最常见的修饰方式,由组蛋白乙酰转移酶和HDAC共同调节[20]。在乳腺癌等多种疾病中,HDACs的表达异常升高,成为治疗癌症的热门分子靶点之一[21]。通过抑制HDAC的活性,可以促进组蛋白的去乙酰化修饰,从而恢复基因的正常表达,抑制肿瘤的生长和转移[22]。研究显示,HDAC抑制剂与Hsp90抑制剂联合用药量有协同抗肿瘤作用[23-27]。目前的研究发现,LMK235(HDAC抑制剂)以及NVP-HSP990(Hsp90抑制剂)联用可以显著性抑制卵巢癌细胞A2780中Hsp90和HDAC双靶点的活性,从而诱导细胞凋亡的发生[28]。此外,LMK235和NVP-HSP990联合治疗还可显著降低A2780细胞对铂类药物的获得性耐药,从而实现铂类药物的逆转作用。17-DMAG(Hsp90抑制剂)与PTACH(HDAC抑制剂)联用能够增加细胞内质网应激,从而诱导肺癌A549细胞凋亡,并使细胞迁移能力几乎丧失[29]。因此Hsp90和HDAC可作为比较理想的筛选双靶点抗肿瘤药物的关键靶点。然而,Hsp90/HDAC双靶点抑制剂在乳腺癌中的研究尚未见报道。
针对乳腺癌增殖能力强、易侵袭和转移的特质,本研究对FXX-W-12-4在乳腺癌细胞MDA-MB-231中的抑制作用进行了深入探究。通过CCK-8实验检测FXX-W-12-4对MDA-MB-231细胞活力的影响,结果显示随着FXX-W-12-4浓度的升高,MDA-MB-231细胞活力逐渐下降,FXX-W-12-4显著抑制了MDA-MB-231细胞的增殖。本研究采用划痕实验、Transwell实验分别检测FXX-W-12-4对MDA-MB-231细胞迁移和侵袭能力的影响,结果显示梯度浓度的FXX-W-12-4作用于MDA-MB-231细胞后,细胞迁移率和侵袭率均明显下降,这表明FXX-W-12-4显著抑制了MDA-MB-231细胞的迁移和侵袭的能力。为了探讨FXX-W-12-4是否通过抑制Hsp90和HDAC双靶点的活性,从而对于MDA-MB-231细胞增殖、侵袭与迁移发挥作用,本研究通过Western Blot实验检测了FXX-W-12-4作用MDA-MB-231细胞以后Hsp70和ac-H3蛋白的相对表达量,结果显示,经FXX-W-12-4处理后,MDA-MB-231细胞中Hsp70、ac-H3蛋白的相对表达量均显著增加,同时p-Akt和p-mTOR蛋白的相对表达量显著降低。这表明FXX-W-12-4对MDA-MB-231细胞增殖、侵袭和迁移的抑制作用可能是通过抑制Hsp90和HDAC双靶点的活性,从而影响Akt/mTOR通路实现的。
综上所述,本研究以新型Hsp90/HDAC双靶点抑制剂FXX-W-12-4为研究对象,发现该小分子化合物对乳腺癌MDA-MB-231细胞的增殖、侵袭和迁移具有显著的抑制作用,其抑制作用可能是通过调节Akt/mTOR通路实现的。FXX-W-12-4有望成为一种治疗乳腺癌的新的有效化合物,具有乐观的临床应用前景。本研究为小分子双靶点药物的研发提供了有力的实验依据。
作者声明:高笑、吴清兰、邓林、宋军莹参与了实验的研究设计工作;高笑、张丽、栾业鹏、张金平、侯琳参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。
