聚多巴胺并木犀草素对细胞毒性淋巴细胞肿瘤杀伤作用的影响
2023-06-07李程琳王梓聿曹丁元国超凡王爽李玲
李程琳 王梓聿 曹丁元 国超凡 王爽 李玲
(青岛大学基础医学院,山东 青岛 266071)
肿瘤细胞为躲避免疫清除而建立的免疫逃避机制,可使机体对肿瘤细胞产生免疫耐受[1-2]。如何打破免疫耐受,防止肿瘤患者术后复发是目前和未来临床治疗的难题[3]。放疗和化疗作为目前临床肿瘤治疗的标准疗法,在抑制肿瘤细胞生长的同时也破坏了自身免疫系统,不利于术后机体的免疫重建[4]。光热治疗是一种新兴的肿瘤治疗方法,也是国内外研究的热点,其治疗机理是可以在局部杀灭肿瘤细胞,并且对机体免疫系统损伤程度较轻[5-7],但是肿瘤患者机体处于免疫耐受状态,经光热治疗后仍然无法避免肿瘤的复发[8]。既往研究发现,木犀草素(LUT)作为肿瘤疫苗佐剂,可以有效激活抗原提呈细胞(APC)和CD8+T细胞对于肿瘤细胞的杀伤功能[9]。目前在抗肿瘤治疗中,光热治疗联合佐剂的相关研究未见报道。新兴的光热材料如聚多巴胺(PDA),因其具有的良好光热转换效率、生物相容性、安全性高和易载药的特点[10],在光热材料中被广泛应用。因此,本研究选用PDA与LUT联合治疗小鼠黑色素瘤,通过流式细胞术检测小鼠免疫水平,为抗肿瘤免疫机制激活提供理论依据。
1 材料与方法
1.1 实验试剂
LUT(MB6799)购买于大连美伦生物科技有限公司,CCK-8试剂盒02571100购买于上海雅酶生物科技有限公司,APC抗小鼠mouse CD11b抗体101212、PB450抗小鼠CD3抗体100334、FITC抗小鼠CD8a抗体100706、PE抗小鼠IFN-γ抗体505808、PE抗小鼠TNF-ɑ抗体506305、PE抗小鼠iNOS抗体696806、Alexa Fluor 700抗小鼠CD206抗体141734购自美国biolegend公司。
1.2 实验动物与细胞
6~8周的龄雌性C57BL/6小鼠购买于斯贝福(北京)生物技术有限公司,许可证:SCXK(京)2019-0010,将小鼠饲养于青岛大学医学部洁净动物室。RAW264.7细胞系和B16F10黑色素瘤细胞购自中国科学院上海细胞资源中心。RAW264.7细胞置于含体积分数0.10胎牛血清的DMEM高糖基础培养基中,B16F10细胞置于含体积分数为0.10胎牛血清的RPMI-1640培养基中,均培养于37 ℃、体积分数为0.05 CO2的细胞培养箱中。
1.3 实验方法
1.3.1PDA的制备以及鉴定 取0.19 g Tris,加入100 mL双蒸水,搅拌2 min,快速加入0.121 g盐酸多巴胺,用保鲜膜迅速封口,在保鲜膜上扎一个小孔,采用磁力搅拌器慢速搅拌24 h,离心并用蒸馏水清洗3次,取最后一次离心所得底物,放入冰箱冷冻12 h后,放入冷冻干燥机冷冻24 h后,合成实验所需的PDA溶液。采用Phenom ProX扫描电子显微镜(SEM)观察PDA表征,使用接触角测定仪检测接触角的大小。
1.3.2CCK8法检测PDA对RAW264.7细胞活性的影响 取对数生长期RAW264.7细胞,胰酶消化,接种至96孔板,密度为每孔5×108个细胞/L。待到细胞贴壁生长过夜以后,弃掉原培养液。将细胞分为Control组、脂多糖(LPS)组、PDA′组,每组设5个复孔。Control组细胞培养液不做任何处理,在LPS组、PDA′组细胞的培养液中分别加入LPS(2 μg/L)、PDA(50 000 μg/L),常规培养48 h。每孔加入CCK-8试剂100 μL孵育2 h,以酶标仪测定波长450 nm处的吸光度。
1.3.3流式细胞术检测LUT对RAW264.7细胞分化的影响 取对数生长期RAW264.7细胞,胰酶消化,接种至96孔板,密度为每孔5×108个细胞/L。待细胞贴壁生长至对数生长期后,弃掉原培养液。设置Control组、IL-4组、LUT+IL-4组,每组设3个复孔。Control组细胞培养液不做任何处理,IL-4组、LUT+IL-4组细胞的培养液中分别加入IL-4(20 μg/L)、LUT(6 670 μg/L)+IL-4(20 μg/L),常规培养48 h,用PE抗小鼠iNOS抗体染色30 min。设置Control组、LPS组、LPS+LUT组,每组3个复孔。Control组细胞培养液不做任何处理,LPS组、LPS+LUT组细胞的培养液中分别加入LPS(2 μg/L)、LUT(6 670 μg/L)+LPS(2 μg/L),常规培养48 h以后,用Alexa Fluor 700抗小鼠CD206抗体染色30 min,用Beckman CytoFLEX进行检测,以FlowJo V10软件分析各组小鼠体内巨噬细胞分化情况。
1.3.4动物分组及处理C57BL/6小鼠适应性喂养1周后,随机分为模型组、PDA组、LUT组以及PDA+LUT组,每组16只,每只小鼠背部皮下注射2×106个B16F10细胞构建黑色素瘤小鼠模型。建模第10天时,模型组和LUT组不注射PDA,PDA组以及PDA+LUT组小鼠在肿瘤局部注射PDA(2.5 μg/只),并采用红外线仪(808 nm)照射肿瘤5 min,照射1次后立即使用热成像仪采集小鼠热能图像。采集图像后立即对LUT组和LUT+PDA组小鼠右大腿肌肉处注射LUT(500 μg/只),每天1次,连续3 d,模型组和PDA组不注射LUT。于治疗结束后第2天,每组小鼠随机取出5只,麻醉后脱颈处死,剖出黑色素瘤,测量计算黑色素瘤面积,计算公式为(π×长×宽)/4。另从每组小鼠中随机取出5只,常规饲养至治疗结束后第14天,观察和记录期间小鼠存活情况。
1.3.5流式细胞术检测各组小鼠脾脏组织中巨噬细胞的分化情况 治疗结束后第3天,每组小鼠随机取出3只,麻醉后脱颈处死,剖离脾脏,放于PBS中用研磨棒研磨,以1 500 r/min离心2 min,弃上清后加入红细胞裂解液,颠倒混匀后静置3 min,再以1 500 r/min离心2 min,弃上清后用PBS重悬,制备成单细胞悬液(1×1010/L)。采用APC抗小鼠mouse CD11b抗体和PE抗小鼠iNOS抗体、Alexa Fluor 700抗小鼠CD206抗体进行胞外染色。采用Beckman CytoFLEX检测细胞iNOS和CD206染色情况,通过FlowJo V10软件分析巨噬细胞分化情况。
1.3.6流式细胞术检测各组小鼠脾脏组织中Th和CTL水平 治疗结束后第7天,每组小鼠随机取出3只,麻醉脱颈处死后剖离脾脏,于PBS中用研磨棒研磨,1 500 r/min离心2 min,弃上清液后加入红细胞裂解液,颠倒混匀静置3 min,再1 500 r/min离心2 min,弃上清后用含体积分数0.10胎牛血清的RPMI-1640培养基重悬,制备成单细胞悬液(约1×1010个细胞/L)。脾细胞悬液置于含体积分数0.10胎牛血清的RPMI-1640培养基中,加10 000 μg/L的B16F10抗原、1 000 μg/L的BFA,于37 ℃下常规培养6 h。收集细胞,采用PB450抗鼠CD3抗体和FITC抗小鼠CD8a抗体4 ℃下染色30 min,于40 g/L多聚甲醛中室温固定8 min。PBS洗涤后,以0.2%的Triton X-100 4 ℃下孵育30 min,分别用PE抗小鼠IFN-γ和PE抗小鼠TNF-ɑ染色CD3+T细胞和CD8+T细胞。使用Beckman CytoFLEX检测细胞IFN-γ和TNF-α染色情况,使用FlowJo V10软件分析各组小鼠脾细胞Th和CTL水平。
1.4 统计学分析

2 结 果
2.1 PDA的表征及对RAW264.7细胞活力的影响
SEM观察显示,合成的PDA为球形颗粒,直径均<1 μm(图1A),有较强的吸附能力;接触角测定显示其为锐角(图1B),表示合成的PDA具有亲水性。Control组、LPS组、PDA′组RAW264.7细胞的细胞活力分别为1.34±0.15、0.52±0.08、1.51±0.15,组间比较差异有显著性(F=48.21,P<0.05),其中LPS组与Control组、PDA′组比较差异均有显著性(t=7.58、9.20,P<0.05)。

A:SEM显示结果,30 000倍,B:PDA涂层的接触角
2.2 LUT对RAW264.7细胞分化的影响
流式细胞术检测结果显示,Control组、IL-4组、IL-4+LUT组RAW264.7细胞CD206的表达水平分别为3 655.00±92.77、7 329.00±1 108.00、3 732.00±233.10。单因素方差分析结果显示,各组间比较差异有显著意义(F=30.72,P<0.05),其中IL-4组与IL-4+LUT组、Control组比较差异有显著性(t=6.72、6.86,P<0.0.5)。
Control组、LPS组、LPS+LUT组中iNOS的表达水平分别为798.70±31.53、3 583.00±84.79、4 607.00±122.00。各组间比较差异有显著性(F=1 516.00,P<0.05),三组间两两比较差异均有显著性(t=14.31~53.21,P<0.05)。
2.3 各组小鼠肿瘤大小的比较
PDA组和PDA+LUT组小鼠经红外线仪照射后,热成像仪观察到肿瘤部位呈现红色,模型组和LUT组小鼠肿瘤部位无变化(图2)。治疗结束后第2天,模型组、PDA组、LUT组以及PDA+LUT组的肿瘤面积分别为(171.30±10.52)、 (100.50±11.24)、(88.28±7.08)、(39.20±3.07)mm2。两因素析因设计方差分析显示,PDA、LUT及PDA与LUT交互作用均对肿瘤面积具有显著影响(FPDA=242.30,FLUT=350.65,FPDA*LUT=7.95,P<0.05)。单独效应分析显示,对小鼠注射或不注射PDA时,则注射或者不注射LUT对肿瘤面积均有显著影响(F=126.52、23.10,P<0.05);对小鼠注射或不注射LUT时,则注射或不注射PDA对肿瘤面积均有显著影响(F=81.24、169.00,P<0.05)。
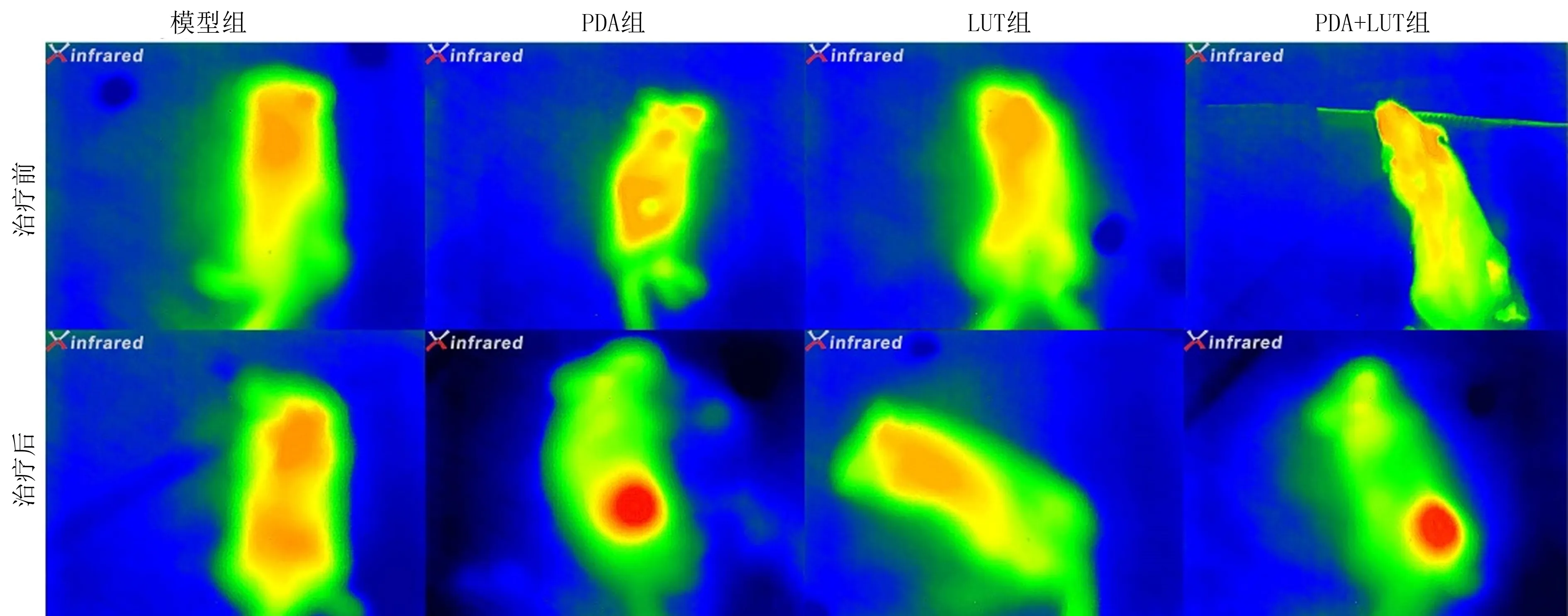
图2 各组小鼠治疗前后热成像仪观察到的肿瘤图像
2.4 各组小鼠生存率比较
治疗结束后第14天小鼠存活率的Mantel-Cox检验显示,PDA+LUT组与其他3组比较差异均有显著性(χ2=9.70,P<0.05),见图3。
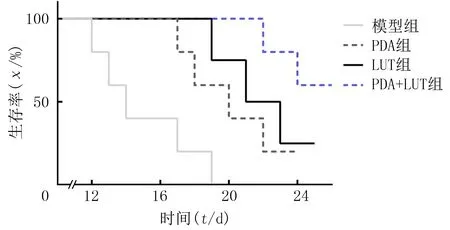
图3 各组建模小鼠生存曲线
2.5 PDA并LUT治疗对各组小鼠脾脏巨噬细胞分化的影响
两因素析因设计方差分析显示,PDA、LUT以及PDA与LUT交互作用对iNOS和CD206的表达水平均具有显著性影响(FPDA=200.90、220.01,FLUT=283.83、272.34,FPDA*LUT=27.90、27.04,P<0.05)。单独效应分析显示,对小鼠注射或者不注射PDA,则注射或不注射LUT对iNOS和CD206表达水平均具有显著影响(F=63.87~235.52,P<0.05);对小鼠注射或不注射LUT时,则注射或不注射PDA对iNOS和CD206表达水平均有显著影响(F=39.54~200.67,P<0.05),见表1。
2.6 PDA并LUT对小鼠体内CTL肿瘤杀伤功能的影响
两因素析因设计的方差分析显示,PDA、LUT以及PDA与LUT交互作用均对IFN-γ+CD4+和TNF-α+CD8+细胞比例均具有显著性影响(FPDA=59.48、65.78,FLUT=181.38、176.54,FPDA*LUT=6.00、15.00,P<0.05)。单独效应分析结果显示,对小鼠注射或不注射PDA,则注射或不注射LUT对IFN-γ+CD4+和TNF-α+CD8+细胞比例均有显著影响(F=44.31~147.23,P<0.05);对小鼠注射或不注射LUT时,则注射或不注射PDA对IFN-γ+CD4+和TNF-α+CD8+细胞比例均具有显著的影响(F=8.98~71.80,P<0.05),见表1。

表1 各组小鼠脾脏巨噬细胞标志荧光强度和T细胞标记阳性细胞百分率比较
3 讨 论
肿瘤免疫逃逸是指肿瘤细胞通过各种机制逃避免疫系统的识别和攻击,是肿瘤生存和发展的重要原因[11]。抑制肿瘤细胞的免疫耐受,激活人体自身的抗肿瘤免疫功能,一直是肿瘤治疗的研究方向和热点[12-13]。而传统治疗方法如化疗、放疗等,毒副作用大,患者难以耐受[14],因此需要寻找更安全有效的抗肿瘤疗法。
研究表明,激活APC细胞是抑制肿瘤免疫耐受的关键[15],因为APC细胞在体内的一个重要功能是促进抗原特异性免疫应答,是激活特异性杀伤肿瘤细胞功能的关键起始点[16]。在先前的研究中已经证实,LUT可以促进体外巨噬细胞向M1方向极化[9]。巨噬细胞在调节肿瘤免疫微环境中发挥着重要作用[17-18],其中M1巨噬细胞抑制肿瘤生长,而M2巨噬细胞促进肿瘤生长,使M2巨噬细胞复极化为M1巨噬细胞或者抑制M2巨噬细胞生成是治疗实体瘤的经典理论[19]。
光热治疗作为近年来新兴的肿瘤治疗手段,与传统手术切除肿瘤相比,虽然在治疗位置上具有局限性,但在抑制肿瘤细胞生长同时,会有大量肿瘤相关抗原(TSA)和肿瘤特异性抗原(TAA)的释放,可以诱导机体产生抗肿瘤的主动免疫应答[20-22]。此外,PDA经近红外照射后产生的热能还有调节肿瘤免疫微环境和激活荷瘤小鼠免疫反应的作用[23]。PDA作为生物材料已被广泛应用[24-26],具有清除自由基、屏蔽紫外线、光热转化等功能[27]。本研究使用盐酸多巴胺合成PDA,SEM下显示其球形颗粒直径<1 μm,说明其吸附能力较强;通过接触角测定仪测定接触角,显示接触角为锐角,说明本研究合成的PDA具有亲水性;CCK-8实验检测结果显示PDA′组对于细胞活性没有影响,提示本研究合成的PDA生物相容性良好。
本研究以流式细胞术检测LUT对RAW264.7细胞分化的影响,结果显示LUT+IL-4组与IL-4组相比,M2标志因子CD206表达水平明显下调,LUT+LPS组与LPS组相比,M1标志因子iNOS表达水平明显上调,提示在RAW264.7细胞系中LUT可以抑制M2的极化,并促进M1极化。本研究又通过构建黑色素瘤小鼠模型,验证LUT是否可以抑制M2极化并促进M1的极化,研究结果显示,PDA+LUT组小鼠脾脏中iNOS表达水平明显上调,而CD206表达水平明显下调,再次说明PDA联合LUT治疗将会抑制小鼠体内巨噬细胞向M2极化。
本研究构建了黑色素瘤小鼠模型,发现不注射PDA的模型小鼠经过近红外线照射后,并不能在肿瘤部位聚集热能,而注射PDA的模型小鼠经过近红外线照射后,可在肿瘤部位聚集热能,从而起到杀灭肿瘤的作用。同时PDA+LUT组小鼠肿瘤生长速度与其他组比较显著减缓,并且其生存率与其他组比较显著延长,说明PDA并LUT治疗后会抑制小鼠肿瘤生长并提高生存率,提示光热治疗后肿瘤部位会有大量抗原释放,与LUT共同作用下激活机体抗肿瘤免疫,起到抑制肿瘤生长的作用。巨噬细胞的M2极化是产生肿瘤免疫耐受的重要因素之一[28-29],为了进一步证明打破M2免疫耐受的微环境后,CTL是否被激活,本研究又通过流式细胞术检测治疗结束后第7天时小鼠脾脏组织,结果显示PDA+LUT组小鼠脾脏中CD4+IFN-γ+细胞比例与其他组比较显著上调,说明小鼠脾脏中Th1细胞增多。本研究同样以流式细胞术检测了治疗结束后第7天小鼠脾脏组织中CD8+TNF-α+细胞的比例,发现PDA+LUT组与其他组的CD8+TNF+细胞比例比较显著上调,大量的杀伤相关细胞因子的产生,也预示着PDA+LUT组存在着较多被激活的CD8+T细胞,并且有着较为强大的杀伤功能[30],因此在PDA并LUT治疗促进巨噬细胞M1极化后,增强Th1以及CTL的功能,最终激活了机体的抗肿瘤免疫反应。
综上所述,本研究结果显示PDA并LUT联合治疗黑色素瘤模型小鼠以后,会诱导小鼠机体产生抗肿瘤的主动免疫应答,从而抑制巨噬细胞M2极化并且促进其向M1极化,增加小鼠脾脏组织内的CD4+IFN-γ+和CD8+TNF-α+细胞比例,其抗肿瘤免疫作用可能是通过激活Th1-CTL发挥作用的。本研究为小鼠实体瘤消除后释放抗原激活机体免疫能力机制的研究提供了实验依据,也为抗肿瘤治疗提供了新思路。
伦理批准和动物权利声明:本研究涉及的所有动物实验均已通过青岛大学医学部伦理委员会的审核批准(文件号QDUAEC2022493)。所有实验过程均遵照《实验动物管理条例》的规定进行。
作者声明:李程琳、李玲、王梓聿、曹丁元、国超凡参与了研究设计;李程琳、王爽、李玲参与了论文的写作和修改。所有作者均阅读并同意发表该论文。所有作者均声明不存在利益冲突。
