桂花OfACOs基因家族鉴定及表达分析
2023-06-07王家璇曾祥玲陈洪国邹晶晶
张 耀,王家璇,蔡 璇,2,曾祥玲,2,杨 洁,2,陈洪国,2,邹晶晶,2
(1.湖北科技学院 国家林业草原桂花工程技术研究中心,湖北 咸宁 437100;2.咸宁市高新桂花产业技术研究院,湖北 咸宁 437100)
桂花Osmanthusfragrans为木犀科Oleaceae 园林观赏植物,是中国十大传统名花之一,桂花树形优美、叶色青翠、香味馥郁,在园林中应用广泛[1]。目前,桂花在食品、化妆品和药品中的应用已经逐渐成熟[2],新兴的桂花香水、乳液、香熏和精油等高档化妆品也逐渐打开市场[3-5]。然而,桂花花期较短,最佳观赏期和采收期仅2~3 d,极大地限制了其观赏价值与经济价值[6-7]。
已有研究证明:OfABFs 基因可能参与调控桂花花瓣衰老[8];蒋琦妮等[9]研究发现:桂花OfAP1 基因在桂花成花转变、花芽分化和发育中有重要作用。向其柏等[10]研究发现:许多经济采收价值较高的桂花品种对乙烯敏感,非授粉诱导的内源乙烯跃变是其衰老的重要调控因子。朱诚等[11]研究表明:盛花末期乙烯释放量的迅速增加及膜脂过氧化程度加剧是导致‘薄叶金桂’O.fragrans‘Baoye Jingui’衰老的主要生理原因。ZHOU 等[12]发现:外源乙烯利处理明显加速‘厚瓣金桂’O.fragrans‘Houban Jingui’和‘柳叶金桂’O.fragrans‘Liuye Jingui’的衰老,而乙烯抑制剂硫代硫酸银则延长了其观赏寿命。ZOU 等[6]发现‘柳叶金桂’内源乙烯跃变峰的出现与花瓣褐化、脱落等衰老特征同时发生,外源乙烯处理不仅明显加速了切花花瓣的萎蔫和脱落,还导致花瓣细胞中央大液泡破裂、各细胞器扭曲挤缩变形,加剧了 DNA 断裂,降低了抗氧化酶活性,增加了超氧自由基的激发和膜脂过氧化程度。由此可见:桂花是乙烯敏感型花卉,乙烯参与了其花瓣衰老过程中花瓣脱落和萎蔫、细胞结构变化、氧化还原系统及核酸降解等多个过程的调节,是桂花衰老的重要调控因子。然而,尚不清楚该过程中内源乙烯合成途径。
氨基环丙烷羧酸氧化酶(1-aminocyclopropane-1-carbox-ylate oxidase,ACO)作为乙烯生物合成途径中的最后一个关键酶,直接催化乙烯的合成,被认为是高等植物中乙烯应答的主要标志[13]。ACO 早期被ADAMS 等[14]发现,并命名为乙烯形成酶,后来发现需要抗坏血酸和氧作为辅助底物,因此称为ACC 氧化酶。目前,ACO 基因家族在多个物种中都有研究,SORNCHAI 等[15]通过导入石斛DendrobiumCpACO基因延长了其花期;有研究表明:杨树PopulusACO 基因参与调节林木茎的生长发育[16]。植物ACO 基因的表达受到生长素、干旱以及盐胁迫的抑制[17];番茄Lycopersiconesculentum、花椰菜Brassicaoleraceavar.botrytis的ACO 基因表达受脱落酸、外部机械损伤和低温的诱导[18]。在拟南芥Arabidopsisthaliana中[19],ACO1 受多种信号调控,影响植株的乙烯产量。然而,目前桂花中还未见相关基因的报道。本研究以‘柳叶金桂’为试材,利用生物信息学方法和工具对桂花OfACOs 家族进行鉴定、进化分析、基因结构分析、表达模式分析等,为进一步探索桂花花瓣衰老机制以及提高桂花园林赏花价值与经济价值提供指导。
1 材料与方法
1.1 材料
‘柳叶金桂’花瓣采自华中农业大学校园内。分别采集不同开花阶段的桂花花瓣,称量后密封,保存在液氮中,立即运送回实验室,置于-80 ℃超低温冰箱备用。参考CHEN 等[20]对桂花开花级数的划分体系,将‘柳叶金桂’开花级数划分为:①铃梗期(花苞期,S1),花朵呈紧闭的花苞状,未展开;②初花期(S2),花朵微张,呈半开放状态;③盛花初期(S3),花瓣进一步展开,夹角为45°~90°;④盛花期(S4),花瓣完全展开,花药膨大浅黄色;⑤盛花后期(S5),花瓣完全展开,花药萎缩变为深褐色;⑥脱落期(S6),花瓣失水,部分从树体上自然脱落。
1.2 方法
1.2.1 桂花OfACOs 基因家族成员的鉴定 ACO 基因家族成员大多含有DIOX-N (PF14226)和2OG-FeIIOxy (PF03171)保守结构域[21]。对‘柳叶金桂’基因进行蛋白质家族数据库(pfam)保守结构域注释,以注释到PF03171 和PF14226 保守结构域的基因作为OfACOs 基因家族候选基因,再通过蛋白结构域搜索(NCBI Conserved Domain Search Service) (https://www.ncbi.nlm.nih.gov/Structure/bwrpsb/bwrpsb.cgi)[22]进一步验证候选基因的PF03171 和PF14226 结构域。
1.2.2 进化树分析 登录拟南芥官网 (www.arabidopsis.org) 下载拟南芥AtACO 基因序列信息。利用MUSCLE[23]比对各基因多序列,采用邻接算法进行系统进化树聚类分析。
1.2.3 基因全家族鉴定及染色体定位 对‘柳叶金桂’基因进行pfam 保守结构域注释,获取OfACOs成员序列信息及其在各染色体上的定位信息,然后使用Mapchart (2.32)[24]绘制染色体上的ACO 基因。
1.2.4 基因结构与保守Motif 分析 利用 MEME 软件( Suite version 5.0.2,http://meme-suite.org/) 对 OfACOs保守基序进行预测分析,设置Motif 个数为15 个。根据基因注释的gff 文件,利用TBtools (v1.098775)[25]对基因结构、Motif 进行可视化。
1.2.5 共线性分析 为分析OfACOs 基因家族成员的重复关系,通过使用blast (2.11.0+)和MCScanX[26]对家族成员进行共线性分析,使用默认参数输出数据,结果使用circos (0.69)圈图展示。此外,下载了拟南芥ACO 基因家族成员的基因注释文件,通过使用blast (2.11.0+)和MCScanX 对家族成员进行共线性分析,使用默认参数输出数据,结果使用circos (0.69)圈图展示。
1.2.6 OfACOs 不同组织器官表达模式分析 从美国国家生物技术信息中心(NCBI)数据库下载桂花在根、茎、叶及不同开花阶段等组织部位的转录组测序数据(PRJNA679852),以基因表达量量化指标(FPKM)计算基因表达水平值,用 TBtools[25]对数据可视化。
1.2.7 OfACOs 不同开花阶段的表达分析 取S1~S6 不同开花阶段的桂花花瓣,按HiPure Universal RNA Kit 提取试剂盒说明提取桂花花瓣RNA。用StarScript II RT Kit 反转录试剂盒将RNA 逆转录为cDNA,稀释10 倍备用。利用染料法(SYBR) 预混2×RealStar Fast 在ABI 7500 系统(Thermo Fisher Scientific,Inc.)进行实时荧光定量PCR 分析(RT-qPCR)。RT-qPCR 体系为10.0 μL 2×RealStar Fast SYBR qPCR Mix,上下游引物各0.8 μL,2.0 μL cDNA,6.4 μL ddH2O。RT-qPCR 的反应程序为:94 ℃ 30 s;40 个循环:94 ℃ 10 s,60 ℃ 30 s,72 ℃ 10 s。以ACTIN作为内参,采用 2-ΔΔCt法计算基因的相对表达量,每个组织每个基因设3 个重复。
1.2.8 数据统计分析 每个试验的每个处理进行3 次生物学重复。数据为平均值 ± 标准误。所有数据用SAS v.8.0 进行方差分析和多重比较分析,在0.05 水平上进行邓肯氏多重比较。
2 结果与分析
2.1 OfACOs 基因鉴定及染色体定位
通过pfam 数据库PF03171 和PF14226 保守结构域注释分析,从桂花基因组中共鉴定到122 个OfACOs 基因家族成员(图1)。这122 个OfACOs 家族成员主要分布于除19 号染色体以外的其他22 条染色体上,其中,1 号14 条、2 号4 条、3 号13 条、4 号4 条、5 号2 条、6 号6 条、7 号和8 号各1 条、9 号7 条、10 号8 条、11 号2 条、12 号5 条、13 号和14 号各3 条、15 号4 条、16 号7 条、17 号3 条、18 号6 条、20 号8 条、21 号和23 号各1 条、22 号11 条。其中1 号染色体上基因最多,7 号、8 号、21 号和23 号染色体上分布最少。
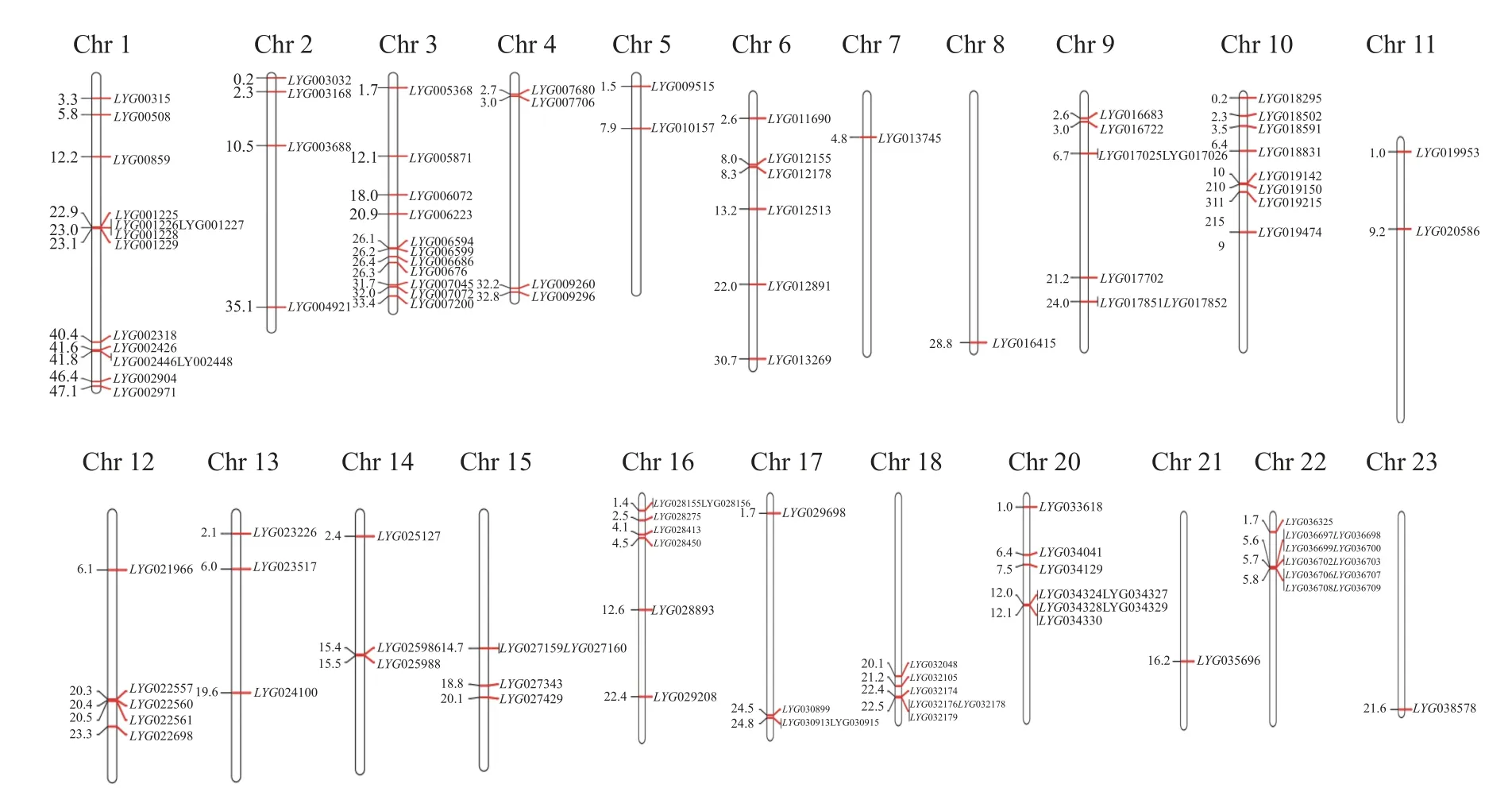
图1 桂花OfACOs 基因家族的染色体定位Figure 1 Chromosomal localization of OfACOs gene family in O. fragrans
用桂花OfACOs 和拟南芥AtACOs 构建进化树,结果如图2所示。通过系统聚类,大致将OfACOs 分为7 组,其中拟南芥基因AT1G05010、AT1G62380、AT1G77330、AT2G19590 和AT1G12010与桂花LYG005871、LYG00776 等21 个OfACOs 共存于第3 组中。其他组不存在拟南芥AtACOs基因。通过拟南芥官网查找发现这5 个基因都具有促进乙烯生成的功能。
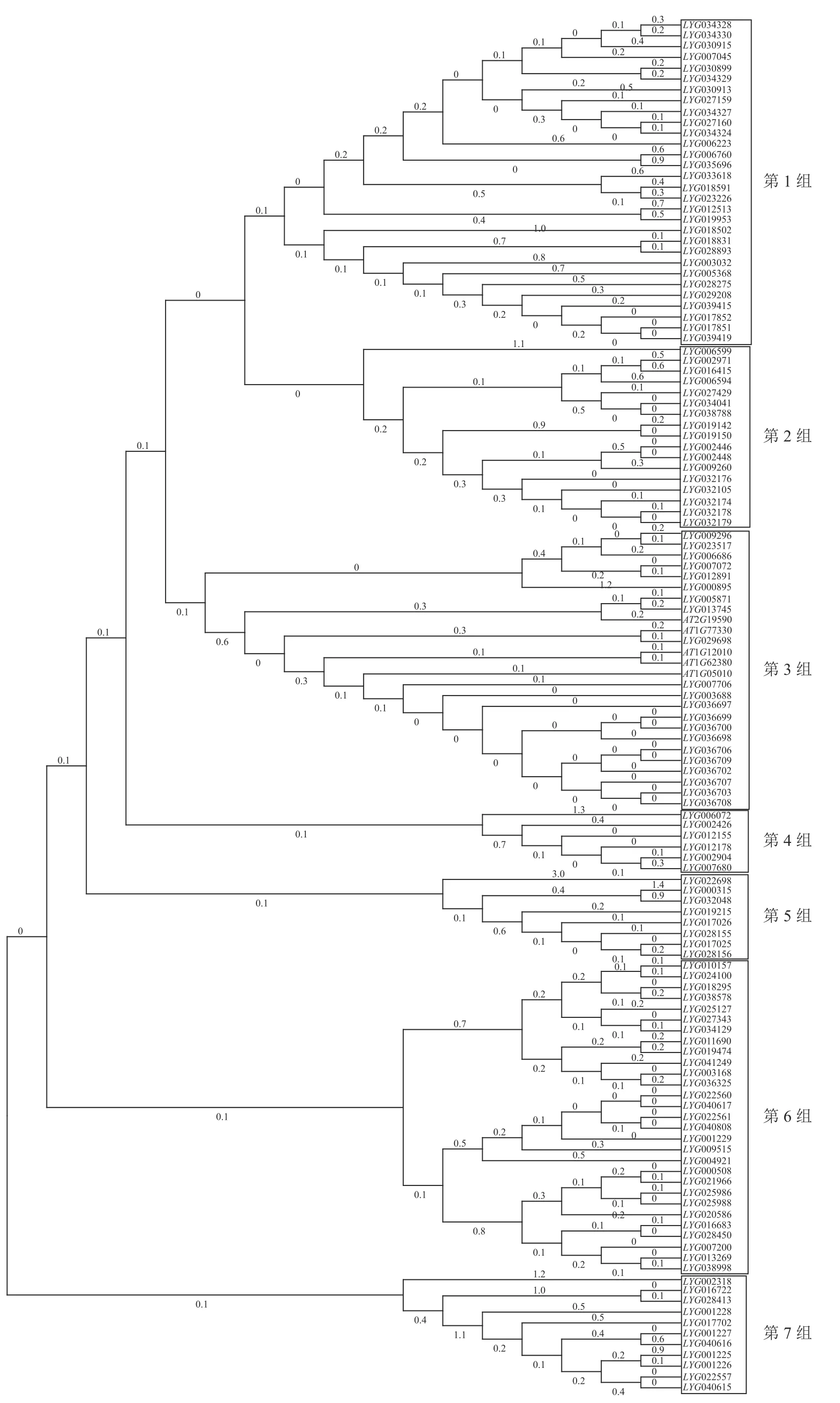
图2 桂花与拟南芥ACOs 基因进化分析Figure 2 Phylogenetic analysis of ACOs in O. fragrans and A. thaliana
2.2 桂花OfACOs 基因家族结构及保守基序分析
进一步对桂花122 个OfACOs 进行基因结构和保守基序分析(图3)。基因结构编码区(CDS)、非翻译区(UTR) 分析结果表明:OfACOs 基因的CDS 数量为2~11 个,其中52 个成员含有3 个CDS 区(42.6%),41 个成员含有4 个CDS 区(33.6%)。其中LYG025988、LYG018295、LYG001228、LYG001225、LYG028156 和LYG030913 的CDS 区分布较散。LYG000315 是CDS 区最多的基因。

图3 桂花OfACOs 基因结构及蛋白质保守结构域Figure 3 Gene structure and conserved motifs analysis of OfACOs in O. fragrans
对122 个OfACOs 的氨基酸序列进行保守基序分析表明:OfACOs 的Motif 为4~25 个,其中,LYG022698 为最少,只有4 个Motif,而LYG028155 有25 个Motif;24 个OfACOs 成员含有14 个Motif,且其中有11 个的Motif 构成完全相同,都位于第3 组中;几乎所有的OfACOs 成员中都含有Motif 1、Motif 2、Motif 3、Motif 4 和Motif 7,表明在桂花OfACOs 家族中这5 个Motif 的保守性更高。
2.3 桂花OfACOs 共线性分析
基因组内共线性分析结果(图4A)表明:染色体复制事件发生在桂花的22 条染色体上,OfACOs 共存在394 对染色体共线性对,其中1 号染色体上最多,有84 对,说明该基因家族可能发生了扩张。

图4 桂花及拟南芥ACO 基因家族共线性分析Figure 4 Collinearity analysis of ACO gene family in O. fragrans and A. thaliana
桂花与拟南芥ACO 基因家族的共线性分析表明:拟南芥的2 条染色体与桂花的15 条染色体共发生了41 对染色体复制对,其中拟南芥1 号染色体存在29 对染色体复制对(图4B)。综上所述,通过与拟南芥ACO 基因共线性分析,有助于利用拟南芥的基因功能探索桂花OfACOs 中相应基因的功能。
2.4 桂花OfACOs 不同组织部位及开花时期的表达模式分析
具有相同的DIOX-N (PF14226)和2OG-FeII-Oxy (PF03171)保守结构域并不一定能行使相同的蛋白功能。为更准确地筛选OfACOs 蛋白,通过swiss-prot 同源序列对比[27],筛选出27 个基因家族成员。对27 个OfACOs 成员在根、茎、叶、花芽,以及不同开花阶段(S1~S6)进行转录组分析。由图5可知:除去FPKM 小于1 的成员后,在根茎叶花中表达的OfACOs 成员共计17 个。其中,LYG013745、LYG034324、LYG027159、LYG027160 主要在根中微量表达;LYG007706 主要在根、叶和花中表达;LYG007045、LYG030899、LYG036697 主要在茎、叶和花中表达;LYG034328 在叶和花中表达;LYG003688、LYG006223、LYG006760、LYG034327、LYG034329 在根、茎、叶、花中均有表达;LYG034330主要在根、茎、叶中表达;LYG035696 主要在根和花中表达;LYG036707 在开花后期微量表达。

图5 桂花OfACOs 基因家族在桂花不同组织部位以及不同开花阶段中的表达分析Figure 5 Expression profiles of OfACOs gene family in different tissues and different flowering stages of O. fragrans
2.5 不同开花时期OfACOs 表达分析
综合OfACOs 基因家族在不同组织部位以及不同开花时期的表达量,以在桂花花瓣中明显表达的成员作为参与乙烯途径花瓣衰老调控的研究对象,筛选出LYG003688 、LYG006223 、LYG034327、LYG034329、LYG034330、LYG035696、LYG007706、LYG007045、LYG030899、LYG036697、LYG034328、LYG036707等12 个成员,其中LYG006223、LYG-007706、LYG007045、LYG035696 等4 个基因在开花后期(S5 或S6)极显著差异上调表达。
进一步对这4 个OfACOs 成员进行RT-qPCR 验证分析(图6)。结果表明:这4 个成员在开花后期(S5 或S6) 显著性差异上调表达(P<0.05),与转录组测序结果一致。

图6 桂花花瓣候选OfACOs 实时荧光定量PCR 分析Figure 6 RT-qPCR analysis of candidate OfACOs genes in O. fragrans
3 讨论
ACO 基因家族是植物的转录因子家族之一,在植物乙烯生物合成中发挥着重要的调控作用[28]。本研究从‘柳叶金桂’的基因组中鉴定出122 个ACO 基因,基因家族总数量高于普通烟草Nicotiana tabacum(19 个ACO 基因)[29]、杞柳Salixintegra(42 个ACO 基因)[21]、玉米Zeamays(8 个ACO 基因)[30]和甜瓜Cucumismelo(9 个ACO 基因)[17]中的数量,低于陆地棉Gossypiumhirsutum(332 个ACO 基因)[31]。ACO基因在植物基因组中分布不均匀,如玉米[32]中62.0%的基因主要分布在其中2 条染色体上,普通烟草[29]40.0%的基因主要分布在其中的2 条染色体上。本研究中桂花OfACOs 基因的42.6%主要分布在其中的5 条染色体上,推测可能与基因复制有关。
通过同源序列比对筛选、不同组织部位及开花阶段的转录组测序分析,最终筛选到4 个在花瓣衰老阶段(S5 和S6)显著上调表达的成员LYG007706、LYG007045、LYG006223、LYG035696。LYG006223 和LYG007045 位于3 号染色体上,LYG007706 位于4 号染色体上。家族内共线性分析发现:LYG007045 与LYG007706 为一对复制对,可见其保守基序、共线性都有紧密联系,可能具有相似的功能。LYG035696家族内进化分析中与LYG006223 聚类较近,两者可能具有相似的功能。与拟南芥进化分析中,LYG007706与拟南芥5 个基因位于同一个分组内。与拟南芥共线性分析中AT1G12010 与LYG007045 为共线性对;研究表明AT1G12010 参与乙烯生物合成[32],通过负调控ACC2 的表达来调控拟南芥内源乙烯水平能[33]。AT1G62380 与LYG006223 是一对共线性对 ;LYG007706 不仅与AT1G62380、AT1G12010 共线性,还与AT2G19590 共线性。AT2G19590 能够通过调控拟南芥乙烯生物合成,调控黑暗中拟南芥幼苗根系发育[34]。
此外,进化分析及基因结构分析表明:桂花中有16 个OfACOs 成员与拟南芥AtACOs 同时聚类于第3 组中,其中11 个OfACOs 成员的Motif 完全相同,且与拟南芥的AtACOs 含有7 个相同的Motif 基序。通过转录组测序及RT-qPCR 分析,在第3 组中筛选到LYG007706 在桂花花瓣衰老后期(S6)显著上调表达,与ZOU 等[6]研究中乙烯释放峰(脱落期)一致,推断其可能参与乙烯途径的桂花花瓣衰老调控。由此推断,第3 组中与拟南芥AtACOs 聚类的10 个其他OfACOs 成员可能参与桂花其他组织部位的调控。
4 结论
本研究通过对桂花OfACOs 基因家族的鉴定与表达分析,筛选到4 个在开花后期显著差异上调的成员:LYG006223、LYG007706、LYG007045 和LYG035696,它们可能参与桂花花瓣衰老的调控。其中,LYG006223 和LYG007045 都定位在3 号染色体上,且有着相同的保守基序;LYG007706 定位在4 号染色体上;LYG035696 定位于21 号染色体。后续将进一步验证这4 个成员的功能,探索其参与桂花花瓣乙烯合成途径及衰老的调控机制。
