桂花OfMYB1R47转录因子在芳香挥发物形成过程中的功能分析
2023-06-07岳远征胡宏敏刘家伟申慧敏施婷婷杨秀莲王良桂
岳远征,胡宏敏,刘家伟,申慧敏,施婷婷,杨秀莲,王良桂
(1.南京林业大学 风景园林学院,江苏 南京 210037;2.南京林业大学 江苏省风景园林重点实验室,江苏 南京 210037)
桂花Osmanthusfragrans是木犀科Oleaceae 木犀属Osmanthus常绿木本植物,具有花朵形小繁多、花香迷人的特点,是一种应用广泛的优良园林树种[1-2],并在食品和香水等商品中具有较高的应用价值[3]。有研究表明:桂花花香挥发物依据化学结构可划分为6 个类别,即萜烯类、酯类、烷烃类、酮类、醇类和醛类[4-6]。也有研究通过气相色谱-嗅觉测量法(GC-Olfactometry)分析,共鉴定出11 种对桂花香气形成具有贡献的萜类活性物质[7];同时,在‘日香桂’O.fragrans‘Rixianggui’中也发现芳樟醇的含量与花香强度的变化高度相关[8];此外,β-紫罗兰酮、芳樟醇及其衍生物等关键花香物质在不同桂花品种中相对含量的改变还是导致桂花品种间花香感官品质差异的重要原因[9]。
花香物质合成的转录调控是一个复杂的过程,其中转录因子对植物次生代谢物合成途径中结构基因的转录调控被认为是植物挥发性芳香物质生物合成的重要环节[10-11]。在桂花中,转录因子OfWRKY3 和OfERF61 可以直接调控催化产生挥发性芳香物紫罗兰酮的类胡萝卜素裂解双加氧酶4 基因(OfCCD4)的表达,并认为它们可能参与了调节酮类花香物质紫罗兰酮的合成[12-13]。此外,有研究通过气相色谱-质谱联用法(GC-MS)分析桂花花香挥发物,并结合桂花全基因组WRKY 和MYB 转录因子的鉴定,获得了一批与桂花萜烯类花香物质合成相关的候选基因[3,14]。
根据MYB 结构域的数量,MYB 转录因子分为4 个亚家族:1R-MYB、R2R3-MYB、3R(R1R2R3)-MYB 和4R-MYB 蛋白[15]。其中,R2R3-MYB 已被证实与多种生物过程有关,其在调控挥发性香气物质的合成与释放以及增强非生物胁迫能力等方面均具有重要的作用[15-18]。1R-MYB 蛋白统称为MYBrelated 蛋白,是最大的MYB 基因亚家族,在某些物种中MYB-related 成员的数量甚至是R2R3-MYB 的2 倍[18-19]。目前,在R2R3-MYB 亚家族中已鉴定出多个与花香挥发物合成有关的成员,如在花香模式植物矮牵牛Petuniahybrida中已鉴定出4 个通过调控苯基/苯丙烷代谢途径中结构基因的表达,来参与花香物质合成的R2R3 型MYB 转录因子[20-21];此外,在玫瑰Rosarugosa[22]、留兰香Menthaspicata[23-24]、姜花Hedychiumcoronarium[25]、百合Liliumbrowniivar.viridulum[26]等观赏植物中,R2R3-MYB 转录因子也会参与调控植物花香物质的合成,但关于MYB-related 亚家族成员在调节植物花香合成的研究仍鲜有报道。
基于前期桂花全基因组和转录组的测序工作[27],本研究筛选出了1 个与花香释放规律较为一致的MYB-related 转录因子,并根据其在染色体上的位置命名为OfMYB1R47。本研究拟先通过实时荧光定量PCR (RT-qPCR)技术,分析OfMYB1R47 基因在‘日香桂’不同发育时期中的表达特性;并结合亚细胞定位和酵母自激活实验进行基因特性分析;然后将该基因在本氏烟草Nicotianabenthamiana中瞬时表达;最后通过GC-MS 分析检测瞬时转化植株与瞬时转化空载植株中主要挥发性有机物质质量分数的变化,进而探讨该基因在桂花花香合成过程中的功能,旨在揭示桂花花香合成的转录调控机制。
1 材料与方法
1.1 材料
2021年10月,采集南京林业大学校园内‘日香桂’5 个不同发育阶段的花朵,分别为铃梗期(S1,聚伞花序开始分散延伸),香眼期(S2,花被纹理明显,花顶端出现孔隙),初花期(S3,大部分花处于半闭合状态,花梗挺立),盛花期(S4,花大部分或近全部呈开放状态)和末花期(S5,花全部开放,花瓣有所褶皱)[28]。所有样品采集后立即放入液氮中速冻处理,并置于-80 ℃超低温冰箱保存。每个花期具有3 个生物学重复。此外,还采集了瞬时转化OfMYB1R47 基因和空载体的本氏烟草叶片,用于后续目的基因半定量表达分析。本氏烟草种子由南京林业大学风景园林学院保存。
1.2 桂花OfMYB1R47 转录因子的克隆及进化分析
使用RNAprep Pure Plant 试剂盒[ 天根生化科技(北京) 有限公司] 从桂花5 个花期提取桂花的总RNA。随后从总RNA 中去除gDNA 后,用SuperMix 反转录试剂盒[天根生化科技(北京)有限公司]合成cDNA,条件如下:65 ℃ 5 min,冰浴2 min,42 ℃ 30 min,最后85 ℃ 5 s[29]。将cDNA 用去离子水稀释10 倍,用于后续的基因克隆。使用 Primer Premier 5.0 软件设计克隆OfMYB1R47 转录因子编码区的引物(表1),基因克隆的反应体系为:cDNA 1 μL、上下游引物各1 μL、PrimeSTAR mix 10 μL,ddH2O 补至20 μL。PCR 扩增程序为:98 ℃ 10 s;58 ℃ 30 s,72 ℃ 90 s,35 个循环;72 ℃ 10 min[30]。通过凝胶电泳检测后,使用北京全式金生物技术公司的DNA 切胶回收试剂盒对扩增产物进行收集,再将目标片段连接至用SmaI和KpnI酶切过的Super1300 载体上,并通过热激法转化大肠埃希菌Escherichiacoli,随后挑选阳性菌落送至测序公司测序,最后通过冻融法将测序正确的质粒转化根癌农杆菌Agrobacterium tumefaciens。此外,使用美国生物技术信息中心(NCBI)在线网址(https://blast.ncbi.nlm.nih.gov/Blast.cgi)得到了与OfMYB1R47 序列同源性较高的物种中的基因序列,并用MEGA 7.0 软件,采用邻接法(Neighbor-joining)分析1 000 次来构建系统进化树。

表1 本研究所使用引物Table 1 Primers used in this study
1.3 桂花OfMYB1R47 转录因子的RT-qPCR 分析以及瞬时转化植株的半定量表达分析
按照上述方法提取了桂花5 个花期的总RNA,并将其反转录为cDNA,用于基因表达分析。使用Primer Premier 5.0 设计OfMYB1R47 转录因子的RT-qPCR 引物。并且选择桂花OfACTIN作为内参基因[31]。每个RT-qPCR 的表达量均来源于3 个生物学重复和3 个技术重复。原始数据使用SPSS 26.0 中的Turkey 检验进行差异显著性分析,利用2-ΔΔCt方法进行表达量分析。同时,提取瞬时转化OfMYB1R47 基因和空载体植株叶片中的总RNA,并反转录成cDNA 进行目的基因OfMYB1R47 的半定量表达分析[14]。烟草NbL25 基因被选为内参基因。此外,还选取了与桂花OfCCD4 和OfCCD1 同源的基因NbCCD4 和NbCCD1 来探究OfMYB1R47 在烟草挥发性香气物质合成过程中潜在的调控关系。
1.4 桂花OfMYB1R47 转录因子的亚细胞定位及酵母自激活
使用不含终止密码子,但包含了OfMYB1R47 转录因子蛋白质编码区(CDS)的Super 1300 载体以及SmaI和KpnI限制位点构建了35S∷OfMYB1R47∷GFP。然后将含有35S∷OfMYB1R47∷GFP的根癌农杆菌(GV3101)和阴性对照载体(EV)注射到生长了35 d 的本氏烟草叶片中进行亚细胞定位分析。注射所用的烟草植株生长在温度为(26±2) ℃、光强为144 μmol·m-2·s-1、光照为15 h 光/9 h 暗的生长室中。注射完载体的烟草浇透水后放置在生长室中生长2 d 后,滴入稀释100 倍后的4,6-二脒基-2-苯基吲哚(DAPI)染液,再放置在LSM710 激光共聚焦显微镜下观测绿色荧光信号。
此外,利用EcoRI和SmaI限制性酶切位点,将缺失终止密码子的OfMYB1R47 基因的CDS 区域连接到pGBKT7 载体上。然后使用酵母菌株AH109 (上海唯地)获得pGBKT7-OfMMB1R47 和pGBKT7 载体。最后经PCR 阳性检测后,挑取阳性克隆的单菌落在选择性培养基SD/-Trp、SD/-Trp-Ade 和SD/-Trp-Ade+X-α-gal 中黑暗培养3 d,在恒温培养箱(30 ℃)中观察目的基因是否具有自激活活性。
1.5 桂花OfMYB1R47 转录因子在本氏烟草叶片中的瞬时表达及芳香成分分析
联合顶空固相微萃取(SPME)和GC-MS 方法检测瞬时转化植株与瞬时转化空载体植株中主要挥发性有机物质量分数的变化。目的基因瞬时转化方法同1.4。测定叶片中芳香性挥发物的方法如下:每30 mL SPME 瓶底部加入1.5 g 新鲜叶片样品,中间加入1 μL 稀释1 万倍的癸酸乙酯[29]。在65 ℃条件下将盖瓶中间暴露30 min 后,将萃取头放到加热的注射器端口3 min,并在250 ℃下进行解吸附作用。随后,通过Trace DSQ GC-MS 装置鉴定解吸后叶片中的芳香挥发物[32],并用正构烷烃混标DLM-1342-5 计算挥发性成分的保留指数(IR),在美国国家标准技术研究所(NIST) 数据库中(https://webbook.nist.gov/chemistry/cas-ser/),与含有DB-5MS (30.00 m×0.25 mm×0.25 μm)的值进行比较,从而确认花香成分[32-33]。此外,采用以下公式计算芳香挥发物质量分数:各组分质量分数=(各组分峰面积×内标质量/内标峰面积/样品质量)。在SIMCA 14.1 软件中,采用主成分分析法(PCA)对数据组内的重复性和组间的差异性进行分析,借助正交偏最小二乘判别分析法(OPLS-DA)和变量重要性投影值(VIP)对转基因组和对照组间关键的有机挥发物进行鉴定。
2 结果与分析
2.1 桂花OfMYB1R47 转录因子的克隆及编码蛋白分析
以桂花‘日香桂’盛花期花朵的cDNA 为模板,使用特异性引物扩增获得了长度为1 485 bp,可编码494 个氨基酸的OfMYB1R47 基因序列。进一步分析发现:OfMYB1R47 基因具有MYB-related 基因家族的保守结构域(图1)。将从NCBI 在线网址中获得的13 个物种中与桂花同源性较高的目的基因进行系统发育树的构建,结果表明:OfMYB1R47 与木犀科木樨榄Oleaeuropaeasubsp.europaea中的基因(CAA3020406.1)具有最高的同源性(图2)。

图1 桂花OfMYB1R47 转录因子编码的氨基酸序列Figure 1 Amino acid sequence of OfMYB1R47

图2 OfMYB1R47 蛋白的系统发育树分析Figure 2 Phylogenetic tree analysis of OfMYB1R47
2.2 RT-qPCR 分析
为了得到可靠的基因表达结果,选择内参基因ACTIN进行了OfMYB1R47 基因在桂花花朵发育5 个典型花期的表达分析(图3)。发现OfMYB1R47 基因在5 个花期中的表达展现出与桂花花朵转录组数据较为相似的表达趋势,即OfMYB1R47 的表达在开花期间呈现先上升后下降的模式,在S3 时期达到最高值,S3~S5 时期逐渐下降。
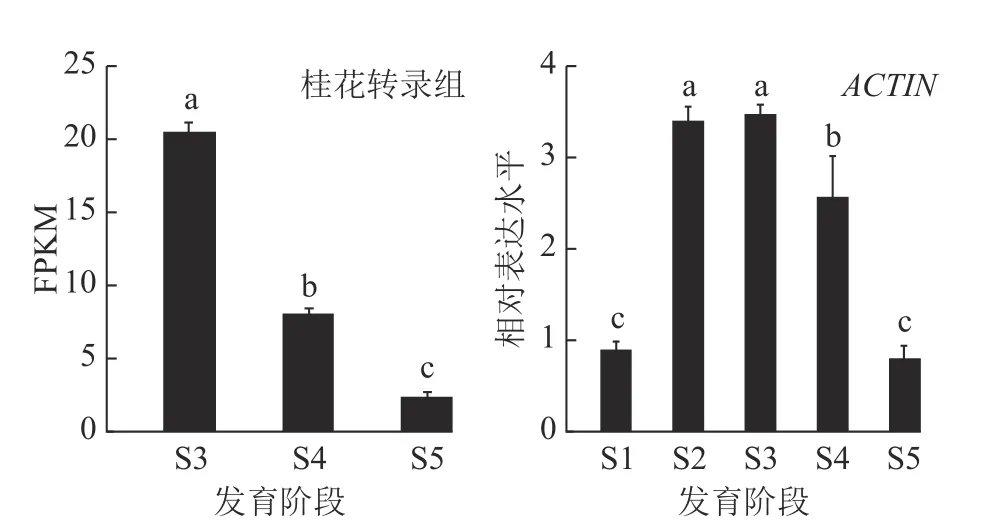
图3 OfMYB1R47 基因在桂花花朵5 个发育时期的表达模式分析Figure 3 Expression pattern of OfMYB1R 47 in the five flower development stages of O. fragrans
2.3 亚细胞定位及酵母自激活
经过亚细胞定位分析,发现在细胞核和细胞质中均检测到了35S::OfMYB1R47::GFP融合蛋白的绿色荧光蛋白(GFP) 荧光信号,经DAPI 染色后发现细胞核绿色荧光与DAPI 染色结果重合,证实了OfMYB1R47 转录因子主要定位于细胞核(图4)。除此之外,将该基因的编码区克隆到酵母表达载体pGBKT7 中,然后将阴性对照pGBKT7 和含有OfMYB1R47 转录因子的pGBKT7 载体在连续稀释的SD/-Trp、SD/-Trp-Ade 和SD/-Trp-Ade+x-α-gal 培养基上培养并进行对比。结果表明:pGBKT7-OfMYB1R47在SD/-Trp 和SD/-Trp-Ade 的平板上能够正常生长,并在含有x-α-gal 的SD/-Trp-Ade 培养基上变成蓝色,这表明OfMYB1R47 转录因子具有自激活功能(图5)。
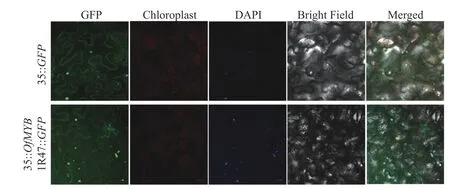
图4 OfMYB1R47 蛋白在本氏烟草叶片中的亚细胞定位结果Figure 4 Subcellular localization analysis of OfMYB1R47 in the N. benthamiana leaves
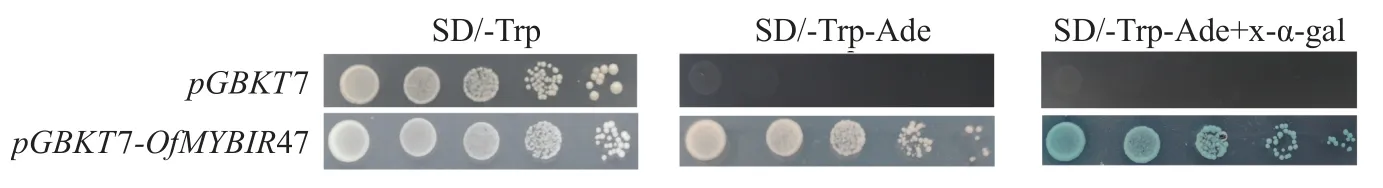
图5 OfMYB1R47 蛋白转录自激活分析Figure 5 Transcriptional activation analysis of OfMYB1R47
2.4 瞬时表达植物挥发性香气成分的验证与测定
OfMYB1R47 基因的半定量表达分析表明:在瞬时转化OfMYB1R47 的植株中,都可以检测到OfMYB1R47 的表达,而在转化空载体植物中均未检测到OfMYB1R47 的表达(图6A),这说明本氏烟草的瞬时转化体系较为成功,可以用于后续基因功能的分析。从瞬时表达OfMYB1R47 本氏烟草叶片中共鉴定出17 种芳香性挥发物,包括6 种酯类、6 种醛类、2 种酮类等(表2)。通过对瞬时表达OfMYB1R47 基因和空载体植株挥发物的主成分PCA 分析,发现瞬时转OfMYB1R47 基因的植株可以与瞬时转化空载体的植株很好地区分开来,表现出较显著的代谢差异(图6B)。同时,最小偏二乘法(OPLS-DA)分析的结果也表明瞬时表达OfMYB1R47 和空载体的组分可以完全分离(图6C)。综上所述,瞬时超量表达OfMYB1R47 可导致本氏烟草叶片芳香性挥发物质量分数的构成发生改变。
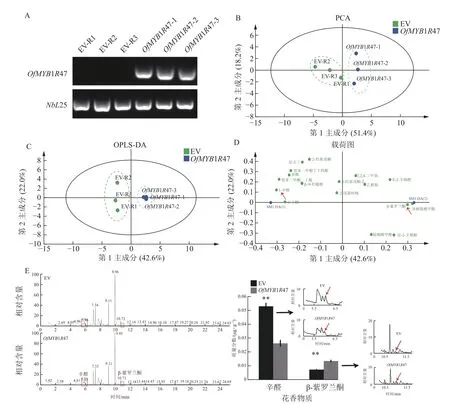
图6 OfMYB1R47 基因的功能分析Figure 6 Functional analysis of OfMYB1R47
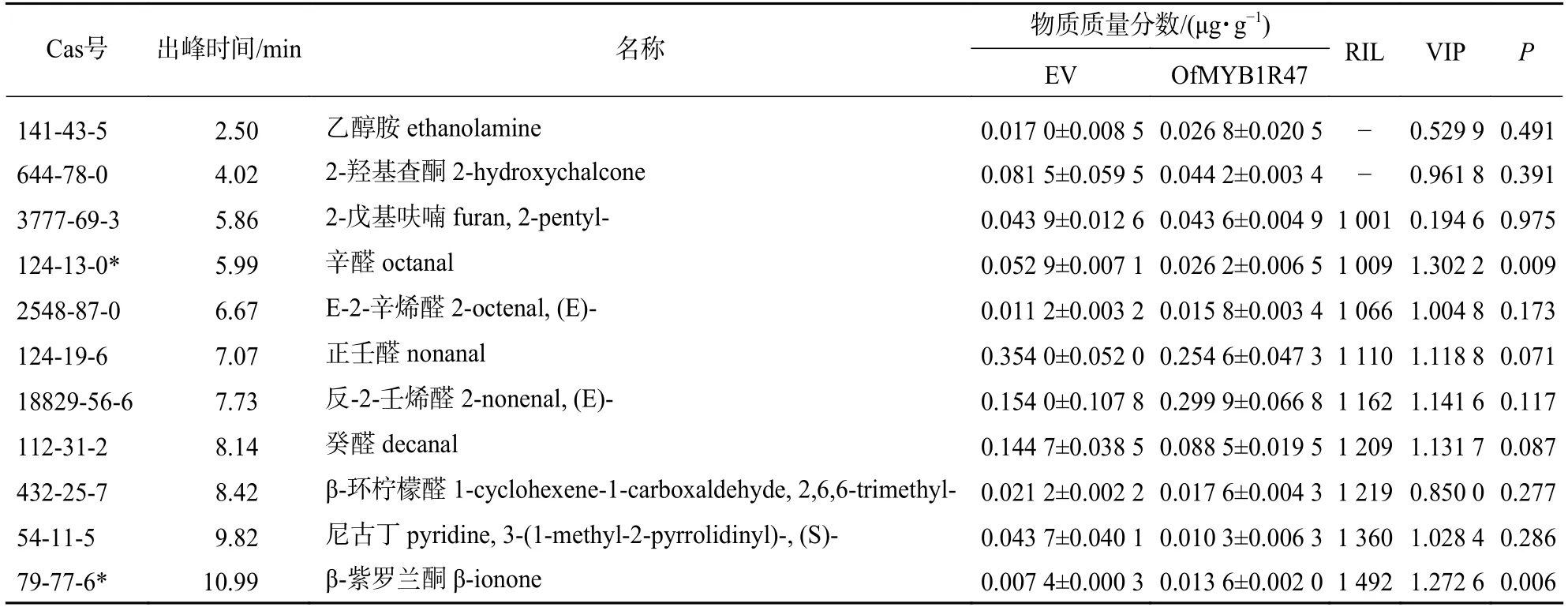
表2 瞬时表达植株中芳香性挥发物的出峰时间和质量分数Table 2 Peak time and content of aromatic volatiles in transient expression plants
基于OPLS-DA 分析,通过筛选VIP>1 和P<0.05 的差异物质,发现与瞬时表达空载体相比,OfMYB1R47 瞬时表达植株中辛醛和β-紫罗兰酮的相对含量都发生了显著改变(表2和图6D)。从GC-MS的峰面积来看,OfMYB1R47 瞬时表达植株中,辛醛的面积明显比对照瞬时表达植株小,表现为辛醛的相对含量显著下降;而β-紫罗兰酮的面积明显比对照瞬时表达植株大,表现为β-紫罗兰酮的相对含量明显上升(图6E)。此外,RT-qPCR 结果显示:与瞬时表达空载体植株相比,在瞬时表达OfMYB1R47-2 植株中NbCCD4.1、NbCCD4.2、NbCCD4.3 以及NbCCD1 等与β-紫罗兰酮合成相关的酶基因的表达量都显著上升(图7)。
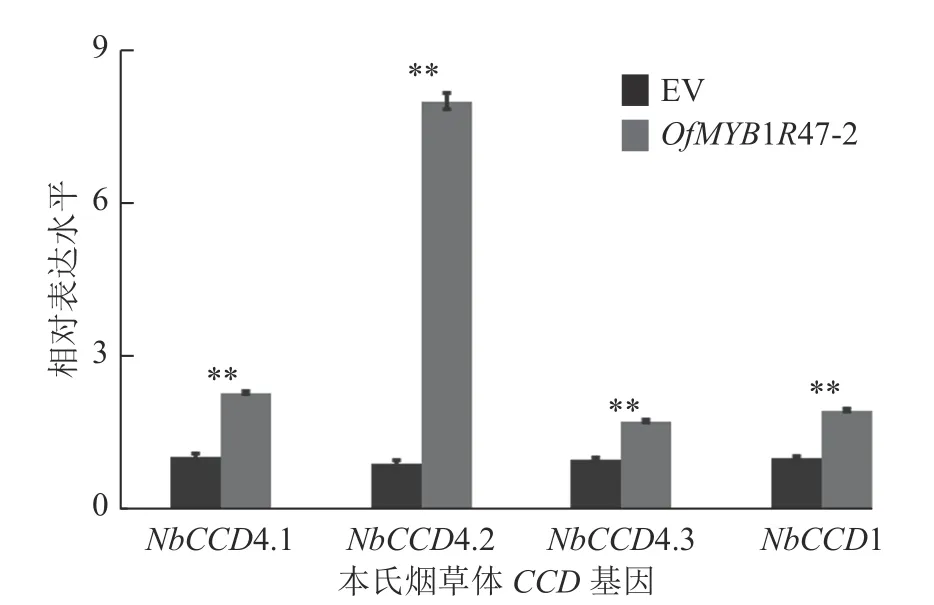
图7 本氏烟草CCD4 和CCD1 基因在瞬时表达植株中的表达量Figure 7 Expression of CCD 4 and CCD 1 gene in transiently transformed plants
3 讨论与结论
MYB-related 和R2R3-MYB 转录因子为植物中MYB 基因家族的2 个主要成员,它们在调节植物生长发育过程和响应非生物胁迫等方面均具有重要的作用。目前,已有较多的与植物挥发性有机化合物合成相关的R2R3-MYB 转录因子成员被鉴定出来[24,34-35],然而,MYB-related 成员在花香挥发物合成过程中的功能目前仍鲜有报道。植物MYB-related 转录因子通常具有一段高度保守的由51 或52 个氨基酸残基构成的结构域,该结构域可以用于识别不同类型的顺式作用元件并发挥调控作用,这也是MYB-related 基因成员的重要特征[16,36-37]。在OfMYB1R47 转录因子的N 端也发现了这段保守结构域,表明该基因为典型的MYB-related 转录因子成员。通过系统进化树分析,在13 个代表性物种中均发现了OfMYB1R47 的直系同源基因,然而这些同源基因的功能仍然未知。
花香调控基因的表达水平往往随着花朵的发育而表现出显著的变化,且往往与不同花期花香释放的强度变化具有较高的相关性[25]。为了获得较为可靠的基因表达分析结果,本研究使用桂花ACTIN这个内参基因进行RT-qPCR 分析,结果发现:OfMYB1R47 转录因子在以内参基因为参考的分析结果中表现为先上升后下降的表达趋势,这与桂花花香物质释放的规律一致[38]。在姜花、矮牵牛、留兰香、蜡梅Chimonanthuspraecox等观赏植物中研究表明:MYB 转录因子家族中的成员可与花香合成酶基因的启动子结合,通过调控相应靶基因的表达水平来调节植物挥发性有机化合物的合成[20,24-25,39]。在桂花中,也发现核定位转录因子OfERF61 可通过调节OfCCD4的表达来影响桂花重要花香物质β-紫罗兰酮的合成[13]。在本研究中,通过亚细胞定位预测发现:OfMYB1R47 转录因子蛋白主要位于细胞核内,为典型的核定位转录因子。同时,酵母自激活实验发现:OfMYB1R47 转录因子还具有较强的自激活活性。可见,OfMYB1R47 转录因子在桂花花香合成过程中可能具有重要的调控作用。
目前,在本氏烟草中进行基因功能瞬时验证的体系已经在本源物种转基因较为困难的植物中广泛应用[13,25-26]。本研究将OfMYB1R47 转录因子在本氏烟草中进行了瞬时超量表达,发现瞬时转化空载体的植株可与瞬时转化OfMYB1R47 载体的植株较好地划分为2 个类群,这说明在本氏烟草中,异源表达OfMYB1R47 基因后会引起本氏烟草芳香性挥发物构成的改变。OPLS-DA 的VIP 值分析表明:辛醛和β-紫罗兰酮是导致瞬时转化OfMYB1R47 载体植株与瞬时转化空载体植株的芳香性挥发物聚类发生明显区分的重要香味物质,且辛醛和β-紫罗兰酮的含量与转化空载体的植株相比都发生了显著变化,这表明OfMYB1R47 转录因子在芳香性挥发物的合成过程中具有重要的调节作用。进一步研究表明:瞬时表达OfMYB1R47 植株中NbCCD4.1、NbCCD4.2、NbCCD4.3 以及NbCCD1 基因的表达明显上升,表明在本氏烟草中瞬时过表达OfMYB1R47 激活了NbCCD4.1、NbCCD4.2、NbCCD4.3 和NbCCD1 等与β-紫罗兰酮合成相关的酶基因的表达,从而导致OfMYB1R47 瞬时表达植物中β-紫罗兰酮相对含量的变化。
本研究鉴定了一个具有转录激活活性,在桂花花朵中的表达模式与花香释放规律一致,且参与调控芳香挥发物合成的核定位转录因子OfMYB1R47,有助于加深对MYB-related 转录因子亚家族功能的了解,可为今后桂花的花香分子育种提供可靠的基因资源。
