代谢物组学和细胞因子谱学探讨颅内动脉瘤破裂的危险因素研究
2023-06-07刘清源姜朋军王硕吴俊
刘清源,姜朋军,王硕,吴俊
颅内动脉瘤破裂是导致蛛网膜下腔出血的主要因素[1],判断动脉瘤是否具有较高的破裂风险,对于制订未破裂颅内动脉瘤(unruptured intracranial aneurysm,UIA)的治疗策略有重要意义。炎症和颅内动脉瘤破裂密切相关[2-3],既往文献显示,相比于UIA,破裂颅内动脉瘤(ruptured intracranial aneurysm,RIA)的瘤壁存在大量炎症细胞浸润和基质降解的特点[4]。进一步研究表明,炎症相关因素(如瘤壁增强和炎症相关蛋白)可以用来区分RIA和UIA,并有可能作为预测颅内动脉瘤生长破裂风险的指标[5]。
代谢物和细胞因子是可以影响血管壁的微环境[6]。细胞因子主要包括促炎因子、抑炎因子和趋化因子等,参与免疫反应和细胞焦亡等病理生理过程。既往文献显示,IL-1β等细胞因子在动脉粥样硬化和脑梗死等疾病的发展过程中起到了重要的作用[7-10],同时也发现,代谢物参与了脑梗死、心力衰竭、腹主动脉瘤破裂等心脑血管疾病。由此可见,深入探讨颅内动脉瘤患者代谢组学和细胞因子谱学特点,有助于发掘和颅内动脉瘤破裂有关的生物学标志物。
本前瞻性研究收集了单发颅内动脉瘤行手术治疗患者的动脉瘤组织和血清样本,利用代谢组学和细胞因子谱学的方法分析代谢物和细胞因子,并探讨与颅内动脉瘤破裂有关的生物学标志物。
1 对象与方法
1.1 研究对象 本研究收集了2020年1月—2022年1月因单发颅内动脉瘤在首都医科大学附属北京天坛医院神经外科行手术治疗的患者。根据患者入院时颅内动脉瘤是否破裂,将患者分为RIA组和UIA组。本研究已经通过伦理委员会批准(伦理批号:KY2017-076-01)。
纳入标准:①年龄18~75岁;②经CTA或者DSA证实颅内单发囊性动脉瘤[11];③动脉瘤经过开颅夹闭治疗,并能获得动脉瘤的组织样本;④患者同意参与本研究,并签署知情同意书。排除标准:①合并其他脑血管畸形(如脑动静脉畸形和海绵状血管瘤)和脑肿瘤(如脑膜瘤、胶质瘤或者垂体瘤);②动脉瘤为夹层性或者血栓性;③动脉瘤为创伤性或者心房黏液瘤性;④动脉瘤家族病史;⑤多囊肾、结缔组织疾病或者风湿免疫性疾病;⑥既往接受过动脉瘤相关的手术治疗,或为复发颅内动脉瘤。
1.2 资料收集 收集患者的年龄、性别、合并疾病情况(原发性高血压、血脂异常、糖尿病、TIA或脑梗死、冠心病)、吸烟史(未戒烟或戒烟时间<1年)、饮酒史(每周喝酒至少1次)和用药史(阿司匹林和他汀类服用情况)。
基于患者术前的CTA和DSA,本研究采用MIMICS软件(17.0版,Mimics Research公司,比利时)对动脉瘤进行三维重建,并进一步分析以下指标:动脉瘤位置(大脑前动脉或前交通动脉、颈内动脉、大脑中动脉和后循环)、动脉瘤大小(从瘤颈平面中心到动脉瘤顶的最远距离)、动脉瘤形态是否规则(动脉瘤是否有子瘤或动脉瘤呈分叶状)。
1.3 样本收集及代谢组学和细胞因子检测 基于动脉瘤组织样本和患者的血清样本,进行代谢组学和细胞因子谱学分析。术中夹闭动脉瘤,切取动脉瘤顶部分组织,生理盐水清洗可见的血块,吸水纸干燥样本,样本保存于液氮中。进行代谢组学和细胞因子谱学分析前,将合适大小的动脉瘤组织研磨成粉,用细胞组织快速裂解液溶解组织粉末,在4 ℃条件下裂解20 min,1000转/分钟4 ℃离心20 min,收集上清液进行下一步检测。
所有患者均在行术前准备后(空腹8 h后)、麻醉前采集静脉血样。血样采集后3 h内,1000转/分钟 4 ℃离心10 min,收集血清并储存在液氮中。基于动脉瘤组织和患者血清样本,非靶向代谢组学的检测方法采用液相色谱质谱连用法,在Q-TOF质谱平台(Triple TOF 5600TM,Thermo公司,美国)上完成。基于动脉瘤组织和患者血清样本,靶向代谢组的检测采用质谱多反应监测法,在TRAP质谱平台(API 6500Q,AB SCIEX,美国)上完成。细胞因子检测在Bio-Plex MAGPIX平台(Bio-Rad公司,美国)上进行,运用Luminax抗体预孵育芯片(Bio-Rad公司,美国)检测46个细胞因子。计算RIA和UIA的代谢物和细胞因子表达水平的平均值,最后计算倍数值(fold change,FC),公式为其中RIA和UIA之间,具备|log1.5FC|>1且P<0.05的代谢物和细胞因子,为具有统计学差异的分子。进一步用ROC检验动脉瘤组织中和血清中的代谢物和细胞因子表达水平是否能区分RIA和UIA,结果用AUC表示。AUC>0.7被认为参数能较好地区分RIA和UIA。如果代谢物和细胞因子的表达水平在组织和血清中存在相关性,且能较好地区分RIA和UIA,则被认为是颅内动脉瘤破裂的潜在生物标志物。
1.4 统计学方法 运用SPSS 20.0进行统计学分析。计数资料用例(%)表示,组间比较采用采用χ2检验、Fisher确切概率检验或非参数检验。符合正态分布的计量资料用表示,不符合正态分布的计量资料用M(P25~P75)表示,组间比较采用t检验或Mann-WhitneyU检验。Spearman相关性检验分析代谢物和细胞因子在组织和血清中表达水平的相关性。以颅内动脉瘤破裂为因变量,将单因素分析中P<0.05且受试者曲线分析中AUC>0.7的参数作为自变量进行多因素logistic回归分析,从中筛选和颅内动脉瘤破裂相关的独立相关因素。以P<0.05为差异有统计学意义。
2 结果
2.1 RIA组和UIA组临床特点比较 本研究共纳入25例RIA患者和31例UIA患者,其中33例为男性,纳入患者的平均年龄为(55±10)岁。17例(30.4%)动脉瘤的大小<7 mm,30例(53.6%)动脉瘤的大小为7~10 mm,9例(16.0%)动脉瘤的大小>10 mm。对比RIA组和UIA组间的患者临床、动脉瘤影像学特点,年龄、性别、原发性高血压、血脂异常、糖尿病、TIA或者脑梗死、冠心病、吸烟史、饮酒史、阿司匹林和他汀类药物服用情况、动脉瘤位置、动脉瘤大小和动脉瘤形态不规则等资料差异无统计学意义(表1)。

表1 RIA和UIA组基线资料对比
2.2 RIA组和UIA组间的动脉瘤组织代谢物和细胞因子差异 主要成分分析显示,RIA和UIA之间的代谢组学和细胞因子谱学特征存在分群差异(图1A)。进一步行聚类分析发现,代谢物和细胞因子在RIA和UIA之间具有明显的聚类特点(图1B)。对比RIA和UIA之间的代谢组学和细胞因子谱学特征的差异,发现43个代谢物和5个细胞因子(FC的绝对值>1,且P<0.05)在RIA和UIA之间存在统计学差异(图1C~D)。

图1 RIA和UIA组间的代谢组学和细胞因子谱学差异
2.3 RIA组和UIA组的血清代谢物和细胞因子差异 进一步行代谢物的分类富集分析显示,RIA和UIA组织之间的差异代谢物主要是脂质、脂质类似物和脂肪酰基类物质(图2A)。通路富集分析发现这些差异代谢物主要参与不饱和脂肪酸的合成,而富集于该通路的3个代谢物(油酸、花生四烯酸和α-亚麻酸)也属于脂质、脂质类似物和脂肪酰基类物质(图2 B)。在R I A 和U I A 组织之间的差异细胞因子中,I L-1β、单核细胞趋化蛋白(monocyte chemoattractant protein,MCP-1)、I L-6 和TNF-α 为促炎因子,而I L-1受体拮抗剂(IL-1 receptor antagonist,I L-1ra)为抗炎因子(图2C)。本研究进一步分析了患者血清中代谢物和细胞因子的表达情况(图2D、表2)。其中油酸、花生四烯酸、IL-1β、MCP-1、IL-6、TNF-α和IL-1ra在RIA和UIA患者之间存在统计学差异(均P<0.05),而α-亚麻酸未见统计学差异(P=0.108)。

图2 脂质相关分子和炎症相关细胞因子与RIA相关
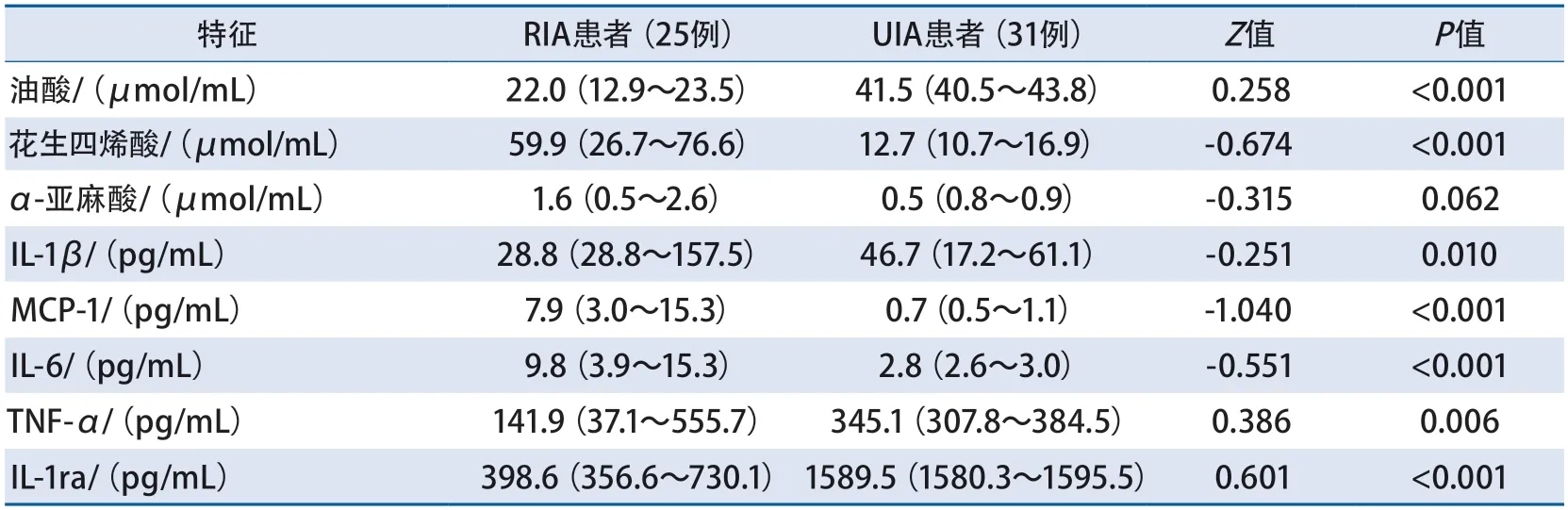
表2 RIA和UIA组血清代谢物和细胞因子水平比较
2.4 组织和血清中代谢物和细胞因子表达水平的相关性 油酸(r2=0.554,P<0.001)、花生四烯酸(r2=0.527,P<0.001)、IL-1β(r2=0.592,P<0.001)、IL-1ra(r2=0.160,P<0.001)和TNF-α(r2=0.246,P<0.001)的表达水平有正相关性(图3A);而α-亚麻酸、IL-6、MCP-1的表达量在组织和血清之间不具有相关性(均P>0.05)。进一步的ROC分析显示,不论是组织中还是血清中的油酸、花生四烯酸和IL-1β的表达水平,均能很好地区分RIA和UIA(均AUC>0.7,图3B)。结合动脉瘤组织中和血清中油酸、花生四烯酸和IL-1β在RIA和UIA之间存在差异这一事实,可见这些分子是RIA的潜在生物学标志物。
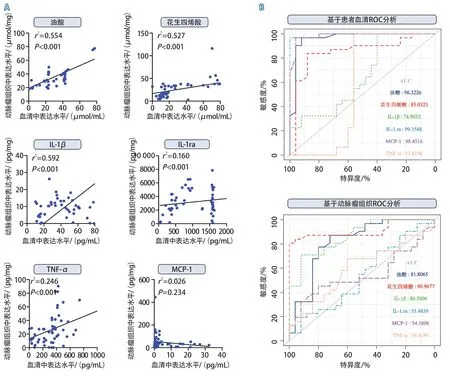
图3 脂质相关分子和炎症相关细胞因子在动脉瘤组织和血清中的表达量存在相关性
2.5 颅内动脉瘤破裂的相关危险因素 动脉瘤组织和血清分析显示,油酸、花生四烯酸和IL-1β在RIA和UIA之间的表达水平存在统计学差异。且组织中和血清中油酸、花生四烯酸和IL-1β的表达水平存在正相关性。同时ROC显示,油酸、花生四烯酸和IL-1β能较好地区分RIA和UIA。因此油酸、花生四烯酸和IL-1β是能较好区分RIA和UIA的生物学标志物。基于这3个生物标志物,进一步行单因素logistic回归分析,结果显示低血清油酸水平(OR0.74,95%CI0.64~0.85,P<0.001)、高血清油酸水平(OR1.03,95%CI1.01~1.05,P=0.006)和高血清IL-1β水平(OR1.02,95%CI1.00~1.03,P=0.010)是动脉瘤表现为RIA的危险因素。进一步行多因素logistic回归分析,结果显示低血清油酸水平是动脉瘤表现为RIA的独立危险因素(表3)。
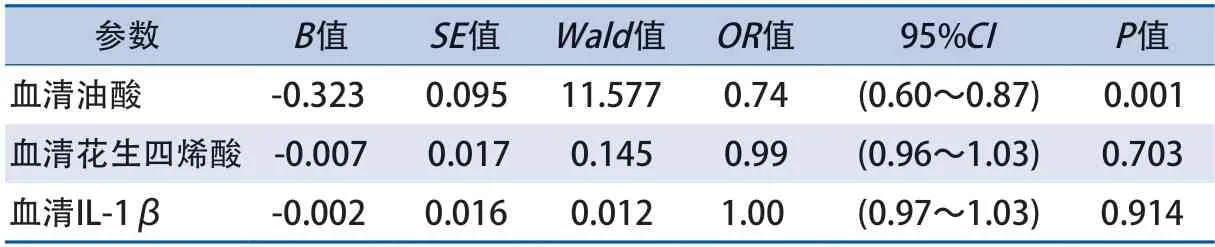
表3 颅内动脉瘤破裂独立相关因素的多因素分析结果
3 讨论
代谢物和细胞因子和脑血管病代谢密切相关。本研究通过分析56例颅内动脉瘤组织样本和血清样本的代谢组学和细胞因子谱学特点,发现RIA具有脂质代谢异常和炎症相关细胞因子分泌异常的特点。油酸、花生四烯酸和IL-1β在动脉瘤组织和血清中的表达水平具有相关性,且ROC显示,油酸、花生四烯酸和IL-1β较好地区分RIA和UIA。因此,油酸、花生四烯酸和IL-1β可能是评估颅内动脉瘤破裂风险的潜在生物学标志物。
代谢物参与了诸多心脑血管疾病的发生发展,并可以导致血管炎症和血管粥样硬化的发生[12]。而伴有炎症和粥样硬化的动脉瘤壁重构是RIA的重要病理生理学特点[13]。本研究通过代谢组学分析,发现RIA中存在脂质代谢异常的特点。同时,相比于UIA,在RIA组织和血清中,存在油酸表达量降低,而花生四烯酸表达量升高的现象。既往研究显示,脂质代谢异常和粥样硬化发生密切相关[14-15]。花生四烯酸可以作为环氧化酶1的底物,促进血管壁的炎症[16]。油酸可以作为粥样硬化抑制因子,促进平滑肌细胞的增殖,抑制血管炎症的发生[17]。因此,在进一步的临床试验中,可以考虑将油酸和花生四烯酸纳入评估颅内动脉瘤破裂风险的生物学标志物。
IL-1β可以被免疫细胞释放进入循环系统或者组织间隙中,通过IL-1受体作用诱导细胞的焦亡反应[7,18]。而焦亡反应会进一步诱发局部的炎症细胞聚集,从而导致组织的炎症浸润。既往研究中发现,IL-1β水平和血管的粥样硬化密切相关[8]。而大面积的粥样硬化导致的血管壁重塑同样也是R IA的重要病理特点[13]。既往动物实验也发现,抑制小鼠全身的IL-1β水平后,可以降低颅内动脉瘤破裂风险[19]。颅内动脉瘤的生长破裂是损伤和修复失衡的结果[20]。本研究中还发现IL-1ra在高风险颅内动脉瘤患者中显著降低。IL-1β可以促进炎症,而IL-1ra可以通过结合IL-1受体从而起到抑制IL-1β生物学作用的效果[21]。因此,IL-1β升高而IL-1ra降低的现象,提示RIA中存在炎症调节失衡的现象。可见,血清IL-1β水平可能作为评估颅内动脉瘤破裂风险的生物学标志物,结合血清IL-1β和IL-1ra的情况可反映患者全身炎症的平衡状态。本研究还发现血清中MCP-1、TNF-α和IL-1ra的表达水平在RIA和UIA患者之间存在差异。但进一步分析显示,MCP-1在动脉瘤组织和血清中的表达水平不存在相关性,同时MCP-1、TNF-α和IL-1ra在动脉瘤组织中的表达水平不能较好的区分RIA和UIA。这可能是由于MCP-1、TNF-α和IL-1ra的表达水平还受到其他合并疾病影响,且与颅内动脉瘤的相关性较弱有关。
本研究存在局限性。第一,本研究虽然对血样采集和检测进行了质量控制,但可能存在其他因素对代谢物和细胞因子水平产生影响。第二,本研究为断面研究,不能很好地反映动脉瘤的自然破裂风险。第三,多因素logistic回归分析只显示油酸为动脉瘤破裂的独立危险因素,这可能是本研究为单中心的小样本研究所致。第四,由于考虑到破裂状态会对血清细胞因子水平产生影响[22],导致本研究存在患者选择偏移。尽管存在以上局限性,本研究探讨了RIA的代谢组学和细胞因子谱学特点,为探讨颅内动脉瘤破裂的生物学标志物提供了基础。
【点睛】本研究基于颅内动脉瘤的组织和相应的血清样本,运用多组学的分析方法,发现油酸、花生四烯酸和IL-1β是评估颅内动脉瘤破裂风险的潜在生物学标志物。本研究为探讨颅内动脉瘤破裂的生物学标志物提供了基础。
