无基础代谢性疾病急性缺血性卒中患者短期营养不良预测模型构建与验证
2023-06-07张兰沈晓芳金瑾徐吉张静
张兰,沈晓芳,金瑾,徐吉,张静
全球每年新发卒中约3300万例,其中80%为急性缺血性卒中(acute ischemic stroke,AIS)[1]。AIS后易发生吞咽障碍、咀嚼无力、感觉异常等症状[2],可导致患者营养不良,出现营养缺乏性神经病变、感染、贫血等并发症,影响病情转归。目前已知高血脂症、糖尿病等基础代谢性疾病与AIS的发病有关,且对机体营养有潜在影响。然而,国内外至今尚无统一的AIS患者营养风险筛查工具。针对上述问题,同时为增强研究结果的可信度,本研究排除基础代谢性疾病的干扰,旨在分析无基础代谢性疾病AIS患者短期营养不良的影响因素并构建预测模型,为临床识别无基础代谢性疾病AIS患者短期营养不良风险和对患者的营养管理提供参考。
1 对象与方法
1.1 研究对象 回顾性选取2019年3月—2021年6月在苏州市第九人民医院神经内科治疗的AIS患者作为建模队列,纳入2021年8月—2022年6月苏州市第九人民医院神经内科治疗的AIS患者作为验证队列。纳入标准:①急性卒中首发病,发病至入院时间≤7 d;②年龄≥18岁;③符合AIS诊断标准[3],并经头颅CT或MRI证实,排除脑出血、非血管病因;④住院时间14 d以上;⑤有入院时营养风险评估和入院2周营养状况评估结果。排除标准:①存在免疫系统或先天性神经系统疾病;②存在贫血、感染、恶性肿瘤等消化性疾病;③存在糖尿病、高血压、高血脂等基础疾病;④心、肝、肾功能不全;⑤TIA;⑥接受急诊手术或静脉溶栓治疗;⑦发病前半年内发生过严重创伤。
1.2 研究方法
1.2.1 资料收集 通过病案科查阅患者的病例资料,收集患者的人口学特征(年龄、性别)、BMI、吸烟史、饮酒史、临床资料[入院时是否有潜在营养风险、入院时的吞咽功能评估结果、入院时的神经功能评估结果、入院时血红蛋白(hemoglobin,Hb)、入院时白蛋白(albumin,Alb)及患者院内营养支持情况]及入院2周的营养状况评估结果等资料。其中患者入院时是否有潜在营养风险采用营养风险量表(nutrition risk screening,NRS-2002)进行评估[4],该量表包括疾病严重程度、营养受损、年龄调整3项内容,总分范围为0~7分,<3分为无营养风险,≥3分为存在营养风险。患者入院时的吞咽状况采用才藤氏分级评估[5],分为1~7级,等级越低表明患者吞咽功能越差。入院时的神经功能采用NIHSS评分评估,总分范围为0~42分,得分越高表示神经功能缺损越严重[6]。患者院内营养支持指患者住院期的肠外营养和肠内营养支持,其中经静脉输注含氨基酸、脂肪乳、葡萄糖等营养素为肠外营养支持,经鼻饲或口服化学成分明确的营养素为肠内营养支持,将持续5 d接受肠外营养支持和(或)肠内营养制剂能量≥15 kcal/(kg·d)定义为营养支持。
1.2.2 营养不良评估 根据患者入院2周时的营养状况、BMI、Alb指标变化情况实施综合评估,其中营养状况采用微型营养评定简表(mininutritional assessment short-form,MNASF)评判[7],内容包括:①最近食欲、进食情况;②入院以来体重下降情况;③卧床与否;④心理是否受急性疾病应激影响;⑤是否伴有抑郁或痴呆。该量表总分范围0~14分,当MNA-SF评分<8分且BMI<18.5 kg/m2、Alb<35.0 g/L时为营养不良[8],以此为依据分为营养不良组和无营养不良组。
1.3 统计学方法 应用SPSS 17.0软件进行分析,其中计数资料用率(%)表示,两组比较采用χ2检验;计量资料用表示,两组比较采用t检验。以无基础代谢性疾病AIS患者短期是否出现营养不良(0=否,1=是)为因变量,将一般资料中差异P<0.05的指标作为自变量纳入多因素logistic回归分析,探索无基础代谢性疾病AIS患者短期营养不良的影响因素并建立预测模型。采用ROC分析模型区分度;采用拟合优度检验评价模型校准度;验证模型正确率。P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 建模队列共纳入924例无基础代谢性疾病AIS患者,年龄19~76岁,平均(55.0±14.3)岁,男性544例(58.9%),女性380例(41.1%)。其中72例(7.8%)为营养不良(营养不良组),其余为营养状况正常(无营养不良组)。两组间的年龄、饮酒史、入院时营养风险、院内营养支持、入院时才藤氏分级、入院时NIHSS评分差异有统计学意义(表1)。

表1 营养不良组与无营养不良组的一般资料比较
2.2 无基础代谢性疾病AIS患者短期营养不良的多因素logistic回归分析 多因素logistic回归分析结果表明,年龄增长、饮酒史、入院时有营养风险、院内无营养支持、入院时才藤氏分级降低、入院NIHSS评分升高均是无基础代谢性疾病AIS患者短期营养不良的影响因素(表2)。
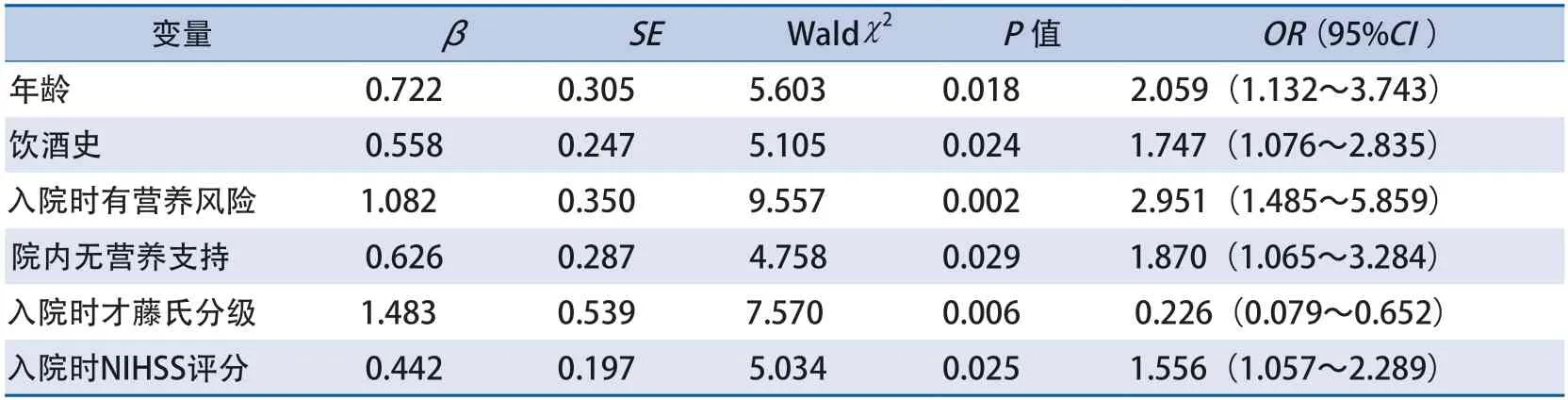
表2 无基础代谢性疾病缺血性卒中患者短期营养不良的多因素分析结果
2.3 无基础代谢性疾病A I S患者短期营养不良的预测模型构建 以表2的回归系数和常数项构建模型,得出预测模型方程:logit(P)=0.722×年龄+0.558×饮酒史(0=无,1=有)+1.0 82×入院时营养风险(0=无,1=有)+0.626×院内无营养支持(0=有,1=无)-1.483×入院时才藤氏分级+0.442×入院时NIHSS评分+0.479-31.187。
以模型的预测概率值为检验变量,以无基础代谢性疾病AIS患者发病后是否出现营养不良为状态变量,绘制ROC评价预测模型的区分度,结果发现ROC曲线下面积为0.863(95%CI0.811~0.914),通过最大约登指数(0.703)计算出该模型的阈值为0.51,对应的灵敏度为87.50%,特异度为83.90%(图1)。拟合优度检验得出χ2=2.754,P=0.498,表明模型不存在过拟合现象。
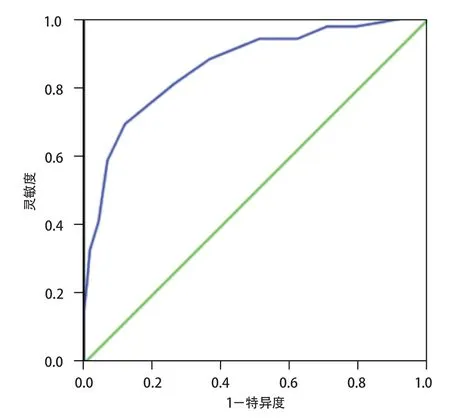
图1 无基础代谢性疾病缺血性卒中患者短期营养不良预测模型的ROC曲线
2.4 预测模型的验证效果 验证队列共纳入126例无基础代谢性疾病AIS患者,采用模型对其短期营养不良进行预测,得出模型预测的灵敏度为86.96%(20/23)、特异度为83.50%(86/103)、正确率为84.13%(106/126)(表3)。

表3 模型的预测值与实际值
3 讨论
营养不良对卒中预后有负面影响[9],且老年患者的营养不良较普遍[10]。可能是部分老年患者合并基础代谢性疾病,加深了对机体营养状况的影响。因此本研究排除上述情况,分析无基础代谢性疾病AIS患者的资料,结果发现此类患者短期营养不良发生率为7.8%,显著低于葛茜茜等[11]报道的28.10%,结果差异可能与本研究的特定人群或院内营养支持率不同等因素有关。
本研究多因素分析发现,高龄、饮酒史、入院时有营养风险、院内无营养支持、入院才藤氏分级低和入院NIHSS评分高是无基础代谢性疾病AIS患者短期营养不良的影响因素。究其原因:①因年龄增长,胃壁细胞萎缩,胃酸和内因子分泌不足[12],容易造成营养吸收障碍而引发营养不良。另外高龄者体力有限,活动量减少,造成胃肠蠕动减慢,影响肠道对食物营养的摄取,易发生营养不良。②饮酒与卒中发生有关联[13-14],同时也与机体营养不良有关。研究表明,个体长期大量饮酒会导致其饮食中营养密集型食物的摄入减少[15]。长期饮酒不仅伤害肝脏,还会造成胃肠黏膜损伤,影响胃肠对食物营养的吸收,易发生营养不良。③营养风险与营养不良的概念完全不同。营养风险是指近期食欲和体重下降,但未见皮褶厚度、血清Alb指标明显下降等营养不良状况。NRS-2002是住院患者营养风险筛查的常用工具[16]。有研究采用NRS-2002调查发现我国神经系统疾病患者入院时潜在的营养风险高达20%[17]。入院时有营养风险,表示体内所需的营养物质缺乏,易发生营养不良,因而需重视院内营养支持,维持机体所需的营养素。④才藤氏评级法是评价吞咽状况的常用工具,其等级越低表示吞咽功能越差。吞咽障碍会影响经口进食[18],使食物和其他营养物质的摄入减少,导致机体营养吸收不足而出现营养不良。有研究提示卒中后出现吞咽障碍是患者的神经功能受损所致[19]。NIHSS评分高提示卒中患者的神经功能受损严重,可导致咽喉肌无力、咀嚼肌无力、吞咽障碍等症状,影响自主摄食,继发营养不良。神经功能受损严重会导致肢体偏瘫,使患者的活动量减少而影响胃肠蠕动,阻碍胃肠道对营养物质的吸收,加之AIS病因所致体内环境不稳定的应激状态,能量消耗大,易造成营养吸收与消耗不平衡而发生营养不良。
良好的预测模型在于筛选出有效指标。本研究通过多因素logistic回归分析无基础代谢性疾病AIS患者短期营养不良的影响因素,随后根据因变量的回归系数和常数项建立模型,发现模型有较高的诊断效能。可能是因为本研究应用独立样本验证,排除掉不相关指标,避免模型过拟合;将相关指标组合,实现信息互补,增强模型的诊断效能。经验证发现模型预测的整体正确率为84.13%,说明根据患者营养不良的影响因素建立模型,能提高预测效能,为患者的营养管理提供指导。
综上,高龄、饮酒史、入院时有营养风险、院内无营养支持、才藤氏分级低、入院NIHSS评分高均是无基础代谢性疾病AIS患者短期营养不良的影响因素,以此构建预测模型的效能良好。但本研究设计为单中心研究,模型建立与验证的样本来源单一,代表较局限,还需开展多中心队列研究进一步验证该模型在更多临床环境下的效能。
【点睛】本文分析无基础代谢性疾病AIS短期营养不良的影响因素并建立预测模型,有助于临床判断患者的营养不良风险,为患者的营养管理提供指导。
