DNA甲基化与高同型半胱氨酸血症
2023-06-07瓮佳旭周宏宇李子孝
瓮佳旭,周宏宇,李子孝,3,4
高同型半胱氨酸血症(hyperhomocysteinemia,HHcy)与动脉粥样硬化性血管病的关联源于McCully[1]对一名有HHcy的8岁男孩进行尸检时,发现了广泛的动脉血栓和动脉粥样硬化病灶形成。统计数据表明,有40%被诊断为早发冠状动脉疾病、外周血管疾病或复发性静脉血栓形成的患者存在HHcy[2]。多项研究表明HHcy是心血管疾病的独立危险因素,并可能与血管内皮细胞功能障碍有关[1,3-5]。DNA甲基化作为基因表达表观遗传调控的重要形式之一,其水平异常在伴有HHcy的心血管疾病患者中也有报道[6-7]。由Hcy和甲硫氨酸(methionine,Met)共同参与的Met-Hcy(methionine-homocysteine,M-H)循环可为甲基化反应提供甲基单元,其代谢关键酶功能缺陷或辅酶因子缺乏所导致的Hcy水平升高可在整体或位点特异性水平参与DNA甲基化的调节[8]。这可能是HHcy增加动脉粥样硬化和心脑血管疾病风险的潜在机制之一。
1 Hcy的来源、代谢途径及影响因素
Hc y是人体内一种含硫的非必需氨基酸,主要来源于食物中摄取的必需氨基酸Met(也称为蛋氨酸)[9]。Met在甲硫氨酸腺苷转移酶(methionine adenosyltransferase,MAT)的催化和ATP的参与下生成S-腺苷甲硫氨酸(S-adenosylmethionine,SAM),SAM通过甲基转移酶(DNA methyltransferases,D N M Ts)将甲基转移至D N A、R N A、蛋白质等分子后,形成S-腺苷同型半胱氨酸(S-adenosyl-L-homocysteine,SAH),再被SAH水解酶(SAH hydrolase,SAHH)水解脱去腺苷后生成Hcy(图1)。目前普遍认为这是人体产生Hcy的唯一途径[10]。
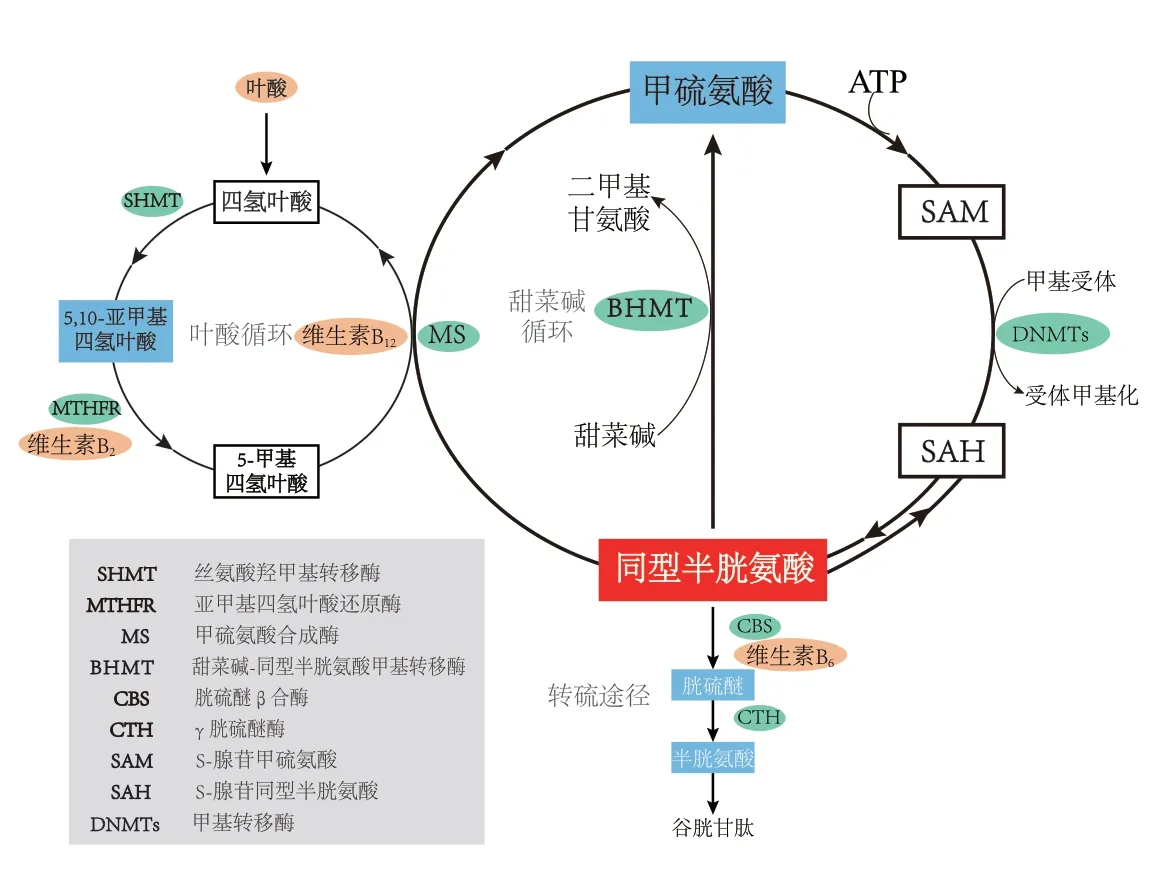
图1 同型半胱氨酸的生成与代谢循环
Hcy在人体内通过再甲基化和转硫化两个途径完成代谢[11]。再甲基化途径是指Hcy在酶催化下结合甲基再次生成Met的过程。根据提供甲基的化学物不同,再甲基化途径分为由5-甲基四氢叶酸(5-methyltetrahydrofolate,5-MTHF)提供甲基的叶酸循环途径和由三甲基甘氨酸(又名甜菜碱)提供甲基的甜菜碱循环途径。叶酸循环途径在甲硫氨酸合成酶(methionine synthetase,MS)的催化下,以维生素B12为辅酶完成[12]。其中,叶酸的活化形式四氢叶酸在5-MTHF生成过程中发挥重要作用,在被丝氨酸羟甲基转移酶(hydroxylmethyl transferase,SHMT)转化为5,10-亚甲基四氢叶酸后,由亚甲基四氢叶酸还原酶(methylenetetrahydrofolate reductase,MTHFR)还原生成5-MTHF,为Hcy叶酸循环途径提供甲基。这个过程几乎存在于所有的细胞中[13]。肝脏和肾脏中也可以发生由甜菜碱—同型半胱氨酸甲基转移酶(betainehomocysteine methyltransferase,BHMT)催化完成的甜菜碱循环[14-15]。转硫途径是指Hcy在胱硫醚β合酶(cysteine beta synthase,CBS)的催化下,以维生素B6作为辅酶因子,与丝氨酸结合生成胱硫醚,之后γ胱硫醚酶将胱硫醚水解为半胱氨酸,再由谷胱甘肽合成酶催化合成谷胱甘肽随尿液排出[16-17]。
体内大部分Hcy以二硫键与血浆蛋白结合,在正常情况下保持稳定水平,正常值为5~15 μmol/L[18]。当Hcy生成或代谢途径受遗传或非遗传因素影响,出现膳食中叶酸、维生素B12和维生素B6缺乏或相关酶缺陷时,Hcy的稳定水平被打破,在人体中发生聚积[19-21]。当血浆中Hcy的浓度增加至15 μmol/L以上时,即为HHcy。
2 HHcy影响sDNA甲基化水平
较多研究表明,Hcy水平可影响整体的DNA甲基化水平。例如:在叶酸和维生素B12缺乏、Hcy代谢酶基因MTHFRC677T型突变的群体中可检测到Hcy水平升高、DNA甲基化水平降低[22]。在HHcy小鼠模型和HHcy患者的动脉粥样硬化斑块中均可观察到整体DNA呈低甲基化状态[23-24]。通过检测动脉粥样硬化性血管病变患者和匹配后的健康对照者血浆中Hcy和白细胞中的DNA甲基化水平,发现动脉粥样硬化性血管病变患者的Hcy水平升高、SAM/SAH比值和DNA甲基化水平降低[25]。研究结论为DNA甲基化的状态与血浆Hcy水平显著相关。此外,有研究发现,Mthfr缺陷小鼠的大脑和卵巢中DNA呈低甲基化水平[26]。有研究显示,妊娠早期叶酸缺乏与婴儿神经管发育缺陷风险增高有关,DNA低甲基化可能是相关机制之一[27]。Pogribny等[28]给雄性大鼠喂食叶酸缺乏饮食9周,检测发现大鼠血浆中SAM浓度、SAM/SAH比值降低,肝脏整体DNA甲基化水平降低。以上研究均证明Hcy水平升高可能与DNA甲基化水平的降低有关。
Hc y水平与DNA甲基化的关系可能与M-H循环中叶酸循环途径的代谢平衡有关。首先,在哺乳动物中,SAM是甲基化反应的甲基供体,SAM及其反应产物SAH的浓度可调节DNA甲基化反应[29-30]。其次,SAH可以与DNMTs的催化区域高亲和力结合,成为强有力的竞争性甲基转移酶抑制剂,因此SAH的快速去除对甲基化反应效率至关重要[31]。在Hcy生成过程中,SAH水解为Hcy作为可逆反应,趋向于SAH的合成明显优于水解。因此,Hcy的快速代谢对于SAH的水解也非常重要,Hcy积聚会造成SAH积聚,进而引起甲基化反应抑制,导致DNA甲基化水平降低[32]。因此,目前观点认为Hcy通过M-H循环中的SAM和SAH与DNA甲基化形成连接,占据了一碳代谢和表观遗传修饰之间的重要连接点[8]。
有研究在小鼠模型中探索了Hcy升高的情况下,SAH积聚与细胞低甲基化的关系,发现Cbs基因缺陷小鼠表现出Hcy及SAH增加,肝脏和大脑中蛋白甲基化状态降低,但整体DNA甲基化状态未受影响[33-34]。研究结果提示,整体DNA低甲基化可能不参与小鼠Cbs基因突变的病理生理学过程,但并不能排除有特定位点DNA甲基化异常的可能性。因此,在未来的研究中分析全基因组DNA甲基化的状态变化是有必要的。
3 HHcy相关DNA甲基化与动脉粥样硬化
在动脉粥样硬化患者中经常观察到Hcy水平升高,有研究认为HHcy对DNA甲基化的影响可能是心血管疾病风险增加的机制之一,这可能与动脉粥样硬化发病过程中的内皮细胞功能障碍、平滑肌细胞增殖和转移、脂质代谢等过程有关[35-37]。
3.1 内皮和平滑肌细胞功能障碍 目前认为血管内皮和平滑肌细胞功能障碍是动脉粥样硬化发展过程中的重要阶段,并预示着不良的心血管结局[38]。
有研究认为HHc y通过影响DNA甲基化从而在内皮细胞的衰老过程中发挥作用。Zhang等[39]发现,体外HHcy条件下培养的人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)在传代期间出现p16、p21和p53等细胞衰老标志物的加速上调,通过实时定量聚合酶链反应、甲基化特异性聚合酶链反应检测,发现了端粒酶逆转录酶(human telomerase reverse transcriptase,hTERT)基因启动子区域的低甲基化。内皮细胞在一氧化氮合酶(nitric oxide synthase,NOS)的催化下合成一氧化氮(nitric oxide,NO),可抑制血小板黏附、平滑肌细胞增殖和LDL-C的氧化[40]。在体外HHcy条件下培养人脐静脉内皮细胞可以检测到NOS的抑制剂——不对称二甲基精氨酸表达含量增加,并导致NO合成抑制、内皮细胞破坏,从而激活动脉粥样硬化过程[41]。其中的机制与HHcy条件下二甲基精氨酸二甲胺水解酶(dimethylarginine dimethyl amino hydrolase,DDAH)基因启动子区域的甲基化水平降低有关[42]。上述研究表明,HHcy对内皮细胞功能的影响可能与DNA甲基化有关。
血管平滑肌细胞的增殖和去分化参与动脉粥样硬化形成的病理过程[43]。血小板衍生生长因子(platelet derived growth factor,PDGF)基因是血管平滑肌细胞增殖的有效促分裂剂[44]。Han等[45]在不同梯度浓度的Hcy条件下培养人血管平滑肌细胞,发现血管平滑肌细胞增殖数量、PDGF表达水平随Hcy浓度增高而增加,PDGF启动子甲基化的水平随Hcy浓度增加而降低。进一步的评估发现,Hcy处理组细胞内SAH的浓度较对照组增加,SAM较对照组浓度降低,SAM/SAH比值显著降低。这与HHcy导致DNA去甲基化水平降低的机制相符,表明HHcy可能影响PDGF启动子区域的低甲基化,导致PDGF表达、刺激血管平滑肌细胞增殖,从而促进动脉粥样硬化的加速发展。
3.2 脂质代谢 有证据表明DNA甲基化异常可能是HHcy相关脂质代谢异常的重要作用机制。一项调查了152例妊娠中期女性维生素B12和脂质关系的队列研究提示,维生素B12水平较低的妊娠期女性Hcy水平显著升高,脂肪细胞中SAH浓度增加,同时血浆TC、LDL-C、TC/HDL-C水平升高。进一步的全基因组DNA甲基化测序分析发现,这种变化与胆固醇调节元件结合蛋白(sterol regulatory element binding transcription factor 1,SREBF1)基因,以及低密度脂蛋白受体(low-density lipoprotein receptor,LDLR)基因转录起始位点甲基化水平降低同步[46]。
有动物实验使用高Met饮食喂养载脂蛋白E(apolipoprotein E,ApoE)基因敲除小鼠20周,检测发现小鼠血清Hcy升高、SAH聚集和DNMT1表达水平降低,基因组分析表明,HHcy组小鼠脂肪酸结合蛋白4(fatty acidbinding protein 4,Fabp4)基因启动子区域甲基化降低,FABP4的表达增加[47]。FABP4作为脂肪细胞和巨噬细胞中长链脂肪酸和视黄酸的脂质转运蛋白,其表达增高可增加TC和TG的积累,在上述试验中测量主动脉根部动脉粥样硬化斑块面积时,HHcy组小鼠较对照组病灶面积明显增大[48]。除此之外,HHcy条件下体外培养巨噬细胞72 h后,实验组Fabp4基因启动子甲基化水平显著降低,Fabp4mRNA转录和蛋白表达明显上调[48]。这提示,Fabp4启动子区域低甲基化在HHcy介导的脂质代谢紊乱中可能发挥重要作用。上述HHcy动物模型实验的结果支持并扩展了动脉粥样硬化发展过程中的体内、体外机制,证明HHcy可能对脂质代谢过程中的DNA甲基化产生影响,从而加速动脉粥样硬化的形成。
4 HHcy与DNA甲基化对心血管危险因素的影响
HHcy与DNA甲基化的关联在糖尿病等心血管疾病的危险因素中也有体现。一项研究选取了85例糖尿病患者和30例健康受试者作为对照,分别采集单纯性糖尿病组、早期糖尿病肾病组、临床糖尿病肾病组和正常对照组外周血白细胞DNA,测定MTHFR基因启动子区域甲基化状态及血清中Hcy水平,结果显示,与正常对照组相比,单纯性糖尿病组、早期或临床糖尿病肾病组均具有更高的Hcy水平,且MTHFR基因启动子区域呈现低甲基化状态[49]。该研究显示,HHcy与MTHFR启动子低甲基化有明显关联,且此种关联与糖尿病有关。
Hcy通过代谢循环中的SAM和SAH影响DNA甲基化状态,是一碳代谢和表观遗传修饰之间的重要连接点。HHcy是心血管疾病的独立危险因素,其机制可能与血管内皮细胞及平滑肌细胞功能障碍、脂质代谢异常等动脉粥样硬化过程中DNA甲基化状态的改变有关,未来需要更多的研究对这些机制进行探索。
【点睛】HHcy可能通过影响DNA甲基化影响动脉粥样硬化的形成,从而增加心血管疾病的风险。
