基于生物信息学分析儿童特发性血小板减少性紫癜的发病机制
2023-06-05周雪陈团营牛静
周雪,陈团营,牛静
(1.河南中医药大学 儿科医学院,河南 郑州 450000; 2.河南中医药大学第二附属医院 儿科,河南 郑州 450002)
特发性血小板减少性紫癜(idiopathic thrombocytopenic purpura,ITP)是自身免疫引起的出血性疾病。ITP在儿童中的发病率较高,每年每10万儿童中有5~10人发病,并呈上升趋势,在发病前期许多患儿无症状,血小板计数减少明显[1-2]。对于有症状的患儿,出血是最常见的表现特征,可发生瘀点、紫癜和鼻出血等轻微出血或者是更严重的颅内、胃肠道或泌尿生殖系统等出血[3-4]。对于儿童ITP的治疗目标一般集中在止血或预防出血,但是儿童自发性缓解的可能性较低,更容易出血[5]。目前一线治疗方案主要包括糖皮质激素、静脉注射免疫球蛋白以及生物制剂如利妥昔单抗等,但是最近的一项随访研究[6]提示某些特定的ITP患者亚组在使用利妥昔单抗时需要更加谨慎。Moulis等[7]发现ITP在2.4%的儿童中是继发性的,其中原发性免疫缺陷是最常见的病因。继发性ITP的病理机制差异很大,对感染的反应可能产生与血小板交叉反应的抗体,这在病毒性疾病或接种疫苗后的儿童ITP中常见。更有研究[8-9]显示ITP与静脉和动脉血栓形成以及疲劳和生活质量下降有关,具有比一般人群更高的死亡率,主要是由出血、感染、心血管事件和较高的血液病患病率造成的。由于基因与环境因素在人类常见疾病中的相互作用,我们需要一种更综合的生物学方法来解决这些复杂性。因此,基于生物信息学所衍生的DNA微阵列技术是生物医学研究的一项重要技术,它能够同时识别数千个基因,甚至整个基因组。高通量数据的系统网络分析是解释生命科学重要意义的最有用的技术,在生物科学研究中至关重要。我们基于生物信息学分析儿童ITP的发病机制,报道如下。
1 资料与方法
1.1 差异表达基因(differential expression genes, DEGs)的筛选和获取
检索GEO(Gene Expression Omnibus database)数据库(https:∥www.ncbi.nlm.nih.gov/geo/),选择“idiopathic thrombocytopenic purpura”或“immune thrombocytopenia”作为关键词;“expression profiling by array”作为研究类型;种族选为“home sapiens”,选取ITP相关芯片数据集。 通过GEO2R(http:∥www.ncbi.nlm.nih.gov/geo/geo2r/)筛选ITP患儿和正常儿童之间的DEGs。将P<0.05和|Log fold change(FC)|>2.5设置为阈值。
1.2 基因本体论(GO)和京都基因和基因组百科全书(KEGG)分析
通过DAVID在线注释、可视化和集成发现数据库(https:∥david.ncifcrf.gov/)对DEGs进行GO注释和KEGG通路富集分析,展示显著富集结果图。
1.3 蛋白质相互作用(PPI)网络的构建以及核心基因的筛选
DEGs的PPI网络构建和分析通过STRING在线数据库(http:∥stringdb.org/)构建,并由Cytoscape软件可视化。蛋白互作网络中核心(Hub)基因(前10个)由CytoHubba插件计算获得。
1.4 基因集富集分析(gene set enrichment analysis,GSEA)
使用GSEA4.1.0软件对ITP组和正常组进行GSEA分析,数据库选择c2.cp.kegg.v7.4. symbols.gmt[Curated],检验次数为1 000。以|NES|>1、P<0.05、FDRq<0.25为差异显著。
1.5 免疫细胞浸润(immune cell infiltration,ICI)分析
将获取的ITP相关芯片数据进行ICI分析。采用CIBERSORT标准,以perm=1 000、P<0.05为筛选条件。
2 结 果
2.1 DEGs获取
GSE46922数据集包含13个样本,以P<0.05和|logFC|>2.5为筛选条件,获得276个DEGs。其中上调的DEGs有191个,下调的有85个,并将|logFC|前20名上调和下调的差异基因的以热图形式展现,见图1。

图1 DEGs热图Fig 1 Heat map of differentially expressed genes
2.2 GO和KEGG分析
GO生物过程(BP)分析显示,DEGs靶基因在细胞黏附及其负调控、细胞基质黏附力、肥大细胞激活的负调控、整合素信号通路以及细胞外基质组织等方面特别富集;GO细胞组分(CC)分析显示,靶基因主要富集于早胞内体、血红蛋白复合体、细胞表面及外区等方面;GO分子功能(MF)分析表明,靶基因在细胞外基质的结构组成、整合素结合、氧气结合、氧转运体活性等方面显著富集。此外,KEGG通路分析显示,DEGs靶基因显著富集于在受体酪氨酸激酶的抑制剂、ErbB信号通路、蛋白质的消化吸收、Rap1信号通路、轴突导向、PI3K-Akt信号通路及补体及凝血系统等。见图2、3。
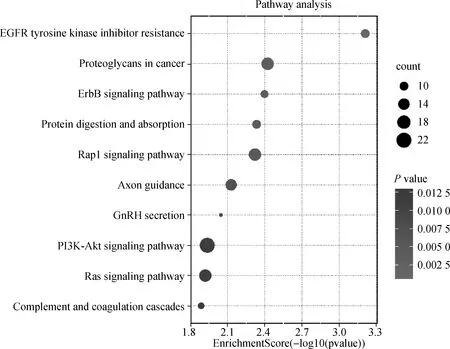
图3 KEGG分析气泡图Fig 3 The bubble chart of KEGG analysis
2.3 PPI网络构建
将STRING数据库构建的PPI网络基因上传至Cytoscape软件,并使用Cytohubba插件筛选核心基因,获取核心靶点基因有ITGB3、ARRB1、COL3A1、COL11A1、CFTR、HBB、ITGB5、KIFC1、CHEK1、MYBL2、DEPDC1、GTSE1等。见图4。
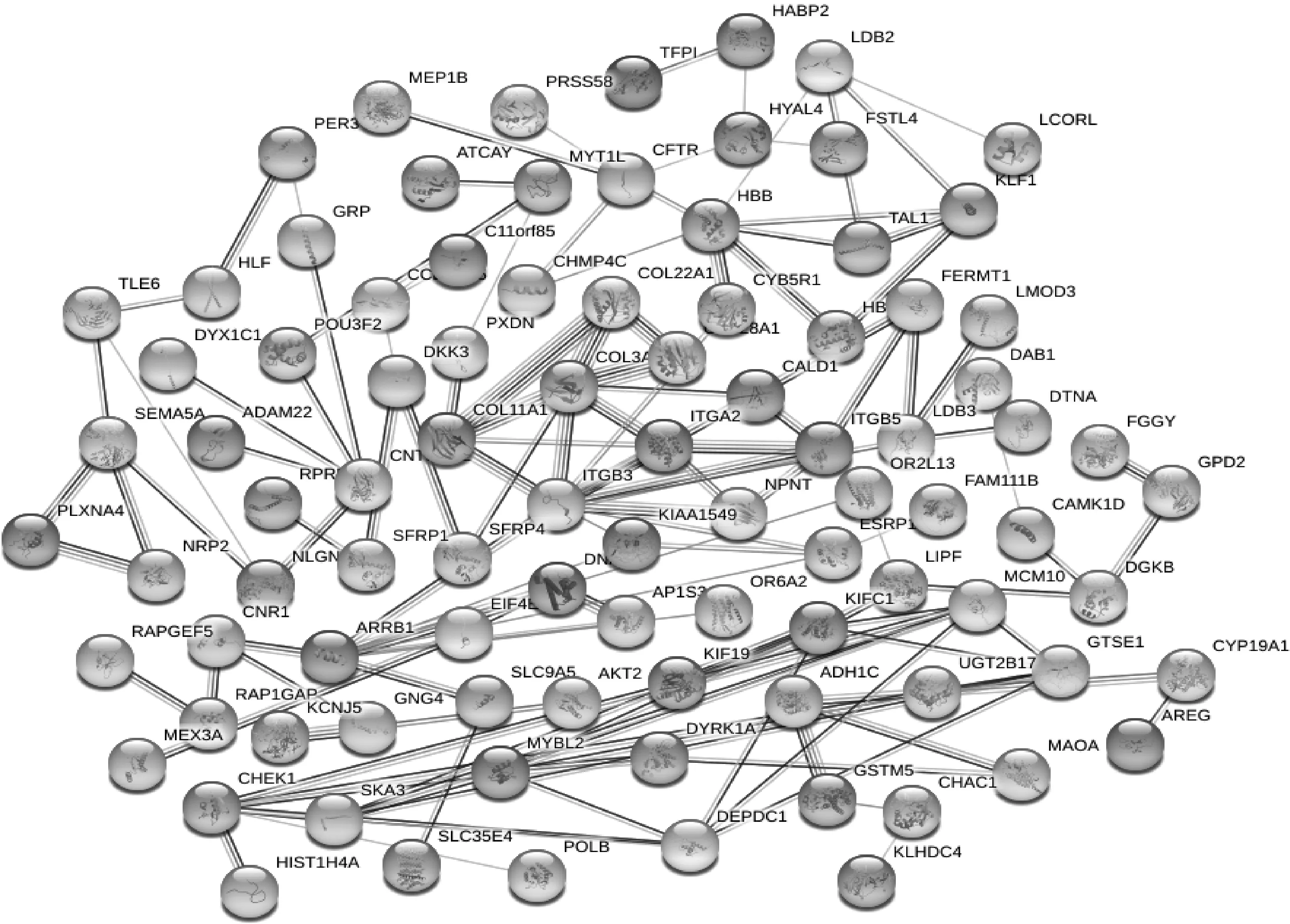
图4 DEGs的PPI网络靶点Fig 4 PPI network target of DEGs
2.4 GSEA富集通路分析
GSEA富集通路分析显示,显著富集于神经活性配体-受体相互作用、黑色素瘤、细胞外基质受体相互作用、调节肌动蛋白细胞骨架、黏着斑等方面。见图5。

图5 GSEA富集通路分析图Fig 5 The diagram of GSEA enrichment pathway analysis
2.5 ICI分析
ICI分析显示,B细胞与静息的记忆CD4+T细胞,激活的CD4+T细胞分别与中性粒细胞、M2巨噬细胞、单核细胞、激活的肥大细胞呈正相关,激活的肥大细胞分别与中性粒细胞、M2巨噬细胞、单核细胞呈正相关,调节性T细胞与激活的NK细胞、M0巨噬细胞、浆细胞也都呈正相关;CD8+T细胞与静息的CD4+T细胞、激活的CD4+T细胞、中性粒细胞、激活的树突状细胞、激活的肥大细胞呈负相关,激活的树突状细胞与静息的肥大细胞呈负相关。见图6。
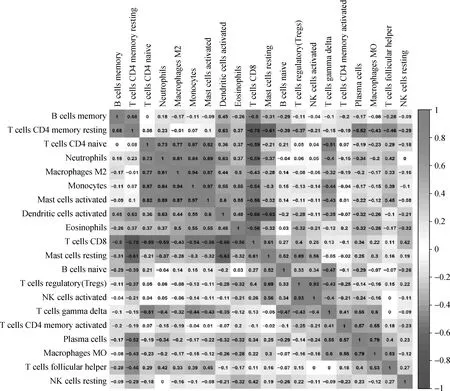
图6 免疫细胞表达相对含量相关性分析Fig 6 The relative content correlation analysis of immune cell expression
3 讨 论
儿童ITP的发病机制目前尚未明确,但是随着测序技术和生物信息学的发展,可通过大数据基因差异分析来探究ITP的发病机制。本研究提取GSE46922中数据,进而筛选ITP与正常儿童之间的DEGs。最终筛选得到276个DEGs,其中上调的DEGs有191个,下调的有85个,上调明显的有GRP180、IL-23R、LCORL等,下调明显的有FOSL2、LDB2、NXF3等。研究[10-11]表明,IL-23R基因多态性rs1884444在隐性遗传模型中与ITP易感性显著相关,IL-23刺激记忆CD4+T细胞产生IFN-γ,激活巨噬细胞产生IL-1、TNF等促炎细胞因子,而且IL-23R是致病性Th17信号的关键组成部分,在细胞介导的免疫中发挥作用[12-13]。
GO和KEGG分析结果表明,ITP可能与细胞黏附及其负调控、血红蛋白复合体、细整合素信号通路、细胞外基质组织等方面密切相关。Zeng等[14]使用抗αvβ3抗体预处理MKs,抑制黏附诱导的局灶性黏附激酶和原癌基因酪氨酸-蛋白激酶Src的磷酸化,发现针对整合素的自身抗体αvβ3通过阻碍MK迁移和黏附到血管生态位,加重ITP患者的血小板减少症。此外,KEGG通路分析显示,DEGs显著富集于在受体酪氨酸激酶的抑制剂、ErbB信号通路、Rap1信号通路、轴突导向、PI3K-Akt信号通路及补体和凝血系统等。
Samira等[15]研究发现,ITP患者Notch通路被ErbB信号通路取代,从而表现出慢性期症状,而Notch信号通路与造血密切相关,涉及造血系统的进化产生造血干细胞以及T细胞等免疫细胞的发育。也有研究表明ITP的发病机制可能与PI3K-Akt信号通路介导的细胞凋亡有关,而且PI3K和Akt还是血小板中整合素αIIbβ3激活最重要的中介因子[16-17]。
通过构建PPI网络,获取的核心靶点基因有ITGB3、ARRB1、COL3A1、COL11A1、CFTR、HBB、ITGB5、KIFC1、CHEK1、MYBL2等。Nam等[18]研究发现,ITGB3在ITP中的表达明显下调,ITGB3可以促使整合素受体αIIbβ3改变构象,使纤维蛋白原结合,在血栓收缩中起主要作用,并有助于增强血栓。通过GSEA分析,我们发现通路主要富集于神经活性配体-受体相互作用、黑色素瘤、细胞外基质受体相互作用、调节肌动蛋白细胞骨架、黏着斑等方面。有研究发现神经活性配体-受体相互作用和癌症通路与ITP有着密切的联系,可能与血小板生成素受体激动剂有关[19-20]。
ICI结果表明ITP患儿M2巨噬细胞和滤泡辅助性T细胞相对含量增加,激活的树突状细胞和静息的记忆CD4+T细胞相对含量减少。研究表明巨噬细胞在ITP的免疫耐受扰动中活跃[21],尤其是在Fcγ受体激活与抑制的平衡紊乱中发挥重要作用。Chen等[22]研究发现,ITP患者的滤泡辅助性T细胞水平显著高于正常对照组,其相关的趋化因子CXCL13和凋亡血小板水平异常高,表明滤泡辅助性T细胞可能成为评估ITP疾病过程的潜在生物标志物。
综上所述,儿童ITP的发病可能是由于ITGB3、ARRB1、COL3A1、COL11A1、CFTR等基因的异常表达,通过神经活性配体-受体相互作用、整合素受体结合、细胞黏附调节等生物过程,以及介导ErbB和PI3K-Akt信号通路,从而造成免疫细胞的异常表达和血小板的减少。本研究从生物信息学角度对ITP发病机制进行探究,为临床研究提供了一定的数据支撑,但是这里使用的数据集的样本量不够多。而且此次研究是仅基于公共数据库的预测,还需要进一步的体内和体外实验来验证我们的分析,期待今后进一步研究论证。
