LncRNA MIAT靶向调节miR-532-3p对心力衰竭小鼠心肌细胞凋亡的影响
2023-06-05刘国斌余谦付国齐
刘国斌,余谦,付国齐
(1.四川大学华西医院金堂医院/金堂县第一人民医院 心血管内科,四川 成都 610400; 2.成都市第五人民医院心内科,四川 成都 611130)
心力衰竭(heart failure,HF)是心血管疾病的终末阶段,在我国患病率呈上升趋势,患者5年生存率较低,死亡率较高,HF的发病机制为心室重构,其病理基础为心肌纤维化造成心肌细胞凋亡,因此,降低心肌凋亡对于改善HF患者症状有重要意义[1-2]。LncRNA可参与调控心肌肥大、纤维化和血管新生等HF的多个病理变化,其中,长链非编码RNA心肌梗死相关转录本(lncRNA MIAT)在急性心肌梗死、冠心病等患者水平升高,研究显示,lncRNA MIAT还可诱导心脏纤维化[3-5]。lncRNAs与miRNAs相互作用,可调控mRNA参与心血管疾病的发生[6]。本研究经Starbase分析显示,LncRNA MIAT与miR-532-3p有互补结合序列,研究[7]显示,miR-532-3p在HF中表达水平降低,过表达miR-532-3p可显著降低异丙肾上腺素诱导的心肌细胞损伤与凋亡。但LncRNA MIAT是否靶向调节miR-532-3p影响HF小鼠的心肌细胞凋亡尚未见报道,本研究通过构建HF小鼠模型,探究lncRNA MIAT对心肌细胞凋亡的影响及其可能机制。
1 材料与方法
1.1 动物
健康雄性C57BL/6小鼠,12~16周,体质量为24~26 g,购于四川省中医药科学院,许可证号为SCXK(川)2018-19。
1.2 主要试剂
1.3 方法
1.3.1 造模及分组 本研究经本院动物福利伦理委员会批准,根据参考文献[8],采用注射阿霉素法建立HF小鼠模型,小鼠适应性饲养1周后,腹腔注射7 mg·kg-1阿霉素,Sham组注射等量生理盐水,每周1次,连续给药8周,心脏彩超检测小鼠心功能指标,左心室射血分数(LVEF)<60%则为造模成功。
造模后将小鼠分为Sham组、HF组、sh-NC组、sh-MIAT组、sh-MIAT+anti-NC组、sh-MIAT+anti-miR-532-3p组,另设置空白对照组(Control组),每组10只,其中sh-NC组、sh-MIAT组、sh-MIAT+anti-NC组、sh-MIAT+anti-miR-532-3p组小鼠尾静脉分别注射50 nmol·L-1相对应的质粒,每周2次,连续4周,Control组、Sham组、HF组尾静脉注射等量生理盐水。
1.3.2 小鼠心功能指标检测 末次给药24 h后腹腔注射戊巴比妥麻醉小鼠,心脏彩超检查心脏功能,记录小鼠LVEF、左心室舒张末期内径(LVDd)、左心室收缩末期内径(LVDs)、左心室短轴缩短率(FS)等心功能指标。
1.3.3 标本采集及心肌组织染色 麻醉处死小鼠,无菌条件下开胸取出心脏,一半组织生理盐水冲洗后置于-80 ℃冰箱保存,另一半组织4%多聚甲醛固定,石蜡包埋后切片。将心肌组织切片脱蜡至水,分别进行HE染色和Masson染色,光学显微镜下观察心肌组织病理学变化及纤维化。
1.3.4 心肌细胞凋亡检测 取心肌组织切片脱蜡至水,根据TUNEL细胞凋亡检测试剂盒进行TUNEL染色,显微镜下观察,阳性细胞呈棕色或褐色,计算细胞凋亡率。
1.3.5 心肌组织LncRNA MIAT、miR-532-3p检测 Trizol试剂提取总RNA,RT-qPCR检测小鼠心肌组织LncRNA MIAT、miR-532-3p水平。LncRNA MIAT上游引物序列5′-TGGAACAAGTCACGCTCGATT-3′,下游引物序列5′-GGTATCCCAAGGAATGAAGTCTGT-3′;miR-532-3p上游引物序列5′-ACACTCCCCTCCCACACCCAAGG-3′;下游引物序列5′-GTGCAGGGTCCGAGGT-3′。反应体系共25 μl,其中SYBR Green Mix 15 μl,上下游引物各0.5 μl,cDNA模板1.0 μl,ddH2O 8 μl。PCR反应程序:95 ℃ 45 s;95 ℃ 15 s,60 ℃ 30 s,38个循环。以GAPDH、U6为内参,采用2-ΔΔCT计算LncRNA MIAT、miR-532-3p的相对表达量。
1.3.6 LncRNA MIAT与miR-532-3p关系验证 H9c2细胞接种于含10%胎牛血清(FBS)的DMEM培养基中,在温度为37 ℃,体积分数为5%的CO2培养箱中培养,取对数生长期的细胞接种于6孔板中培养,待细胞贴壁生长至60%左右时,将LncRNA MIAT野生型(WT)和突变型(MUT)质粒与miR-NC、miR-532-3p minics共转染H9c2细胞48 h,检测细胞相对荧光素酶活性。
1.3.7 Western blot检测小鼠心肌组织Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达 心肌组织加入RIPA裂解液,匀浆后3 000 r·min-1离心15 min取上清,蛋白定量后取30 μg蛋白电泳并转膜,加入Caspase-3(1∶1 500)、collagenⅠ(1∶1 000)和collagen Ⅲ(1∶1 000)一抗稀释液,孵育过夜,再加入IgG二抗(1∶2 000)稀释液,室温孵育2 h,ECL溶液显影,以β-actin为内参,分析蛋白相对表达。
(3)城市危险因素复杂多样,风险评价过程中存在很大程度的随机性和不确定性,云模型的应用则恰好的表达了风险的随机性、不确定性和模糊性。构建城市灾害综合风险评价云模型,评价中将定性与定量指标综合分析,以某市为例,评价该市的灾害综合风险等级为中等风险级别,以期为城市防灾减灾规划提供理论依据。
1.4 统计学处理

2 结 果
2.1 造模结果
造模后HF组小鼠LVEF为(47.52±3.43)%,显著低于Sham组的(81.23±5.26)%及Control组的(79.64±5.35)%(P<0.05),且LVEF均<60%,提示造模成功。
2.2 各组小鼠心功能指标比较
与Sham组比较,HF组小鼠LVDd、LVDs显著升高,LVEF、FS显著降低(P<0.05);与sh-NC组比较,sh-MIAT组小鼠LVDd、LVDs显著降低,LVEF、FS显著升高(P<0.05);与sh-MIAT+anti-NC组比较,sh-MIAT+anti-miR-532-3p组小鼠LVDd、LVDs显著升高,LVEF、FS显著降低(P<0.05),Control组与Sham组、sh-NC组与HF组、sh-MIAT组与sh-MIAT+anti-NC组之间各指标差异无统计学意义(P>0.05)。见表1。
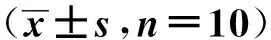
表1 各组小鼠心功能指标比较Tab 1 Comparison of cardiac function indexes of mice in each n=10)
2.3 各组小鼠心肌组织病理变化
HE染色结果显示,Control组和Sham组小鼠心肌细胞结构完整,心肌纤维紧密,细胞排列整齐,间质无水肿,而经过造模后,HF组和sh-NC组小鼠心肌细胞肿胀,细胞排列紊乱,间质明显水肿,有大量炎症细胞浸润,部分细胞核丢失(图1箭头所示),表明心肌组织损伤严重;转染质粒后,sh-MIAT组和sh-MIAT+anti-NC组较HF组细胞肿胀减轻,细胞排列较为规则,细胞核增大,轻度水肿,心肌损伤有所减轻,而同时转染sh-MIAT及miR-532-3p抑制剂后,sh-MIAT+anti-miR-532-3p组较sh-MIAT+anti-NC组病理损伤加重,细胞排列紊乱,细胞核凝缩,间质明显水肿,大量炎症细胞浸润。见图1。

箭头示大量炎症细胞浸润,部分细胞核丢失,间质明显水肿图1 小鼠心肌组织HE染色(×200)Fig 1 HE staining of mouse myocardial tissue(×200)
2.4 各组小鼠心肌组织纤维化情况
Masson染色结果显示,心肌细胞染色呈红色,胶原纤维染色呈蓝色(图2箭头所示),Control组和Sham组心肌纤维排列整齐、紧密,有少量胶原纤维,造模后HF组和sh-NC组心肌纤维排列紊乱,有大量心肌纤维显示,表明造模后发生心肌纤维化,而转染质粒后,sh-MIAT组和sh-MIAT+anti-NC组较HF组心肌纤维化减轻,胶原纤维明显减少;sh-MIAT+anti-miR-532-3p组较sh-MIAT+anti-NC组心肌纤维化加重,可见大量蓝色胶原纤维。见图2。
箭头表示胶原纤维图2 小鼠心肌组织Masson染色(×200)Fig 2 Masson staining of mouse myocardial tissue(×200)
2.5 各组小鼠心肌细胞凋亡比较
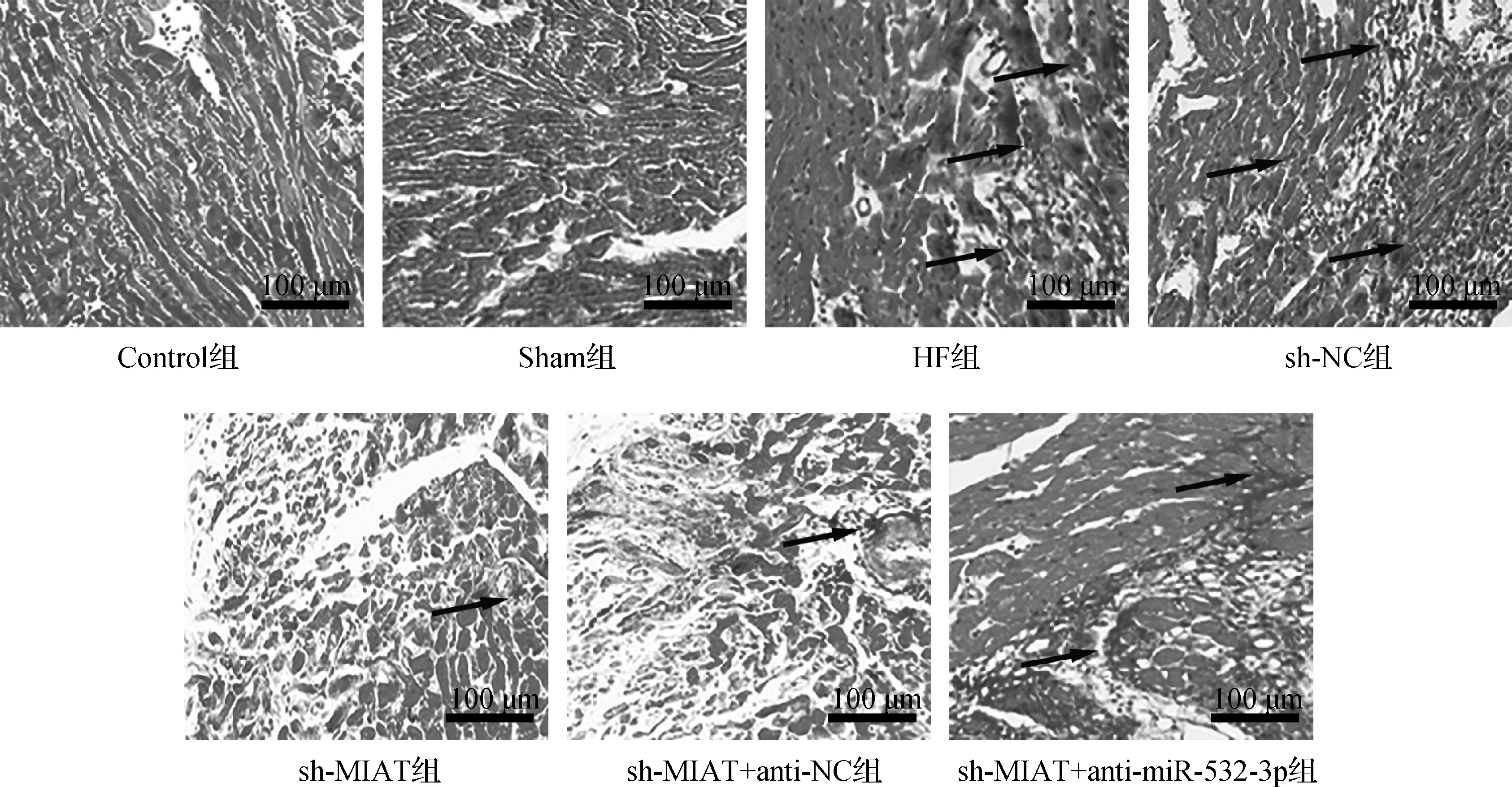
TUNEL染色结果显示,Control组和Sham组仅有少量心肌细胞凋亡,与Sham组比较,HF组小鼠心肌细胞凋亡率显著升高(P<0.05);转染质粒后,与sh-NC组比较,sh-MIAT组小鼠心肌细胞凋亡数显著降低(P<0.05),同时转染sh-MIAT+anti-miR-532-3p后,与sh-MIAT+anti-NC组比较,sh-MIAT+anti-miR-532-3p组小鼠心肌细胞胞凋亡率显著升高(P<0.05);Control组与Sham组、sh-NC组与HF组、sh-MIAT组与sh-MIAT+anti-NC组之间心肌细胞凋亡率差异无统计学意义(P>0.05)。见图3、表2。
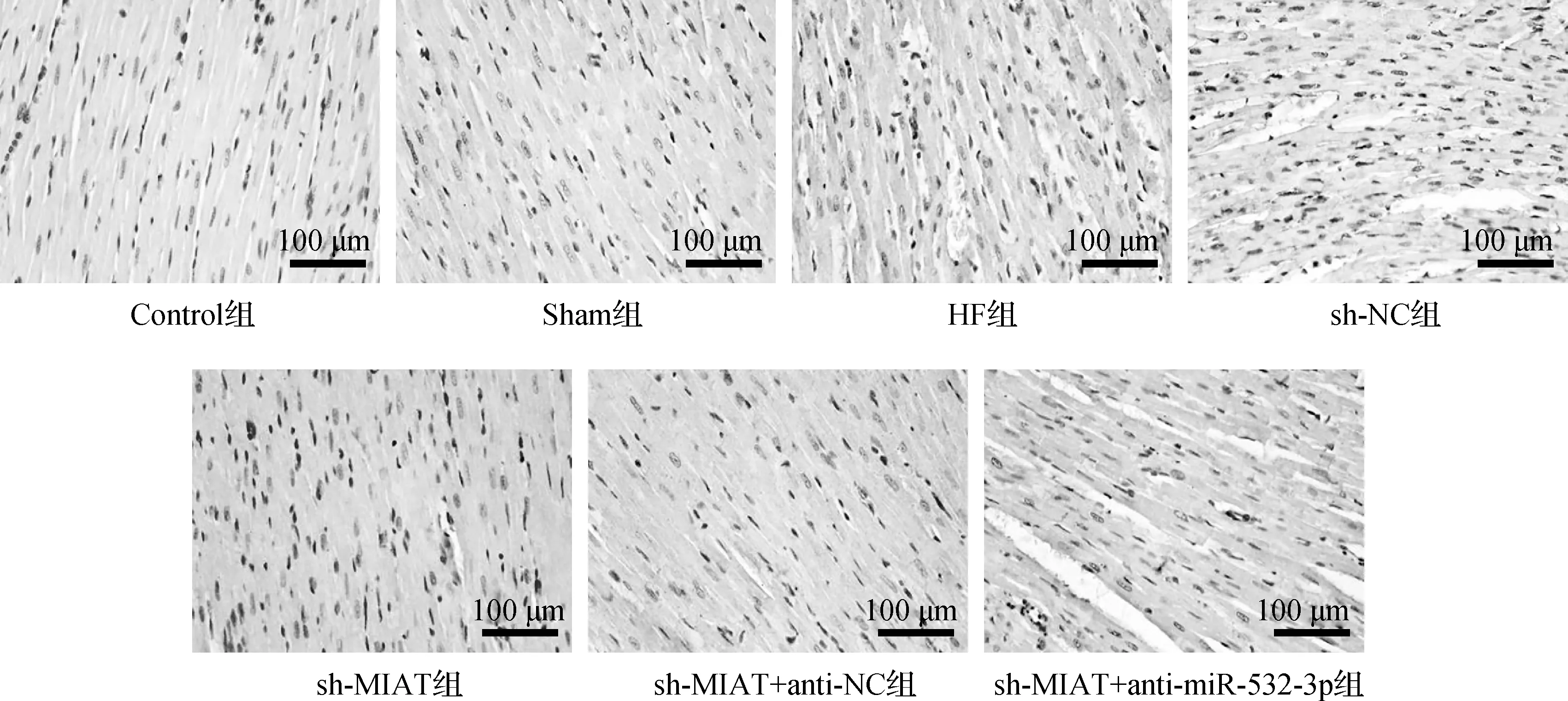
图3 TUNEL染色检测小鼠心肌细胞凋亡(×200)Fig 3 Detection of myocardial cell apoptosis in mice by TUNEL staining(×200)
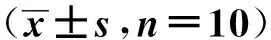
表2 各组小鼠心肌细胞凋亡率比较Tab 2 Comparison of apoptosis rates of myocardial cells in each n=10)
2.6 各组小鼠心肌组织Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达的比较
与Sham组比较,HF组小鼠心肌组织Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达水平显著升高(P<0.05);与sh-NC组比较,sh-MIAT组小鼠心肌组织Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达水平显著降低(P<0.05);与sh-MIAT+anti-NC组比较,sh-MIAT+anti-miR-532-3p组小鼠心肌组织Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达水平显著升高(P<0.05),Control组与Sham组、sh-NC组与HF组、sh-MIAT组与sh-MIAT+anti-NC组之间Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达差异无统计学意义(P>0.05)。见图4、表3。
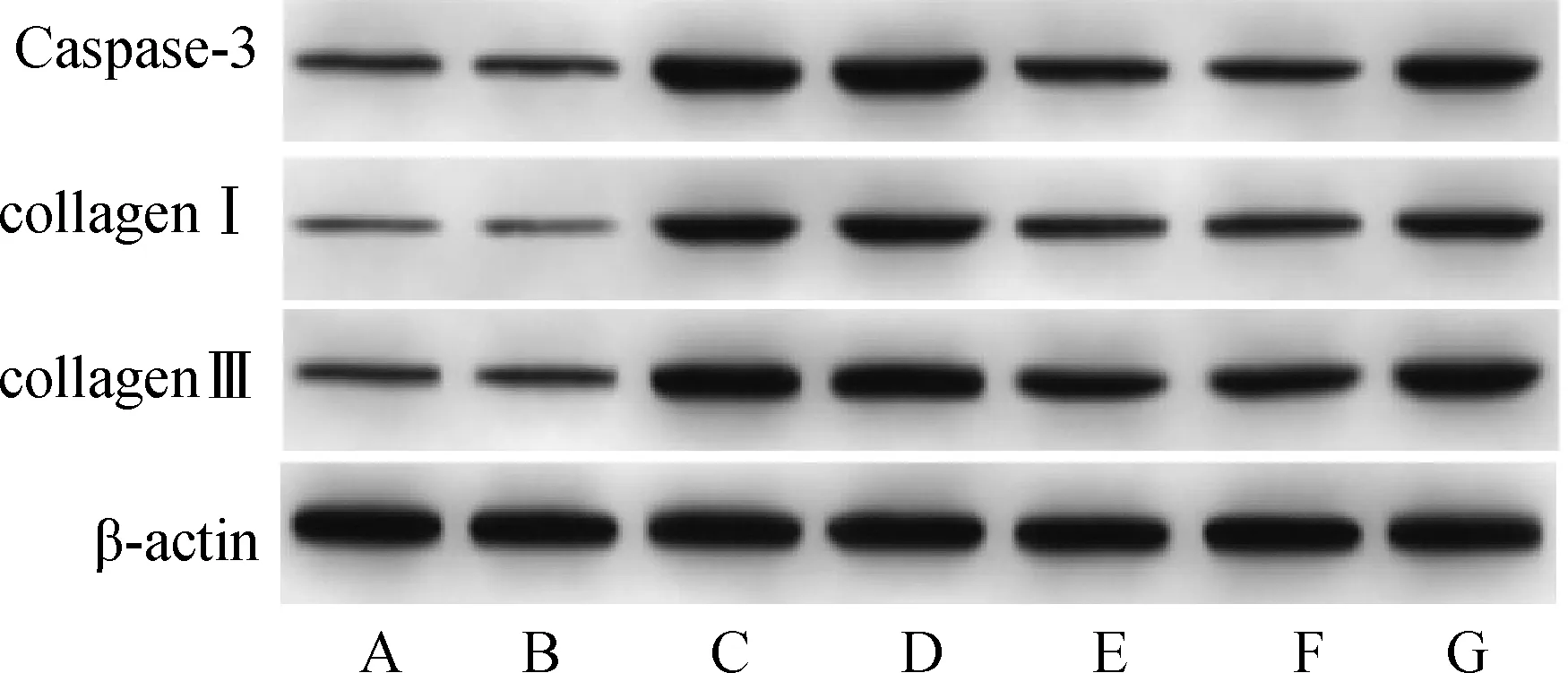
A.Control组;B.Sham组;C.HF组;D.sh-NC组;E.sh-MIAT组;F.sh-MIAT+anti-NC组;G.sh-MIAT+anti-miR-532-3p组图4 Western blot检测小鼠心肌组织Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达Fig 4 Expressions of Caspase-3, collagen Ⅰ and Ⅲ in mouse myocardial tissue detected by Western blot
表3 各组小鼠心肌组织Caspase-3、collagenⅠ和collagen Ⅲ蛋白表达的比较Tab 3 Comparison of protein expressions of Caspase-3, collagen Ⅰ and Ⅲ in myocardial tissue of mice in each n=10)
2.7 各组小鼠心肌组织LncRNA MIAT、miR-532-3p表达比较
与Sham组比较,HF组小鼠心肌组织LncRNA MIAT表达水平显著升高,miR-532-3p表达水平显著降低(P<0.05);与sh-NC组比较,sh-MIAT组小鼠心肌组织LncRNA MIAT表达水平显著降低,miR-532-3p表达水平显著升高(P<0.05);与sh-MIAT+anti-NC组比较,sh-MIAT+anti-miR-532-3p组小鼠心肌组织miR-532-3p表达水平显著降低(P<0.05),LncRNA MIAT表达水平差异无统计学意义(P>0.05);Control组与Sham组、sh-NC组与HF组、sh-MIAT组与sh-MIAT+anti-NC组之间LncRNA MIAT、miR-532-3p表达差异无统计学意义(P>0.05)。见表4。
表4 各组小鼠心肌组织LncRNA MIAT、miR-532-3p表达比较Tabl 4 Comparison of LncRNA MIAT and miR-532-3p expression in myocardial tissue of mice in each n=10)
2.8 LncRNA MIAT与miR-532-3p相互关系
Starbase分析显示LncRNA MIAT与miR-532-3p有互补结合序列,双荧光素酶报告基因检测结果显示,LncRNA MIAT野生型质粒与miR-532-3p minics共转染H9c2细胞后,荧光素酶活性显著降低(P<0.05),见图5。

a 与miR-NC比较,P<0.05A.LncRNA MIAT与miR-532-3p靶向预测;B.双荧光素酶活性检测结果图5 LncRNA MIAT与miR-532-3p靶向验证Fig 5 Targeting verification of LncRNA MIAT and miR-532-3p
3 讨 论
HF是由多种原因引起心肌结构与功能的改变,对患者造成不良影响,其死亡率高,预后较差,从分子水平研究HF发病机制,对HF的靶向治疗具有重要意义[9]。HF的病理基础为心室重构,主要表现为心肌纤维化、心肌细胞肥大[10]。本研究采用注射阿霉素法建立HF小鼠模型,造模后小鼠LVDd、LVDs显著升高,LVEF、FS显著降低;HE染色显示小鼠心肌细胞肿胀,细胞排列紊乱,间质明显水肿,有大量炎症细胞浸润,部分细胞核丢失;Masson染色显示心肌纤维排列紊乱,可见大量心肌纤维;TUNEL染色结果显示小鼠心肌细胞凋亡增多,与牛欢等[8]报道相似,提示造模成功。
LncRNA在心脏发育与HF中发挥重要调控作用,通过参与调控炎症、氧化应激、心肌肥大、心肌纤维化、凋亡等多种机制与HF的发生密切相关[11-12]。LncRNA MIAT与冠心病、HF的发生有关,研究[13]显示,LncRNA MIAT在心房颤动患者血清表达水平升高,体外与体内实验显示富含LncRNA MIAT血清来源的胞外囊泡能促进心房纤维化、炎症和氧化应激,加重心房重构,导致房颤。Zhao等[14]研究显示,在HF大鼠模型中,沉默LncRNA MIAT可能通过PI3K/Akt信号通路改善心肌纤维化,缓解HF。本研究结果显示,HF小鼠模型注射sh-MIAT后,与sh-NC组比较,sh-MIAT组小鼠LVDd、LVDs显著降低,LVEF、FS显著升高,HE染色显示细胞肿胀减轻,细胞排列较为规则,细胞核增大,轻度水肿,提示抑制LncRNA MIAT表达可显著改善HF小鼠心功能及心肌损伤。心肌纤维化是心脏重塑的主要表现,其病理改变表现为纤维蛋白增生和各种胶原的失衡,collagenⅠ和collagen Ⅲ为主要心肌胶原蛋白,其水平增加导致胶原重塑,使心室舒张与收缩功能受损[15]。本研究中HF小鼠模型注射sh-MIAT后,与sh-NC组比较,Masson染色显示sh-MIAT组小鼠心肌纤维化减轻,胶原纤维明显减少,Western blot结果显示collagenⅠ和collagen Ⅲ蛋白表达水平显著降低,提示抑制LncRNA MIAT表达可抑制HF心肌纤维化和胶原重塑。心肌细胞凋亡是HF的特征之一,Caspase-3是细胞凋亡最后的执行者,本研究还显示,给予HF小鼠sh-MIAT治疗后,心肌细胞凋亡率降低,心肌组织Caspase-3表达水平降低,提示抑制LncRNA MIAT表达可抑制HF引起的心肌细胞凋亡。
lncRNAs通过调控miRNA表达进而调控下游靶基因参与心血管疾病的发生,如LncRNA MIAT可通过调控miR-214-3p表达,促进糖尿病心肌病炎症反应和心肌纤维化[16]。本研究经Starbase分析及双荧光素酶报告基因实验证实,LncRNA MIAT可靶向负调控miR-532-3p表达。miR-532-3p在肿瘤领域研究较多,可调控细胞增殖分化等,还与心血管疾病的发生有关,研究显示,miR-532-3p可通过靶向调控粒细胞巨噬细胞集落刺激因子2(GM-CSF)受体α亚基参与动脉粥样硬化斑块形成的调节,促进动脉粥样硬化血栓形成[17]。研究显示,miR-532-3p为内皮细胞向间质转化的正向调节因子,能抑制蛋白酶丝氨酸23表达,在急性心肌梗死中减轻心脏损伤[18]。本研究结果显示,HF小鼠心肌组织LncRNA MIAT表达水平升高,miR-532-3p表达水平降低,anti-miR-532-3p与sh-MIAT共同治疗HF小鼠后,可显著逆转sh-MIAT对HF小鼠心肌损伤的保护作用,提示抑制LncRNA MIAT表达可通过靶向调控miR-532-3p表达改善HF小鼠的心功能及心肌损伤,降低心肌细胞凋亡。
综上所述,HF小鼠心肌组织LncRNA MIAT表达水平升高,抑制LncRNA MIAT表达,可通过靶向上调miR-532-3p表达改善HF引起的小鼠心肌损伤,降低心肌细胞凋亡。
