基于斑马鱼模型的纯绿青霉醇抗炎活性研究
2023-05-30李风玲张云李培海李华杨桂文刘可春
李风玲 张云 李培海 李华 杨桂文 刘可春


摘要:目的 利用斑马鱼急性炎症模型,对纯绿青霉醇(viridicatol)抗炎作用及其机制进行初步研究。方法 采用硫酸铜(CuSO4)构建斑马鱼急性炎症模型,评价纯绿青霉醇的抗炎活性。将炎症状态下的斑马鱼(3 dpf)暴露在不同浓度的纯绿青霉醇(30、60和90 μg/mL)中2 h,布洛芬(ibuprofen,IBF)作为阳性对照,观察斑马鱼神经侧线炎症细胞迁移和聚集的数量变化情况并计算荧光强度;利用RT-PCR技術测定各组斑马鱼炎症相关基因的转录水平。结果 与炎症模型组相比,布洛芬组和纯绿青霉醇组斑马鱼炎症细胞迁移和聚集的数量以及荧光强度均显著降低,同时30、60、90 μg/mL剂量下的纯绿青霉醇能显著提高pparγ的mRNA表达水平,抑制炎症相关因子iκbαa、ap-1、nf-κb、il-1b、il8、ptges和myd88的mRNA表达。结论 本研究通过建立斑马鱼急性炎症模型探究了纯绿青霉醇的抗炎作用,首次发现其机制可能是纯绿青霉醇激活pparγ表达,抑制nf-κb和ap-1转录活性,降低炎症因子表达,从而缓解炎症,为纯绿青霉醇的应用开发提供了新思路。
关键词:纯绿青霉醇;斑马鱼;抗炎;作用机制
中图分类号:R9 文献标志码:A
Anti-inflammatory activity of viridicatol based on zebrafish model
Li Feng-ling1,2,3, Zhang Yun2,3, Li Pei-hai2,3, Li Hua1, Yang Gui-wen1 and Liu Ke-chun2,3
(1 School of Life Sciences, Shandong Normal University, Jinan 250014;
2 Qilu University of Technology (Shandong Academy of Sciences)Institute of Biology, Jinan 250103;
3 Engineering Research Center og Zebrafish Models for Human Diseases and Drug Screening of Shandong , Jinan 250103))
Abstract Objective The anti-inflammatory effect and mechanism of viridicatol were studied by using zebrafish acute inflammation model. Methods The acute inflammation model of zebrafish was constructed with CuSO4 to evaluate the anti-inflammatory activity of viridicatol. zebrafish (3 dpf) in inflammatory state were exposed to different concentrations of viridicatol (30, 60, or 90 μg/mL) for two hours, with ibuprofen as a positive control. The migration and aggregation of inflammatory cells in zebrafish nerve lateral line were observed, and the fluorescence intensity was calculated. The transcription levels of inflammation related genes in zebrafish were measured by RT-PCR. Results Compared with the inflammation model group, the number and fluorescence intensity of inflammatory cell migration and aggregation in zebrafish in ibuprofen group and viridicatol group were significantly reduced. At the same time, viridicatol at the dose of 30, 60, or 90 μg/mL could significantly increase the mRNA level of pparγ and inhibit the mRNA expression of inflammation related factors, such as iκbαa、ap-1、nf-κb、il-1b、il8、ptges and myd88. Conclusion This study explored the anti-inflammatory effect of viridicatol by establishing an acute inflammation model of zebrafish. It was found for the first time that the mechanism may be viridicatol activating the expression of pparγ, inhibiting the transcription activities of nf-κb and ap-1, and reducing the expression of inflammatory factors, so as to alleviate inflammation, which provides a new idea for the application and development of viridicatol.
Key words Viridicatol; Zebrafish; Anti-inflammatory; Mechanism
炎症是对外来生物体(包括人类病原体、尘埃颗粒和病毒)的一系列全面的生理反应[1],是多细胞因子通过调节促炎和抗炎系统之间的平衡而参与炎症发生、发展的过程。但过度炎症或长时间的慢性炎症会造成免疫系统对机体自身正常组织的攻击,使机体正常功能受到损伤,甚至引发一系列的病理反应[2]。研究表明,多种疾病都与炎症反应相关,例如静脉和慢性动脉疾病、急性脑卒中[3]、心肌缺血[4]、阿尔兹海默症、癌症[5-6]和动脉高血压[7]。此外,在高度抑郁患者中也有一些炎症指标[8]。与炎症分子介质相关的疾病数量巨大且不断扩大,基于已有抗炎药物的副作用和耐药性,以及炎症类型的复杂性,研发高效低毒的新型抗炎药物符合临床需求。近年来,从海洋来源的曲霉中发现了大量的新次生代谢产物,如聚酮、生物碱、萜烯、甾体和肽等[9],并表现出抗菌、抗肿瘤、抗氧化和抗炎等多种生物活性[10]。本实验室从曲霉中分离获得已知化合物纯绿青霉醇,并初次发现其具有抗炎活性[11],但对其机制尚不明确,因此,本研究首次对纯绿青霉醇的抗炎作用机制进行初步研究,以期获得具有成药潜力的海洋抗炎先导化合物,对于探索海洋生物资源挖掘利用具有重要借鉴意义。
近年来,随着斑马鱼(Danio rerio)药物筛选模型的多样化和日益成熟,正越来越多的用于药物先导分子的发现。斑马鱼的生理结构和功能与哺乳动物高度相似,与人类基因同源性达87%。作为模式生物,具有饲养成本低、发育周期短、体积小、透明易观察、用药量低等优势,特别适用于天然产物的活性筛选评价和作用机制研究[12]。本实验采用硫酸铜诱导法建立斑马鱼炎症模型,研究纯绿青霉醇的抗炎活性及作用机制,为纯绿青霉醇的应用开发提供参考。
1 纯绿青霉醇的分子结构
纯绿青霉醇(图1)[11,13]是从海洋真菌澳大利亚曲霉(Aspergillus austroafricanus)Y32-2的次级代谢产物中分离出来的一种喹啉酮类生物碱,分子式为C15H11NO3。
2 材料与仪器
2.1 样品和试剂
纯绿青霉醇由山东省科学院生物研究所斑马鱼药物筛选实验室从海洋真菌代谢产物中分离鉴定所得。
硫酸铜购自国药集团化学试剂有限公司,质量分数为99.0%;布洛芬购自上海源叶生物科技有限公司,质量分数≥98.0%;RNA提取试剂盒购于南京诺唯赞生物科技股份有限公司;实验用水为斑马鱼胚胎培养用水(5.0 mmol/L NaCl,0.17 mmol/L KCl,0.4 mmol/L CaCl2,0.16 mmol/L MgSO4)。
2.2 仪器
SZX16 型荧光显微镜及DP2-BSW图像采集系统购自日本奥林巴斯公司;体视显微镜AXIO Zoom V16购于德国蔡司公司;实时荧光定量PCR仪购于美国罗氏公司;斑马鱼养殖饲养设备购于北京爱生科技公司。
3 方法
3.1 实验动物的获取
本实验采用由山东省科学院生物研究所斑马鱼药物筛选平台提供的成熟绿色荧光标记炎症细胞的转基因斑马鱼品系Tg(zlyz: EGFP),雌雄斑马鱼在28℃标准条件下、照明14 h/黑暗10 h分开饲养。用卵时,选取健康性成熟的斑马鱼,按照雌: 雄为1:1或1:2的数量比放入交配缸内,第二天抽板交配,10时至11时获得受精卵,将受精卵清洗并消毒,移入斑马鱼胚胎培养用水中,28℃下控光培养。
3.2 硫酸铜诱导斑马鱼炎症模型及步骤
将发育至3 dpf的斑马鱼从培养箱中取出,在显微镜下随机挑取荧光正常的转基因斑马鱼,移入6孔板中,每孔40尾,分别设置空白组、模型组、阳性药布洛芬(ibuprofen)组和纯绿青霉醇(viridicatol)组。在药物作用2 h后,向除空白组外的各组分别加入硫酸铜(CuSO4),使CuSO4作用浓度为20 ?mol/L,作用1 h后,在荧光显微镜下拍照观察斑马鱼神经侧线炎症细胞的迁移情况,统计荧光强度变化以及迁移至侧线的炎症细胞个数。
3.3 实时荧光定量PCR测定炎症相关基因的mRNA水平
将给药后的斑马鱼用PBS清洗后,放入匀浆器中匀浆,利用试剂盒FastPure Cell/Tissue Total RNA Isolation Kit V2提取RNA。将各组样本RNA逆转录得到cDNA,采用BIO-RAD CFX96实时系统测定与炎症相关基因的表达量,分3个重复进行。
实时定量PCR扩增反应条件为95℃预变性30 s 1个循环后,变性95℃ 10 s,退火60℃ 10 s,共40个循环后,最后95℃ 15 s,60℃ 60 s,95℃ 15 s 1个循环。以β-actin为内参对结果进行相对定量分析。内参基因β-actin以及目的基因的PCR引物由上海捷瑞生物工程有限公司合成、纯化,并经质量检测。相关基因引物设计见表1。
3.4 数据统计
运用软件GraphPad Prism 7.0进行统计分析,所有实验数据均以(x±s)表示。P<0.05为有显著性差异,P<0.01为有极显著性差异。
4 结果
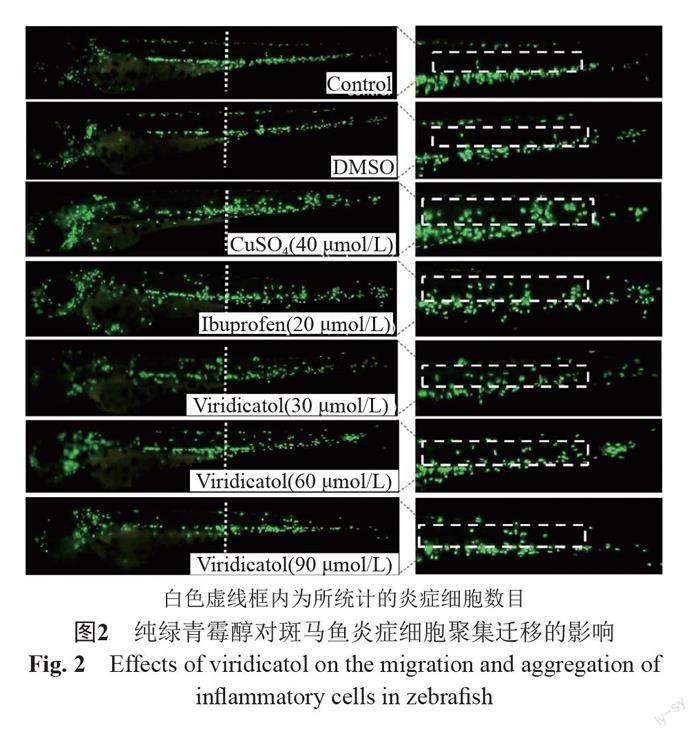
4.1 纯绿青霉醇对硫酸铜引起的炎症细胞聚集的影响
利用CuSO4损伤斑马鱼体表侧线器的末梢器官——神经丘,造成斑马鱼炎症细胞向神经丘周围(侧线部位)迁移,建立CuSO4诱导的斑马魚炎症模型,通过计算迁移到斑马鱼侧线部位的炎症细胞数目以及荧光强度变化情况来评价化合物的抗炎活性。如图2~3所示,空白组与DMSO组的炎症细胞迁移情况无显著性差异;与空白对照组相比,硫酸铜模型组斑马鱼迁移至侧线的炎症细胞数量显著增多,硫酸铜导致斑马鱼体内发生炎症反应。阳性药(布洛芬)组和30、60和90 μg/mL纯绿青霉醇组斑马鱼机体内迁移至侧线部位的炎症细胞数量,与硫酸铜模型组相比显著降低。同样,与模型组相比,阳性药组和30、60和
90 μg/mL纯绿青霉醇组斑马鱼荧光强度显著降低。
4.2 纯绿青霉醇对斑马鱼炎症相关基因表达水平的影响
实验结果表明,与空白对照组相比,硫酸铜模型组斑马鱼中nf-κb、iκbαa、ap-1和mapk8的mRNA表达升高(P<0.05),炎症因子il-1b、il8、ptges和myd88的mRNA表达显著升高(P<0.05),pparγ的mRNA表达显著下降。与模型组相比,30、60和90 μg/mL纯绿青霉醇组基因ptges、il-1b和ap-1的mRNA表达量显著降低并呈剂量依赖性,基因pparγ的mRNA表达量呈剂量依赖性显著升高。与模型组相比,30、60和90 μg/mL纯绿青霉醇组nf-κb、il8的mRNA表达显著降低,60和90 μg/mL纯绿青霉醇组iκbαa、myd88的mRNA表达显著降低,90 μg/mL纯绿青霉醇组基因mapk8的mRNA的表达量显著降低,见图4。
5 讨论
布洛芬属于非甾体抗炎药(non-steroidal anti-inflammatory drug,NSAID),是临床上第一个被用于抗炎的丙酸衍化物类制剂,具有类似于阿司匹林的药理特性,并且其对胃的不良影响较小。已有研究[14]发现:布洛芬具有对全身炎症反应综合征(systemic inflammatory response syndrome,SIRS)患儿血清炎症因子进行早期干预的功效,能够抑制白细胞介素6(interleukin-6,IL-6)和白细胞介素2(interleukin-2,IL-2)生成增多、肿瘤坏死因子α(tumor necrosis factor alpha,TNF-α)的释放等。因此,目前已有多项抗炎研究[11,15]将布洛芬作为阳性对照药,以评价目的化合物的抗炎活性。
纯绿青霉醇具有抗过敏、抗菌和抗肿瘤[16]等多种活性。Shu等[17]通过建立卵清蛋白诱导的食物过敏小鼠模型和大鼠嗜碱性粒细胞白血病(rat basophil leukemia,RBL)-2H3细胞模型发现从深海灰黄青霉中分离出的纯绿青霉醇通过抑制肥大细胞活化来减轻过敏反应并修复小鼠的肠道屏障。本实验利用斑马鱼炎症模型研究了纯绿青霉醇的抗炎活性和作用机制。采用硫酸铜造成斑马鱼炎症模型的方法,与对照组相比,造模后斑马鱼体内炎症细胞迁移或聚集数量显著增多,表明斑马鱼产生炎症反应。向斑马鱼暴露2 h的不同浓度纯绿青霉醇(30、60和90 μg/mL)溶液中加入硫酸铜作用1 h,结果显示,与炎症模型组相比,各化合物组斑马鱼体内炎症细胞迁移和聚集数量显著减少,表明化合物纯绿青霉醇具有抗炎活性。
铜作为先天性免疫系统中的一个重要成分,可以通过活性氧(reactive oxygen species,ROS)等途径诱导氧化应激调节炎症反应。硫酸铜诱导的斑马鱼急性炎症模型是目前斑马鱼实验通常采用的模拟免疫系统对于炎症的应激过程的方法之一,是无创伤性的[18]。在斑马鱼的成鱼和幼鱼中,硫酸铜可以刺激斑马鱼炎症细胞向神经隆起迅速迁移,具有抗炎活性的化合物可以抑制这一迁移,使炎症细胞返回,利用这一结果来评价化合物是否具有抗炎活性。Zhang等[19]将炎症状态斑马鱼暴露于不同浓度异烟肼(isoniazid,INH)中,观察斑马鱼炎症细胞迁移和聚集变化情况,1、2和4 mmol/L INH组斑马鱼机体中迁移至侧线部位的炎症细胞数量,与硫酸铜模型组比显著降低(P<0.05),验证了INH具有抗炎作用,为异烟肼的临床应用提供了参考。本实验采用相同的CuSO4造模方法验证了纯绿青霉醇具有抗炎活性。
白细胞介素1b(interleukin-1b,IL-1b)由活化的巨噬细胞产生,是炎症反应的重要介质[20]。白细胞介素8(interleukin-8,IL-8)可以吸引和激活中性粒细胞,导致中性粒细胞产生一系列活性分子并引起炎症反应[21]。前列腺素E2合成酶(prostaglandin E2 synthase,ptges)是一种调节前列腺素E2生成的重要酶,前列腺素E2是公认的炎症预后标志物,在炎症反应中常被视为治疗靶点[22-23]。核因子-κB(nuclear factor kappa B,NF-κB)转录因子家族是天然免疫和获得性免疫反应的关键参与者,是炎症过程的中心介质[24-25]。分布在真核细胞中的NF-κB抑制剂α(inhibitor of NF-κB alpha,iκbα)是iκb的家族成员之一。在静息状态下,NF-κB与iκb聚合,以非激活形式存在于细胞核外;当受到细胞外基质降解产物和促炎细胞因子等因素的刺激时,iκb降解,NF-κB跨过细胞膜进入细胞核,与有NF-κB结合位点的基因结合,启动转录进程[26]。激活蛋白-1(activator protein-1,AP-1)是一个统称,指的是由Jun,Fos或激活转录因子(activating transcription factor,ATF)亚基组成的二聚体转录因子,这些亚基与共同的DNA位点(AP-1结合位点)结合,AP-1在炎症反应中具有诱导细胞凋亡,增加黏附因子和炎性因子合成等功能[27-28]。过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)是核激素受体家族中的配体激活受体,是炎症反应中的关键负反馈调节器[29],可通过信号转导途径抑制炎症反应,比如PPAR γ与NF-κB形成转录抑制复合物,抑制NF-κB与DNA相互作用,进而抑制NF-κB的转录活性[30-31]。与此一致,硫酸铜暴露后斑马鱼体内pparγ的mRNA表达呈下降趋势。丝裂原活化蛋白激酶(mitogen-activated protein kinases,MAPK)信号通路由4个不同的级联反应共享,包括细胞外信号激酶(extracellular signal-related kinases,ERK1 / 2),Jun氨基末端激酶(Jun amino-terminal kinases,JNK1/2/3),p38-MAPK和ERK5[32],与细胞的生长、分化、对环境的应激适应、炎症反应等多种重要的细胞生理/病理过程有关。髓系分化因子88(myeloid differentiation factor 88,MyD88)可介导多种Toll样受体(toll-like receptors,TLRs)、白介素1受体(interleukin-1 receptor,IL-1R)、白介素18受体(interleukin-18 receptor,IL-18R),是細胞内信号转导的重要接头蛋白,MyD88信号转导通路是参与机体炎症反应的一种重要信号通路,具有调控炎性因子生成与释放的作用,抑制该信号通路的激活,可有效抑制促炎因子的分泌[33-34]。本研究给予硫酸铜诱导的炎症模型不同浓度纯绿青霉醇干预后,结果显示,斑马鱼组织中pparγ的表达显著增加,炎症介质nf-κb、ap-1、il-1b、il8、myd88、iκbαa和ptges的表达明显降低,从而达到缓解炎症的效果,而mapk8的表达量并没有降低,猜测可能是化合物纯绿青霉醇并不通过此通路来调节炎症反应。
综上所述,本实验的研究结果表明纯绿青霉醇具有一定的抗炎作用。其机制可能是纯绿青霉醇激活pparγ表达,抑制nf-κb和ap-1转录活性,降低炎症因子表达,从而缓解炎症(图5)。本实验首次在斑马鱼模型中系统的探究了纯绿青霉醇的抗炎活性和作用机制,为纯绿青霉醇的深入研究奠定基础,也为海洋来源天然产物的有效利用提供了新思路。
参 考 文 献
Arulselvan P, Fard M T, Tan W S, et al. Role of antioxidants and natural products in inflammation[J]. Oxid Med Cell Longev, 2016: 5276130.
Lu F F, Lan Z X, Xin Z Q, et al. Emerging insights into molecular mechanisms underlying pyroptosis and functions of inflammasomes in diseases[J]. J Cell Physiol, 2020, 235(4): 3207-3221.
Schmid-Sch?nbein G W, Hugli T E. A new hypothesis for microvascular inflammation in shock and multiorgan failure: self-digestion by pancreatic enzymes[J]. Microcirculation, 2005, 12(1): 71-82.
Entman M L, Michael L, Rossen R D, et al. Inflammation in the course of early myocardialis chemia[J]. The FASEB J, 1991, 11(5): 2529-2537.
Cabrales P. RRx-001 acts as a dual small molecule checkpoint inhibitor by downregulating CD47 on cancer cells and SIRP-α on monocytes/macrophages[J]. Transl Oncol, 2019, 12(4): 626-632.
Haidari F, Abiri B, Iravani M, et al. Randomized study of the effect of vitamin D and omega-3 fatty acids cosupplementation as adjuvant chemotherapy on inflammation and nutritional status in colorectal cancer patients[J]. J Diet Suppl, 2020, 17(4): 384-400.
Suematsu M, Suzuki H, Delano F A, et al. The inflammatory aspect of the mi-crocirculation in hypertension: Oxidative stress, leukocytes/endothelial inter-action, apoptosis[J]. Microcirculation, 2002, 9(4): 259-276.
Toker S, Shirom A, Shapira I, et al. The association between burnout, depression, anxiety, and inflammation biomarkers: C-reactive protein and fibrinogen in men and women[J]. J Occup Health Psychol, 2005, 10(4): 344-62.
Lee Y M, Kim M J, Li H, et al. Marine-derived Aspergillus species as a source of bioactive secondary metabolites[J]. Mar Biotechnol, 2013, 15(5): 499-519.
Wang K.W, Ding P. New bioactive metabolites from the marine-derived fungi Aspergillus[J]. Mini Rev Med Chem, 2018, 18(13): 1072-1094.
Li P H, Zhang M Q, Li H N, et al. New prenylated indole homodimeric and pteridine alkaloids from the marine-derived fungus Aspergillus austroafricanus Y32-2[J]. Mar Drugs, 2021, 19(2): 98.
Wittmann C, Reischl M, Shah A M, et al. Facilitating drug discovery: An automated high-content inflammation assay in zebrafish[J]. J Vis Exp, 2012, 16(65): e4203.
何平. 南五味子及海洋真菌肉色曲霉化學成分的研究[D]. 保定: 河北大学, 2015.
余嘉璐, 邓力. 布洛芬退热作用和对炎症因子早期干预的临床研究[J]. 实用医学杂志, 2005, 21(13): 1412-1414.
王炎焱, 赵征, 黄烽, 等. 红曲对胶原诱导性关节炎大鼠血清趋化因子的影响[J]. 中华风湿病学杂志, 2010, (2): 80-83.
Liang P, Zhang Y Y, Yang P, et al. Viridicatol and viridicatin isolated from a shark-gill-derived fungus Penicillium polonicum AP2T1 as MMP-2 and MMP-9 inhibitors in HT1080 cells by MAPKs signaling pathway and docking studies[J]. Med Chem Res, 2019, 28: 1039-1048.
Shu Z D, Liu Q M, Xing C P, et al. Viridicatol isolated from deep-sea Penicillium griseofulvum alleviates anaphylaxis and repairs the intestinal barrier in mice by suppressing mast cell activation[J]. Mar Drugs, 2020, 18(10): 517.
段秀英, 馬瑞娇, 张云, 等. 斑马鱼炎症模型及其在中药抗炎领域的应用[J]. 药物评价研究, 2021, 44(8): 1573-1580.
Zhang Y, Wang C, Jia J L, et al. Isoniazid promotes the anti-inflammatory response in zebrafish associated with regulation of the PPARγ/NF-κB/AP-1 pathway[J]. Chem Biol Interact, 2020, 25, 316: 108928.
Ghafelehbashi H, Kakhki M P, Kular L, et al. Decreased expression of IFNG-AS1, IFNG and IL-1B inflammatory genes in medicated schizophrenia and bipolar patients[J]. Scand J Immunol, 2017, 86(6): 479-485.
Zheng J, Zhang H Q, Lu X, et al. Influence of ulinastatin auxiliary general anesthesia on TNF-α IL-6 and IL-8 levels of patients with chronic obstructive pulmonary disease[J]. J North Sichuan Med Coll, 2017, 18: 47-53.
Zhang W, Zhang R X, Wang T C, et al. Selenium inhibits LPS-induced pro-inflammatory gene expression by modulating MAPK and NF-κB signaling path ways in mouse mammary epithelial cells in primary culture[J]. Inflammation, 2014, 37(2): 478-485.
Sun X, He Y, Guo Y, et al. Arsenic affects inflammatory cytokine expression in Gallus gallus brain tissues[J]. BMC Vet Res, 2017, 13(1): 157-172.
DiDonato J A, Mercurio F, Karin M. NF-κB and the link between inflammation and cancer[J]. Immunol Rev, 2012, 246(1): 379-400.
Karin M. NF-kappa B as a critical link between inflammation and cancer[J]. Cold Spring Harb Perspect Biol, 2009, 1(5): a000141.
赵泽明, 张柳. NF-κB信号通路与骨关节炎的关系研究进展[J]. 华北理工大学学报(医学版), 2021, 23(3): 232-238.
Bi C J, Cai Q P, Shan Y Y, et al. Sevoflurane induces neurotoxicity in the developing rat hippocampus by upregulating connexin 43 via the JNK/c-Jun/AP-1 pathway[J]. Biomed Pharmacother, 2018, 108:1469-1476.
Papavassiliou A G and Musti A M. The multifaceted output of c-Jun biological activity: Focus at the junction of CD8 T cell activation and exhaustion[J]. Cells, 2020, 9(11): 2470.
Zhang C, Deng J J, Liu D, et al. Nuciferine inhibits proinflammatory cytokines via the PPARs in LPS-induced RAW264.7 cells[J]. Molecules, 2018, 23(10): 2723.
Xu G M, Zan T, Li H Y, et al. Betulin inhibits lipopolysaccharide/D-galactosamine-induced acute liver injury in mice through activating PPAR-γ[J]. Biomed Pharmacother, 2018, 106: 941-945.
Chung S W, Kang B Y, Kim S H, et al. Oxidized low density lipoprotein inhibits interleukin-12 production in lipopolysaccharide-activated mouse macrophages via direct interactions between peroxisome proliferator-activated receptor gamma and nuclear factor-kappa B[J]. J Biol Chem, 2000, 275(42): 32681-32687.
Sun Y, Liu W Z, Liu T, et al. Signaling pathway of MAPK/ERK in cell proliferation, differentiation, migration, senescence and apoptosis[J]. J Recept Signal Transduct Res, 2015, 35(6): 600-604.
Liu M, Li G, Zhao G Q, et al. Boxb mediate BALB/c mice corneal inflammation through a TLR4/MyD88-dependent signaling pathway in Aspergillus fumigatus keratitis[J]. Int J Ophthalmol, 2018, 11(4): 548-552.
王燕碧, 趙采芹, 唐宏, 等. 鸡SPOP和MyD88基因分子特征及其组织表达特性分析[J]. 南方农业学报, 2021, 52(11): 3111-3120.
收稿日期:2022-03-09
基金项目:齐鲁工业大学生物及生物化学ESI培育学科开放课题(No. ESIBBC202002),济南市“高校20条”资助项目(No. 2020GXRC053, No. 2021GXRC047),齐鲁工业大学(山东省科学院)科教产融合创新试点工程项目(No. 2020KJC-ZD08)
作者简介:李风玲,女,生于1995年,在读硕士研究生,研究方向为基于斑马鱼模型的药物活性筛选与安全性评价,E-mail: 17853532669@163.com
通讯作者,杨桂文,E-mail: yanggw@sdnu.edu.cn; 刘可春,E-mail: hliukch@sdas.org.
