2016—2020年四川地区无菌体液来源标本细菌分布及其耐药率变迁分析
2023-05-30常凡黄湘宁龙姗姗喻华
常凡 黄湘宁 龙姗姗 喻华
摘要:目的 了解2016—2020年間四川地区无菌体液来源标本(血液除外)检出细菌的分布及其耐药情况变迁,为本地区医疗机构经验使用抗菌药物提供实时依据。方法 采用MOLDI-TOF质谱系统、VITEK自动化药敏系统和纸片扩散法等对2016—2020年四川省细菌耐药监测网成员单位无菌体液标本的细菌进行鉴定及药敏试验, 参照 CLSI M100第30版标准进行结果判读,使用WHONET 5.6软件进行数据分析。结果 2016—2020年四川地区无菌体液标本共分离非重复细菌35096株,其中革兰阴性菌占比64.0%,革兰阳性菌占比36.0%。分离率前5名分别为大肠埃希菌、肺炎克雷伯菌、屎肠球菌、铜绿假单胞菌和粪肠球菌。肠杆菌目细菌中,大肠埃希菌和肺炎克雷伯菌碳青霉烯类耐药率分别为1.5%和5.0%;非发酵菌中,铜绿假单胞菌对亚胺培南和美罗培南耐药率均稳定在10.0%左右,鲍曼不动杆菌对亚胺培南和美罗培南耐药率呈现逐渐下降趋势(下降百分比分别为27.5%和28.1%)。甲氧西林耐药金黄色葡萄球菌(MRSA)和甲氧西林耐药凝固酶阴性葡萄球菌(MRCNS)的检出率分别为31.4%和73.3%,未发现万古霉素、替考拉宁和利奈唑胺耐药金黄色葡萄球菌。屎肠球菌和粪肠球菌对万古霉素和利奈唑胺均保持高度活性,且耐药率呈逐年下降趋势。结论 2016—2020年间,四川地区无菌体液标本分离细菌以革兰阴性菌为主,主要耐药菌增长率得到有效控制。各地各级医疗机构应持续强化感染防控措施,推动抗菌药物管理团队建设,加强门诊抗菌药物使用限制。
关键词:无菌体液;细菌分布;耐药菌;耐药率变迁
中图分类号:R978.1 文献标志码:A
The analysis on distribution of pathogens and changes of drug resistance rates
in sterile body fluid specimens in Sichuan from 2016 to 2020
Chang Fan, Huang Xiang-ning, Long Shan-shan, and Yu Hua
(Department of Laboratory Medicine, Sichuan Provincial Peoples Hospital,
University of Electronic Science and Technology of China, Chengdu 610072)
Abstract Objective Analyze the distribution of pathogens and their drug resistance changes in sterile body fluid samples (except blood) in Sichuan Province from 2016 to 2020, and provide real-time basis for the experience in using antimicrobials in medical institutions in the province. Methods Non-repetitive pathogens isolated from clinical sterile body fluid samples from member units with qualified data from 2016 to 2020 were obtained from the Sichuan Province Antimicrobial Resistance Surveillance System.Identification and antimicrobial susceptibility analysis were carried out by Vitek2 Compact, the standard disc diffusion method and E-test detection. The results obtained were interpreted referencing to CLSI M100-30th, and analyzed with WHONET 5.6 software. Results From 2016 to 2020, a total of 35,096 non-repetitive bacteria were isolated from sterile body fluid samples in Sichuan, of which 20,359 were Gram-negative bacteria, accounting for 64.0%, and 12,143 were Gram-positive bacteria, accounting for 36.0%. The five pathogens with the highest isolation rates were Escherichia coli(32.1%), Klebsiella pneumonia(9.0%), Enterococcus faecium(6.9%), Pseudomonas aeruginosa(4.8%), and Enterococcus faecalis(4.5%). Carbapenem-resistant Escherichia coli and carbapenem-resistant Klebsiella pneumoniae were 1.5% and 5.0%, respectively. Among non-fermenting bacteria, Pseudomonas aeruginosa had stable resistance rates at 10.0% to imipenem and meropenem, and the resistance rates of Acinetobacter baumannii to imipenem and meropenem was gradually decreasing. The detection rates of MRSA and MRCNS were 31.4% and 73.3%, respectively. The resistant strains to vancomycin and linezolid in Staphylococcus aureus were not isolated.Enterococcus faecium and Enterococcus faecalis maintained high activity to vancomycin and linezolid during the five years, and their drug resistance rates showed a downward trend. Conclusion From 2016 to 2020, the pathogenic bacteria isolated from sterile body fluid samples in Sichuan were mainly Gram-negative bacteria, and the growth rates of the main drug-resistant bacteria had been effectively controlled. Medical institutions at all levels should continue to strengthen infection prevention and control measures, promote the construction of antimicrobial drug management teams, and strengthen restrictions on the use of antimicrobial drugs in outpatient clinics.
Key words Sterile body fluid; Distribution of pathogenic bacteria; Drug-resistant bacteria; Change of drug-resistant rate
随着2016—2020年时期卫生健康改革发展的进程,我国医疗卫生技术得到了飞速的提升,微创介入性检查和治疗手段广泛运用于临床实践中,无菌体腔的感染也越来越受到临床医生的重视[1-2]。2016年8月,国家卫生计生委等14部门联合制定了《遏制细菌耐药国家行动计划(2016—2020)》(国卫医发[2016]43号),明确提出以下目标:健全医疗机构抗菌药物应用和细菌耐药监测网络、医疗机构主要耐药菌增长率得到有效控制、加强抗菌药物应用和耐药控制体系建设等。为了实时监测四川地区无菌体液标本细菌的分布及常用抗菌药物耐药率变迁情况,指导本地区医疗机构合理使用抗菌药物,本文对2016—2020年四川地区无菌体液标本细菌分布及其耐药数据进行了回顾性分析,现将结果阐述如下。
1 材料与方法
1.1 细菌来源
经数据审核,2016—2020年四川省细菌耐药监测网成员单位86家医院临床无菌体液标本(包括胸水、腹水、脑脊液和胆汁等)分离菌株纳入最终分析,以保留同一患者相同细菌第一株为原则剔除重复菌株。
1.2 细菌鉴定及药敏试验
采用VITEK 2鉴定药敏系统、BD Phoenix 100全自动分析系统、DL96检测系统、Autoscan-4半自动微生物系统、TDR鉴定药敏系统、MA120微生物鉴定药敏分析系统和MOLDI-TOF质谱系统等进行细菌鉴定。参照2020年美国临床实验室标准化协会(Clinical Laboratory Standard Institute, CLSI)指南[3-4]推荐的微量肉汤稀释法的最低抑菌浓度(minimal inhibitory concentration, MIC)试验、纸片扩散法(Kirby-Bauer法,K-B)和E-test法进行药敏试验。药敏纸片来自杭州滨和、温州康泰和Oxoid等公司。
1.3 结果判读
MIC值和抑菌圈直径结果判读参照CLSI M100第30版指南标准。质控菌株药敏结果在控的情况下,研究菌株结果方可纳入数据分析。
1.4 质量控制
药敏试验每周进行一次常规质量控制程序。普通细菌药敏试验使用MH琼脂培养基,流感嗜血杆菌药敏试验使用HTM培养基,肺炎链球菌及β-溶血链球菌使用5%羊血MH琼脂培养基。质控菌株包括但不限于:金黄色葡萄球菌ATCC25923、大肠埃希菌 ATCC25922、肺炎克雷伯菌ATCC700603、铜绿假单胞菌ATCC27853、阴沟肠杆菌ATCC700323、肺炎链球菌ATCC49619和流感嗜血杆菌ATCC49247等。
1.5 统计学处理
所有数据使用WHONET 5.6软件剔除重复株后进行统计分析。
2 结果
2.1 细菌分布及标本来源
2.1.1 细菌分布
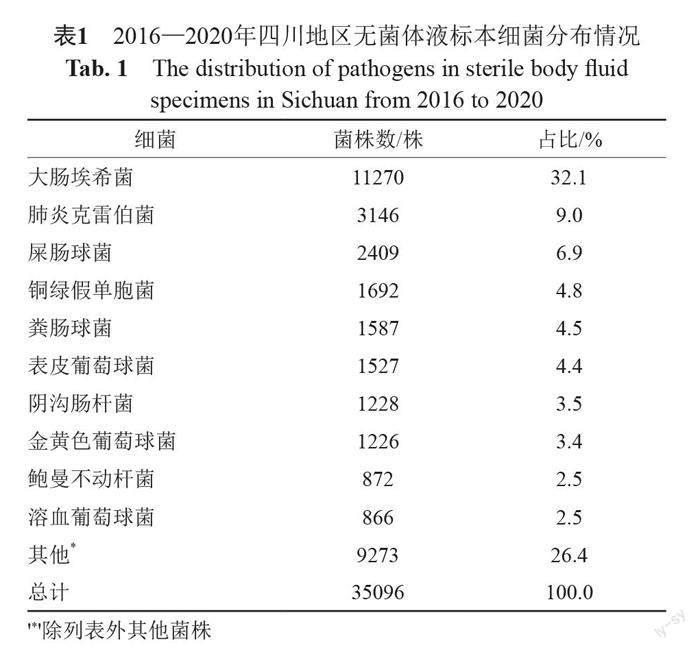
2016—2020年四川地区无菌体液标本共分离细菌共35096株, 其中革兰阴性菌22446株,占比64.0%;革兰阳性菌12650株,占比36.0%。革兰阴性菌中,分离率前3名分别为大肠埃希菌(11270,32.1%)、肺炎克雷伯菌(3146,9.0%)和铜绿假单胞菌(1692,4.8%)。革兰阳性菌中分离率第一位为屎肠球菌,共2409株,占比6.9%,其次为粪肠球菌(1587,4.5%)和表皮葡萄球菌(1527,4.4%)(表1)。2016—2020年菌株分离率前十名变化趋势(图1)。
2.1.2 标本来源
2016—2020年四川地区无菌体液35096株细菌中,胆汁标本和腹水标本分别占比37.7%和37.5%,其次为胸水标本(10.5%)和脑脊液标本(7.7%)。详见表2。
2.2 主要细菌对常见抗菌药物的敏感性及耐药率变迁
2.2.1 肠杆菌目细菌
本研究纳入分析的35096株细菌中,大肠埃希菌和肺炎克雷伯菌分列第1位和第2位。2016—2020年,大肠埃希菌对常用抗菌藥物的敏感性整体较平稳(图2),对头孢哌酮/舒巴坦、碳青霉烯类和替加环素等均保持较高活性(耐药率浮动在0~6.7%之间),其中,碳青霉烯类耐药率始终保持在2.0%之内。
肺炎克雷伯菌对常用抗菌药物的敏感性较大肠埃希菌稍高,整体耐药率保持在40%以下(图3),对亚胺培南、美罗培南和厄他培南的耐药率从2016年的1.3%、3.6%和2.8%上升至2020年的7.0%、8.1%和5.3%,对替加环素的耐药率从2016年的2.8%下降至2020年的0.9%。
大肠埃希菌和肺炎克雷伯菌5年整体耐药率见表3。
2.2.2 非发酵菌
铜绿假单胞菌位列分离率的第4位,共1692株。其对常用抗菌药物均保持较高活性,整体耐药率数值0~26.8%之间,见图4。其中,头孢他啶、氨曲南、庆大霉素耐药率波动幅度相对较大,呈逐年下降趋势;亚胺培南和美罗培南耐药率均稳定在10.0%左右。
相较铜绿假单胞菌,鲍曼不动杆菌对抗菌药物活性较低,总体耐药率波动在50%左右(图5)。近5年来,氨苄西林/舒巴坦、头孢他啶、头孢吡肟、碳青霉烯类、氨基糖苷类以及喹诺酮类抗菌药物耐药率呈逐年下降趋势,且降幅较明显。铜绿假单胞菌和鲍曼不动杆菌5年整体耐药率见表4。
2.2.3 葡萄球菌属
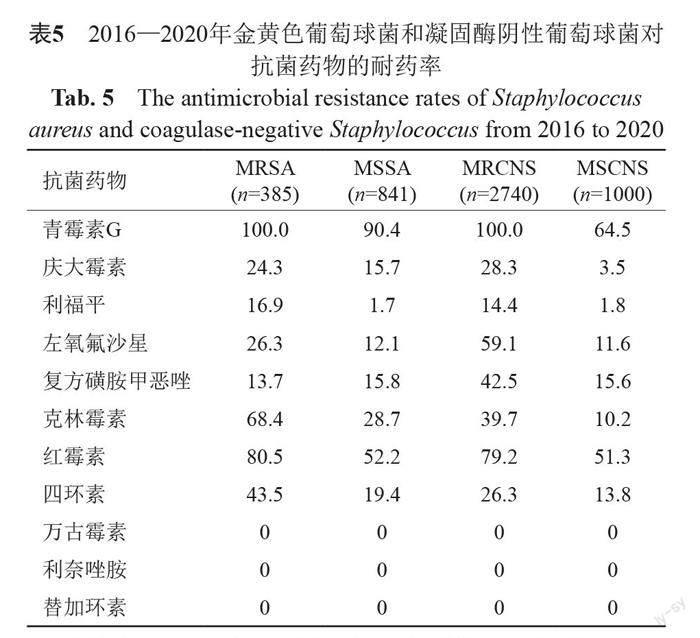
本研究纳入分析无菌体液标本中共检出金黄色葡萄球菌1226株和凝固酶阴性葡萄球菌3740株,甲氧西林耐药金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus, MRSA)和甲氧西林耐药凝固酶阴性葡萄球菌(methicillin-resistant coagulase-negative Staphylococcus,MRCNS)的检出率分别为31.4%和73.3%,MRSA和MRCNS对β-内酰胺类、大环内酯类、氨基糖苷类和喹诺酮类的耐药率显著高于甲氧西林敏感菌株。葡萄球菌属5年整体耐药率见表5。
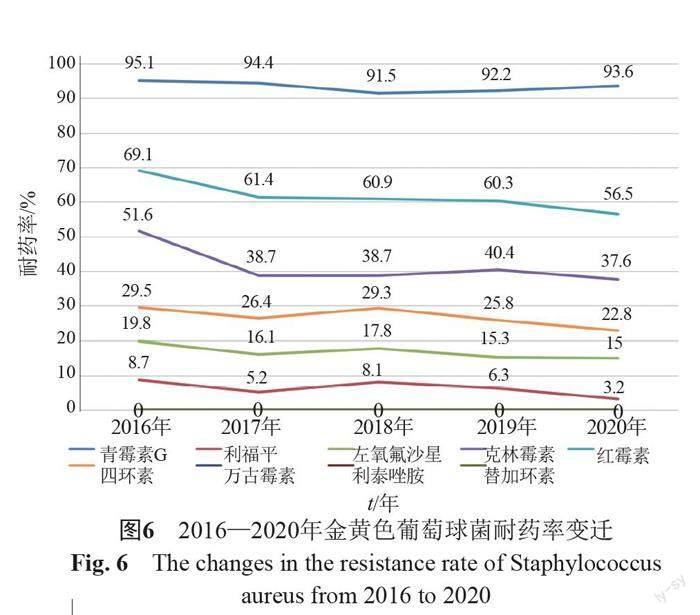
2016—2020年,金黄色葡萄球菌对万古霉素、替加环素和利奈唑胺均保持高度敏感性,其中,红霉素和克林霉素耐药率整体呈下降趋势(图6)。MRSA的检出率除2019年攀升至36.0%外,均稳定在约30.0%。
2.2.4 肠球菌属
屎肠球菌和粪肠球菌分列细菌总检出率的第3名和第5名。2016—2020年,屎肠球菌和粪肠球菌对万古霉素和利奈唑胺均保持高度活性,其中,屎肠球菌对万古霉素耐药率由2016年的2.7%降至2020年的0.2%(图7),粪肠球菌对利奈唑胺的耐药率由2016年的3.0%降至2020年的1.4%(图8)。除四环素外,屎肠球菌对抗菌药物耐药率均显著高于粪肠球菌。肠球菌属5年整体耐药率见表6。
3 讨论
本次监测结果显示,2016—2020年间四川地区86家医院无菌体液标本共分离细菌35096株, 标本来源主要为胆汁(37.7%)、腹水(37.5%)、胸水(10.5%)和脑脊液(7.7%)等。其中,革兰阴性细菌分离率64.0%,前3名分别为大肠埃希菌(32.1%)、肺炎克雷伯菌(9.0%)和铜绿假单胞菌(4.8%);革兰阳性细菌分离率36.0%,最多为屎肠球菌(6.9%),其次为粪肠球菌(4.5%)和表皮葡萄球菌(4.4%),与国内其他相关报道基本一致[5-9]。
大肠埃希菌和肺炎克雷伯菌作为2016—2020年四川地区无菌体液分离率前2名的细菌,分离数量呈现上升趋势(图1)。5年间,大肠埃希菌对抗菌药物的敏感性整体较平稳,碳青霉烯类耐药率波动在1.2%~1.9%之间。碳青霉烯类耐药肺炎克雷伯菌的检出率虽明显低于2020年全国耐药监测数据 [10],但其由2016年的2.6%增加至了2020年的7.8%。非发酵菌中,铜绿假单胞菌对亚胺培南和美罗培南耐药率稳定在10%左右;鲍曼不动杆菌对亚胺培南和美罗培南耐药率呈现逐年下降趋势,分别从2016年的74.6%和77.0%降至2020年的47.1%和48.9%。
随着碳青霉烯类耐药肠杆菌目细菌发病率不断上升和流行,其死亡率高达6.6%至20%[11],被认为是对人类和动物健康的全球威胁,已被世界卫生组织列为优先级1级关键病原体[12]。产碳青霉烯酶作为肠杆菌目细菌对碳青霉烯类耐药最主要的耐药机制[13],不同类型碳青霉烯酶需要针对性地使用碳青霉烯酶抑制剂复合制剂。因此,建议实验室按照专家共识[14]所倡议的开展碳青霉烯酶表型或基因型的检测,并进行临床报告。
碳青霉烯类耐药革兰阴性杆菌由于普遍携带对其他抗菌药物的耐药基因[15],通常表现出广泛耐药甚至全耐药的特性,使临床抗感染治疗陷入困境。目前,头孢他啶/阿维巴坦、替加环素和多黏菌素被认为是治疗碳青霉烯类耐药革兰阴性杆菌所致感染最有效的抗菌药物。实验室在应用以上抗菌药物的同时应尽可能开展其他抗菌药物的药敏试验,必要时可进行联合药敏试验,以筛选更多有效的抗感染治疗方案[16]。
本次监测分离的革兰阳性菌中以肠球菌和葡萄球菌为主。其中,MRSA和MRCNS的检出率分别为31.4%和73.3%,与2020年全国监测数据基本持平[10]。5年间,金黄色葡萄球菌始终对万古霉素、利奈唑胺、替加环素保持高度敏感性,万古霉素仍为治疗MRSA感染的首选药物。为了预防万古霉素非敏感金黄色葡萄球菌的出现,同时应对高剂量万古霉素治疗导致的肾毒性,美国FDA批准了包括利奈唑胺、达托霉素和替加环素在内的5种抗菌药物用于MRSA感染的治疗。此外,表皮葡萄球菌虽检出率与金黄色葡萄球菌相当,但其作为人体皮肤、黏膜正常定植菌群,随着侵入性操作的增多,如留置导管、气管插管和医用器具的植入等,需排除因操作不当引起的污染,界定其是否为真正的细菌。
肠球菌属中的屎肠球菌和粪肠球菌分列革兰阳性菌检出率的前两名。5年间,屎肠球菌和粪肠球菌对万古霉素和利奈唑胺均保持高度活性,且耐药率呈现下降趋势。需要警惕的是,利奈唑胺易诱发血液系统不良反应(如红细胞、血红蛋白和血小板降低)[17-18] ,用药过程中需密切監测血常规相关指标。
综上,2016—2020年,四川地区无菌体液标本分离细菌以革兰阴性菌为主,主要耐药菌增长率得到有效控制,医疗机构细菌耐药监测网络已逐渐健全,耐药控制体系建设正在加强完善中。2021年2月,国家卫生健康委办公厅关于《印发2021年国家医疗质量安全改进目标的通知》(国卫办医函[2021]76号)文件发布了10个改进目标,其中目标四为提高住院患者抗菌药物治疗前病原学送检率,明确提出了提升无菌样本的送检比例,可有效提高抗菌药物使用的科学性和规范性。各地各级医疗机构应持续强化感染防控措施,推动抗菌药物管理团队建设,加强门诊抗菌药物使用限制。
参 考 文 献
Madigubba H, Deepashree R, Monika, et al. Bacteriological profile and antimicrobial susceptibility pattern in sterile body fluid specimens from a tertiary care hospital, South India[J]. J Cur Res Sci Med, 2020, 6(2): 96-101.
Yoo I Y, Kang O K, Lee M K, et al. Comparison of 16S ribosomal RNA targeted sequencing and culture for bacterial identification in normally sterile body fluid samples: Report of a 10-Year clinical laboratory review[J]. Ann Lab Med, 2020, 40(1): 63-67.
Clinical and Laboratory Standards Institute. Methods for dilution antimicrobial susceptibility tests for bacteria that grow aerobically[S]. M07-A11. Melvin P.W: CLSI, 2018.
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial disk susceptibility tests[S]. M02-A13. Melvin P.W: CLSI, 2018.
刘爽, 肖晓光, 林琳. 2013—2015年无菌体液细菌分布及耐药性分析[J]. 检验医学与临床, 2017, 14(14): 2038-2041.
臧婉, 殷勤, 何建维, 等.2013—2019年无菌体液细菌分布及耐药性分析[J]. 国际检验医学杂志, 2020, 41(1): 65-68.
钟敏, 龙姗姗, 黄湘宁, 等. 2015—2018年四川地区无菌体液细菌的分布及耐药性分析[J]. 中国抗生素杂志, 2019, 44(10): 1181-1188.
邓懋清, 曹春芳, 黄浩南, 等. 胸腹水标中的细菌分布及耐药性分析[J]. 实验与检验医学, 2016, 34(6): 774-776.
王晶, 范丽丽, 张晓荣. 1241例无菌体液标本分离的细菌分布及耐药分析[J]. 中国药物与临床, 2021, 21(15): 2729-2732.
胡付品, 郭燕, 朱德妹, 等. 2020年CHINET中国细菌耐药性监测[J]. 中国感染与化疗杂志, 2021, 21(4): 377-387.
Livorsi D J, Chorazy M L, Schweizer M L, et al. A systematic review of the epidemiology of carbapenem-resistant Enterobacteriaceae in the United States[J]. Antimicrob Resist Infect Control, 2018, 7(55): 1-9.
Tacconelli E, Carrara E, Savoldi A, et al. Discovery, research, and development of new antibiotics: The WHO priority list of antibioticresistant bacteria and tuberculosis[J]. Lancet Infect Dis, 2018, 18: 318-327.
Han R R, Shi Q Y, Wu S, et al. Dissemination of carbapenemases (KPC, NDM, OXA-48, IMP, and VIM) among carbapenem-resistant Enterobacteriaceae isolated from adult and children patients in China[J]. Front Cell Infect Microbiol, 2020, 10: 314.
喻華, 徐雪松, 李敏, 等. 肠杆菌目细菌碳青霉烯酶的实验室检测和临床报告规范专家共识[J]. 中国感染与化疗杂志, 2020, 20(6): 671-679.
Kopotsa et al. Plasmid evolution in carbapenemase-producing Enterobacteriaceae: A review[J]. Ann N Y Acad Sci, 2019, 1457(1): 61-91.
Zhang W X, Guo Y, Yang Y, et al. Study of in vitro synergistic bactericidal activity of dual β-lactam antibiotics against KPC-2-producing Klebsiella pneumonia[J]. Microb Drug Res, 2020, 26(3): 204-210.
叶雪梅, 陈裕. 利奈唑胺血药浓度与血液毒性相关性的回顾性分析[J]. 药物流行病学杂志, 2020, 29(6): 391-394.
陈彦, 陈培莉. 利奈唑胺与传统方案治疗多重耐药菌重症感染患者的临床效果比较[J]. 临床医学研究与实践, 2020, 5(24): 21-23.
收稿日期:2022-04-06
作者简介:常凡,女,生于1991年,硕士,检验师,主要研究方向为细菌耐药流行病学及耐药机制研究,E-mail: changfanzi@outlook.com
通讯作者, E-mail: yvhua2002@163.com
