响应面法优化碱法提取藜麦淀粉及其性质研究
2023-05-30潘自强张琦潘鑫高娅邬晓勇
潘自强 张琦 潘鑫 高娅 邬晓勇
摘要:目的:研究藜麦淀粉的提取工艺并对其形貌和理化特征等进行研究。方法:选用ZL-01藜麦为原料,以氢氧化钠作为提取液,室溫下以一定范围的固液比、氢氧化钠浓度、浸泡提取时间为条件,对藜麦淀粉的提取工艺进行优化。通过扫描电镜、傅里叶变换红外光谱、X射线衍射对藜麦淀粉的形貌特征进行研究,对胶稠度、透明度、淀粉糊化曲线(RVA)等理化性质进行测定。结果:碱法提取藜麦淀粉最佳工艺为固液比1∶6、氢氧化钠浓度0.3%、提取时间10 h,此时藜麦淀粉提取量预测值为0.477 g。以最佳工艺提取藜麦淀粉,实际提取量为(0.478±0.004) g。预测值和实际值相对误差为0.02%,两者无显著性差异。验证试验说明此模型预测参数准确,表明此模型用于藜麦淀粉提取工艺优化真实可靠。形貌性质测定结果表明,藜麦淀粉颗粒呈不规则多边形,大小为0.4~1.5 μm,晶体结构为C型,结晶度为43.6%。理化性质结果表明藜麦淀粉属于中米胶长度且易加工,由于颗粒较小,初始透明度较低(16%),且随时间增加,透明度下降至11%。结论:藜麦淀粉具有糊化温度低、衰减值高、回生值高等特点,且易于加工,可为藜麦淀粉相关产品的研究提供一定的理论依据。
关键词:藜麦淀粉;淀粉提取;响应面法;RVA
中图分类号:TS235.1 文献标志码:A 文章编号:1000-9973(2023)05-0057-08
Abstract: Objective: To investigate the extraction process and the morphological and physicochemical properties of quinoa starch. Methods: The extraction process of quinoa starch is optimized with ZL-01 quinoa as the raw material, sodium hydroxide as the extraction solution, and under the conditions of a certain range of solid-liquid ratio, sodium hydroxide concentration, soaking and extraction time at room temperature. The morphological characteristics of quinoa starch are studied by scanning electron microscope, Fourier transform infrared spectroscopy and X-ray diffraction. The physical and chemical properties such as adhesive, transparency and starch pasting curve (RVA) are determined. Results: The optimal extraction process of quinoa starch by alkaline method is solid-liquid ratio of 1∶6, the sodium hydroxide concentration of 0.3%, and the extraction time of 10 h, at this time, the predicted value of starch extraction amount is 0.477 g. The actual extraction amount of quinoa starch extracted by the optimal process is (0.478±0.004) g. The relative error between the predicted value and the actual value is 0.02%, and there is no significant difference between them. The validation test shows that the predicted parameters of this model are accurate, and this model is suitable for the optimization of quinoa starch extraction process. The measurement results of morphological properties show that quinoa starch granules are irregular polygons with the size of 0.4~1.5 μm. The crystal structure is type C, and the crystallinity is 43.6%. The results of physical and chemical properties show that quinoa starch is of medium rice gum length and easy to process. Due to the small size of the granules, the initial transparency is 16% and decreases to 11% with time. Conlcusion: Quinoa starch has the characteristics of low pasting temperature, high decay value, high retrogradation value and easy processing, which can provide a theoretical basis for the research of quinoa starch-related products.
Key words: quinoa starch; starch extraction; response surface methodology; rapid visco analyzer (RVA)
藜麦(Chenopodium quinoa Willd.)属于苋科藜属一年生双子叶植物,是一种非常古老的作物。最早来源于南美洲安第斯地区[1],已经有数千年的种植历史,因为藜麦不属于禾本科,所以被称为“假谷物”。2013 年,联合国粮农组织(FAO)宣布该年为“国际藜麦年”(IYQ),并将藜麦视为 21 世纪应对粮食安全的重要谷物之一[2]。藜麦营养丰富,含有人体所需的各类营养物质,对各种非生物胁迫(如盐度、霜冻)具有高度耐受性[3],具有高蛋白、高维生素、高纤维以及低糖、低脂肪的特点,同时,藜麦不含麸质,对于乳糜泻患者来说是特别友好的食物[4],联合国粮农组织将藜麦誉为可基本满足人体营养需求的唯一单体植物,与小麦、玉米、小米、稻米等常见谷物中的蛋白质、灰分等成分相比,藜麦的含量均高于它们,其蛋白质、脂肪以及灰分的含量分别为,14.4,5.8,2.7 g/100 g[5]。
淀粉是一种植物贮藏多糖,在食品、材料、生物及医药等领域的应用越发广泛[6-9]。它是一种半晶状的生物聚合物,存在于许多植物中,包括谷物、根、茎、种子和水果。淀粉的种类不同,颗粒的形状、大小、结构和化学成分也不尽相同[10]。按照淀粉的来源,可以将淀粉分为三大类:薯类淀粉、禾谷类淀粉和其他类淀粉[11]。支链淀粉和直链淀粉共同构成淀粉颗粒,不同分布比例和排列方式决定了淀粉颗粒结构[12]。直链淀粉决定了无定形区,而支链淀粉决定了结晶区[13]。淀粉又是藜麦中的主要营养成分,是非常重要的大分子物,占总含量的58%~64%[14],藜麦淀粉的直径为1.5~3 μm,属于小颗粒淀粉,它的平均摩尔质量为1.13×106 g/mol,低于大米淀粉(0.52×108~1.19×108 g/mol),但是高于小麦淀粉(5.5×106 g/mol)[15]。实验室分离制备淀粉的方法主要有碱法和酶法[16]。酶法成本高,不适用于工业生产,所以采用碱法提取藜麦淀粉以降低成本。碱法提取即加入稀碱溶液在一定的温度下搅拌,使得淀粉脱离蛋白质,再经过离心、水洗、干燥,即可得到淀粉。Sharma等[17]用NaOH溶液离心提取大麦淀粉,淀粉得率为70.9%~83.7%。响应面法(response surface methodology,RSM)通过多元回归方程计算得出因素和结果之间的相互关联,通过对回归方程分析来寻找最佳工艺方案,常用于多个变量的交互影响。
本文以藜麦为研究对象,使用碱法提取和响应面法优化淀粉提取工艺,并对其形貌性质、理化特性进行探究,为藜麦淀粉的深入应用提供了理论支撑。
1 材料与方法
1.1 材料与试剂
藜麦(ZL-01):成都大学农业农村部杂粮加工重点实验室提供。
百里酚蓝(25 g):上海麦克林生化科技股份有限公司;氢氧化钠(500 g)、盐酸(500 mL)、无水乙醇(500 mL)、正丁醇(500 mL)、异戊醇(500 mL):成都市科龙化工试剂厂。
1.2 仪器与设备
BGZ-140电热鼓风干燥箱 上海博迅实业有限公司医疗设备厂;高速冷冻离心机 美国贝克曼库尔特有限公司;Synergy HTX酶标仪 美国BioTek公司;FE20 pH计 梅特勒-托利多仪器(上海)有限公司;CPA2250分析天平 德国赛多利斯公司。
1.3 试验方法
1.3.1 碱法制备藜麦淀粉
碱法提取参考刘新兴[18]、刘树兴等[19]的方法并改进,藜麦水洗除皂苷,烘箱40 ℃烘干后粉碎,过80目筛制得藜麦原粉。将藜麦粉按照一定固液比加入一定浓度的NaOH溶液。将混匀后的藜麦浆液置于室温下浸泡提取30 min,将浸泡提取后的藜麦浆液pH值调至7.0,以4 000 r/min离心15 min,弃上清液,去除上层黏稠液体和暗黄色物质,用蒸馏水重悬沉淀,并用300目尼龙网过滤,弃掉留在纱布上的物质,将过滤得到的白色液体用蒸馏水反复洗涤,过滤,离心,此过程重复操作3次。将沉淀物用95%的乙醇洗涤,以4 000 r/min离心15 min,弃上清液,随后置于45 ℃烘箱中烘干过100目药典筛,即可获得藜麦淀粉。
1.3.2 工艺优化试验说明
1.3.2.1 单因素试验
以影响因子固液比、氢氧化钠浓度、提取时间设计单因素试验,考察这些因素对藜麦淀粉提取量的影响。称取1 g藜麦粉在固液比(1∶3、1∶4、1∶5、1∶6、1∶7,g/mL)、氢氧化钠浓度(0.1%、0.15%、0.2%、0.25%、0.3%、0.35%)、提取时间(2,4,6,8,10 h)条件下进行单因素试验。
1.3.2.2 响应面工艺参数
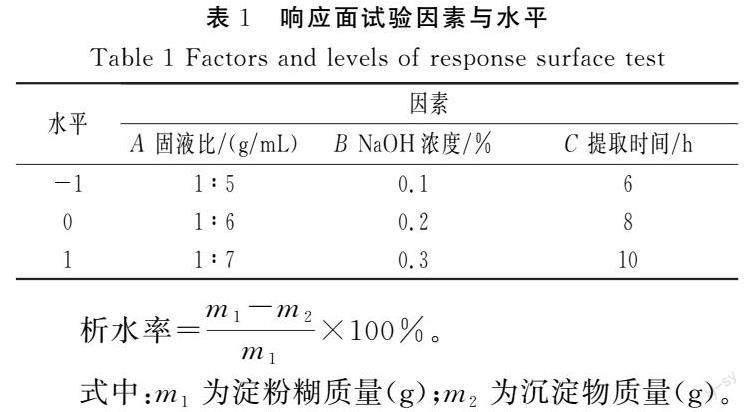
通过Central Composite Design试验设计响应面试验,以淀粉量为响应值(单位为g)设计因素水平,见表1。
1.4 淀粉的形貌性质和理化性质分析
1.4.1 扫描电镜观察藜麦淀粉颗粒形貌
分别称取藜麦淀粉置于扫描电镜下观察,并拍照保存,观察淀粉形态。
1.4.2 X射线衍射(XRD)分析晶体
将过200目筛的藜麦淀粉在室温下平衡24 h后,进行X射线衍射分析。衍射条件:铜靶电压40 kV,电流40 mA,CuKa輻射。扫描范围为5°~50°,步长为0.02°,扫描速度为5°/min[20]。
1.4.3 傅里叶红外光谱(FT-IR)
称取约1.0 mg藜麦淀粉加150 mg不含水的溴化钾粉末,快速研磨后加压制成样品薄片,放入样品架上,置于红外光谱仪上扫描,扫描波谱范围为400~4 000 cm-1,分辨率为4 cm-1,扫描次数为16。记录样品的FT-IR图谱,用Omnic软件对所得红外图谱进行分析。
1.4.4 胶稠度测定
采用国标GB/T 22294—2008的方法进行[21]。
1.4.5 淀粉透明度测定
参照刘新兴[18]的方法,将1%的淀粉糊静置0,5,10,15,30,45,60,90,120 min后测定OD620 nm,以蒸馏水作为空白,然后通过公式计算透明度。
T(%)=102-A。
式中:T为透明度(%),A为吸光度。
1.4.6 淀粉冻融稳定性测定
将3%的淀粉液于沸水浴中15 min,冷却至室温,置于-20 ℃冰箱中冷冻24 h,取出,于25 ℃室温下解冻,以上步骤再重复3次,5 000 r/min离心10 min,称取沉淀物质量。
析水率=m1-m2m1×100%。
式中:m1为淀粉糊质量(g);m2为沉淀物质量(g)。
1.4.7 淀粉糊化曲线(RVA)
测试方法参照GB/T 24853—2010《小麦、黑麦及其粉类和淀粉糊化特性测定 快速黏度仪法》测定藜麦淀粉糊化特性[22]。
1.5 结果分析
采用响应面设计软件Design-Expert 12进行响应面拟合分析,采用SPSS 26.0对数据显著性进行分析,采用Origin 2018软件作图。
2 结果与分析
2.1 单因素试验
2.1.1 固液比对淀粉提取量的影响
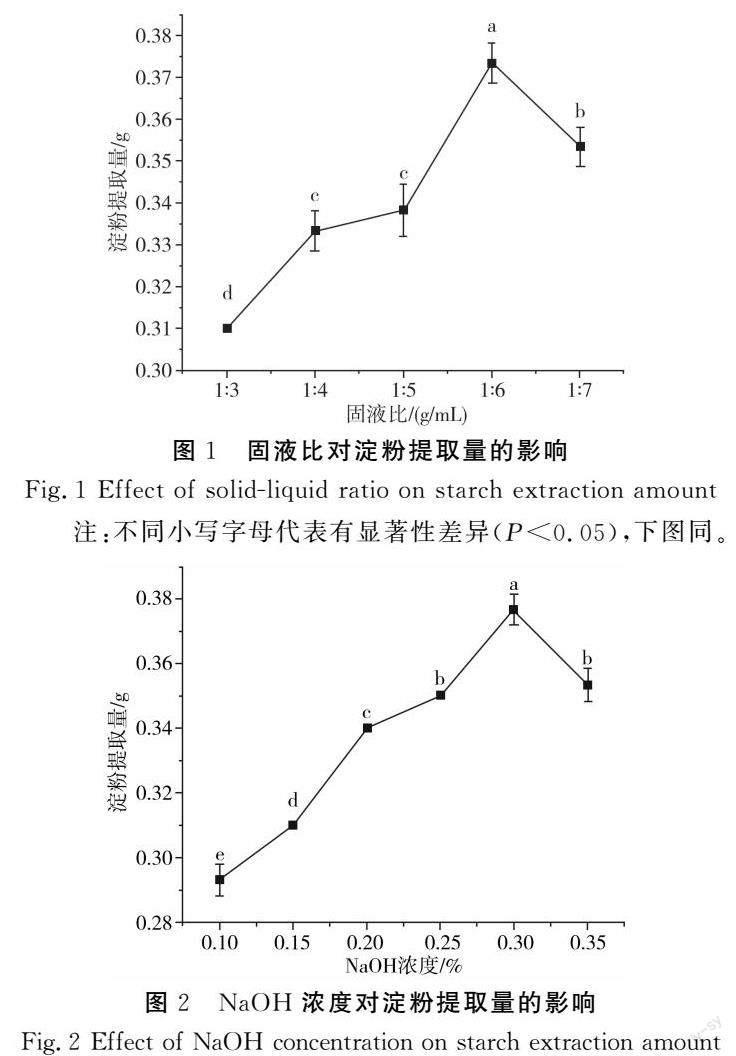
由图1可知,随着固液比的增加,淀粉提取量呈现先上升后下降的趋势。当固液比为1∶6时,藜麦淀粉提取量达到最高值。可能是因为过少的溶液不能完全浸泡,藜麦粉淀粉难以溶出,而溶液量的增加有利于藜麦淀粉更好地溶出[23]。
2.1.2 NaOH浓度对淀粉提取量的影响
由图2可知,氢氧化钠浓度从0.1%增加到0.35%的过程中淀粉量先升高后降低,在氢氧化钠浓度为0.3%时,淀粉提取量达到最高。原因可能是随着氢氧化钠浓度的增加,蛋白溶解量增大,淀粉颗粒脱离蛋白束缚从而被提取出来。氢氧化钠浓度过高会使淀粉产生糊化,糊化后淀粉颗粒难以脱离蛋白束缚,所以提取率有所降低。
2.1.3 提取时间对淀粉提取量的影响
由图3可知,随着提取时间的增加,淀粉提取量逐渐增大。这是因为随着提取时间的增加,蛋白不断溶解,使得藜麦淀粉被提取出来,所以淀粉量随时间的增加而增加。
2.2 响应面中心组合试验设计及提取结果
根据单因素试验结果,选取固液比、NaOH浓度、提取时间进行三因素三水平响应面优化试验。利用Design-Expert 12软件的中心组合(Central Composite Design)试验设计,探究藜麦淀粉提取最佳提取条件,试验方案和分析结果见表2~表4。
预测值对自变量二次多项式回归方程:Y=0.438 3+0.005 6A+0.045 5B+0.013 7C+0AB+0.002 5AC-0.002 5BC-0.014 9A2-0.020 2B2+0.001C2。
由表3可知,模型的P值<0.000 1,所以响应面模型極显著,失拟项的P值为0.324 1>0.05,失拟项不显著,说明本次试验拟合程度高,与实际值极吻合。由表4可知,模型的R2为0.958 412,预测的R2为0.784 988,与调整后的R2为0.920 983是合理一致的。精度测量信噪比的比率大于4,达到17.665 02,表明信噪比充分。可以使用此模型对藜麦淀粉提取工艺进行分析和预测。根据F值可知,各因素对淀粉提取量的影响大小为氢氧化钠浓度(B)>提取时间(C)>固液比(A)。
A、B、C 3个因素交互作用时淀粉提取量的影响见图4~图6。
响应面曲线图曲线弯曲程度直接反映两个因素之间对淀粉提取量的影响大小。曲线越陡说明影响越大。等高线形状可以反映交互影响的大小,等高线越接近圆形,交互影响越小,等高线越密集说明影响越大[24-25]。由图4可知,藜麦淀粉提取量与固液比和氢氧化钠浓度的大小密切相关,呈现先增大后减小的趋势,且陡峭程度较大。由图5可知,藜麦淀粉提取量随着固液比的增加先增加后减小,随着时间的增加呈逐渐增加的趋势。为满足实际工业生产需求,提取时间过长不符合实际生产所需,所以提取时间选择10 h。由图6可知,藜麦淀粉提取量随着氢氧化钠浓度和提取时间的增加呈先增大后减小的趋势。
由图4~图6综合分析可知A、B、C 3个因素之间相互作用都存在淀粉提取最高值,相比而言,A和B交互对淀粉提取量的影响最显著,即固液比和氢氧化钠浓度交互的影响显著。
2.3 藜麦淀粉提取条件验证试验
由软件模拟得到淀粉量最高条件为固液比1∶6.274,氢氧化钠浓度0.3%,提取时间10 h,在此条件下得到的淀粉量最高,为0.477 g。为方便实际操作,最佳条件优化为固液比1∶6,氢氧化钠浓度0.3%,提取时间10 h。为证明试验的可信度,对使用响应面得到的最佳工艺进行3次平行试验,验证试验结果见表5。
由表5可知,通过3次重复试验,藜麦淀粉提取量为(0.478±0.004) g,与理论值相对误差为0.02%,两者无显著性差异,验证试验说明此模型预测参数准确,得到的提取条件可靠。
2.4 淀粉的颗粒形貌(SEM)
通过扫描电镜观察藜麦淀粉的表面形态,见图7。由图7可知,藜麦淀粉颗粒较小,呈现多边形结构,有棱角且分布较均匀[15],颗粒大小主要在0.4 ~1.5 μm范围内。观察淀粉颗粒表面有少量凹陷空洞,说明碱法提取淀粉颗粒有少量破坏,但总体淀粉颗粒保存完好,说明碱法提取藜麦淀粉方法可行且颗粒结构保存相对完整。
2.5 淀粉晶体性质分析(XRD)
淀粉的晶型是表征淀粉分子结构的一个重要参数。目前,常用测定淀粉晶型的方法为X射线衍射法,淀粉晶型结构的差异通过X射线衍射仪会表现出不同的吸收峰。淀粉是一种晶体聚集物,按照其结构的不同,可划分为结晶、亚结晶、非晶[26],不同的淀粉晶体在X衍射曲线上会表现出不同的特征峰,所以可根据X衍射图谱分析淀粉晶体结构。晶体线度大、晶体形态完整的区域在曲线上出现尖锐衍射形态峰特征,又称为结晶区,而非结晶区在X衍射图谱上出现弥散峰特征,称为无定形峰[27]。
藜麦淀粉的XRD图谱见图8。
由图8可知,衍射角2θ在15.2°、17°、18°、23.1°处有较强的衍射峰,对应的是A型晶体;26°衍射峰对应的是B型晶体,说明藜麦淀粉同时具有A型和B型结构,所以藜麦淀粉为C型晶体,这与焦梦悦[27]和汪晓璇等[28]的研究结果一致。
支链淀粉组成了双螺旋结构的结晶区,由表6和表7可知,藜麦淀粉相对结晶度约为43.6%,与焦梦悦研究其他淀粉结晶度相比藜麦淀粉仅次于糯米淀粉,显著高于其他几种淀粉的结果相似,表明藜麦淀粉结晶区占比较高,支链淀粉较多,能使藜麦淀粉对外力和化学作用抵抗力更高[27]。
2.6 红外表征图谱分析(FT-IR)
藜麦淀粉的FT-IR图见图9,红外图谱对淀粉分子的构象和螺旋结构变化敏感,可以通过吸收峰位置来判断内部结构。3 444 cm-1处出现的峰属于-OH的伸缩振动峰,2 931 cm-1处出现的峰属于-CH2-的非对称伸缩振动吸收峰,1 638 cm-1处出现的峰属于淀粉吸收水后-OH形成的吸收峰,1 154 cm-1处出现的峰属于C-C和C-O的伸缩振动吸收峰,1 023 cm-1处出现的峰属于C-O-H的伸缩振动吸收峰[20]。经过碱法提取,吸收峰没有显著差异性改变,也没有出现新的吸收峰,说明淀粉晶体结构没有遭到破坏。
由表8可知,淀粉双螺旋结构有序度和结晶度的变化与1 047.17,1 022.10,995.10 cm-1之间的吸光度比值有关,其中1 047.17 cm-1与1 022.10 cm-1处吸光度比值越大说明淀粉结晶度越高,1 022.10 cm-1与995.10 cm-1处吸光度比值越小表示淀粉中双螺旋分子的有序度越高[29]。由表8可知,1 047.17 cm-1与1 022.10 cm-1处吸光度比值为0.835 821,与袁晓丽[15]的结果相近。1 022.10 cm-1与995.10 cm-1处吸光度比值为1.786 667,略高于杜春婷等[30]研究的1.41,说明藜麦淀粉中双螺旋结构有序度较低。
2.7 淀粉的冻融稳定性和胶稠度
淀粉的冻融稳定性是指淀粉糊反复冻融后依然维持胶体的能力。由测定结果可知,藜麦淀粉析水率为(77.17±0.06)%,表明藜麦淀粉析水率略高于刘新兴[18]的青稞淀粉,米胶长度为(58±0.3) mm,属于中米胶长度。所以,析水率较高的藜麦淀粉不适合加工速冻食品等。
2.8 淀粉的透明度
由表9可知,藜麦淀粉的透明度起始最高,随着时间的推移,透明度逐渐下降。在前10 min下降速度较快,随后变化呈平缓的趋势。可能是因为藜麦淀粉受热吸水破裂,起初淀粉分子间并未相互聚集,在淀粉液中无残存的淀粉颗粒以及回生后所形成的凝胶团,當光线穿过淀粉糊液时,无反射和散射现象产生,所以起始透明度较高,随后淀粉分子重新排列相互聚集,淀粉糊的透明度呈下降趋势。杜先锋等[31]的研究表明较大的淀粉颗粒吸水容易膨胀,糊化后形成的液体透明度较高,藜麦淀粉颗粒较小,起始透明度相较于其他淀粉[32]较低,符合扫描电镜中藜麦淀粉颗粒较小的结论。
2.9 淀粉糊化曲线(RVA)
淀粉糊化特性与产品品质密切相关[28]。可以采用快速黏度仪法(RVA)对淀粉在糊化过程中黏度的变化进行测定,并对藜麦淀粉RVA图谱不同区段黏度曲线进行分析。
由图10可知,藜麦淀粉的糊化曲线分为3个阶段:第一阶段为可逆吸水阶段,水从缝隙进入淀粉颗粒的无定形区中,淀粉颗粒略微变大[15],黏度无变化;第二阶段为淀粉糊化阶段,随着温度的升高,淀粉发生膨胀破裂,黏度增大,达到峰值黏度(peak viscosity);第三阶段时维持温度为95 ℃,胶体溶液逐渐松懈,因此黏度有所下降,达到最低黏度(trough viscosity),淀粉继续膨胀破裂变为淀粉糊达到最终黏度(final viscosity)。
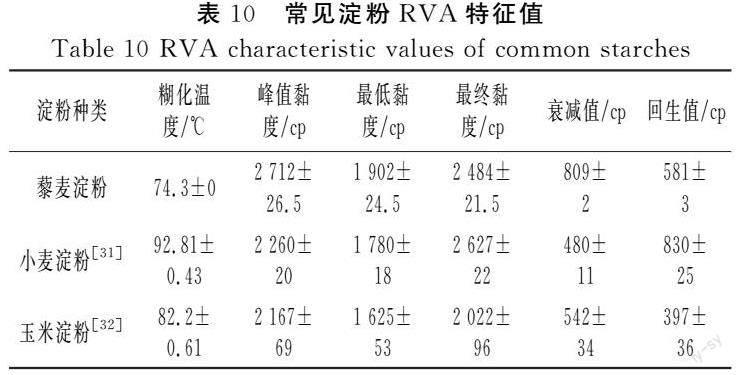
对比3种不同淀粉糊化特征值(见表10),最低温度为藜麦淀粉,其次是玉米淀粉,小麦淀粉最高。据报道,支链淀粉占比大,排列松散,结构混乱,淀粉结构破坏所需能量较少,在低温下就能糊化[28]。藜麦淀粉支链比例高,螺旋结构有序度较低,与傅里叶红外光谱和X射线图谱分析结果一致,表明藜麦淀粉容易加工,可用于营养粉和挤压膨化小零食的加工生产。回生值代表最终黏度与最低黏度的差值,回生值可以反映淀粉的老化程度和冷稳定性[28],回生值越高,冷稳定性和老化程度越差。藜麦淀粉的回生值比玉米淀粉高,但低于小麦淀粉,因此藜麦用于加工冷藏食品和冷冻食品具有一定优势。
衰减值是指峰值黏度与最低黏度的差值,衰减值与淀粉抵抗外力的能力有关。衰减值越大,稳定性越弱[33]。将藜麦淀粉、小麦淀粉和玉米淀粉的衰减值相互比较,藜麦淀粉的衰减值比小麦淀粉和玉米淀粉高,说明藜麦淀粉抗外力能力和抗剪切能力较差。
3 讨论与结论
本试验选用ZL-01藜麦,采用碱法提取,通过响应面法优化得到氢氧化钠浓度与固液比交互影响下,藜麦淀粉提取量随着体积的增加呈现上升趋势,原因是液体体积的增加可以更好地溶解蛋白,释放淀粉。氢氧化钠浓度的增加有利于蛋白溶解,但体系中氢氧化钠浓度过高会破坏淀粉颗粒,最终糊化,难以与蛋白质分离从而影响提取量。响应面法优化结果最优条件为固液比1∶6,氢氧化钠浓度0.3%,提取时间10 h,在此条件下得到的淀粉量最高,为0.477 g。验证试验证明此模型具有科学性和指导性,可用于藜麦淀粉提取条件的指导。
扫描电镜显示藜麦淀粉形态呈多边形颗粒,大小主要在0.4~1.5 μm之间。由扫描电镜图可知,碱法提取后的藜麦淀粉颗粒表面存在少量腐蚀凹陷,印证了氢氧化钠浓度过高时淀粉颗粒的表面结构相应出现破坏。通过XRD分析淀粉晶体结构呈C型,其相对结晶度为43.6%,比小麦、玉米淀粉等结晶度高,说明藜麦淀粉可以更好地抵抗化学试剂。通过FT-IR分析发现藜麦淀粉双螺旋结构有序度较低。理化性质试验表明,藜麦淀粉析水率较高且属于中米胶长度。由于其支链淀粉含量较高,糊化温度较低且具有良好的衰减值,可以用于营养粉等冲泡类产品的加工,而藜麦淀粉相对于小麦淀粉具有较低的回生值,低回生值说明作为冷冻淀粉类食品可以更好地被人体消化吸收,更加符合当今快节奏的生活。但藜麦淀粉的衰减值较高,对抗机械破坏能力不强。制作乳制饮品等剪切均质过程需要添加非淀粉类水凝胶,例如卡拉胶、阿拉伯胶、果胶等以提高其抵抗外力的能力。目前对于藜麦淀粉结构、理化性质、改性以及加工方式对淀粉性质影响的报道较多,但涉及藜麦淀粉系列加工开发的报道较缺乏,所以藜麦淀粉还有很大的研究空间。
综上,响应面法分析得出碱法提取藜麦的最佳工艺为固液比1∶6、氢氧化钠浓度0.3%、提取时间10 h,每1 g藜麦粉中淀粉提取量为0.477 g。藜麦淀粉大小为0.4~1.5 μm,晶体呈C型,相对结晶度为43.6%,RVA图谱分析结果:糊化温度74.3 ℃,回生值较低,衰减值较高。藜麦营养丰富,产量逐年增加,本文可为其进一步研究提供理论支撑。
参考文献:
[1]罗秀秀.藜麦茶主要营养功能成分分析及抗氧化评价研究[D].北京:中国农业科学院,2018.
[2]高睿,李志坚,秦培友,等.藜麦的发展与应用潜力分析[J].饲料研究,2019,42(12):77-80.
[3]XING B, TENG C, SUN M, et al. Effect of germination treatment on the structural and physicochemical properties of quinoa starch[J].Food Hydrocolloids,2021,115:106604.
[4]王天,江含秀,路丽妮,等.藜麦可溶性膳食纤维提取工艺优化及其抗氧化活性研究[J].中国食品添加剂,2022,33(2):137-146.
[5]徐霞.藜麦蛋白质及多肽对高脂血症小鼠降脂作用及其降脂产品开发研究[D].成都:成都大学,2020.
[6]WANG Z F, FANG L, ZHANG K X, et al. Application and research progress of starch in polymer materials[J].Journal of Clinical Rehabilitative Tissue Engineering Research,2008,12(19):3789-3792.
[7]CHOI J M, PARK C S, BAIK M Y, et al. Enzymatic extraction of starch from broken rice using freeze-thaw infusion with food-grade protease[J].Starch-Strke,2017,70(1-2):1-8.
[8]LI H P, HU Y H, WANG D Z, et al. Effect of hydroxamic acid polymers on reverse flotation of bauxite[J].Journal of Central South University of Technology,2004,11(3):291-294.
[9]STEFFOLANI M E, LEN A E, PREZ G T. Study of the physicochemical and functional characterization of quinoa and kaiwa starches[J].Starch-Strke,2013,65(11-12):976-983.
[10]顧晓敏,杨海龙,韩延超,等.不同品种莲藕淀粉与全粉颗粒形态及品质特性分析[J].食品工业科技,2021,42(23):95-101.
[11]代养勇.挤压膨化机无碱制备氧化淀粉及其机理研究[D].泰安:山东农业大学,2012.
[12]BULON A, COLONNA P, PLANCHOT V, et al. Starch granules: structure and biosynthesis[J].International Journal of Biological Macromolecules,1998,23(2):85-112.
[13]SAIBENE D, SEETHARAMAN K. Amylose involvement in the amylopectin clusters of potato starch granules[J].Carbohydrate Polymers,2010,82(2):376-383.
[14]CORDEIRO L, REINHARDT V, BAGGIO C H, et al. Arabinan and arabinan-rich pectic polysaccharides from quinoa (Chenopodium quinoa) seeds: structure and gastroprotective activity[J].Food Chemistry,2012,130(4):937-944.
[15]袁晓丽.藜麦淀粉的提取及改性后理化性质的分析[D].天津:天津科技大学,2017.
[16]李家豪,张善英,任赛豪,等.豇豆淀粉的提取及理化性质研究[J].食品工业科技,2021,42(20):199-206.
[17]SHARMA P, TEJINDER S.Extraction of starch from hulled and hull-less barley with papain and aqueous sodium hydroxide[J].Journal of Food Science,2014,51(12):3870-3877.
[18]刘新兴.青稞淀粉的提取、分离与分子量分布规律的研究[D].天津:天津商业大学,2014.
[19]刘树兴,杨麒,赵广蒙.正丁醇沉淀法分离小麦淀粉的研究[J].食品工业科技,2016,37(1):114-117.
[20]杜涓,寇福斌,刘芳兰,等.球磨处理对藜麦淀粉结构和特性的影响[J].中国粮油学报,2022,37(3):46-51.
[21]国家标准化管理委员会,国家质量监督检验检疫总局.粮油检验 大米胶稠度的测定:GB/T 22294—2008[S].北京:中国标准出版社,2008.
[22]国家标准化管理委员会,国家质量监督检验检疫总局.小麦、黑麦及其粉类和淀粉糊化特性测定 快速黏度仪法:GB/T 24853—2010[S].北京:中国标准出版,2010.
[23]喻林华,方晰,田春燕,等.正交试验优选薄荷总黄酮超声提取工艺研究[J].中南林业科技大学学报,2012,32(8):94-97.
[24]朱广成,杨慧,路风银,等.超声辅助酶法提取绿芦笋可溶性膳食纤维工艺条件优化[J].食品研究与开发,2020,41(20):130-136.
[25]朱凤霞,梁盈,林亲录,等.响应面法优化超声辅助酶法提取米糠水溶性膳食纤维[J].食品工业科技,2015,36(14):194-198.
[26]陈福泉,张本山,黄强,等.X射线衍射测定淀粉颗粒结晶度的研究进展[J].食品工业科技,2010,31(1):432-435.
[27]焦梦悦.藜麦淀粉特性、结构及其对Ⅰ型糖尿病小鼠的影响[D].保定:河北农业大学,2019.
[28]汪晓璇,张妤,钱澄,等.藜麥的营养及其淀粉特性的研究进展[J].粮油食品科技,2021,29(4):12-19.
[29]李涛,安凤平,宋洪波,等.热处理对紫山药淀粉理化和消化特性的影响[J].福建农林大学学报(自然科学版),2018,47(2):250-256.
[30]杜春婷,党斌,杨希娟,等.不同加工方式对藜麦淀粉结构与功能特性的影响[J].中国粮油学报,2022,37(4):54-61.
[31]杜先锋,许时婴,王璋.淀粉糊的透明度及其影响因素的研究[J].农业工程学报,2002(1):129-131.
[32]侯蕾,韩小贤,郑学玲,等.不同淀粉理化性质的比较研究[J].河南工业大学学报(自然科学版),2014,35(1):51-54.
[33]缪铭,江波,张涛.淀粉的消化性能与RVA曲线特征值的相关性研究[J].食品科学,2009(5):16-19.
