乙酰半胱氨酸雾化吸入对硅肺大鼠肺组织氧化应激的影响
2023-05-30张松洪波陈玲鲍翊君柯志成孙鸣欢
张松 洪波 陈玲 鲍翊君 柯志成 孙鸣欢


[摘要] 目的 探究乙酰半胱氨酸霧化吸入对硅肺大鼠肺组织氧化应激的影响。方法 采用随机数字表法将72只SD大鼠分为对照组、模型组、吡非尼酮组(100mg/kg)、乙酰半胱氨酸低剂量组(22.5mg/kg)、乙酰半胱氨酸中剂量组(45mg/kg)、乙酰半胱氨酸高剂量组(90mg/kg),每组各12只。除对照组外,其余各组通过非暴露式气管内滴注二氧化硅混悬液的方法建立硅肺大鼠模型,对照组大鼠气管内滴注等量生理盐水,经药物分组处理后,检测大鼠肺功能;使用苏木精-伊红(hematoxylin eosin,HE)染色法检测各组大鼠肺组织病理形态并进行Holfbauer评分;使用Masson染色检测大鼠肺组织纤维化情况;使用试剂盒检测大鼠肺组织超氧化物歧化酶(dismutase,SOD)、丙二醛(malondialdehyde,MDA)水平和血清白细胞介素(interleukin,IL)-1β、IL-6、转化生长因子-β1(transforming growth factor-β1,TGF-β1)水平;使用蛋白免疫印迹法检测大鼠肺组织Ⅰ型胶原蛋、Ⅲ型胶原蛋白表达情况。结果 与模型组相比,乙酰半胱氨酸各剂量组及吡非尼酮组大鼠肺组织病理损伤和纤维化变性均减轻,Holfbauer评分、肺组织胶原纤维占比、吸气阻力、MDA水平、IL-1β水平、IL-6水平、TGF-β1水平、Ⅰ型胶原蛋白和Ⅲ型胶原蛋白表达均降低,每分通气量、呼气峰流速值、SOD水平均升高,且乙酰半胱氨酸各组呈剂量依赖性,差异有统计学意义(P<0.05)。结论 雾化吸入乙酰半胱氨酸可抑制硅肺大鼠肺组织炎症和氧化应激,减轻其肺损伤和纤维化变性,改善肺功能。
[关键词] 雾化吸入;乙酰半胱氨酸;硅肺;氧化应激
[中图分类号] R713.4 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.02.025
[Abstract] Objective To explore the effect of aerosol inhalation of acetylcysteine on oxidative stress in lung tissue of silicosis rats. Methods A total of 72 SD rats were divided into control group, model group, pirfenidone group (100mg/kg), acetylcysteine low dose group (22.5mg/kg), acetylcysteine medium dose group (45mg/kg) and acetylcysteine high dose group (90mg/kg) using random number table method, 12 rats in each group. In addition to the control group, the other groups established the silicosis rat model by non exposed intratracheal instillation of silica suspension, and the control group received intratracheal instillation of the same amount of normal saline. After the drug treatment, the lung function of the rats was detected; hematoxylin eosin (HE) staining was used to detect the pathological morphology of the lung tissues of rats, and Holfbauer score was performed; Masson staining was used to detect the fibrosis of rat lung tissue. The levels of superoxide dismutase (SOD) and malondialdehyde (MDA) in lung tissue and interleukin (IL)-1β, IL-6, transforming growth factor-β1 (TGF-β1) level in serum were detected with the kit; Western blotting was used to detect the expression of collagen-Ⅰ and collagen-Ⅲ in rat lung tissue. Results Compared with those in the model group, the pathological injury and fibrosis of lung tissue in low, medium and high dose acetylcysteine groups and pirfenidone groups were reduced, Holfbauer score, Proportion of collagen fibers in lung tissue, inspiratory resistance, MDA level, IL-1β level, IL-6 level, TGF-β1 level, collagen-Ⅰand collagen-Ⅲ expression were significantly increased, the minute ventilation, peak expiratory flow and SOD levels were significantly decreased, acetylcysteine groups were dose-dependent (P<0.05). Conclusion Aerosol inhalation of acetylcysteine can inhibit the inflammatory reaction and oxidative stress in lung tissue of silicosis rats, reduce lung injury and fibrosis, and improve lung function.
[Key words] aerosol inhalation; acetylcysteine; silicosis; oxidative stress
硅肺是因长期处于粉尘污染环境吸入大量二氧化硅(silicon dioxide,SiO2)引起,对患者的生活质量和工作能力造成极大负面影响[1-3]。SiO2可引发严重的氧化应激,损伤肺组织和肺泡巨噬细胞,致使肺组织发生炎症损伤和纤维化变性,因而抗氧化应激是目前公认的硅肺治疗方案[4-5]。N-乙酰半胱氨酸在临床中广泛用于慢性阻塞性肺疾病、特发性肺纤维化、硅肺等各种肺疾病的治疗,可降低硅肺患者血清炎性因子水平,提高超氧化物歧化酶(superoxide dismutase,SOD)活性,增強机体的抗氧化能力,还可提高其动脉氧分压,显著改善硅肺患者肺功能及血气相关指标,提高患者生活质量[6-7]。研究发现,雾化吸入给药可直接作用于肺组织,起效更快速,并能提高肺脏药物浓度,减少用药量[8]。因而推测乙酰半胱氨酸雾化吸入可能减轻硅肺大鼠肺组织氧化应激损伤,本文通过建立硅肺大鼠模型,对此进行探索。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD大鼠购买于肇庆市瑞思元生物科技有限公司,生产许可证号:SCXK(粤)2020-0053,SPF级,体质量200~220g,6周龄左右。在宁波市中医院动物中心常规饲养,动物房中温度设为20~24℃、相对湿度设为50%~60%,自然光照,大鼠自由饮水、摄食,本研究经宁波市中医院医学伦理委员会批准(伦理审批号:AF/SQ-01/03.1)。
1.1.2 主要药品及试剂 SiO2粉尘(纯度99%,80%粒子为1~5?m)购买于美国Sigma公司;主要药品如下:吸入用乙酰半胱氨酸溶液(生产厂商:ZAMBON S.p.A.,注册证号:国药准字HJ20150548,规格:3ml:0.3g)、吡非尼酮胶囊(生产单位:北京康蒂尼药业股份有限公司,批准文号:国药准字H20133376,规格:100mg);大鼠白细胞介素(interleukin,IL)-1β酶联免疫吸附试剂盒(货号:ab100768)、大鼠IL-6 酶联免疫吸附试剂盒(货号:ab100772)、大鼠转化生长因子-β1(transforming growth factor-β,TGF-β1)酶联免疫吸附试剂盒(货号:ab119558)、兔源GAPDH一抗(货号:ab181602)、兔源抗I型胶原蛋白抗体(一抗)(货号:ab260043)、兔源抗Ⅲ型胶原蛋白抗体(一抗)(货号:ab7778)、羊抗兔二抗(货号:ab6721)均购买于美国Abcam公司。
1.1.3 主要实验仪器 无创全身体积描记系统-无创非束缚小动物肺功能测量仪购买于法国EMKA公司(型号:EMKA-WBP),切片机购买于德国Leica公司(型号:CM3050S),显微镜系统购买于日本Olympus公司(型号:BX41);酶标仪购买于美国Molecular device公司(型号:Spectra Max M2/M2e);蛋白电泳仪和转膜仪、凝胶成像仪购买于美国Bio-Rad公司(型号分别为Mini PROTEAN、ChemiDoc XRS+)等。
1.2 方法
1.2.1 模型建立及分组 SiO2粉尘经高温干燥后,加入蒸馏水混匀,配制为浓度50mg/ml的混悬液备用。采用随机数字表法,将SD大鼠分为对照组、模型组、吡非尼酮组(100mg/kg)、乙酰半胱氨酸低剂量组(22.5mg/kg)、乙酰半胱氨酸中剂量组(45mg/kg)、乙酰半胱氨酸高剂量组(90mg/kg),每组各12只。除对照组外,其余各组大鼠向气管内滴注SiO2混悬液构建硅肺模型[9],剂量为250mg/kg,造模大鼠肺脏表面粗糙、质地变硬,颜色呈灰白与粉红色相间,苏木精-伊红(hematoxylin eosin, HE)染色显示肺泡结构受损,肺组织可见结节,并有大量巨噬细胞浸润,存在广泛条索状纤维增生,即可证实硅肺模型建立成功,对照组大鼠向气管内滴注等量生理盐水。
造模后第2天,吡非尼酮组大鼠以100mg/kg的剂量灌胃吡非尼酮药液[10],同时雾化吸入与乙酰半胱氨酸各剂量组等量的生理盐水;乙酰半胱氨酸各剂量组大鼠雾化吸入乙酰半胱氨酸溶液,剂量分别为22.5mg/kg、45mg/kg、90mg/kg[8],同时以与吡非尼酮组等量的生理盐水灌胃;模型组和对照组生理盐水灌胃,同时雾化吸入与乙酰半胱氨酸各剂量组等量的生理盐水,均每天用药1次,持续用药28d。
1.3 观察指标
1.3.1 肺功能指标测定 大鼠在末次用药结束24h后,置于体描箱,设置监测条件如下:输入校准-50、传感器放大倍数500、气泵流量2L/min、采样率200Hz,采用小动物肺功能测量仪对数据进行分析,获得肺功能指标吸气阻力(resistance inspiratory,Ri)、每分通气量(minute ventilation,MV)、呼气峰流速值(peak expiratory flow,PEF)的数值。
1.3.2 标本采集及肺组织病理形态、纤维化变性检测 注射器刺入尾静脉采集血液3ml,离心(3000转/min,15min),上清液于-80℃储存。大鼠乙醚麻醉并断头处死,解剖、分离获得肺脏,肺组织匀浆,离心取上清,-80℃储存。剩余肺组织在PBS缓冲液中漂洗,多聚甲醛固定、脱水、包埋,病理切片为3μm,参照各自试剂盒说明书的指导步骤,进行HE染色和Masson染色,显微镜下观察染色情况。根据HE染色后大鼠肺组织病理损伤程度进行Holfbauer评分,评判标准如下:肺组织无病理改变评0分;25%视野中肺组织有水肿、出血、炎症浸润等病理改变评1分;50%视野中肺组织有水肿、出血、炎症浸润等病理改变评2分;75%视野中肺组织有水肿、出血、炎症浸润等病理改变评3分;全部视野中肺组织有水肿、出血、炎症浸润等病理改变评4分。Masson染色后于显微镜下采集各组大鼠肺组织图像,以Image J软件分析图像来定量其中胶原纤维所占面积和切片总面积,计算各组肺组织胶原纤维占比,肺组织胶原纤维占比=胶原纤维所占面积/切片总面积×100%。
1.3.3 超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(malondialdehyde,MDA)水平和血清IL-1β、IL-6、TGF-β1水平检测 取出已项制备的肺组织蛋白样品液和血清,参照试剂盒说明书,测定其中SOD、MDA、IL-1β、IL-6、TGF-β1含量。
1.3.4 Ⅰ型胶原蛋白、Ⅲ型胶原蛋白表达检测 将项制备的剩余蛋白样品液,二喹啉甲酸(bicinchoninic acid,BCA)法测定总蛋白浓度,煮沸变性,5%脱脂奶粉封闭膜上蛋白,兔源GAPDH一抗、兔源抗Ⅰ型胶原蛋白抗体(一抗)、兔源抗Ⅲ型胶原蛋白抗体(一抗)溶液分别孵育,4℃过夜后以TBST缓冲液清洗,加入羊抗兔二抗溶液37℃孵育,电化学发光剂显色,凝胶成像仪拍照,ImageJ软件分析蛋白灰度值,获得各目的蛋白相对表达量。
1.4 统计学方法
采用SPSS 24.0统计学软件对数据处理分析,符合正态分布的计量资料采用均数±标准差()表示,多组间比较采用单因素方差分析,两组间进一步比较行最小显著性差异法t检验,P<0.05为差异有统计学意义。
2 结果
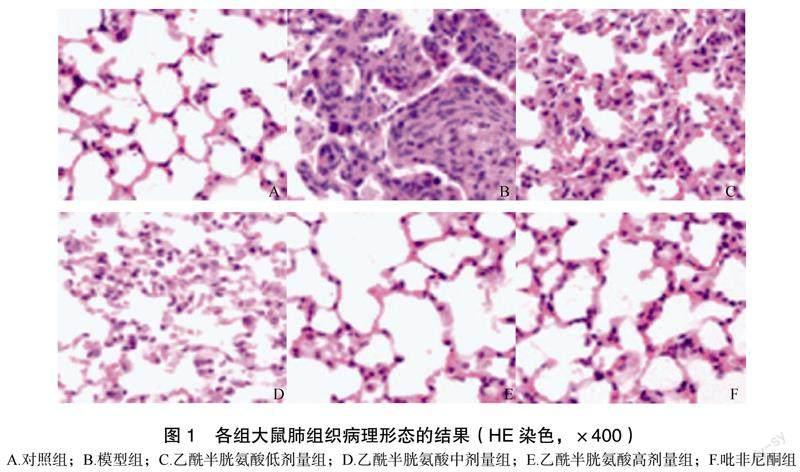
2.1 对大鼠肺组织病理形态的影响
对照组大鼠肺泡结构正常,肺组织形态完好无明显纤维增生及炎症细胞浸润,无损伤。模型组大鼠肺间质水肿充血,可见大量炎症细胞浸润,肺泡结构紊乱黏连,发生萎缩,且肺泡壁明显增厚,肺组织表现出明显病理损伤,与对照组(0±0)分相比,模型组[(3.73±0.26)分]Holfbauer评分明显升高,差异有统计学意义(t=49.697,P<0.05)。与模型组相比,乙酰半胱氨酸低剂量组[(2.82±0.30)分]、乙酰半胱氨酸中剂量组[(1.35±0.21)分]、乙酰半胱氨酸高剂量组[(0.18±0.05)分]及吡非尼酮组[(0.20±0.06)分]大鼠肺组织病理损伤均减轻,Holfbauer评分均降低,差异有统计学意义(F=854.700,P<0.05),乙酰半胱氨酸各组呈剂量依赖性,见图1。
2.2 对大鼠肺组织纤维化的影响
对照组大鼠肺组织无胶原沉积,没有发生纤维化变性。模型组大鼠肺组织胶原纤维增生明显,有大量胶原沉积,呈现明显纤维化变性,与对照组(0.11±0.02)%相比,模型组[(31.32±4.51)%]肺组织胶原纤维占比明显升高,差异有统计学意义(t=23.972,P<0.05)。与模型组相比,乙酰半胱氨酸低剂量组[(21.08±3.73)%]、乙酰半胱氨酸中剂量组[(11.84±3.12)%]、乙酰半胱氨酸高剂量组[(0.96±0.30)%]及吡非尼酮组[(0.87±0.25)%]大鼠肺组织纤维化变性均减輕,肺组织胶原纤维占比均降低,差异有统计学意义(F=273.128,P<0.05),乙酰半胱氨酸各组呈剂量依赖性,见图2。
2.3 大鼠肺功能指标比较
与对照组相比,模型组大鼠Ri升高,MV、PEF降低,差异有统计学意义(P<0.05)。与模型组相比,乙酰半胱氨酸各剂量组及吡非尼酮组大鼠的Ri均降低,MV、PEF均升高,差异有统计学意义(P<0.05),乙酰半胱氨酸各组呈剂量依赖性,见表1。
2.4 大鼠肺组织SOD和MDA水平比较
与对照组相比,模型组大鼠肺组织MDA明显升高,SOD明显降低,差异有统计学意义(P<0.05)。与模型组相比,乙酰半胱氨酸低、中、高剂量组及吡非尼酮组大鼠肺组织MDA水平均降低,SOD水平均升高,差异有统计学意义(P<0.05),乙酰半胱氨酸各组呈剂量依赖性,见表2。
2.5 大鼠血清IL-1β、IL-6、TGF-β1水平比较
与对照组相比,模型组大鼠血清IL-1β、IL-6、TGF-β1水平明显升高,差异有统计学意义(P<0.05)。与模型组相比,乙酰半胱氨酸各剂量组及吡非尼酮组大鼠血清IL-1β、IL-6、TGF-β1水平均降低,差异有统计学意义(P<0.05),乙酰半胱氨酸各组呈剂量依赖性,见表3。
2.6 大鼠肺组织Ⅰ型胶原蛋白、Ⅲ型胶原蛋白表达水平比较
与对照组相比,模型组大鼠肺组织胶原蛋白I型胶原蛋白、Ⅲ型胶原蛋白表达水平明显升高,差异有统计学意义(P<0.05)。与模型组相比,乙酰半胱氨酸低、中、高剂量组及吡非尼酮组大鼠肺组织Ⅰ型胶原蛋白、Ⅲ型胶原蛋白表达水平均降低,差异有统计学意义(P<0.05),乙酰半胱氨酸各组呈剂量依赖性,见表4、图3。
3 讨论
硅肺作为一种难以治愈的慢性进行性肺病,患者会出现肺门淋巴结肿大、肺动脉高压、右心室压力升高等并发症,因而探索硅肺的病理机制并找到安全有效的治疗方法,具有重要的临床价值[11-12]。本研究结果表明大鼠肺部进入大量SiO2粒子后,肺组织出现明显病理损伤并引发肺纤维化,损伤肺脏通换气功能,提示硅肺大鼠模型构建成功。
SiO2晶体进入肺部后,可使肺组织细胞脂质过氧化水平升高,引发氧化应激、肺细胞变性死亡、肺组织结构受损和肺部炎症,最终导致肺纤维化,因而持续性的肺部氧化应激损伤和炎症反应是硅肺的主要致病机制[13-14]。乙酰半胱氨酸对特发性肺纤维化疾病具有明显的疗效,且不良反应少[15]。另有研究证明,在肺疾病的治疗中,雾化吸入给药是一种疗效更明显且更加安全可靠的用药方式[8]。本文通过雾化吸入不同剂量的乙酰半胱氨酸处理硅肺模型大鼠,结果显示,大鼠经处理后,相比模型组,其肺组织病理损伤和纤维化变性均减轻,Holfbauer评分、肺组织胶原纤维占比、Ri、MDA水平、IL-1β水平、IL-6水平、TGF-β1水平均降低,MV、PEF、SOD水平均升高,且乙酰半胱氨酸各组呈剂量依赖性,表明乙酰半胱氨酸可降低促纤维化因子和促炎因子合成分泌,抑制肺组织炎症反应和氧化应激,减轻硅肺大鼠肺组织损伤,缓解肺纤维化,改善肺功能,且随乙酰半胱氨酸剂量升高而作用增强。
成纤维细胞大量增殖及细胞外基质沉积是硅肺患者肺纤维化变性的主要病理基础,在成纤维细胞增殖分化过程中,Ⅰ型胶原蛋白、Ⅲ型胶原蛋白大量合成,沉积在肺组织中,引发肺部纤维化[3,16]。本研究结果显示,硅肺模型大鼠肺组织Ⅰ型胶原蛋白、Ⅲ型胶原蛋白表达明显升高;雾化吸入不同剂量的乙酰半胱氨酸处理后,肺组织Ⅰ型胶原蛋白、Ⅲ型胶原蛋白表达降低,且乙酰半胱氨酸各组呈剂量依赖性,表明Ⅰ型胶原蛋白、Ⅲ型胶原蛋白参与介导硅肺病理过程,而乙酰半胱氨酸可下调两者表达,改善肺纤维化症状,且随乙酰半胱氨酸剂量升高而作用增强。
综上所述,乙酰半胱氨酸可下调促炎因子和促纤维化因子表达,抑制氧化应激和炎症反应发生发展,降低胶原蛋白合成、沉积,减轻肺组织病理损伤及纤维化变性,改善肺功能,为硅肺的临床治疗提供了新的方案。但本文只做了初步探索,还未对其分子机制进行全面研究,后续将进一步研究。
[参考文献]
[1] PERUZZI C P, BRUCKER N, BUBOLS G, et al. Occupational exposure to crystalline silica and peripheral biomarkers: an update[J]. J Appl Toxicol, 2022, 42(1): 87–102.
[2] WALTERS E H, SHUKLA S D. Silicosis: pathogenesis and utility of animal models of disease[J]. Allergy, 2021, 76(10): 3241–3242.
[3] ALTUNDA? HATMAN E, ACAR KARAG?L D, et al. Premature deaths due to silicosis in Turkey, 2006-2017: a twelve-year longitudinal study[J]. Balkan Med J, 2021, 38(6): 374–381.
[4] ADAMCAKOVA J, MOKRA D. Herbal compounds in the treatment of pulmonary silicosis[J]. Physiol Res, 2021, 70(S3): S275–S287.
[5] ZHAO Y, XU G, LI H, et al. Genome-wide mRNA profiling identifies the NRF2-regulated lymphocyte oxidative stress status in patients with silicosis[J]. J Occup Med Toxicol, 2021, 16(1): 40–54.
[6] 文建平, 林国进, 高学军, 等. 汉防己甲素联合大剂量乙酰半胱氨酸治疗对矽肺患者血清sIL-2R、IL-6、TNF-α水平的影响[J]. 福建医药杂志, 2022, 44(1): 27–29.
[7] 欧联松. N-乙酰半胱氨酸治疗尘肺对患者肺功能及血气指标的影响[J]. 实用临床医学, 2019, 20(11): 12–13, 62.
[8] 马燕, 陈依婷, 何文秀, 等. 祛痰药物在小鼠肺组织分布及对肺泡表面活性物质的影响[J]. 中国药物经济学, 2020, 15(1): 34–38.
[9] 肖漪, 彭子荷, 孙悦, 等. 依达拉奉对矽肺大鼠的干预治疗作用研究[J]. 中国现代医学杂志, 2018, 28(15): 13–17.
[10] 邵琳琳, 杜春玲, 陈艳芹, 等. 橙皮素对矽尘暴露大鼠肺组织中细胞因子的影响[J]. 环境与健康杂志, 2019, 36(9): 773–777, 847.
[11] ZHOU M, XUE C, FAN Y, et al. Plasma metabolic profiling in patients with silicosis and asbestosis[J]. J Occup Environ Med, 2021, 63(9): 787–793.
[12] PFISTERER B R, ASHLEY A L, DONNELL R L, et al. Pulmonary silicosis in 2 rock hyraxes, and literature review[J]. J Vet Diagn Invest, 2022, 34(1): 98–101.
[13] ZHOU M, XUE C, FAN Y, et al. Plasma metabolic profiling in patients with silicosis and asbestosis[J]. J Occup Environ Med, 2021, 63(9): 787–793.
[14] HE R, YUAN X, LV X, et al. Caveolin-1 negatively regulates inflammation and fibrosis in silicosis[J]. J Cell Mol Med, 2022, 26(1): 99–107.
[15] 陳冠逹, 尹姣. 吡非尼酮联合乙酰半胱氨酸对特发性肺间质纤维化的治疗效果[J]. 中国药物经济学, 2022, 17(4): 67–70.
[16] ANGOURANI K J, MAZHARI S, FARIVAR S, et al. Fibroblast-myofibroblast crosstalk after exposure to mesenchymal stem cells secretome[J]. Gastroenterol Hepatol Bed Bench, 2019, 11(Suppl 1):S73–S79.
(收稿日期:2022–06–23)
(修回日期:2022–12–08)
