免疫原性细胞死亡在结直肠癌治疗中的研究进展
2023-05-30徐鹏福杨磊磊张锐利
徐鹏福 杨磊磊 张锐利
[摘要] 免疫原性细胞死亡(immunogenic cell death,ICD)在结直肠癌的治疗中有重要作用。发生ICD时,细胞分泌多种损伤相关分子模式(damage-associated molecular patterns,DAMPs),DAMPs通过各种模式识别受体吸引自然杀伤细胞、巨噬细胞、树突状细胞等先天免疫细胞,并促进其成熟、活化,以杀死肿瘤细胞,同时产生记忆效果。目前通过诱导ICD治疗结直肠癌主要是药物方式、生物方式及物理方式。本文就诱导ICD通过免疫途径改变致癌信号的相关研究和临床发现进行综述,以帮助未来设计更有效和更精确的策略来治疗结直肠癌。
[关键词] 免疫原性细胞死亡;结直肠癌;肿瘤免疫;光动力疗法
[中图分类号] R735 [文獻标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.02.031
随着时代的发展,筛查和治疗结直肠癌(colorectal cancer,CRC)的技术不断进步,但结直肠癌作为全球第三大恶性肿瘤[1],其发病率、患病率和死亡率仍然很高。在我国,结直肠癌的发病率和死亡率逐年上升,甚至出现年轻化、低龄化趋势[2]。就诊断为Ⅳ期结直肠癌的患者而言,由于目前尚无有效的治疗方案,大多患者只能接受化疗(如5-氟尿嘧啶、奥沙利铂或伊立替康)和(或)靶向治疗(如贝伐单抗、靶向血管内皮生长因子,或西妥昔单抗、靶向表皮生长因子受体),5年生存率低于10%[3]。结直肠癌的发生发展过程十分复杂,包括肿瘤微环境改变(tumor microenvironment,TME)、细胞死亡、慢性炎症和氧化应激等。现有研究证实,免疫系统在肿瘤的发生、发展和治疗中起到关键作用,如肿瘤微环境的改变会导致免疫抑制和免疫监测丧失促进了肿瘤发展,免疫治疗必然成为一种有前景的治疗癌症、抑制癌症复发和转移的方法[4]。免疫原性细胞死亡(immunogenic cell death ,ICD)作为免疫治疗的重要机制,可由多种化学药剂、辐射和靶向药物诱导,释放出多种损伤相关分子模式(damage-associated molecular patterns, DAMPs),能够破坏免疫抑制性TME并重新建立机体肿瘤细胞免疫监测[5],以此通过全身抗肿瘤免疫起到抗肿瘤作用。本文对有关通过诱导ICD治疗结直肠癌的相关研究和发现进行简单总结,以帮助未来设计更有效和更精确的策略来预防和治疗结直肠癌。
1 免疫原性细胞死亡
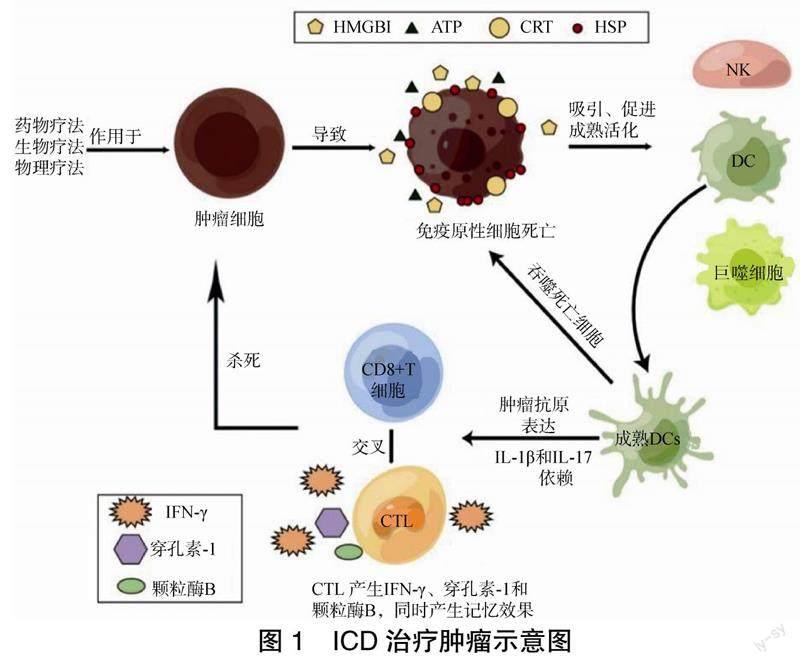
2005年,Casares等[6]率先用ICD来描述因阿霉素让小鼠的结直肠癌细胞CT26具有的抑制接种外源CT26活细胞生长的免疫原性,并且具有长期的免疫功能。与自噬、凋亡及焦亡等癌细胞的程序性死亡方式不同,免疫原性细胞死亡是指是机体在发生细胞凋亡时,非免疫原性的细胞能够转化免疫原性细胞,释放DAMPs,最终增强肿瘤免疫效应的一种细胞死亡形式[7]。ICD能够起到肿瘤疫苗的作用,不仅可以杀死由ICD诱导剂诱导产生的细胞,还可以杀死垂死肿瘤细胞,从而引起针对活肿瘤细胞和残留肿瘤组织的肿瘤特异性免疫反应。通过这种方式,患者可以从细胞毒性化疗和物理诱导引发的治疗反应中获得长期的临床益处。ICD发生时,垂死的肿瘤细胞会出现表面高表达DAMPs,包括钙网蛋白(calreticulin,CRT)、热休克蛋白(Hot shock protein,HSP)、三磷酸腺苷(adenosine triphosphate,ATP)、高迁移率族蛋白B1(high mobility group box 1,HMGB1)信号分子,以及TypeⅠ干扰素(interferon-1,IFN-1)等。DAMPs通过各种模式识别受体,吸引自然杀伤细胞、巨噬细胞、树突状细胞等先天免疫细胞,并促进其成熟、活化,完成包括死亡细胞的清除,最佳抗原的摄取、加工和呈递,以及细胞因子产生等多个步骤,最终在几天内杀死肿瘤细胞[5]。此外,成熟的树突状细胞以白细胞介素(interleukin,IL)-1β和IL-17依赖的方式触发CD8+细胞与细胞毒性T淋巴细胞(cytotoxic T lymphocytes,CTL)的交叉,然后CTL通过产生IFN-γ、穿孔素-1和颗粒酶B引发直接的细胞毒性反应以杀死肿瘤细胞,同时产生记忆效果[5],见图1。
2 诱导免疫原性细胞死亡治疗结直肠癌
2.1 药物诱导ICD
2.1.1 化疗药物 ICD独特的肿瘤细胞杀伤功能被证实后,近来一直是研究热点。一些经典的ICD诱导剂,如蒽环类药物、奥沙利铂、博来霉素和环磷酰胺等,已被广泛证实能够通过诱导ICD成功抑制肿瘤生长。5-氟尿嘧啶(5-fluorouracil,5-FU)是一种嘧啶类似物,可抑制核苷酸合成所需的胸苷酸合酶,是结直肠癌患者的常用化疗药物之一。铂类药物奥沙利铂或拓扑异构酶Ⅰ抑制剂伊立替康通常与5-FU一起用于FOLFOX(氟尿嘧啶、亚叶酸和奥沙利铂)或FOLFIRI(氟尿嘧啶、亚叶酸和伊立替康)方案,联合使用以提高疗效[8]。5-FU或伊立替康诱导的ICD在小鼠结肠癌细胞系CT-26和人类癌细胞中的标志是CRT暴露和MHC-1表达[9]。奥沙利铂(而非顺铂)通过触发内质网应激和CRT暴露,在结直肠肿瘤同基因小鼠模型中起到有效的ICD诱导作用[10]。此外,金丝桃素联合光动力疗法已被证实可诱导phox-ER应激,从而导致早期诱导ecto-CRT表达、ATP的主动分泌和热休克蛋白(heat shock protein,HSP)的被动释放,例如HSP70和HSP90,在细胞凋亡晚期,并通过在未免疫小鼠中诱导ICD来能有效阻止肿瘤发展[11]。
2.1.2 靶向药物 目前用于结直肠癌治疗的靶向药物,有贝伐珠单抗、西妥昔单抗、帕尼单抗及雷戈拉非尼[12]。mCRC患者中基于贝伐珠单抗的治疗,可整体改善B、T细胞区室,并在体内增强了DC的抗原呈递功能[13]。西妥昔单抗联合化疗增加了mCRC患者的循环DCs、NKs、记忆性T细胞和癌症特异性CTL,并在体外促进了内质网应激和树突状细胞的吞噬作用[14]。雷戈拉非尼促进人结直肠癌模型中的细胞凋亡和NF-κB活化[15],并增强mCRC患者的抗肿瘤免疫[16]。在CT-26同基因模型中,PI3Kα/δ抑制通过直接增强效应CD8+T细胞活性来促进抗肿瘤免疫[17]。
2.1.3 纳米药物 近年来,纳米颗粒包封已被证实可通过精确控制药物剂量以降低药理学和物理方式中使用的物质的毒性来提高化疗药物的活性,这些治疗效果与ICD的诱导有关[18]。Kuai等[19]发现与游离多柔比星治疗相比,将多柔比星加载在合成高密度脂蛋白(synthetic high density lipoprotein,sHDL)样的纳米盘中,纳米给药的肿瘤中药物的有效量显著高于游离药物,CD8+淋巴细胞较对照组增加了3倍,治疗在盲肠部的MC38结肠细胞的有效率高达80%。Alizadeh等[20]开发了一种封装姜黄素的聚合物纳米载体(polymeric nanocarrier-curcumin,PNCC),可以增强对CRC的化学预防作用,研究通过对肿瘤数量、大小和位置的表征,比较游离姜黄素和PNCC对偶氮甲烷(azomethanem,AOM)诱导的结肠癌的预防作用,结果表明,与游离姜黄素治疗组相比,PNCC治疗组动物的肿瘤大小和数量显著下降。与对照组相比,PNCC还更有效地抑制β-连环蛋白激活(已知致癌)和刺激生成Bcl-2基因相关X蛋白,以表现出更高的抗肿瘤特性。此外,还有研究发现将传统ICD化学诱导剂米托蒽醌(mitoxantrone,MIT)和雷公藤红醇(celastrol,CEL)通过纳米给药,可增强ICD效应;纳米粒子包裹的奥沙利铂(nanoparticle-encapsulated oxaliplatin,NP-OXA)在体外诱导释放更多的DAMPs,并比单独使用OXA更能增强DC和T淋巴细胞的免疫反应[21]。纳米给药方法可与ICD诱导剂相结合,增强抗肿瘤作用,降低化疗药物的不来个你反应。
2.2 溶瘤病毒(oncolytic virus,OVs)疗法 研究显示,当有效的溶瘤病毒诱导针对肿瘤抗原的特异性免疫反应时,溶瘤病毒疗法显示出最有效的抗肿瘤效果。然而,OVs治疗与免疫系统之间存在着复杂的关系,宿主免疫系统是优化该治疗的不可或缺的因素。除了直接杀死癌细胞外,OVs还可以通过释放癌源性DAMPs和病毒源性病原体相关分子模式来刺激宿主的抗肿瘤免疫,在溶瘤病毒治疗的背景下诱导ICD是导致溶瘤效应和免疫反应的关键因素。目前,OVs通过增强ICD诱导来破坏癌症免疫耐受和刺激抗肿瘤免疫的能力已在多个细胞系进行了测试[22-23]。病毒疗法可增加血液中的CD8+T淋巴细胞,上调肿瘤中的穿孔素和颗粒酶B,抑制转化生长因子-β的表达,提高DC的生成[23]。在实验模型中,携带粒细胞-巨噬细胞集落刺激因子(granulocyte- macrophage colony stimulating factor,GM-CSF)的溶瘤麻疹病毒延缓了肿瘤进展,提高了总体中位生存率,并增加了CD3+淋巴细胞的肿瘤浸润[24]。同样,在小鼠CRC模型中,携带GM-CSF的溶瘤单纯疱疹病毒通过诱导适应性免疫显示肿瘤消退[25]。当OVs与传统ICD诱导剂(如MIT或奥沙利铂)结合时,它们可能增强抗肿瘤作用,甚至破坏癌症免疫耐受。在OVs介导的癌细胞溶瘤过程中观察到ICD的典型特征,如钙网蛋白表面暴露、HMGB1和ATP释放以及内质网应激;所有这些暴露的DAMPs显著增加分泌IFN-γ的HER-2特异性CD8+肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes,TIL)的数量,增加中性粒细胞和肿瘤抗原特异性CD8+T细胞的肿瘤内浸润[26]。因此,OVs作为单一疗法或与其他免疫原性化疗联合使用,可能会导致癌症免疫治疗的突破。
2.3 物理疗法诱导ICD
2.3.1 纳米脉冲刺激 与药物诱导的ICD相比,使用纳秒级超短电脉冲的纳米脉冲刺激(nanopulse stimulation,NPS)似乎更安全,侵入性更小。纳秒脉冲高速、高强度地穿透肿瘤中的所有细胞和细胞器,这使得细胞内部钙离子重新排列。钙离子从内质网“逃逸”并引发内质网应激,促使更多活性氧的释放[27]。在几种癌细胞系中,NPS首先激活半胱天冬酶3/7以誘导细胞凋亡,然后外显CRT在细胞表面增加表达,并且外显CRT表达细胞的百分比是NPS能量依赖性的,NPS诱导外显CRT表达的能力与蒽环类药物治疗相当,在NPS治疗后能观察到HMGB1和ATP的分泌[28]。事实上,NPS可能负责通过ICD释放DAMPs并触发DC抗原呈递;通过诱导免疫反应和激活适应性免疫记忆,高比例地消除的原发性4T1肿瘤(75%~100%)[29]。因此,NPS被定义为诱导内质网应激依赖性ICD的物理方法,其在结直肠肿瘤治疗地独特的临床应用值得进一步深入研究。
2.3.2 近红外光免疫疗法(near-infrared photo- immunotherapy,NIR-PIT) NIR-PIT是一种包括近红外辐射和抗体光敏剂共轭物的联合疗法,抗体起到了“引导”的作用,可直接锁定质膜上抗原过度表达的肿瘤细胞,而光活化二氧化硅酞菁九光敏剂IRDye700DX(IR700)定位于靶细胞并吸引近红外光。一旦靶癌细胞暴露于近红外光下,就会触发一系列选择性细胞毒性作用,最终导致细胞死亡。NIR-PIT诱导的细胞肿胀和ICD的可能细胞毒性机制是近红外光照射后,微小的质膜损伤导致特定大小的离子和分子进入细胞[30];Ogawa等[31]证实NIR-PIT诱导的损伤会导致细胞外液流入细胞,从而导致细胞明显的快速肿胀。因此,NIR-PIT诱导的膜损伤是随后免疫原性信号暴露和死亡细胞释放的原因。NIR-PIT处理后肿瘤细胞在质膜上表达越来越多的CRT、HSP70和HSP90,并检测到HMGB1和ATP的快速分泌。此外,NIR-PIT诱导的ICD可以促进未成熟树突状细胞的成熟,这有助于实现持久的抗肿瘤免疫。体外NIR-PIT以激光强度剂量依赖性方式造成小鼠结直肠肿瘤细胞的死亡,在原位结肠癌模型中,对照小鼠出现持续的肿瘤生长,而持续接受NIR-PIT治疗的小鼠出现持续的肿瘤生长抑制[32]。
2.3.3 氧增強光动力疗法(photodynamic therapy, PDT) 研究显示,PDT能够通过操纵光敏剂和活性氧触发phox-ER应激并诱导抗肿瘤免疫从而来杀死癌细胞,可有效和选择性地消除残留或转移性肿瘤[33]。实体瘤环境中的缺氧有利于促进肿瘤转移,而缺氧是降低PDT疗效的严重因素[34]。为了解决缺氧对PDT的限制作用,Chen等[35]用蛋白杂交方法对生物杂化蛋白氧纳米载体装载Ce6 (chlorine e6 encapsulated, C@HPOC),C@HPOC通过光敏剂和活性氧的肿瘤靶向共传递显著增加肿瘤中的氧含量,C@HPOC可使PDT的抗肿瘤效果显著改善,证明了PDT的有效性。He等[36]将涂有二氧化锰和透明质酸(a core-shell gold nanocage coated with manganese dioxide and hyaluronic acid,AMH)的核壳金纳米笼,靶向输送到结直肠肿瘤急性氧合增强的原位进行免疫原性光疗。AMH纳米粒子可以在弱酸性/H2O2介质中产生丰富的氧,进一步增强AMH本身的PDT功效。同时,基于AMH的PDT可通过诱导细胞表面CRT暴露增加和ATP分泌,成功增强ICD。诱导的ICD促进DC成熟,进一步增强针对晚期肿瘤的系统抗肿瘤免疫,而充足的氧生成可缓解TME中的免疫抑制,进一步促进CD8+T细胞渗入肿瘤[36-37]。因此,氧增强的PDT治疗是一种诱导ICD和激发全身抗肿瘤免疫的有效策略。
3 总结与展望
免疫原性细胞死亡作为一种增强肿瘤免疫效应的细胞死亡形式,越来越多的研究证明药物、生物及物理方式诱导ICD,触发机体的抗肿瘤免疫是治疗结直肠肿瘤的有效方式,但更多相关的临床实验还需进一步完善,在未来的结直肠癌治疗研究中,激活ICD发生可能作为一种新的策略,为更多的结直肠癌患者带来治愈的机会。
[参考文献]
[1]BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394–424.
[2]中国医师协会结直肠肿瘤专业委员会. 中国结直肠癌脑转移多学科综合治疗专家共识(2020版)[J]. 中华结直肠疾病电子杂志, 2020, 9(2): 109–114.
[3]MILLER K D, NOGUEIRA L, MARIOTTO A B, et al. Cancer treatment and survivorship statistics, 2019[J]. CA Cancer J Clin, 2019, 69(5): 363–385.
[4]SPROOTEN J, DE WIJNGAERT P, VANMEERBEERK I, et al. Necroptosis in immuno-oncology and cancer immunotherapy[J]. Cells, 2020, 9(8): 1823–1852.
[5]GALLUZZI L, BUQUE A, KEPP O, et al. Immunogenic cell death in cancer and infectious disease[J]. Nat Rev Immunol, 2017, 17(2): 97–111.
[6]CASARES N,PEQUIGNOT M O,TESNIERE A,et al. Caspase-dependent immunogenicity of doxorubicin- inducedtumor cell death[J]. J Exp Med, 2005, 202(12): 1691–1701.
[7]QIANG W, JU X, WANG J, et al. Immunogenic cell death in anticancer chemotherapy and its impact on clinical studies[J]. Cancer Lett, 2018, 438: 17–23.
[8]ATREYA C E, YAEGER R, CHU E. Systemic therapy for metastatic colorectal cancer: from current standards to future molecular targeted approaches[J]. Am Soc Clin Oncol Educ Book, 2017, 37: 246–256
[9]H?L?NE B, M?LANIE B, H?L?NE B, et al. Bleomycin exerts ambivalent antitumor immune effect by triggering both immunogenic cell death and proliferation of regulatory T cells[J]. PLoS One, 2013, 8(6): e65181.
[10]FESSLER E, MEDEMA J P. Colorectal cancer subtypes: developmental origin and microenvironmental regulation[J]. Trends Cancer, 2016, 2(9): 505–518.
[11]GARG A D, VANDENBERK L, KOKS C, et al. Dendritic cell vaccines based on immunogenic cell death elicit danger signals and T cell–driven rejection of high-grade glioma[J]. Sci Transl Med, 2016, 8(328): 328ra27.
[12]GROTHEY A, VAN CUTSEM E, SOBRERO A, et al. Regorafenib monotherapy for previously treated metastatic colorectal cancer (CORRECT): an international, multicentre, randomised, placebo- controlled, phase 3 trial[J]. Lancet, 2013, 381(9863): 303–312.
[13]MANZONI M, ROVATI B, RONZONI M, et al. Immunological effects of bevacizumab-based treatment in metastatic colorectal cancer.[J]. Oncology, 2009, 79(3-4): 187–196.
[14]POZZI C, CUOMO A, SPADONI I, et al. The EGFR-specific antibody cetuximab combined with chemotherapy triggers immunogenic cell death[J]. Nat Med, 2016, 22(6): 624–631.
[15]TONG J, WANG P, TAN S, et al. Mcl-1 degradation is required for targeted therapeutics to eradicate colon cancer cells[J]. Cancer Res, 2017, 77(9): 2512–2521.
[16]ARAI H, BATTAGLIN F, WANG J, et al. Molecular insight of regorafenib treatment for colorectal cancer[J]. Cancer Treatment Rev, 2019, 81: 101912.
[17]CARNEVALLI L S, SINCLAIR C, TAYLOR M A, et al. PI3Kα/δ inhibition promotes anti-tumor immunity through direct enhancement of effector CD8+ T-cell activity[J]. J Immunther Cancer, 2018, 6(1): 158.
[18]MATOS A I, CARREIRA B, PERES C, et al. Nanotechnology is an important strategy for combinational innovative chemo-immunotherapies against colorectal cancer[J]. J Control Release, 2019, 307: 108–138.
[19]KUAI R, YUAN W, SON S, et al. Elimination of established tumors with nanodisc-based combination chemoimmunotherapy[J]. Sci Adv, 2018, 4(4): eaao1736.
[20]ALIZADEH A M, KHANIKI M, AZIZIAN S, et al. Chemoprevention of azoxymethane-initiated colon cancer in rat by using a novel polymeric nanocarrier–curcumin[J]. Eur J Clin Pharmacol, 2012, 689(1–3): 226–232.
[21]ZHAO X, YANG K, ZHAO R, et al. Inducing enhanced immunogenic cell death with nanocarrier-based drug delivery systems for pancreatic cancer therapy[J]. Biomaterials, 2016: 187–197.
[22]LEE P, GUJAR S. Potentiating prostate cancer immunotherapy with oncolytic viruses[J]. Nat Rev Urol. 2018, 15(4): 235–250.
[23]LIU Z, YANG Y, ZHANG X, et al. An oncolytic adenovirus encoding decorin and GM-CSF inhibits tumor growth in a colorectal tumor model by targeting pro-tumorigenic signals and via immune-activation[J]. Human Gene Ther, 2017, 28(8): 667–680.
[24]GROSSARDT C, ENGELAND C E, BOSSOW S, et al. Granulocyte-macrophage colony-stimulating factor- armed oncolytic measles virus is an effective therapeutic cancer vaccine.[J]. Human Gene Ther, 2013, 24(7): 644–654.
[25]LEI Y, CHUNHONG Z, JIXIA H, et al. Antitumor effects of oncolytic herpes simplex virus type 2 against colorectal cancer in vitro and in vivo[J]. Ther Clin Risk Manag, 2017, 13: 117–130.
[26]GUJAR S, POL J G, KIM Y, et al. Antitumor benefits of antiviral immunity: an underappreciated aspect of oncolytic virotherapies[J]. Trends Immunol, 2018, 39(3): 209–221.
[27]NUCCITELLI R, LUI K, KREIS M, et al. Nanosecond pulsed electric field stimulation of reactive oxygen species in human pancreatic cancer cells is Ca2+ -dependent[J]. Biochem Bioph Res Co, 2013, 435(4): 580–585.
[28]NUCCITELLI R, MCDANIEL A, ANAND S, et al. Nano-Pulse stimulation is a physical modality that can trigger immunogenic tumor cell death[J]. J Immunother Cancer, 2017, 5: 32.
[29]GUO S, JING Y, BURCUS N, et al. Nano‐pulse stimulation induces potent immune responses, eradicating local breast cancer while reducing distant metastases[J]. Int J Cancer. 2018; 142: 629–640.
[30]KOHEI N, HIDEO T, YOICHI S, et al. Changes in plasma membrane damage inducing cell death after treatment with near-infrared photoimmunotherapy[J]. Cancer Sci, 2018, 109(9): 2889–2896.
[31]OGAWA M, TOMITA Y, NAKAMURA Y, et al. Immunogenic cancer cell death selectively induced by near infrared photoimmunotherapy initiates host tumor immunity[J]. Oncotarget, 2017, 8(6): 10425–10436.
[32]HOLLANDSWORTH H M, AMIRFAKHRI S, FILEMONI F, et al. Near-infrared photoimmunotherapy is effective treatment for colorectal cancer in orthotopic nude-mouse models[J]. PLoS One, 2020, 15(6): e0234643.
[33]GALLUZZI L, KEPP O, KROEMER G. Enlightening the impact of immunogenic cell death in photodynamic cancer therapy[J]. Embo J, 2014, 31(5): 1055–1057.
[34]CHOUAIB S, NOMAN M Z, KOSMATOPOULOS K, et al. Hypoxic stress: obstacles and opportunities for innovative immunotherapy of cancer[J]. Oncogene, 2017, 36(4): 439–445.
[35]CHEN Z, LIU L, LIANG R, et al. Bioinspired hybrid protein oxygen nanocarrier amplified photodynamic therapy for eliciting anti-tumor immunity and abscopal effect[J]. ACS Nano, 2018, 12(8): 8633–8645.
[36]HE H, LIU L, LIANG R, et al. Tumor-targeted nanoplatform for in situoxygenation-boosted immunogenic phototherapy of colorectal cancer[J]. Acta Biomater, 2020, 104: 188–197.
[37]HATFIELD S M, KJAERGAARD J, LUKASHEV D, et al. Immunological mechanisms of the antitumor effects of supplemental oxygenation[J]. Sci Transl Med, 2015, 7(277): 277ra30.
(收稿日期:2022–07–28)
(修回日期:2022–12–05)
