甘草次酸修饰的莪术醇-芍药苷共载纳米脂质体的制备及表征
2023-05-29曾盈蓉蒋婉婷彭程雷雨菁夏新华
曾盈蓉 蒋婉婷 彭程 雷雨菁 夏新华


〔摘要〕 目的 优选甘草次酸修饰的莪术醇-芍药苷共载纳米脂质体(GA-Cur-PF-Lips)的制备工艺,并对其理化性质进行表征。方法 采用乙醇注入法制备GA-Cur-PF-Lips,通过单因素考察和Box-Behnken响应面优化法优选其制备工藝;利用透射电镜观察其显微形态,采用马尔文激光粒径仪测定其粒径、多分散指数(polydispersity index, PDI)及Zeta电位,并对其体外释放度、溶血性进行考察。结果 最佳工艺:脂质量85.19 mg,胆脂比1∶9.74,总投药量4.5 mg,导脂比1∶40,超声时间6.4 min(工作2 s、停2 s)。制得的GA-Cur-PF-Lips外观澄清并伴有淡蓝色乳光,透射电镜下观察呈类球形;其平均粒径为(101.1±0.25) nm,PDI为0.170±0.011,Zeta电位为(0.333±0.060) mV,莪术醇包封率为86.65%±1.11%,芍药苷包封率为47.85%±1.02%,总载药量为1.233%±0.022%;体外释放呈现缓释特征,且无明显的溶血作用。结论 优化后的GA-Cur-PF-Lips包封率高、粒径小且分布均匀,无溶血性,且具有一定的缓释作用,可为GA-Cur-PF-Lips进一步研发为低毒高效的抗肝癌新药奠定基础。
〔关键词〕 莪术醇;芍药苷;纳米脂质体;乙醇注入法;Box-Behnken响应面法;理化性质
〔中图分类号〕R283.6 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.05.011
Preparation and characterization of curcumol and paeoniflorin co-loaded nanoliposomes
modified by glycyrrhetinic acid
ZENG Yingrong, JIANG Wanting, PENG Cheng, LEI Yujing, XIA Xinhua
College of Pharmacy, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To optimize the preparation process of curcumol and paeoniflorin co-loaded nanoliposomes (GA-Cur-PF-Lips) modified with glycyrrhetinic acid, and to characterize the physicochemical properties. Methods GA-Cur-PF-Lips were prepared by ethanol injection, and the preparation process was optimized by single-factor investigation and Box-Behnken response surface optimization method. The microscopic morphology was observed by transmission electron microscopy, the particle size, polydispersion index (PDI) and Zeta potential were measured by Malvern laser particle size analyzer, and the release degree and hemolysis were investigated in vitro. Results The optimum process was as follows: lipid weight was 85.19 mg, the ratio of cholesterol to phospholipid was 1∶9.74, the total dosage was 4.5 mg, the ratio of the guiding molecule to the lipid mass was 1∶40 and the ultrasonic time was 6.4 min (on for 2 s, off for 2 s). The obtained GA-Cur-PF-Lips were clear with pale blue opalescence, and spherical in appearance under transmission electron microscope. The average particle size was (101.1±0.25) nm, the PDI was 0.170±0.011, the Zeta potential was (0.333±0.060) mV, the encapsulation rate of curcumol was 86.65%±1.11%, the encapsulation rate of paeoniflorin was 47.85%±1.02%, the total drug load was 1.233%±0.022%. Its in vitro release presented slow release characteristics, and there was no obvious hemolysis. Conclusion With high encapsulation rate, small particle size and uniform distribution, the optimized GA-Cur-PF-Lips have no obvious hemolysis, and have a certain sustained release effect. The experimental findings can lay a foundation for the further development of GA-Cur-PF-Lips as a new drug with low toxicity and high efficiency against liver cancer.
〔Keywords〕 curcumol; paeoniflorin; nano liposomes; ethanol injection method; Box-Behnken response surface method; physicochemical property
肝癌是世界范圍内癌症死亡的主要原因之一,肿瘤细胞具有很强的增殖能力,且很容易转移到身体的其他部位并产生有害物质,破坏正常器官结构,危害人类生命和健康[1-2]。莪术醇是近年来发现的新的抗肿瘤中药单体之一,它与许多传统化学抗肿瘤药物相比,具有无致突变性、低毒、安全可靠的特点,并且对多种肿瘤有治疗效果[3],芍药苷是一种水溶性单萜类糖苷,在抗肿瘤方面有广阔的应用前景[4]。已有研究表明莪术醇和芍药苷均能通过不同途径和通路抗肝癌:莪术醇抑制肿瘤细胞增殖,诱导肿瘤细胞衰老和凋亡[5-8],芍药苷可通过不同的分子机制诱导细胞凋亡、抑制增殖、侵袭和转移[9-12]。
脂质体系指将药物包封于类脂质双分子层而形成的微型泡囊体[13]。脂质体拥有独特的双分子层结构,既无毒又可生物降解,且具有改善药物溶解性,提高药物稳定性,增强体内靶向性从而提高药物疗效等优点,被广泛应用于肿瘤的治疗[14]。肝癌多发生于肝实质细胞,研究证实该细胞表面存在大量的甘草次酸(glycyrrhetinic acid, GA)特异性结合位点[15],脂质体经甘草次酸修饰后,对HepG2细胞具有更高的亲和力[16],从而提高了脂质体对肝癌细胞的靶向性。
前期预实验发现莪术醇-芍药苷(1∶1)联用对HepG2细胞增殖的抑制有一定的协同作用,为此设计将莪术醇-芍药苷共载于甘草次酸修饰的脂质体中,以便二者通过不同途径和通路发挥协同作用,进一步提高其抗肝肿瘤效果。本文采用单因素实验结合Box-Behnken设计-效应面优化法,对GA修饰的莪术醇-芍药苷共载纳米脂质体(GA-Cur-PF-Lips)的处方与制备工艺进行了优化,以期为研发一种低毒高效的抗肝癌新制剂奠定制剂学基础。
1 材料
Agilent Technologies 1200 Series高效液相色谱仪(美国安捷伦公司);Precisa XB 220A型分析天平(瑞士Precisa重量分析股份公司);01A418型超声细胞粉碎机、SCIENTZ-10N型冷冻干燥机(宁波新芝生物科技股份有限公司);Zetasizer Nano-ZS90激光粒度分析仪(英国马尔文仪器有限公司);ZNCL-G型智能磁力搅拌器(巩义市予华仪器有限责任公司);RE-52AA型旋转蒸发器(上海亚荣生化仪器厂);SPX-250B型恒温培养箱(上海博泰实验设备有限公司);H3-20KR型台式高速冷冻离心机(湖南可成仪器设备有限公司)。
莪术醇对照品(批号:100185-201908,质量分数99.9%)、芍药苷对照品(批号:110736-202145,质量分数94.6%)(中国食品药品检定研究院);莪术醇原料药(批号:F17HB175748,质量分数98.0%)、芍药苷原料药(批号:M28GS143089,质量分数90%)、大豆卵磷脂(批号:T7011F127302))、D44 mm透析袋(截留相对分子质量8000~14 000)(上海源叶生物有限公司);二硬脂酰基磷脂乙醇胺-聚乙二醇2000-甘草次酸(DSPE-PEG2000-GA,西安齐岳生物科技有限公司);胆固醇(批号20181128)、甲醇(色谱纯)、无水乙醇(分析纯)(国药集团化学试剂有限公司);无菌脱纤维兔血(批号210624,广州鸿泉生物科技有限公司);乙腈(色谱纯,美国TEDIA天地试剂公司);磷酸(色谱纯,天津市科密欧化学试剂有限公司);蒸馏水(华润怡宝饮料有限公司),其余试剂均为分析纯。
2 方法与结果
2.1 莪术醇与芍药苷的HPLC含量测定
2.1.1 色谱条件 (1)莪术醇:Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 μm);以0.1%磷酸水-乙腈溶液(40∶60)为流动相;检测波长为210 nm;柱温为35 ℃;流速为1.0 mL/min;进样量为20 μL。
(2)芍药苷:Zorbax SB-C18色谱柱(250 mm×4.6 mm,5 μm),以乙腈-0.1%磷酸水(14∶86)为流动相;检测波长为230 nm;柱温为25 ℃;流速为1.0 mL/min;进样量为10 μL。
2.1.2 对照品溶液、供试品溶液及阴性对照溶液的制备 (1)对照品溶液的制备:精密称取莪术醇对照品适量,加甲醇稀释制成每1 mL含5 μg的莪术醇对照品溶液。另精密称取芍药苷对照品,加甲醇稀释制成每1 mL含10 μg的芍药苷对照品溶液。
(2)空白对照溶液、供试品溶液与阴性对照溶液的制备:溶剂甲醇过0.22 μm微孔滤膜,作为空白对照,备用;精密移取GA-Cur-PF-Lips供试品1 mL,加入甲醇[17](破乳剂)定容至25 mL,过0.22 μm微孔滤膜,备用。同样方法处理空白脂质体样品作为阴性溶液。
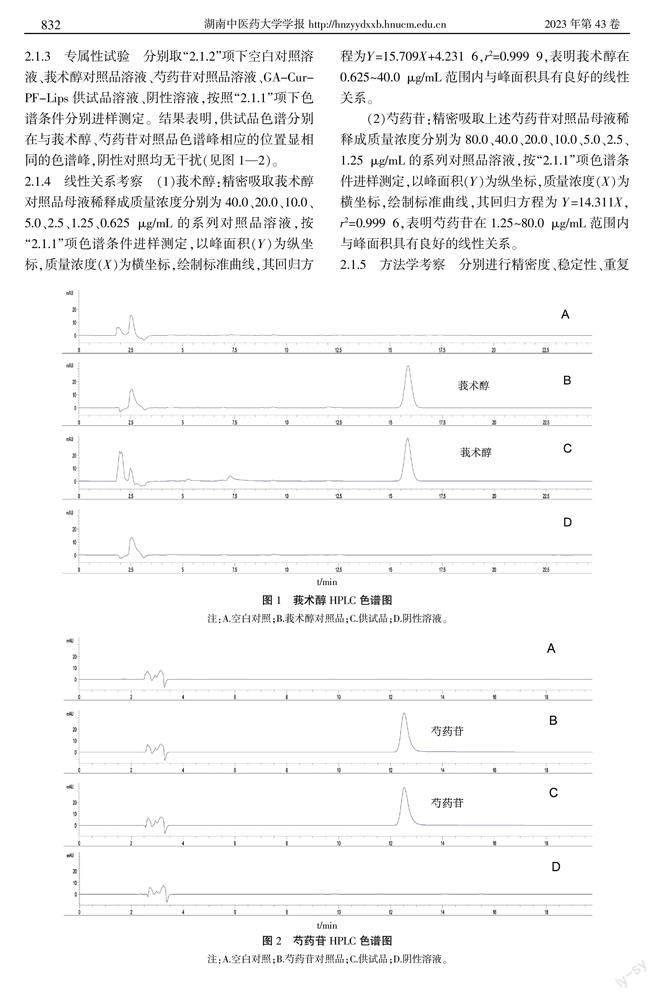
2.1.3 专属性试验 分别取“2.1.2”项下空白对照溶液、莪术醇对照品溶液、芍药苷对照品溶液、GA-Cur-PF-Lips供试品溶液、阴性溶液,按照“2.1.1”项下色谱条件分别进样测定。结果表明,供试品色谱分别在与莪术醇、芍药苷对照品色谱峰相应的位置显相同的色谱峰,阴性对照均无干扰(见图1—2)。
2.1.4 线性关系考察 (1)莪术醇:精密吸取莪术醇对照品母液稀释成质量浓度分别为40.0、20.0、10.0、5.0、2.5、1.25、0.625 μg/mL的系列对照品溶液,按“2.1.1”项色谱条件进样测定,以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准曲线,其回归方程为Y=15.709X+4.231 6,r2=0.999 9,表明莪术醇在0.625~40.0 μg/mL范围内与峰面积具有良好的线性关系。
(2)芍药苷:精密吸取上述芍药苷对照品母液稀释成质量浓度分别为80.0、40.0、20.0、10.0、5.0、2.5、1.25 μg/mL的系列对照品溶液,按“2.1.1”项色谱条件进样测定,以峰面积(Y)为纵坐标,质量浓度(X)为横坐标,绘制标准曲线,其回归方程为Y=14.311X,r2=0.999 6,表明芍药苷在1.25~80.0 μg/mL范围内与峰面积具有良好的线性关系。
2.1.5 方法学考察 分别进行精密度、稳定性、重复性、加样回收实验,结果表明,莪术醇和芍药苷的精密度、稳定性、重复性实验RSD均小于3%,符合要求;加样回收莪术醇加样平均回收率为101.84%±0.78%,芍药苷加样回收率是101.78%±0.67%,表明测定方法的准确度高。
2.2 包封率和载药量的测定
2.2.1 包封率的测定 采用透析法测定GA-Cur-PF-Lips包封率。精密移取pH=5的PBS 50 mL作为透析介质,吸取GA-Cur-PF-Lips 1 mL放入透析袋中,在25 ℃、磁力搅拌(300 r/min)下透析,分别于透析15、30、45、60、90、120、150、180 min时取透析液进样测定。结果表明,随着透析时间延长,透析介质中游离莪术醇与芍药苷的峰面积均一直增加,从30~45 min期间,透析袋内外的莪术醇与芍药苷呈现透析平衡状态,而后透析介质中游离药物逐步增多,说明脂质体结构开始被破坏,故确定透析时间为30~45 min(见图3)。包封率按下述公式计算。
包封率(%)=(总药量-游离药量)/总药量×100%
2.2.2 总载药量的测定 精密移取2 mL GA-Cur-PF-Lips置于已干燥至恒定质量的西林瓶中,冷冻干燥 48 h,得冻干粉,称量,计算供试品冻干粉净质量。将冻干粉复溶后取1 mL样品充分破乳后,按“2.1.1”项下色谱条件测定冻干粉中的莪术醇和芍药苷的总药量,计算总载药量。
总载药量(%)=总药量/冻干粉净质量×100%
2.3 GA-Cur-PF-Lips的制备
采用乙醇注入法制备GA-Cur-PF-Lips。精密称取芍药苷2 mg溶于10 mL磷酸盐缓冲液(PBS,pH=5)中作为水相,大豆卵磷脂80 mg、胆固醇20 mg、莪术醇2 mg溶于5 mL无水乙醇中作为油相,将油相预热至60 ℃匀速滴入水相中,在磁力搅拌下(600 r/min)于60 ℃避光水合1 h后减压旋蒸除去乙醇,经探头超声(200 W,工作2 s、停2 s)一定时间后定容,分别过0.45、0.22 μm微孔滤膜,即得。同样方法制备空白脂质体样品。
2.4 制备工艺的单因素考察
2.4.1 超声时间的考察 参照“2.3”项下方法制备脂质体,并分别考察不同超声时间(3、6、9、12、15 min)对脂质体的影响。结果表明,随着超声时间的增加,粒径呈现增大的趋势,PDI与Zeta电位变化不明显,芍药苷与莪术醇的包封率则先增大后减小,两药包封率均在超声6 min时达到最大值,故选择超声时间3~9 min做进一步优化。
2.4.2 脂质量的考察 通过预实验摸索,选择以大豆卵磷脂为原料,其他制备条件同“2.4.1”项,设计脂质量为20、40、80、120、160 mg分别进行考察。结果表明,随着脂质总量的增加,粒径总体呈现减小的趋势,PDI升高,Zeta电位总体先升高后降低,包封率均呈现增大的趋势,在脂质量为80 mg时两药包封率及各项指标均无较大变化,故选择脂质量在40~120 mg做进一步优化。
2.4.3 胆脂比的考察 固定脂质量80 mg,水合温度55 ℃,其他制备条件同“2.4.2”项,设计胆脂比(即胆固醇与大豆卵磷脂的质量比)为1∶6、1∶8、1∶10、1∶12、1∶14分别进行考察。结果表明,随着胆脂比的减少(即胆固醇相对比例下降),粒径总体呈现减小的趋势,PDI总体呈减小趋勢,Zeta电位总体略有降低,包封率均呈现增大后减小的趋势,在胆脂比1∶10时达最优值,故选取胆脂比1∶8~1∶12做进一步优化。
2.4.4 总投药量的考察 固定胆脂比为1∶10,其他制备条件同“2.4.3”项,设计总投药量为3、4.5、6、9 mg分别进行考察。由于莪术醇包封率约为芍药苷的2倍,故将二者投药比设为1∶2以使包封的莪术醇-芍药苷接近1∶1,从而更好地发挥其协同作用。结果表明,总投药量增加,平均粒径、PDI、Zeta电位及莪术醇包封率无明显变化,芍药苷包封率则呈先升后降的趋势,故选取总投药量为4.5 mg进行后续实验。
2.4.5 导脂比的考察 以二硬脂酰基磷脂乙醇胺-聚乙二醇2000-甘草次酸(DSPE-PEG2000-GA)为导向分子,固定总投药量为4.5 mg,其他制备条件同“2.4.4”项,设计导脂比(即导向分子与脂质量之比)为1∶80、1∶40、1∶20分别进行考察。结果表明,导脂比增加(即导向分子相对比例增加),平均粒径、PDI呈上升趋势,而Zeta电位和包封率则呈下降趋势。考虑加入过少导向分子将影响其靶向性,而过多导向分子会引起包封率下降,甚至出现浑浊现象,故选择导脂比1∶40进行后续实验。
2.5 Box-Behnken响应面法优化工艺条件
2.5.1 实验设计及结果 在前期单因素考察的基础上,选择影响较为显著的脂质量(A)、胆脂比(B)和超声时间(C)作为考察因素,采用3因素3水平的Box-Behnken响应面优化法按排试验,以芍药苷包封率(Y1)、莪术醇包封率(Y2)和总载药量(Y3)为评价指标,通过熵值法[18]对三指标进行赋权(Y1、Y2、Y3的权重系数分别为0.25、0.364、0.385)并计算综合评分(Y)。因素水平、试验设计及结果见表1—2。
2.5.2 模型拟合及方差分析 应用Design Expert 10.0.7软件对表2实验数据进行处理,以Y对A、B、C进行多元回归,拟合得到二次多项式回归方程:Y=79.79+7.12A-4.94B+2.33C+3.67AB-1.69AC+1.52BC-24.57A2-16.28B2-6.57C2。方差分析表明(表3),回归模型P<0.001,表明模型具有显著性;失拟项P>0.05,说明模型拟合良好;回归方程拟合决定系数(r2)为0.959 6,校正决定系数(R2adj)为0.907 6,说明该模型可以解释90.76%的响应值的变异,且方程拟合程度较好;模型变异系数为9.44%<10%,表明模型准确度高;精密度值是有效信号与噪声的比值,为13.588>4,说明模型合理,表明该模型可用于设计分析。另外,脂质量(A)、胆脂比(B)对Y均有显著性影响(P<0.05),各因素之间交互作用不明显,且各因素均不是单纯的一次关系,而是二次关系(A2、B2、C2的P<0.05)。以Y为评价指标对交互因素的响应面等高线图及3D效果图见图4。
2.5.3 验证试验 基于上述建立的二次多项式回归方程模型,通过Design Expert 10.0.7软件得到最优工艺条件,即脂质量85.19 mg,胆脂比1∶9.74,超声时间6.4 min。在此工艺条件下平行试验3次,结果实测值与预测值较为接近,相对偏差较小,表明模型预测性良好,优选的GA-Cur-PF-Lips制备工艺稳定可行(见表4)。
2.6 质量评价
2.6.1 外观及显微形态 按优化工艺制得的GA-Cur-PF-Lips,外观澄清并伴有淡蓝色乳光,透射电镜下可见脂质体呈类球形,且饱满圆整(见图5)。
2.6.2 粒径与Zeta电位测定 取适量脂质体,采用Zetasizer Nano-ZS90激光粒度分析仪测定脂质体的平均粒径和Zeta电位,结果表明:其平均粒徑为(101.1±0.25) nm,PDI为0.170±0.011,Zeta电位为(0.333±0.060) mV。
2.6.3 体外释放度考察 采用透析袋法[19]考察莪术醇-芍药苷的混合溶液与GA-Cur-PF-Lips的体外释放情况。取5 mL脂质体溶液置于透析袋中,然后将透析袋置于含有100 mL释放介质(PBS溶液,pH=5.0)的容器内,于37 ℃、150 r/min恒温震荡,分别于0.5、1、1.5、2、3、4、6、8、10、12、24 h取样1 mL(同时补充等温等量释放介质),测定莪术醇、芍药苷含量,计算各时间点的累积释放率并作图。计算脂质体的累积释放度[20]并绘制释放曲线(见图6)。
2.6.4 溶血性考察 参照2020版《中华人民共和国药典》[21]的规定,对GA-Cur-PF-Lips的溶血性进行评估。取EP管18只,分为2组,分别为莪术醇-芍药苷共载纳米脂质体组(Cur-PF-Lips)、GA-Cur-PF-Lips组,每组9只,对其进行编号(各组中1~6号管为供试品管,7号管为阴性对照管,8号管为阳性对照管,9号管为供试品对照管)。参考文献[22]方案依次加入样品、2%红细胞混悬液、生理盐水、去离子水,混匀后,立即置于(37.0±0.5) ℃的恒温水浴中。3 h后观察溶血和凝聚反应,肉眼观察并拍照。同时取上清液于比色皿中,用紫外分光光度计于576 nm处测定其吸光度值,计算溶血率,溶血率低于5%为合格。结果表明,Cur-PF-Lips和GA-Cur-PF-Lips均未出现明显的溶血及凝聚现象,其溶血率均小于5%,符合注射用药要求,可以用于后续动物实验的静脉给药(见表6)。溶血率计算公式如下:
3 讨论
本研究以二硬脂酰基磷脂乙醇胺-聚乙二醇2000-甘草次酸(DSPE-PEG2000-GA)为导向分子,利用其磷脂端(DSPE端)可嵌入到脂质体的脂质双分子层实现对莪术醇-芍药苷共载纳米脂质体的表面修饰,其GA端可与肝癌细胞膜上高表达的GA结合位点结合而使其具有肝肿瘤靶向性,其亲水性PEG2000长链可增加脂质体的稳定性与体内循环时间,从而使莪术醇-芍药苷能更大程度地的协同发挥抗肝癌作用。
为了评价GA-Cur-PF-Lips的药物包封率,本研究前期曾采用葡聚糖凝胶柱色谱法、低速离心法、凝胶微柱离心法等方法分离脂质体与游离的莪术醇、芍药苷,但均不能将其较好地分离,而透析法简单快捷,能同时实现莪术醇与芍药苷游离药物与脂质体的分离,且回收率符合要求、结果可靠,因此,选择透析法测定莪术醇与芍药苷的包封率。
本研究较系统地考察了超声时间、脂质量、胆脂比、总投药量和导脂比多个因素对脂质体的粒径、PDI、Zeta电位、莪术醇和芍药苷的包封率影响,并在此基础上采用Box-Behnken响应面优化法确定了GA-Cur-PF-Lips的最优工艺条件,即脂质量为85.19 mg,胆脂比为1∶9.74,总投药量为4.5 mg,导脂比为1∶40,超声时间为6.4 min(工作2 s、停2 s)。Box-Behnken响应面优化法具有具预测性好、实验次数少、高效等优点,并能对各个影响因素及其相互作用进行分析[23],故常用于制剂工艺条件的优化。本研究前期对脂质体制备的其他影响因素(如油水比、水相pH、水合温度、水合时间等)也进行了考察,发现其他因素对脂质体的各项质量指标均无较大影响。另外,考虑到莪术醇和芍药苷的包封率差异,将二者投料比设计为1∶2,可使脂质体包载的莪术醇-芍药苷的配比接近1∶1,从而有助于二者发挥协同作用。
本研究制备的GA-Cur-PF-Lips具有粒径小、分布均匀、外观圆整等特点,较小粒径的脂质体有更快、更强的肿瘤分布[24];PDI小于0.3说明脂质体的粒径分布均匀且狭窄,有助于提高其稳定性。体外释放实验显示GA-Cur-PF-Lips具有缓释特性,这将有助于延长药物成分在体内的作用时间;溶血性实验表明GA-Cur-PF-Lips与Cur-PF-Lips均无明显的溶血与凝聚作用,故可注射给药。综上所述,本研究可为GA修饰的莪术醇-芍药苷共载纳米脂质体的进一步研究奠定基础,同时对于研发低毒高效的抗肝癌新药也具有一定的意义。
参考文献
[1] YANG J Q, PAN G D, GUAN L J, et al. The burden of primary liver cancer caused by specific etiologies from 1990 to 2019 at the global, regional, and national levels[J]. Cancer Medicine, 2022, 11(5): 1357-1370.
[2] LIU S Y, YAO M Z, LI X L, et al. Effects of circFOXO3 on the proliferation and invasion of liver cancer cells by regulating PI3K/Akt pathway[J]. Contrast Media & Molecular Imaging, 2022, 2022: 2109908.
[3] 李文杰. 莪术醇肝靶向脂质体的制备及其抗肿瘤研究[D]. 广州: 广州中医药大学, 2014.
[4] WANG X Z, XIA L, ZHANG X Y, et al. The multifaceted mechanisms of Paeoniflorin in the treatment of tumors: State-of-the-Art[J]. Biomedecine & Pharmacotherapie, 2022, 149: 112800.
[5] 黄岚珍, 杨飞城, 阳 晶, 等. 莪术醇诱导人肝癌HepG2细胞衰老及其机制研究[J]. 广西植物, 2018, 38(7): 894-902.
[6] 聂添情, 孟祥伟, 应宇晨, 等. 莪术醇及其衍生物的抗肿瘤活性研究进展[J]. 中草药, 2020, 51(21): 5613-5621.
[7] ZHANG R Z, ZHONG L, SUN K W, et al. A study on curcumol influencing proliferation and apoptosis of hepatocellular carcinoma cells through DJ-1/PTEN/PI3K/AKT pathway[J]. BioMed Research International, 2022, 2022: 9912776.
[8] ZUO H X, JIN Y, WANG Z, et al. Curcumol inhibits the expression of programmed cell death-ligand 1 through crosstalk between hypoxia-inducible factor-1α and STAT3 (T705) signaling pathways in hepatic cancer[J]. Journal of Ethnopharmacology, 2020, 257: 112835.
[9] 王昌高, 韋 红, 王裕宣, 等. 芍药苷对肝癌HepG2细胞侵袭和迁移作用研究[J]. 中国临床药理学杂志, 2019, 35(15): 1625-1628.
[10] 万南燕, 蒋翠花, 高 萌, 等. 芍药苷调控JAK/STAT3通路干预HepG2细胞PD-L1表达的研究[J]. 中国药科大学学报, 2019, 50(2): 213-221.
[11] ZHOU Y, LIU X, GAO Y H, et al. Paeoniflorin affects hepatocellular carcinoma progression by inhibiting Wnt/β-catenin pathway through downregulation of 5-HT1D[J]. Current Pharmaceutical Biotechnology, 2021, 22(9): 1246-1253.
[12] LIU H, ZANG L L, ZHAO J, et al. Paeoniflorin inhibits cell viability and invasion of liver cancer cells via inhibition of Skp2[J]. Oncology Letters, 2020, 19(4): 3165-3172.
[13] 侯 婷, 陈 军, 蔡宝昌, 等. 硫酸铵梯度法制备脂质体的研究进展[J]. 中国药师, 2009, 12(12): 1723-1725.
[14] DE LEO V, MAURELLI A M, GIOTTA L, et al. Liposomes containing nanoparticles: Preparation and applications[J]. Colloids and Surfaces B, Biointerfaces, 2022, 218: 112737.
[15] SALVI M, FIORE C, ARMANINI D, et al. Glycyrrhetinic acid-induced permeability transition in rat liver mitochondria[J]. Biochemical Pharmacology, 2003, 66(12): 2375-2379.
[16] DINH C T, VU H T, PHAN Q T H, et al. Synthesis of glycyrrhetinic acid-modified liposomes to deliver Murrayafoline A for treatment of hepatocellular carcinoma[J]. Journal of Materials Science Materials in Medicine, 2022, 33(10): 72.
[17] 席 宁, 王永辉, 王丽森, 等. 线粒体靶向性的姜黄素TPP-PEG-PLGA脂质体的制备及促肝癌细胞凋亡研究[J]. 中国药学杂志, 2022, 57(17): 1438-1446.
[18] 麻学锋, 吕逸翔. 张家界城镇居民幸福水平对旅游城镇化集聚的响应识别及测度[J]. 自然资源学报, 2020, 35(7): 1647-1658.
[19] 张 丹, 廖 芳, 周 洁, 等. Box-Behnken Design-响应面优化法优化芍药总苷脂质体的制备工艺及体外释放研究[J]. 中草药, 2015, 46(3): 359-364.
[20] 冯宇飞, 常书源, 秦国昭, 等. 星点设计-效应面法优化pH值响应及线粒体靶向双功能金丝桃苷脂质体的处方及其体外评价[J]. 中草药, 2020, 51(23): 5934-5942.
[21] 国家药典委员会. 中华人民共和国药典[M]. 北京: 中国医药科技出版社, 2020: 516.
[22] 吴斯宇, 曾盈蓉, 唐 聘, 等. RGD环肽修饰的姜黄素/黄芩苷靶向共递送纳米脂质体的制备工艺优化及表征[J]. 中草药, 2021, 52(22): 6834-6844.
[23] 彭晓霞, 路莎莎. 响应面优化法在中药研究中的应用和发展[J]. 中国实验方剂学杂志, 2011, 17(19): 296-299.
[24] MA S Y, LI M Y, LIU N, et al. Vincristine liposomes with smaller particle size have stronger diffusion ability in tumor and improve tumor accumulation of vincristine significantly[J]. Oncotarget, 2017, 8(50): 87276-87291.
