谷胱甘肽响应型探针的制备及其在天然药物筛选中的应用
2023-05-29毛林夕王梦云杨皓宇覃艳王炜
毛林夕 王梦云 杨皓宇 覃艳 王炜
〔摘要〕 目的 制備谷胱甘肽(glutathione, GSH)响应的香豆素类荧光探针并应用于中药GSH调节剂的筛选。方法 以香豆素为荧光团,2-氯-5-硝基嘧啶为淬灭基团,构建GSH响应的荧光探针(HCN),通过紫外、高效液相色谱、荧光光谱和核磁等表征手段确定HCN的结构及其对GSH响应的可行性、特异性、灵敏性,以确定最佳响应条件。通过MTT实验及细胞成像考察HCN的细胞毒性及胞内荧光信号。以GSH商品化消耗剂(NEM)为阳性对照,选取民族药血筒中16种化合物为筛选对象,通过HCN检测所选化合物对GSH水平的调控能力,并进一步采用分子对接手段验证筛选结果的可靠性。结果 核磁谱表明HCN合成成功,能与GSH特异性响应并呈线性关系,且HCN的最佳反应温度和反应时间分别为37 ℃和100 min。MTT实验表明,在HepG2细胞中,与0 μmol/mL相比,80 μmol/mL和100 μmol/mL的HCN降低了细胞活力(P<0.05),说明HCN对HepG2细胞增殖有影响;在HL-7702细胞中,与0 μmol/mL相比,各浓度HCN对细胞活力影响微弱(P>0.05),说明HCN对HL-7702细胞增殖无影响。在细胞成像实验中,与0 μmol/mL相比,各浓度HCN的荧光强度增强(P<0.05)。在药物筛选中,与control相比,血筒中的化合物五内酯B、南五内酯和异南内酯A下调了GSH的水平(P<0.001,P<0.05)。分子对接结果表明,血筒中的化合物五内酯B、南五内酯和异南内酯A与GSH形成了2个及以上的氢键,结合能分别为-3.94、-3.64、-4.87 kal/mol。结论 本文设计合成了一种GSH响应的香豆素类探针HCN,HCN具有良好的GSH响应特异性、灵敏性、光稳定性及低细胞毒性等特点,能应用于中药GSH调节剂的筛选,该研究可为荧光探针技术服务与中药活性成分筛选提供参考。
〔关键词〕 荧光探针;香豆素;谷胱甘肽;生物硫醇;天然产物;血筒
〔中图分类号〕R284;R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.05.012
Preparation of GSH-responsive probe and its application in screening natural medicine
MAO Linxi, WANG Mengyun, YANG Haoyu, QIN Yan, WANG Wei
College of Pharmacy, Hunan University of Chinese Medicine, Changsha, Hunan 410208, China
〔Abstract〕 Objective To prepare the glutathione (GSH)-responsive coumarin fluorescent probe and apply it to screen GSH regulators in Chinese medicine. Methods A GSH-responsive fluorescent probe (HCN) was constructed by coumarin as fluorophore and 2-chloro-5-nitropyrimidine as quench group. The structure of HCN and the feasibility, specificity, and sensitivity of its response to GSH were determined by ultraviolet-visible (UV-Vis), high performance liquid chromatography (HPLC), fluorescence spectrum and nuclear magnetic resonance (NMR) spectrum, so as to ascertain the optimal response conditions. The cytotoxicity and intracellular fluorescence signal of HCN were examined by MTT assay and cell imaging, respectively. Using GSH commercial consumable (NEM) as the positive control, 16 compounds of Xuetong in the ethnic medicine were selected as screening objects. The regulatory ability of the selected compounds on GSH level was checked by HCN, and the reliability of the screening results was further verified by molecular docking method. Results The NMR spectrum showed that HCN was synthesized successfully and could respond to GSH in a linear relationship. The optional temperature and time of reaction of HCN were 37 ℃ and 100 min, respectively. MTT assay showed that, in HepG2 cells, HCN of 80 μmol/mL and 100 μmol/mL lowered the cell viability compared with HCN of 0 μmol/mL (P<0.05), which indicated the influence of HCN on HepG2 cell proliferation. While in HL-7702 cells, HCN with various concentrations has mild effects on cell viability compared with HCN of 0 μmol/mL (P>0.05), which indicated that HCN had no effects on HL-7702 cell proliferation. Cell imaging experiment demonstrated that HCN of various concentrations possessed higher fluorescence intensity compared with HCN of 0 μmol/mL (P<0.05). Schisanlactone B, kadsudilactone, and heteroclitalactone A of Xuetong down-regulated GSH level compared with control in drug screening (P<0.001, P<0.05). Molecular docking results showed that two or more hydrogen bonds were formed by Schisanlactone B, kadsudilactone, and heteroclitalactone A of Xuetong, and GSH, with the binding energies of -3.94, -3.64, and -4.87 kal/mol. Conclusion In this paper, HCN, a GSH-responsive coumarin fluorescent probe, was designed and synthesized. It is featured by good GSH response specificity, sensitivity, light stability and low cytotoxicity, which could help screen GSH regulators of Chinese medicines. This study aimed to provide reference for fluorescence probe technology to screen active ingredients in Chinese medicines.
〔Keywords〕 fluorescent probe; coumarin; glutathione; biological thiols; natural products; Xuetong
谷胱甘肽(glutathione, GSH)作为细胞中最丰富的生物硫醇,1~10 mmol/L的含量在维持人体正常生理活动方面发挥着重要作用。因此,检测体内GSH具有重要意义[1-3]。现有分析方法如高效液相色谱法[4-6]、质谱法[7-9]、荧光探针法[10-12]、电化学法[13]和量热法[14]已被广泛用于GSH水平检测。其中,荧光探针法具有操作方便、成本低和灵敏可视等特点,已成为目前检测GSH的主要手段。GSH是细胞内氧化还原活动、细胞内信号转导和基因调控的重要单位[15],常为疾病诊断和治疗的重要生物标志物。癌症、心脏病和肝损伤等疾病,可能都是由GSH水平异常引起的[16-17]。因此,开发定量检测GSH水平的荧光探针方法具有重要的疾病诊断和治疗意义[18-19]。
荧光探针主要由荧光团、连接基团和识别基团组成,荧光团可用来发射荧光信号,其结构多含有共轭体系,识别基团是荧光探针与分析物特异性识别的位点,连接基团的作用是将荧光团和识别基团连接起来[20]。荧光分子探针检测方法具有选择性高、灵敏度高、肉眼可见、操作简单和成本低等特点,已成为生物学分析、有机合成与代谢和临床诊断的重要手段之一[21]。香豆素的基本结构是苯并吡喃环,为一种内酯化合物,具有荧光量子产率高、斯托克斯位移大和光学性能好等优点[22]。本实验以7-羟基香豆素为荧光基团、2-氯-5-硝基嘧啶为荧光淬灭基团,合成具有GSH识别位点的香豆素型探针HCN。研究通过合成一种开关型荧光探针,从而可视化地对细胞内外GSH的水平变化进行定量检测,并据此快速地筛选具有GSH水平调控能力的中药活性成分,为GSH相关疾病的调控寻找新的候选中药活性分子。
1 材料与方法
1.1 实验试剂
GSH(上海源叶生物科技有限公司,批号:Z17S10C97807);7-羟基香豆素(批号:I1818049)、2-氯-5-硝基嘧啶(批号:G2123334)均购自上海阿拉丁试剂公司;N,N-二甲基甲酰胺(上海麦克林生化科技股份有限公司,批号:C13331861);吡啶(批号:20150930)、二氯甲烷(批号:20220119)、石油醚(批号:20210914)、二甲基亚砜(批号:20220218)均购自国药集团化学试剂有限公司;胎牛血清(批号:SA220415)、DMEM高糖培养基(批号:WH0022D221)、青霉素-链霉素(双抗,100×)(批号:WH0622G181)均购自武汉普诺赛生命科技有限公司;PBS(批号:20221101)、胰蛋白酶(批号:20220501)均购自北京赛文创新科技有限公司。天然产物来自湖南中医药大学中医药名族医药国际联合实验室從血筒叶中分离出来的化合物。
1.2 实验仪器
荧光分光光度计(日本Hitachi公司,型号:F-7000);紫外分光光度计(日本岛津公司,型号:UV-1800);激光扫描共聚焦显微镜(日本奥林巴斯公司,型号:FV1200); NMR光谱(德国Brucker公司,型号:Bruker 600MHz);微孔板检测器(美国PerkinElmer公司,型号:Epire);细胞CO2培养箱、高速冷冻离心机(美国赛默飞公司,型号:HERA CELL 150i、ST 8R);双目倒置相差显微镜(美国尼康公司,型号:TS2R)。
1.3 HCN的合成和表征
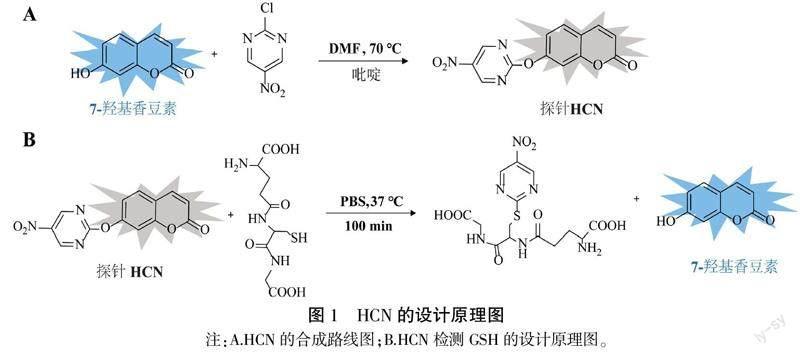
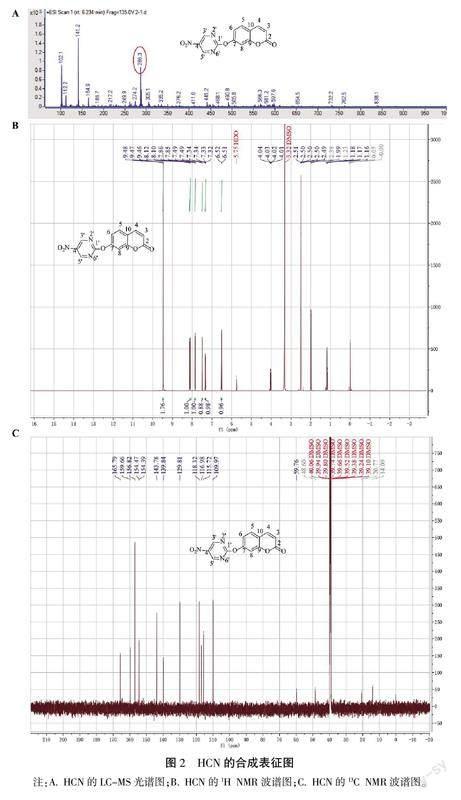
氮气保护下,向250 mL圆底烧瓶中分别加入7-羟基香豆素(10.5 mg)、2-氯-5-硝基嘧啶(28.6 mg)和吡啶(20 μL),加入10 mL无水N,N-二甲基甲酰胺中,在70 ℃下反应7 h。将混合物蒸发,并通过二氯甲烷和石油醚(v/v,10/1)洗脱的硅胶色谱进一步纯化残留物,以获得HCN(白色固体,20.8 mg,53.3%)。HCN的氢谱数据显示有7个氢,分别为δH9.47(s,2H)、8.11(1H,d,J=58 Hz)、7.85(1H,d,J=8.45 Hz)、7.49(1H,d,J=2.23 Hz)、7.33(1H,dd,J=8.46,2.28 Hz)、6.51(1H,d,J=9.61 Hz)。碳谱数据显示有13个碳,分别为δC165.8、159.7、156.8、154.5、154.4、143.8、139.8、129.8、118.3、117.0、115.7、110.0、59.8。液质数据LC-MS m/z[C13H7N3O5+]为286.3。
1.4 HCN的可行性和特异性实验
用去离子水制备GSH(10 mmol/mL)的储存溶液,并稀释至不同浓度。HCN储备液用DMSO/PBS(1/9,v/v)制备,并将储备液用去离子水稀释至终浓度为20 μmol/mL,得到光谱测定溶液。用荧光分光光度计或紫外可见吸收分光光度计记录不同分析物的荧光或紫外吸收光谱。
1.5 MTT实验
HL-7702和HepG2细胞(1×104个/孔)在含有100 μL DMEM培养基(10%胎牛血清、1%链霉素、37 ℃,5% CO2)的96孔板中培养24 h,待细胞密度达到 80%时,弃掉培养基,将含不同浓度HCN的培养基(1%胎牛血清)加入96孔板中进一步孵育48 h。HCN孵育结束后去除培养基,将含有MTT溶液(0.5 mg/mL)的100 μL新鲜DMEM培养基加入每个孔中,再孵育2~4 h。最后,弃掉含有MTT溶液的培养基,加入DMSO(100 μL),并在细胞活力测定前,在黑暗中低速摇动15 min。
1.6 细胞成像
将HepG2细胞(4×104个/孔)接种在铺有爬片的12孔板上,用1 mL DMEM(10%胎牛血清、1%链霉素、37 ℃和5% CO2)培养 24 h,待细胞密度达到80%后,用Mito-Tracker红色染料(200 μL)孵育30 min。随后用恢复至室温的PBS 洗3遍,用不同浓度的HCN(0、40、80、100、200、300、400 μmol/mL)孵育30 min后,用PBS洗3遍,最后用激光扫描共聚焦显微镜进行荧光成像。
1.7 GSH中药调节剂的筛选
在含有200 μL PBS的EP管中依次加入16种血筒化合物(20 μmol/mL)和GSH(100 μmol/mL),室温下反应30 min。隨后加入HCN(20 μmol/mL),在37 ℃下反应30 min。用荧光分光光度计测量荧光强度。激发波长为350 nm,发射范围为 400~550 nm。
1.8 分子对接
研究HCN和血筒化合物(五内酯B、南五内酯、异南内酯A)与GSH之间的潜在结合模式,使用Le Dock.win32软件进行分子对接。通过Chem 3D 20.0将HCN和血筒化合物结构的2D模式转换为3D模式,将HCN和血筒化合物(五内酯B、南五内酯、异南内酯A)结构能量质子化并最小化,以获得稳定的3D结构,并以“moe file”形式保存。从NCBI数据库中下载GSH(PDB代码:1b4q)的氨基酸序列。用LeDock.win32软件进行分子对接。
2 结果
2.1 HCN的检测原理
香豆素类化合物具有荧光强度高、光稳定性强、荧光量子产率高等特点,是一种优良的荧光基团。同时,2-氯-5-硝基嘧啶作为一种经典的荧光淬灭剂,具有稳定可靠的荧光淬灭性能。本实验以7-羟基香豆素为荧光团、2-氯-5-硝基嘧啶为淬灭基团,成功合成了无荧光信号的HCN。HCN可特异性地与GSH反应,释放出荧光基团7-羟基香豆素,实现了荧光信号从无到有的转变。详见图1。
2.2 HCN的表征
为验证HCN是否成功合成,采用质谱对其分子量进行了分析。由图2可见,HCN的分子量为286.3,与计算所得分子量286.2相符。同时,采用核磁技术进一步确证了HCN的结构。从氢谱中可以看出该探针含有7个氢,并且有2个氢化学位移相同,说明这2个氢在嘧啶基团上空间位置相同,且香豆素上的7位羟基与嘧啶上的2位氯发生取代反应。从碳谱可以看出该探针含有13个碳,故氢谱和碳谱数据表明HCN合成成功。
2.3 HCN的可行性和特异性
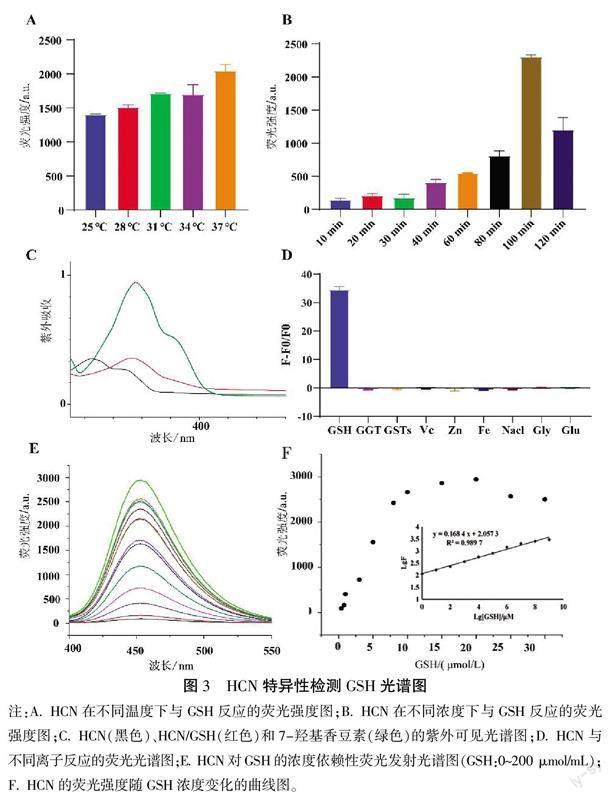
为了研究HCN对GSH的敏感性,研究特定浓度HCN(20 μmol/mL)和GSH(100 μmol/mL)的温度和时间依赖性荧光响应。温度依赖性实验表明在37 ℃时其荧光强度最高,故后续实验在37 ℃下进行(见图3A)。时间依赖性实验中,在刚开始的10~100 min,可以发现其峰值发射强度迅速增加,120 min时达到平台期后开始下降,因此,100 min为HCN与GSH的最佳反应时间(见图3B)。在紫外可见吸收光谱实验中,当HCN的溶液中含有GSH时,其紫外吸收峰和荧光团7-羟基香豆素吸收峰位置相同,而不含GSH的溶液几乎没有紫外吸收,说明HCN与GSH反应后释放的荧光物质为7-羟基香豆素,这与预期结果相符(见图3C)。在离子选择性实验中,HCN与各组分析物反应后,HCN与GSH响应最强,说明HCN可以特异性地响应GSH而不受其他干扰因素的影响(见图3D)。HCN对GSH的浓度依赖性实验中,在不含GSH时,几乎没有荧光发射峰,然而,随着GSH(0~200 μmol/mL)浓度的增加,各发射光谱曲线在450 nm处的发射条带逐渐增强,并与0~200 μmol/mL范围内的GSH浓度具有线性相关性(R2=0.9897)(见图3E、3F)。分子对接结果表明,HCN和GSH通过氢键与GLN-65、ASN-66和ALA-67结合,形成了3个稳定的氢键,其结合能为-6.09 kcal/mol,说明HCN与GSH可以稳定地结合(见图4)。
2.4 HCN细胞毒性和成像
两株细胞分别用不同浓度的HCN孵育48 h后,在HepG2细胞中,与0 μmol/mL相比,80 μmol/mL和100 μmol/mL的HCN降低了细胞活力(P<0.05),对HepG2细胞增殖有影响。在HL-7702细胞中,与0 μmol/mL相比,各浓度的HCN对细胞活力影响微弱(P>0.05),对细胞增殖无影响。细胞成像实验中,与0 μmol/mL相比,各浓度HCN蓝色荧光强度增强(P<0.05),直到浓度达到400 μmol/mL时,荧光强度趋于稳定。详见图5—6。
2.5 GSH中药调节剂的筛选及其分子对接
与control相比,化合物五内酯B、南五内酯和异南内酯A的GSH水平下调(P<0.05),而其他化合物对GSH水平变化的影响微弱(P>0.05)。分子对接结果表明,五内酯B通过氢键与LYS-A:19和GLN-A:57结合,而南五内酯通过氢键与VAL-A:29、TYR-A:24、CYS-A:22和LYS-A:19连接,异南内酯A通过氢键与SER-A:83、GLN-A:57和ARG-A:67连接,各自形成了2个及以上稳定的氢键,其结合能分别为-3.94、-3.64、-4.87 kal/mol。详见表1、图7。
3 讨论
土家族药物血筒[Kadsura heteroclita (Roxb.) Craib]为五味子科(Schisandraceae)南五味子属(Kadsura),是一种常绿攀缘型木质藤本,主要药用部位是茎和果实。目前,已经有较多的文献报道了中药血筒中化学成分的研究,从中药血筒茎中分离并鉴定的化合物主要有木脂素类、三萜类、倍半萜类、黄酮类、甾体类等化学成分[23-26]。药理学研究也表明,中药血筒中分离得到的单体化合物具有抗类风湿关节炎、抗炎、镇痛、保肝、抗HBV、抗HIV和抗癌等药理活性[27]。本实验中筛选的化合物主要是从血筒叶中分离提取得到,除了传统的抗炎和抗癌等药理作用外,血筒化合物五内酯B、南五内酯和异南内酯A 3个三萜化合物可以下调GSH的表达水平。
GSH是含量最多的一種生物硫醇,在维持氧化还原稳态、抵御自由基和毒素方面起着重要作用。本研究成功合成了GSH响应型HCN,其具有高选择性、低细胞毒性和高灵敏度等特点。通过紫外、液相、荧光光谱和细胞成像等实验发现HCN可以灵敏地检测细胞内外GSH表达水平的变化,并通过HCN成功地从血筒化合物中筛选了中药GSH调节剂五内酯B、南五内酯和异南内酯A。综上所述,本文主要以HCN为筛选工具,GSH为筛选靶标,成功获取了能下调GSH水平的中药GSH调节剂,该研究为快速发现中药活性成分提供了新思路。
参考文献
[1] CHEN S, HOU P, SUN J W, et al. A new long-wavelength emission fluorescent probe for imaging biothiols with remarkable Stokes shift[J]. Spectrochimica Acta Part A, Molecular and Biomol?鄄ecular Spectroscopy, 2020, 241: 118655.
[2] SONG Y, ZHOU L Y, WANG J J, et al. Synthesis and application of benzoxazole derivative-based fluorescent probes for naked eye recognition[J]. Luminescence, 2020, 35(7): 1010-1016.
[3] ZHONG Q, CHEN Y, SU A, et al. Synthesis of catalytically active carbon quantum dots and its application for colorimetric detection of glutathione[J]. Sensors and Actuators, 2018, 273: 1098-1102.
[4] LIU S, ANSARI N H, WANG C, et al. A rapid HPLC method for the quantification of GSH and GSSG in ocular lens[J]. Current Eye Research, 1996, 15(7): 726-732.
[5] GIUSTARINI D, DALLE-DONNE I, COLOMBO R, et al. An improved HPLC measurement for GSH and GSSG in human blood[J]. Free Radical Biology & Medicine, 2003, 35(11): 1365-1372.
[6] DI PIETRA A M, GOTTI R, BONAZZI D, et al. HPLC determination of glutathione and L-cysteine in pharmaceuticals after derivatization with ethacrynic acid[J]. Journal of Pharmaceutical and Biomedical Analysis, 1994, 12(1): 91-98.
[7] ZHANG Y F, WANG Y, ZHANG K R, et al. Development and validation of a rapid, robust and sensitive UPLC-QQQ-MS/MS method for simultaneous quantification of GSH metabolism in lung cancer cells[J]. Journal of Chromatography B, 2020, 1148: 122145.
[8] HABERHAUER-TROYER C, DELIC M. Accurate quantification of the redox-sensitive GSH/GSSG ratios in the yeast Pichia pastoris by HILIC-MS/MS[J]. Analytical & Bioanalytical Chemistry, 2013, 405(6): 2031-2039.
[9] HARWOOD D T, KETTLE A J, WINTERBOURN C C. Production of glutathione sulfonamide and dehydroglutathione from GSH by myeloperoxidase-derived oxidants and detection using a novel LC-MS/MS method[J]. The Biochemical Journal, 2006, 399(1): 161-168.
[10] SEDGWICK A C, HAN H H, GARDINER J E, et al. The development of a novel AND logic based fluorescence probe for the detection of peroxynitrite and GSH[J]. Chemical Science, 2018, 9(15): 3672-3676.
[11] LI X Q, HUO F J, YUE Y K, et al. A coumarin-based "off-on" sensor for fluorescence selectivily discriminating GSH from Cys/Hcy and its bioimaging in living cells[J]. Sensors and Actuators B: Chemical, 2017, 253: 42-49.
[12] LIU C, QI F, WEN F, et al. Fluorescence Detection of Glutathione (GSH) and Oxidized Glutathione (GSSG) in Blood with a NIR-Excitable Cyanine Probe[J]. Methods and Applications in Fluorescence, 2017, 25(4): 580-586.
[13] XIE J, CHENG D, LI P, et al. Au/metal-organic framework nanocapsules for electrochemical determination of glutathione[J]. ACS Applied Nano Materials, 2021, 4(5): 4853-4862.
[14] XIANYU Y L, XIE Y Z Y, WANG N X, et al. A dispersion-dominated chromogenic strategy for colorimetric sensing of glutathione at the nanomolar level using gold nanoparticles[J]. Small, 2015, 11(41): 5510-5514.
[15] ZHAI L, SHI Z, TU Y, et al. A dual emission fluorescent probe enables simultaneous detection and discrimination of Cys/Hcy and GSH and its application in cell imaging[J]. Dyes and Pigments, 2019, 165: 164-171.
[16] LI X R, LIU W S, DENG M, et al. Fluorescent glutathione probe based on MnO2-Si quantum dots nanocomposite directly used for intracellular glutathione imaging[J]. Sensors and Actuators B: Chemical, 2018, 255: 1687-1693.
[17] 朱玉辉, 柴 劲. 黄芪补气汤联合还原型谷胱甘肽对肝癌介入治疗后患者肝功能、氧化应激及炎症的影响[J]. 陕西中医, 2021, 42(5): 570-572, 576.
[18] LIU Y, XIANG K, TIAN B, et al. A fluorescein-based fluorescence probe for the fast detection of thiol[J]. Tetrahedron Letters, 2016, 57(23): 2478-2483.
[19] ZHANG J, WANG N, JI X, et al. Recent Progress in BODIPY-based Fluorescent Probes for Biothiols[J]. Chemistry, 2019, 26(19): 4172-4192.
[20] 韩文强. 罗丹明和香豆素类金属离子荧光探针的合成及光谱性能研究[D]. 南昌: 南昌大学, 2017.
[21] 陈祥根. 香豆素类多反应位点的活性硫荧光探针:设计合成与应用[D]. 合肥: 中国科学技术大学, 2022.
[22] 商理超. 用于检测肝细胞肝癌患者GSH水平变化的香豆素荧光探针及其生物成像应用[D]. 泸州: 西南医科大学, 2022.
[23] 李曉光, 罗焕敏. 南五味子属植物化学成分及其活性研究进展[J]. 中国中药杂志, 2003, 28(12): 1120-1125.
[24] 陆晓珊, 胡胜涛, 唐 琳, 等. 血筒化学成分、药理作用及质量控制研究进展[J]. 中成药, 2022, 44(10): 3263-3268.
[25] 苏 维. 血筒氯仿部位的化学成分及其生物活性的研究[D]. 长沙: 湖南中医药大学, 2014.
[26] 罗艺萍, 王素娟, 赵静峰, 等. 异型南五味子的化学成分研究[J]. 云南大学学报(自然科学版), 2009, 31(4): 406-409.
[27] CAO L, SHEHLA N, LI B, et al. Schinortriterpenoids from Tujia ethnomedicine Xuetong-the stems of kadsura heteroclita[J]. Phytochemistry, 2020, 169: 112178.
