脑泰方含药血清对缺氧缺糖/复氧PC12细胞损伤的保护作用
2023-05-29宋洋陈瑶胡立娟王璇葛金文
宋洋 陈瑶 胡立娟 王璇 葛金文
〔摘要〕 目的 探討脑泰方含药血清通过内质网应激相关通路调控缺氧缺糖/复氧PC12细胞凋亡,从而阐明脑泰方对脑缺血再灌注损伤的保护作用机制。方法 将PC12细胞分为正常组(常规培养)、模型组(OGD/R)、抑制剂(4-PBA)组及脑泰方低浓度(10%)、中浓度(15%)、高浓度(20%)组。CCK8法检测细胞活力;采用乳酸脱氢酶(lactate dehydrogenase, LDH)试剂盒检测LDH活性;Hoechst 33258染色观察细胞核形态变化;Tunel染色检测细胞凋亡率;免疫荧光法和Western blot检测细胞Beclin-1、LC3、GRP78、CHOP、PERK蛋白表达情况。结果 模型组LDH活性增加,细胞凋亡率增加,细胞存活率下降(P<0.01),GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白表达明显增加,LC3Ⅰ蛋白表达减少(P<0.05,P<0.01);与模型组比较,抑制剂(4-PBA)组、脑泰方中浓度组、脑泰方高浓度组LDH活性降低,细胞凋亡率减少,细胞存活率明显增加(P<0.05,P<0.01),GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白表达明显降低,LC3Ⅰ蛋白表达明显增加(P<0.05,P<0.01)。结论 脑泰方含药血清可有效抑制缺氧缺糖/复氧PC12细胞的凋亡,调控GRP78/PERK/CHOP信号通路,表明脑泰方可能缓解受损神经细胞内质网应激导致的过度自噬状态,进而抑制细胞凋亡,发挥一定的神经保护作用。
〔关键词〕 脑泰方;脑缺血再灌注损伤;缺氧;缺糖;复氧;内质网应激;自噬
〔中图分类号〕R259 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.05.009
Protective effects of Naotai Formula medicated serum on oxygen-glucose
deprivation/reoxygenation-induced injury of PC12 cells
SONG Yang CHEN Yao HU Lijuan WANG Xuan GE Jinwen
1. The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China; 2. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 3. The Second Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410005, China
〔Abstract〕 Objective To explore the regulation of Naotai Formula medicated serum on the apoptosis of PC12 cells induced by oxygen-glucose deprivation/reoxygenation (OGD/R) through endoplasmic reticulum stress-related pathways, so as to demonstrate the mechanism of Naotai Formula's protective effects on cerebral ischemia-reperfusion injury (CIRI). Methods PC12 cells were divided into normal group (conventional culture), model group (OGD/R), inhibitor (4-PBA) group and low- (10%), medium- (15%) and high- (20%) concentration Naotai Formula groups. CCK8 method was used to examine cell viability; LDH activity was detected by LDH quantification kit. Hoechst 33258 staining was used to observe the nuclear morphological changes and the apoptosis rate was checked by Tunel staining. The expressions of Beclin-1, LC3, GRP78, CHOP and PERK proteins was examined by immunofluorescence method and the Western blot. Results In the model group, the LDH activity of PC12 cells increased, the apoptosis rate increased and the cell survival rate decreased (P<0.01), the expressions of GRP78, PERK, CHOP, LC3Ⅱ, and Beclin-1 were notably elevated, while LC3Ⅰ expression was lower (P<0.05, P<0.01). Compared with the model group, the LDH activity of PC12 cells in the inhibitor (4-PBA) group, the medium- and high- concentration groups of Naotai Formula decreased, the apoptosis rate was lower and the cell survival rate increased significantly (P<0.05, P<0.01). The expressions of GRP78, PERK, CHOP, LC3Ⅱand Beclin-1 proteins were reduced significantly, while the expression of LC3Ⅰ protein increased significantly (P<0.05, P<0.01). Conclusion Naotai Formula medicated serum can effectively inhibit the apoptosis of PC12 cells induced by oxygen-glucose deprivation/reoxygenation and regulate the GRP78/PERK/CHOP signaling pathway. It indicates that Naotai Formula may alleviate the excessive autophagy caused by endoplasmic reticulum stress of the injured nerve cells, and then inhibit the apoptosis of cells, so as to play a certain neuroprotective role.
〔Keywords〕 Naotai Formula; cerebral ischemia-reperfusion injury; oxygen deprivation; glucose deprivation; reoxygenation; endoplasmic reticulum stress; autophagy
缺血性脑卒中(ischemic stroke, IS)是脑卒中最常见的类型,具有高发病率、高死亡率、高致残率等特点[1]。目前,血管内溶栓是治疗IS的主要手段,但当脑缺血责任血管再通后常继发脑缺血再灌注损伤(cerebral ischemia reperfusion injury, CIRI),导致更加严重的脑功能障碍。CIRI发病机制较复杂,主要包括内质网应激(endoplasmic reticulum stress, ERS)、自噬、炎症反应等[2]。研究发现,当CIRI发生时大量未折叠或错误折叠蛋白在内质网(endoplasmic reticulum, ER)中会进一步蓄积,跨膜受体被激活,进一步诱导未折叠蛋白反应(unfolded protein response, UPR)的发生,从而减轻未折叠或错误折叠蛋白的积累[3],然而当UPR不能有效代偿ERS时,会激活促凋亡相关通路,加速细胞的凋亡[4]。因此,抑制ERS或可成为防治CIRI的关键靶点。脑泰方具有补气活血、化瘀通络的功效,对IS气虚血瘀证患者具有良好的临床效果[5]。本研究拟建立缺氧缺糖/复氧(oxygen glucose deprivation/reoxygenation, OGD/R)PC12细胞模型体外模拟CIRI,然后使用不同浓度脑泰方含药血清进行给药培养,检测细胞存活情况及GRP78、CHOP、PERK、Beclin-1、LC3蛋白表达,旨在基于ERS相关通路探讨脑泰方对CIRI脑组织损伤的保护作用机制。
1 材料与方法
1.1 动物与细胞
SPF级雄性SD大鼠8只,体质量180~200 g,湖南中医药大学实验动物中心提供,动物生产许可证号:SYXK(湘)2021-0005。本研究由湖南中医药大学动物实验伦理委员会审核批准,审查号:2021-0086。高分化PC12细胞株购自武汉普诺赛生命科技公司(批号:CM0481)。
1.2 主要试剂与仪器
4-苯基丁酸购自美国MedChemexpress公司(批号:HY-A0281);DMEM培养液、胎牛血清均购自美国Gibco公司(批号分别为19106、8121279);LDH试剂盒购自南京建成生物科技公司(批号:20211218);CCK8检测试剂盒购自北京博奥森生物科技公司(批号:BA08198127);Tunel凋亡试剂盒购自上海碧云天生物技术公司(批号:C1086);兔抗大鼠Beclin-1抗体、兔抗大鼠LC3-B抗体、兔抗大鼠LC3-A抗体、兔抗大鼠GRP78抗体、兔抗大鼠CHOP抗体、兔抗大鼠PERK抗体均购自美国Affinity公司(批号分别为AF-5128、AF-4650、AF-4007、AF-5366、DF-6025、AF-5304);Hoechst 33258购自北京索莱宝科技公司(批号:B8030)。
低速离心机(湖南湘仪实验仪器公司,型号:7DZ5-WS);多功能酶标仪(美国Perkinelmer公司,型号:Enspire);二氧化碳细胞培养箱(美国Thermo公司,型号:HERACE);细胞成像分析系统(广州明美显微仪器公司,型号:MSX2);超高分辨激光共聚焦显微镜(德国Zeiss公司,型号:LSM880)。
1.3 脑泰方含药血清制备
脑泰方由黄芪50 g、川芎12.5 g、地龙18.75 g、僵蚕18.75 g組成。脑泰方浓缩颗粒购自湖南中医药大学第一附属医院药剂科,每100 g生药相当于浓缩颗粒剂8.44 g。溶解于60 ℃双蒸水中,配成终浓度为0.281 g/mL的中药溶液,4 ℃密封保存。8只大鼠适应性喂养1周后,随机分为含药血清组、空白血清组,每组4只,按照人临床用量的等效剂量和动物体表面积[6]计算,含药血清组以0.9 g/kg浓度的脑泰方浓缩颗粒灌胃,每天灌胃2次,持续5 d,空白血清组大鼠予以2 mL生理盐水灌胃。末次灌胃结束1.5 h后,麻醉大鼠,腹主动脉取血,室温静置2 h,以3000 r/min(半径13.5 cm)离心10 min,将同组大鼠血清进行混装,水浴锅56 ℃灭活30 min,然后过滤除菌,分装,于-80 ℃超低温冰箱内保存备用。
1.4 OGD/R PC12细胞损伤模型制备与分组给药
采用1%双抗+10%胎牛血清+89% DMEM的完全培养基培养PC12细胞,每2~3 d传代一次,置于二氧化碳细胞培养箱中培养。取生长状态良好的细胞,PBS洗细胞2遍,0.25%胰蛋白酶消化后,终止,离心,重悬,细胞计数,按2000个/孔接种至96孔细胞培养板中,继续培养24 h后,待细胞密度为70%融合时进行OGD/R模型建立[7],其中缺氧缺糖4 h,复氧18 h,以镜下观察细胞形态发生变化及细胞存活率(CCK8法)小于50%作为模型制备成功的评价指标。将细胞随机分为正常组、模型组、抑制剂组(2 mmol/L的4-PBA)、脑泰方低浓度组(10%含药血清)、脑泰方中浓度组(15%含药血清)、脑泰方高浓度组(20%含药血清)6个组,各组在复氧的同时加入相应浓度的药物或等量培养基处理,继续培养18 h,用于后续实验。
1.5 CCK8法检测细胞活力
取生长状态良好的PC12细胞,0.25%胰蛋白酶消化后,按每孔2000个细胞接种于96孔细胞培养板,后续造模与给药步骤同“1.4”。弃掉孔内液体,然后加入完全培养基200 μL,同时每孔加入20 μL的CCK8溶液,于细胞培养箱中继续培养3~4 h,最后用酶标仪于450 nm波长下测定各孔光密度(optical density, OD)值,并计算各组药物的细胞存活率。
1.6 细胞乳酸脱氢酶(lactate dehydrogenase, LDH)活性检测
按上述方法造模并分组给药培养后,收集各组细胞上清液,以1500 r/min(半径13.5 cm)离心15 min,严格参照试剂盒说明书,采用LDH试剂盒检测各组LDH活性,主要步骤严格参照试剂盒说明书。
LDH活性(U/L)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度×稀释倍数×1000。
1.7 Hoechst 33258染色观察细胞核形态改变
取生长状态良好的PC12细胞,0.25%胰蛋白酶消化后,调整细胞密度,按每孔2000个细胞接种于黑色96孔细胞培养板,静置培养24 h,后续造模与给药步骤同“1.4”。弃掉孔内液体,PBS洗2次,加入Hoechst 33258工作液,室温避光孵育15 min,PBS洗3次,激光共聚焦显微镜下观察细胞凋亡情况。
1.8 Tunel染色检测细胞凋亡率
取生长状态良好的PC12细胞,0.25%胰蛋白酶消化后,调整细胞密度,按每孔10 000个细胞接种于黑色24孔细胞培养板,静置培养24 h,后续造模与给药步骤同“1.4”。弃掉孔内液体,PBS洗2次,经4%多聚甲醛固定30 min、0.25% Triton X-100处理10 min及3% H2O2作用2 min后,PBS洗3次;加入预先配制的Tunel反应混合液(50 μL TdT+450 μL荧光素标记的dUTP),37 ℃湿盒避光孵育1 h,弃掉孔内液体,PBS洗3次;加入DAPI工作液(1∶800),室温避光孵育15 min,PBS洗3次,激光共聚焦显微镜下观察细胞凋亡情况,随机选取5个视野,根据凋亡阳性细胞数/DAPI阳性细胞数的比值计算细胞凋亡率。
1.9 免疫荧光法检测细胞Beclin-1、LC3、GRP78、CHOP、PERK蛋白表达
取生长状态良好的PC12细胞,0.25%胰蛋白酶消化后,按每孔2000个细胞接种于96孔细胞培养板,后续造模与给药步骤同“1.4”。弃掉孔内液体,PBS洗2次,经4%多聚甲醛固定30 min、0.25% TritonX-100处理15 min及5% BSA封闭30 min后,PBS洗3次;加入兔抗大鼠Beclin-1、LC3-A、LC3-B、GRP78、CHOP或PERK一抗工作液(1∶100或1∶200),4 ℃避光孵育过夜,弃掉孔内液体,PBS洗5次;加入FITC标记的山羊抗兔二抗工作液(1∶400),37 ℃避光孵育30 min,弃掉孔内液体,PBS洗4次;加入DAPI工作液(1∶800),室温避光孵育15 min,PBS洗3次,最后于激光共聚焦显微镜下进行荧光检测。
1.10 Western blot检测细胞Beclin-1、LC3、GRP78、CHOP、PERK蛋白表达
PC12细胞经0.25%胰蛋白酶消化后,按每孔50 000个细胞接种于6孔细胞培养板,静置培养24 h,后续造模及分组给药同“1.4”。加入含1%蛋白酶抑制剂PMSF的RIPA细胞裂解液,于冰上裂解30 min,以12 000 r/min(半径13.5 cm)离心15 min,取上清,-80 ℃冰箱内保存、备用。BCA法蛋白定量。适量蛋白样品进行电泳分离,5%浓缩胶60 V,10%分离胶90 V;然后湿转90 min,电流300 mA,5%脱脂牛奶封闭1 h,加一抗(1∶1000),4 ℃摇床过夜。次日,TBST漂洗3次,二抗(1∶5000)室温孵育60 min,TBST漂洗3次,添加ECL发光液暗室曝片。用ImageJv1.8.0软件分析各条带灰度值,统计各组与β-actin灰度值的比值。
1.11 统计学方法
使用SPSS 23.0统计软件进行数据处理。实验数据均以“x±s”表示,组间数据比较采用ANOVA方差分析,方差齐用LSD法,方差不齐用Dunnett's T3作组间多重比较。以P<0.05为差异具有统计学意义。
2 结果
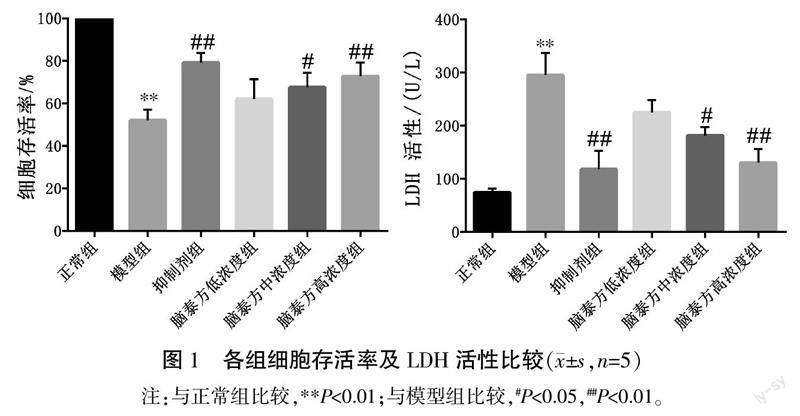
2.1 各组PC12细胞存活率及LDH活性
与正常组比较,模型组LDH活性明显升高(P<0.01),细胞存活率明显降低(P<0.01)。与模型组比较,抑制剂组、脑泰方中浓度组、脑泰方高浓度组LDH活性明显降低(P<0.05,P<0.01),细胞存活率明显升高(P<0.05,P<0.01)。详见图1。
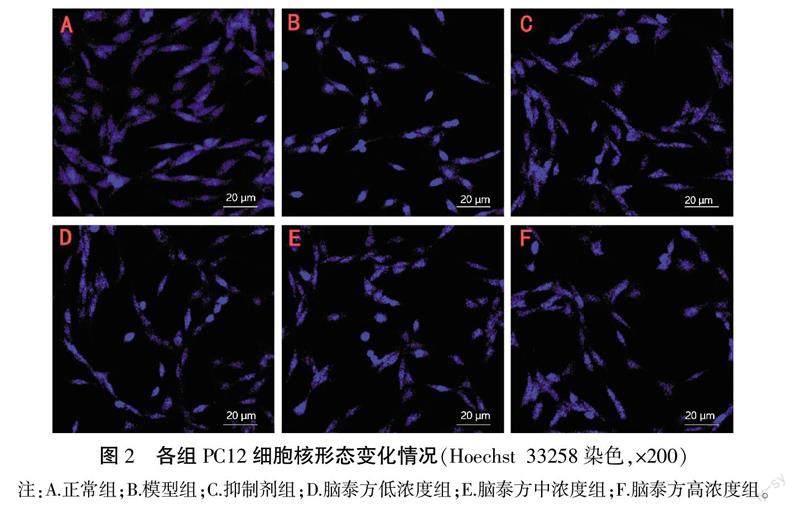
2.2 各组PC12细胞核形态改变
模型组细胞凋亡数明显增加,凋亡细胞核聚集,染色质浓染,呈马蹄形或月牙状的典型凋亡特征;抑制剂组、脑泰方中浓度组、脑泰方高浓度组均能显著抑制PC12细胞凋亡,染色质浓染、细胞核固缩现象减轻,凋亡細胞数明显减少,提示其能有效抑制OGD/R造模损伤后的PC12细胞凋亡,并改善细胞凋亡状态。详见图2。
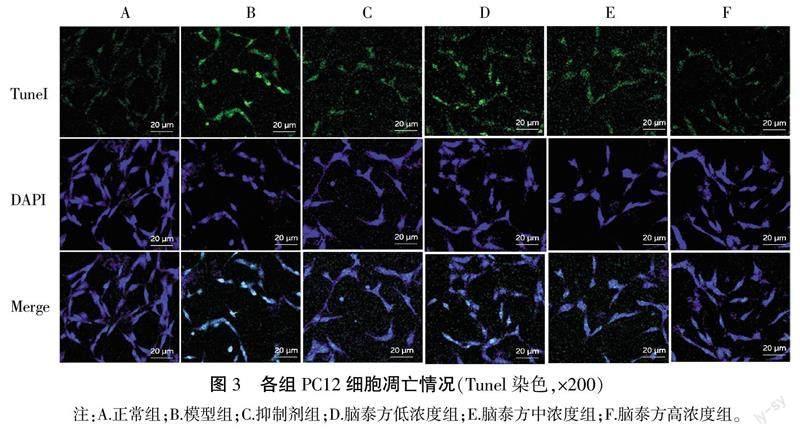
2.3 各组PC12细胞凋亡率比较
与正常组比较,模型组细胞凋亡率明显升高(P<0.01)。与模型组比较,抑制剂组、脑泰方中浓度组、脑泰方高浓度组细胞凋亡率明显降低(P<0.05,P<0.01)。详见图3—4。
2.4 各组PC12细胞Beclin-1、LC3、GRP78、CHOP、PERK蛋白表达情况
与正常组比较,模型组GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白表达明显升高(P<0.01),LC3Ⅰ蛋白表达明显降低(P<0.01)。与模型组比较,脑泰方中浓度组、脑泰方高浓度组GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白表达明显降低(P<0.05,P<0.01),LC3Ⅰ蛋白表达明显升高(P<0.01);抑制剂组GRP78、CHOP、LC3Ⅱ、Beclin-1蛋白表达明显降低(P<0.05,P<0.01),LC3Ⅰ蛋白表达明显升高(P<0.01);脑泰方低浓度组LC3Ⅱ蛋白表达明显降低(P<0.05),LC3Ⅰ蛋白表达明显升高(P<0.05)。详见图5—6。
2.5 各组PC12细胞内GRP78、PERK、CHOP、LC3、Beclin-1蛋白相对表达情况
与正常组比较,模型组GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白相对表达水平明显升高(P<0.01),LC3Ⅰ蛋白相对表达水平明显降低(P<0.01)。与模型组比较,抑制剂组和脑泰方高浓度组GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白相对表达水平明显降低(P<0.05,P<0.01),LC3Ⅰ蛋白表达量明显升高(P<0.01);脑泰方中浓度组PERK、CHOP、LC3Ⅱ蛋白相对表达水平明显降低(P<0.05),LC3Ⅰ蛋白相对表达水平明显升高(P<0.01)。详见图7—8。
3 讨论
IS可归属于中医学“中风”“仆击”“偏枯”等疾病范畴。素体气血亏虚,正气渐衰,或情志饮食失调、长期劳逸失度等导致机体阴阳失调,脏腑功能紊乱,气血运行失常,后由风、火、痰、瘀、虚五端相互交作引触,遂发中风[8]。清代名医王清任在《医林改错》中提出中风之气虚血瘀理论,认为中风是由于元气亏虚导致血液运行不畅而为瘀,强调在治疗中风时须补气药与活血药合用,并创益气活血之代表方“补阳还五汤”,为后世医家治疗中风提供了新的方向[9]。脑泰方正是根据中风之气虚血瘀理论创制,由黄芪、川芎、地龙、僵蚕4味药组成,方中重用黄芪为君,取其补气以行气、补气以养血活血之意;川芎“血中之气药”为臣,可活血行气,祛内外之邪风;地龙性善走窜,长于通络,与黄芪、川芎之品合用,大大增强行气活血通络之功效;僵蚕长于祛外风、息内风,还可化痰散结,具有祛风化痰通络之功效。全方药简而力宏,共奏补气活血、化瘀通络之功效。脑泰方是葛金文教授课题组研发的专利处方(专利号:ZL201110178359.4),临床试验表明脑泰方对于脑卒中气虚血瘀证患者具有良好的临床效果,目前已成熟运用于临床[10]。课题组前期实验研究发现,脑泰方可有效抑制CIRI大鼠病灶内神经细胞的凋亡,调控神经细胞内铁死亡,减少铁沉积,促进神经功能恢复;脑泰方含药血清对血红蛋白刺激的大鼠皮质神经元细胞也表现出明显的保护作用,其机制可能与增强SOD酶、GPX4等抗氧化因子的活性,进而提高神经细胞抗氧化能力有关[11-14]。
ER是细胞质内重要的细胞器,主要参与蛋白质的合成、加工与修饰,大多数膜脂的合成、细胞内重要信号物质Ga2+的储存以及重要激素的合成等多种生理活动与ER关系同样密切[15]。当CIRI引起脑组织损伤时,神经细胞内ER平衡状态被打破,大量未折叠/错误折叠的蛋白在ER囊腔内蓄积,引发ERS,进一步代偿性激活UPR,减少蛋白质的合成,清除未折叠/错误折叠蛋白以缓解ERS状态[16],但是当ERS时间及强度超过UPR承载范围后,则会激活下游凋亡信号通路,促使细胞发生凋亡。GRP78是ERS发生的标志性效应蛋白,在正常生理状态下,GRP78主要与ER的应激下游受体PERK、ATF6和IRE1相结合,以保持它们处于失活状态,当ERS发生时,GRP78则与之发生解离,导致GRP78含量增加。罗书萍等[17]研究发现,CIRI模型组大鼠脑内缺血半暗带区GRP78 mRMA表达明显增加,并且随着灌注时间的延长不断增加,在12 h达到高峰,24 h后表达才开始减少。PERK是ER中重要的跨膜感受蛋白之一,在过度ERS状态下,GRP78与PERK解离,PERK通过同源二聚化或自身磷酸化而自我激活,最终激活CHOP基因转录,从而进一步介导细胞凋亡[18]。细胞自噬与凋亡关系非常密切且复杂,自噬可以增强或抑制凋亡的发生,这主要取决于刺激强度和时间,而凋亡相关信号通路的某些部分又可与自噬蛋白相互作用而影响自噬的发生[19]。Beclin-1蛋白是细胞自噬过程中重要的调节蛋白,同时对细胞凋亡也起着至关重要的作用[20]。吕栋辉等[21]研究发现,CIRI大鼠LC3Ⅱ、Beclin-1蛋白及mRNA表达明显增加,经过药物干预之后,其表达均明显下降,其机制可能是通过干预CIRI的神经细胞自噬发挥神经保护作用。LC3Ⅱ是检测细胞自噬发生的标志蛋白,LC3前体合成后,通过自噬相关蛋白4水解形成LC3Ⅰ,LC3Ⅰ继续被其他自噬相关蛋白片段激活与磷脂酰乙醇胺共价结合形成LC3Ⅱ,最后被转移结合至自噬体膜上,而LC3Ⅰ/LC3Ⅱ比值升高则说明细胞的自噬活性增强[22-23]。
本研究采用OGD/R PC12细胞是目前最理想的体外模拟CIRI损伤的模型[24-25]。此次研究结果显示,模型组细胞内LDH活性增加,细胞凋亡率增加,存活率下降,GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白表达增加,LC3Ⅰ蛋白表達减少,提示经过OGD/R损伤的PC12细胞发生明显凋亡,其机制可能与ERS导致细胞发生凋亡有关,与前人研究结果一致[26]。进一步研究发现,脑泰方含药血清可降低OGD/R损伤的PC12细胞内LDH活性,降低细胞凋亡率,负向调控GRP78、PERK、CHOP、LC3Ⅱ、Beclin-1蛋白的表达,且15%及20%浓度的脑泰方含药血清效果可能更优,表明脑泰方可有效缓解受损神经细胞ERS导致的过度自噬状态,进而抑制细胞凋亡,发挥神经保护作用。
参考文献
[1] 倪小佳, 蔡业峰, 陈耀龙, 等. 中西医结合脑卒中循证实践指南(2019)[J]. 中国循证医学杂志, 2020, 20(8): 901-912.
[2] KURIAKOSE D, XIAO Z C. Pathophysiology and treatment of stroke: Present status and future perspectives[J]. International Journal of Molecular Sciences, 2020, 21(20): 7609.
[3] XU D D, KONG T T, CHENG B H, et al. Orexin-a alleviates cerebral ischemia-reperfusion injury by inhibiting endoplasmic reticulum stress-mediated apoptosis[J]. Molecular Medicine Reports, 2021, 23(4): 266.
[4] ZHU Y, YU J B, GONG J B, et al. PTP1B inhibitor alleviates deleterious microglial activation and neuronal injury after ischemic stroke by modulating the ER stress-autophagy axis via PERK signaling in microglia[J]. Aging, 2021, 13(3): 3405-3427.
[5] 贺运河, 葛金文, 成战鹰, 等. 脑泰方对气虚血瘀型脑梗死患者血浆TXB2、6-Keto-PGF1α及血清TNF-α含量的影响[J]. 中国中医药信息杂志, 2002, 9(4): 16-17.
[6] 黄继汉, 黄晓晖, 陈志扬, 等. 药理试验中动物间和动物与人体间的等效剂量换算[J]. 中国临床药理学与治疗学, 2004, 9(9): 1069-1072.
[7] YANG Z J, WANG L, HU Y J, et al. Butorphanol protects PC12 cells against OGD/R-induced inflammation and apoptosis[J]. Molecular Medicine Reports, 2020, 22(3): 1969-1975.
[8] 赵 欣, 周 明. 中医药治疗缺血性中风的研究进展[J]. 医学综述, 2021, 27(22): 4548-4552.
[9] 柳 娇. 刘完素与王清任论治中风病学术思想的比较[J]. 中国中医药现代远程教育, 2021, 19(21): 144-146.
[10] 贺 旭, 宋祯彦, 王珊珊, 等. 脑泰方治疗脑卒中的研究进展[J]. 中国组织化学与细胞化学杂志, 2021, 30(4): 387-391, 400.
[11] 饶政清, 梅志刚, 葛金文, 等. 脑泰方调控细胞铁转运抑制铁死亡保护脑卒中缺血损伤的机制研究[J]. 中草药, 2021, 52(21): 6552-6560.
[12] 易亚乔, 刘 检, 刘 林, 等. 基于SIRT1介导的凋亡相关信号通路探讨加味脑泰方对缺氧/复氧损伤海马神经元的保护作用[J]. 中华中医药杂志, 2019, 34(10): 4516-4522.
[13] 石詠梅, 马英民, 廖 君, 等. 内质网应激PERK通路在脑泰方提取物保护局灶性脑缺血大鼠海马神经元中的作用[J]. 中国老年学杂志, 2017, 37(22): 5512-5515.
[14] LIAO J, XIA X, WANG G Z, et al. Naotaifang extract treatment results in increased ferroportin expression in the hippocampus of rats subjected to cerebral ischemia[J]. Molecular Medicine Reports, 2015, 11(6): 4047-4052.
[15] 吴欣怡, 刘长安, 龚建平, 等. 内质网应激介导细胞凋亡及免疫炎症反应的研究进展[J]. 国际免疫学杂志, 2022, 45(1): 69-73.
[16] 白 波, 李东芳, 王美琴, 等. 内质网应激在高血糖加重脑缺血再灌注损伤中的研究进展[J]. 脑与神经疾病杂志, 2020, 28(6): 384-386.
[17] 罗书萍, 方雅玲, 常小娜, 等. 栝楼桂枝颗粒对脑缺血再灌注损伤模型大鼠缺血区脑组织内质网应激及细胞凋亡的影响[J]. 中医杂志, 2022, 63(1): 72-77.
[18] 沈 雁, 倪思忆, 郑华君, 等. 甘草泻心汤调控PERK-elF2α-CHOP信号通路保护溃疡性结肠炎肠黏膜屏障的机制[J]. 中华中医药杂志, 2021, 36(5): 2657-2663.
[19] 张 杨, 孙弯弯, 陆丽丹, 等. 细胞自噬与凋亡相互作用分子机制的研究进展[J]. 基础医学与临床, 2021, 41(9): 1342-1346.
[20] TRAN S, FAIRLIE W D, LEE E F. BECLIN1: Protein structure, function and regulation[J]. Cells, 2021, 10(6): 1522.
[21] 吕栋辉, 安方玉, 颜春鲁, 等. 中风胶囊对脑缺血/再灌注损伤模型鼠脑组织自噬相关蛋白表达的影响[J]. 中国应用生理学杂志, 2022, 38(1): 25-31.
[22] MO Y, SUN Y Y, LIU K Y. Autophagy and inflammation in ischemic stroke[J]. Neural Regeneration Research, 2020, 15(8): 1388-1396.
[23] 丁 宇, 王彦丰, 左夏林, 等. 人类细胞自噬研究的起源及细胞自噬的分子机制[J]. 国际老年医学杂志, 2022, 43(1): 98-101, 114.
[24] 胡艳红, 雷洪涛, 王淑艳, 等. 缺血再灌注损伤脑微血管内皮细胞Necroptosis模型的建立[J]. 世界中医药, 2017, 12(4): 879-883.
[25] MA H X, HOU F, CHEN A L, et al. Mu-Xiang-You-Fang protects PC12 cells against OGD/R-induced autophagy via the AMPK/mTOR signaling pathway[J]. Journal of Ethnopharmacology, 2020, 252: 112583.
[26] 郑 菊, 刘雨霞, 张文萍, 等. PC12细胞氧糖剥夺不同时间段再灌注后内质网应激及细胞凋亡[J]. 中国老年学杂志, 2020, 40(6): 1297-1301.
