基于电子鼻和高光谱成像技术的冷鲜牛肉微生物的生长模型构建
2023-05-29刘小花周彬静彭菁屠康吴菊清徐静武杰潘磊庆
刘小花,周彬静,彭菁,屠康,吴菊清,徐静,武杰*,潘磊庆*
(1.南京农业大学食品科学技术学院,江苏 南京 210095;2.蚌埠学院食品与生物工程学院,安徽 蚌埠 233030)
牛肉是我国仅次于猪肉的第二大消耗肉品,冷鲜牛肉更是凭借肉质鲜嫩多汁、低脂低胆固醇、高营养价值等优势成为肉品消费界的新星[1]。通常,冷鲜牛肉一直贮藏于0~4 ℃的低温环境,大部分微生物的生长繁殖受到抑制。但我国冷链系统不完善仍可能造成微生物的大量繁殖[2],引起冷鲜牛肉腐败变质。实际上,微生物是造成冷鲜肉腐败最直接最主要的原因。根据肉品卫生标准,新鲜肉的菌落总数低于 104CFU·g-1,次新鲜肉为104~106CFU·g-1,变质肉高于106CFU·g-1,而Borch等[3]认为当肉中的菌落数量为107~109CFU·g-1时,肉就开始腐败。因此,监测冷鲜牛肉贮藏过程中微生物数量的变化,模拟微生物的生长曲线对肉品质量和公共卫生安全控制具有重要而深远的意义。
预测微生物学结合传统平板计数法是微生物生长曲线拟合的常用方法。平板计数法是微生物测定的黄金法则[4],PCR及免疫学检测也是常见的食品微生物检测方法。平板计数法用于微生物检测的耗时较长、效率较低;PCR属于分子生物学方法,快速、灵敏、特异性强,但成本及技术水平要求较高;免疫学检测法经济实用、重现性好、灵敏度和特异性强,但无法用于在线监测[5-6],难以满足现代工业化、自动化、精细化生产的需求。因此,探索简单有效的快速无损检测技术在微生物生长曲线拟合方面的适用性,有望实现食品工业生产中微生物的在线监测。
电子鼻和高光谱成像技术(hyperspectral imaging technique,HSI)是常见的典型无损检测技术,可分别从肉类腐败过程中产生的挥发性物质(即气味)和肉类表面固有物理化学属性2个层面无损快速获取微生物信息。电子鼻技术通过感知微生物产生的挥发性化学物质可快速鉴别和检测食品微生物,已广泛应用于各种食品场景,如过程监控、新鲜度评估、保质期调查、掺假鉴定和产品可追溯性[7-8]。Ye等[9]使用电子鼻评估了牛肉新鲜度;Li等[10]通过电子鼻定量预测了猪肉中的菌落总数。HSI集成了成像和光谱技术,在微生物代谢物提供特征指纹的前提下,被广泛用于肉类微生物检测。如,Duan等[11]及Khoshnoudi-Nia等[12]基于HSI成功检测了羊肉及鱼肉中的菌落总数。单一的检测技术在获取多性状信息方面具有一定局限性,可能无法准确评估肉类新鲜度,如电子鼻技术忽略了食品固有特性,HSI则无法描述肉类气味特征。已有研究聚焦于将电子鼻和HSI结合以获取更全面的信息,提高食品质量评价的准确性。Liu等[13]使用电子鼻和HSI检测了羊肉新鲜度;Aheto等[14]则采用电子鼻和HSI检测猪肉的肌内脂肪和过氧化值。目前,国内外基于电子鼻和HSI的研究主要集中在肉类新鲜度评价及微生物预测,本文侧重于探索电子鼻和HSI在微生物生长拟合上的适用性。
基于此,本研究测定冷鲜牛肉冷藏过程中的菌落总数,并采集其电子鼻和HSI数据,通过与传统平板计数法所建生长模型比较,探讨电子鼻和HSI特征信息在拟合冷鲜牛肉中微生物生长曲线上的适用性,旨在为无损检测技术在微生物生长拟合的应用提供理论和技术支持。
1 材料与方法
1.1 材料与仪器
新鲜牛肉(牛背最长肌)购于南京苏果超市。平板计数琼脂培养基购于青岛海博科技有限公司。
BD-HWS型恒温培养箱购于南京贝蒂实验仪器有限公司;PEN 3便携式电子鼻购于德国AIRSENSE公司;可见-近红外高光谱成像系统主要由Im Spector V10E型光谱成像仪(芬兰Specim公司)、ICLB1620CCD相机(美国Imperx公司)、IT3900ER 150W卤素光源(美国Illumination Technologies公司)、高光谱分析软件(五铃光学股份有限公司)等组成。
1.2 试验方法
1.2.1 样品处理将冷鲜牛肉置于装有冰袋的泡沫盒中,15 min内运至实验室进行处理。在超净台上剔除脂肪、筋膜后,将其分割成4 cm×4 cm×1 cm的牛肉块(约30 g)。制备好的样本贮藏于(4±1) ℃恒温培养箱中,每天采集10个样本的电子鼻和高光谱数据,并测定菌落总数,共计12 d(包括0 d),获得120个样本数据。
1.2.2 电子鼻数据采集采用顾欣哲[15]的方法并略有改动。试验前,打开电子鼻仪器预热30 min。将牛肉样本放入250 mL玻璃烧杯中,室温下用锡箔纸密封,顶空15 min,采集电子鼻数据。试验参数如下:进样时间为45 s,洗气时间为120 s,调零时间和样本准备时间均为5 s,流速为300 mL·min-1。
1.2.3 高光谱数据采集与校正采用戈永慧等[16]的方法并略有改动。高光谱成像系统光谱分辨率为 2.8 nm,有效波段范围为400~1 000 nm,共420个波段,数据采集模式为反射。通过预试验,高光谱数据采集参数设置如下:光源为90 W的卤素灯,曝光时间为2.5 ms,输送速度为7.23 mm·s-1。
为消除相机暗流和光源强度等造成的不良影响,对原始图像进行黑白校正。校正方法为:采集聚四氟乙烯白板(反射率99.9%)获得全白反射图像,盖住相机镜头以获得全黑反射图像,再通过公式(1)[17]获得校正后图像。
(1)
式中:Ical为校正后图像;Iraw为原始图像;Iwhite为全白反射图像;Idark为全黑反射图像。
1.2.4 菌落总数(TVC)测定参照《食品安全国家标准 食品微生物学检验 菌落总数测:GB 4789.2—2016》,并略有修改。无菌环境下,取5 g牛肉置于无菌均质袋,加入45 mL 8.5 g·L-1无菌生理盐水,均质器拍打2 min,10倍梯度稀释。选择2个合适梯度,取100 μL稀释液涂布于平板计数琼脂培养基,(36±1) ℃恒温培养(48±1)h后计数。
1.3 数据处理
1.3.1 电子鼻数据处理记录样本对应的10个传感器信号响应值,传感器响应值为相对电导率(G/G0),其值越偏离1,表明气体浓度越大。电子鼻信号通过Origin 2021b软件(OriginLab公司)进行主成分分析(PCA),获得前3个主成分(PC)得分的加权平均值[公式(2),方法ⅰ];并经Pearson相关性分析获取与菌落总数相关性最强的传感器,提取特征传感器的响应值(方法ⅱ),基于上述获取的特征信息用于微生物的生长拟合。
(2)
式中:PC为前3个主成分得分的加权平均值;PC1、PC2和PC3分别为第1、第2和第3主成分的得分值;a、b和c分别为第1、第2和第3主成分的方差贡献率。

1.4 数学模型
本文采用的生长模型为修正的Gompertz[公式(3)]、Logistic[公式(4)]、Huang[公式(5)和(6)]以及Baranyi模型[公式(7)和(8)]。
(3)
(4)
N(t)=N0+Nmax-ln[eN0+(eNmax-eN0)×e-μmax×B(t)]
(5)
(6)
(7)
(8)
式中:Y0、Y(t)和Ymax分别为初始、t时刻及最大细菌浓度,lg(CFU·g-1);N0、N(t)和Nmax分别为初始、t时刻及最大细菌浓度,ln(CFU·g-1)[为便于模型比较,数据被转换成lg(CFU·g-1)];μmax为最大比生长速率,h-1;λ为迟滞期,h;t为时间,h。
1.5 模型评价与验证
采用均方根误差(RMSE)、决定系数(R2)和赤池信息准则(AIC)评价模型性能与可靠性[公式(9)—(11)]。RMSE反映模型误差大小,其越接近0,模型准确度越高;R2越接近1,模型回归性能越好;AIC越小,模型拟合效果越好。模型验证数据来自重复进行的上述冷藏试验,通过准确因子(Af)[公式(12)]、偏差因子(Bf)[公式(13)]及残差分布图评价模型验证结果[18-19],Af表示实际值与预测值的平均误差,Bf表示预测值对实测值的评估是否过低或过高,残差分布图则用于反映模型系统偏差。
(9)
(10)
(11)
(12)
(13)
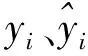
2 结果与分析
2.1 基于传统平板计数法的冷鲜牛肉中微生物生长曲线拟合
由图1可见:微生物生长的延滞期不明显,其数量随时间呈上升趋势,约168 h后趋于平稳。基于修正的Gompertz、Logistic、Huang和Baranyi模型拟合冷鲜牛肉中微生物生长的效果良好,菌落总数(TVC)实测值在各生长曲线上下小范围波动。
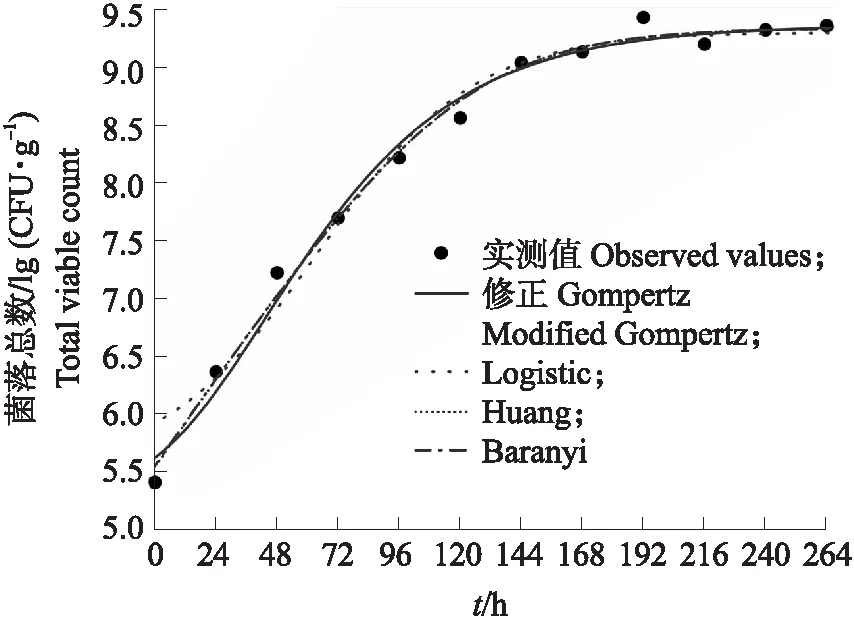
图1 基于平板计数法拟合的冷鲜牛肉中微生物的生长曲线Fig.1 Growth curves of microorganisms in chilledbeef by the plate count method
由表1可见:4个生长模型估计的初始菌落数约为5.50 lg(CFU·g-1),最大菌落数平均约为9.33 lg(CFU·g-1),μmax约为0.033 h-1。迟滞期λ很难预测[20],不同预测模型得到的λ不同。Logistic模型的λ约为64.21 h,其余模型的λ约为0.30 h,差别较大。总体而言,4个模型的RMSE为0.128~0.227 lg(CFU·g-1),R2为0.976~0.993,都能很好地模拟冷鲜牛肉中微生物的生长。Huang模型和Baranyi模型的AIC最小,修正Gompertz模型次之,Logistic模型不仅AIC最大,λ估计值较大,且R2较其他三者而言最小。Huang模型和Baranyi模型虽均为机理模型,但拟合效果近乎相同,难以区分最佳模型,故均被用于后续基于电子鼻和高光谱成像技术的冷鲜牛肉中微生物的生长曲线拟合。
2.2 基于电子鼻技术的冷鲜牛肉中微生物生长曲线拟合
由图2可见:传感器S6、S7、S9和S10响应值较大,可能是由于牛肉中蛋白质、不饱和脂肪酸和碳水化合物被氧化分解,释放出NO2、H2S、H2和CH4等挥发性物质造成的[13]。表明电子鼻可以检测牛肉变质过程产生的挥发性物质,从而间接表征微生物数量,尤其是传感器S6、S7、S9和S10,其响应值在0~10 s变化迅速,30~40 s趋于平稳。故将第35秒的传感器响应值用于进一步的数据分析。
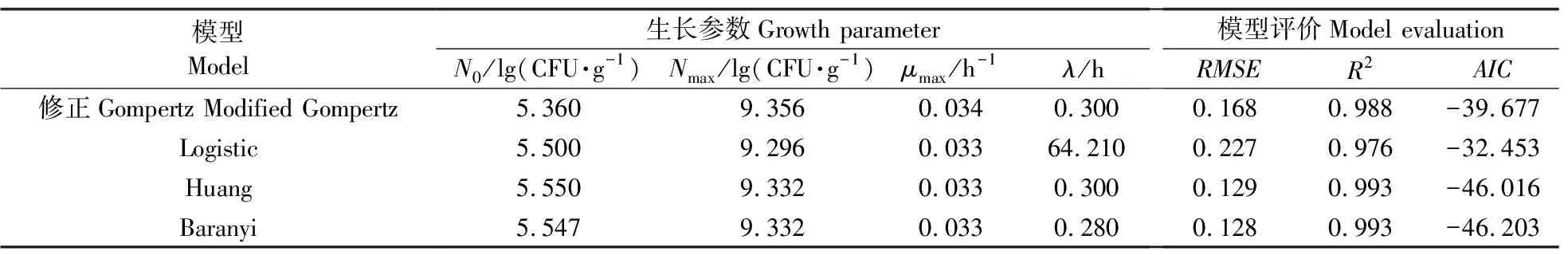
表1 基于平板计数法的冷鲜牛肉中微生物动力学参数及模型评价Table 1 Kinetic parameters and model evaluation of the microbes in chilled beef by the plate count method

图2 冷鲜牛肉贮藏72 h时10个电子鼻传感器(S1—S10)的响应值Fig.2 Response values of 10 E-nose sensors(S1-S10)when chilled beef was stored for 72 hG/G0表示传感器响应值,下同。G/G0 indicates sensor response values,the same below.
对10个传感器进行主成分分析(PCA),得出前3个主成分(PC1、PC2和PC3)的方差贡献率分别为67.7%、17.2%和5.7%,累计方差贡献率为90.6%,可代表牛肉样本大部分的电子鼻信息。将PC1、PC2和PC3的加权平均数(PC)用于冷鲜牛肉中微生物的生长拟合(方法ⅰ)。由图3可见:传感器S7、S9和S10与TVC之间的相关系数分别为 0.85、0.86和0.93,具有显著相关性。方法ⅱ选择相关性最强的传感器S10的响应值(G/G0)作为冷鲜牛肉微生物生长拟合的输入值。
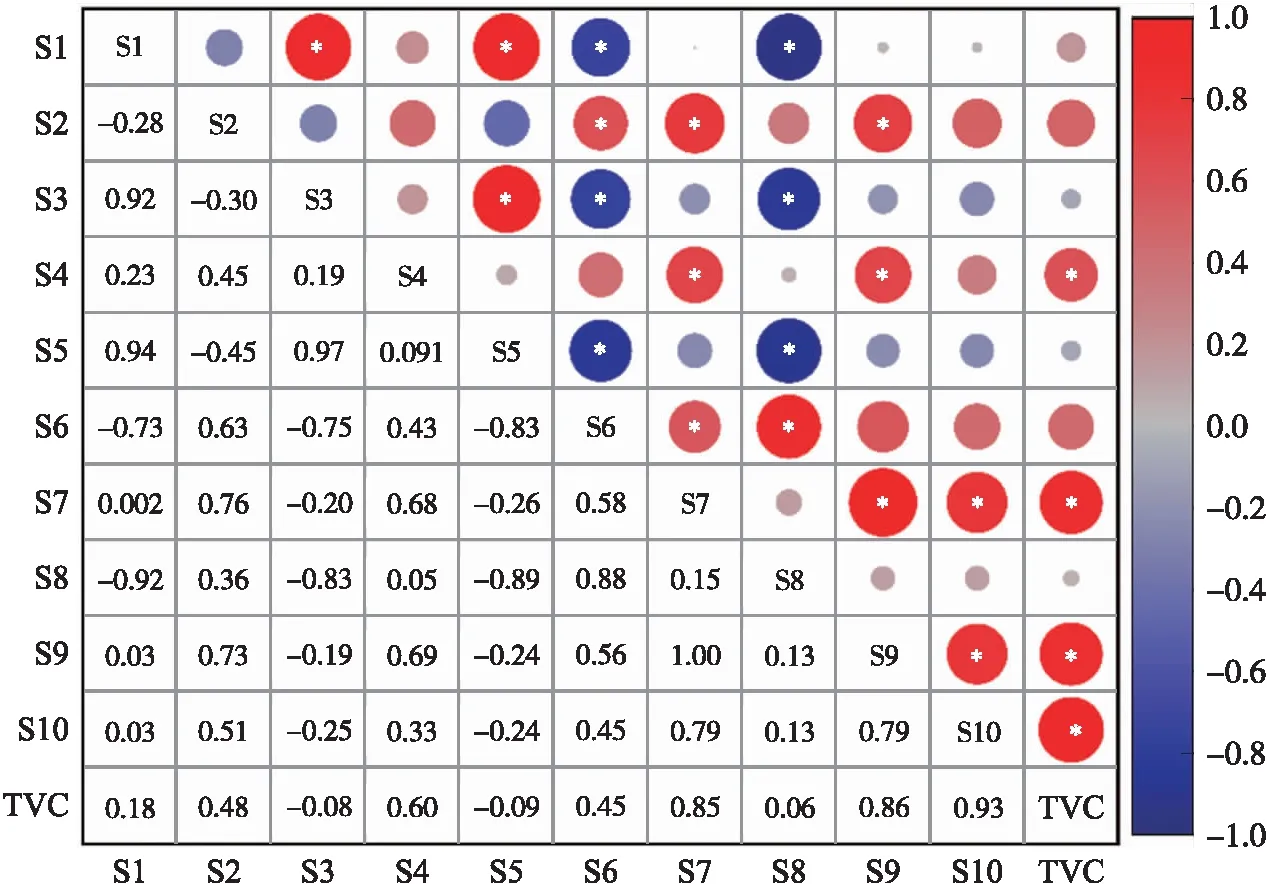
图3 冷鲜牛肉贮藏过程中电子鼻响应值与菌落总数(TVC)之间的相关性分析Fig.3 Correlation analysis between E-nose response values and total viable count(TVC)during storage of the chilled beef*P<0.05.
由图4可见:不论是方法ⅰ还是方法ⅱ,Huang模型和Baranyi模型都表现出良好的拟合精度,PC值和G/G0值都分布在Huang模型和Baranyi模型模拟的生长曲线附近。由表2可见:在模型拟合效果方面,方法ⅰ和方法ⅱ中Baranyi模型性能更优,具有比Huang模型更低的RMSE和AIC,以及更高的R2,但二者差异不显著,均比平板计数法所得生长模型精度略低。方法ⅰ和方法ⅱ中Huang模型的μmax值为0.071和0.019 h-1,Baranyi模型的μmax值分别为0.119和0.044 h-1,这与基于平板计数法所得μmax有略微差别;而λ值却与平板计数法的相差甚远。尽管在生长动力学参数的估计上存在不足,但整体上看,基于电子鼻技术采用方法ⅰ和方法ⅱ的生长曲线的R2均高于0.871,结果大体令人满意,且两者所得模型与基于传统计数法所得生长模型之间的相关系数(r)为0.917~0.994,二者高度相关。其中,方法ⅱ的r值更接近1,故与单个传感器响应值相比,主成分能更全面充分地表达电子鼻信息,获得更准确的生长模型。

图4 基于电子鼻信息拟合的冷鲜牛肉中微生物的生长曲线Fig.4 Growth curves of microorganisms in chilled beef by E-nose information
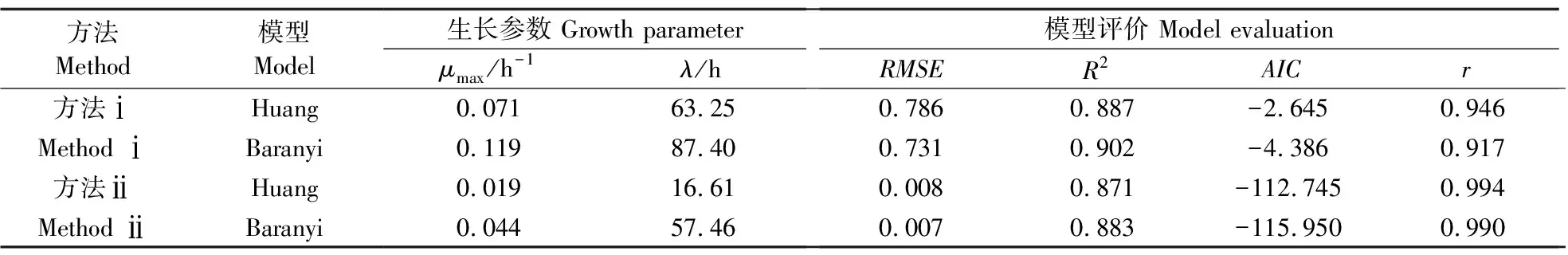
表2 基于电子鼻信息的冷鲜牛肉中微生物动力学参数及模型评价Table 2 Kinetic parameters and model evaluation of the microbes in chilled beef by E-nose information
2.3 基于高光谱成像技术的冷鲜牛肉中微生物生长曲线拟合
2.3.1 光谱分析由图5可见:不同贮藏时间的平均光谱曲线形状大致相同,响应值(相对反射率)存在差异,暗示各贮藏时间牛肉样本的化学成分存在差异,这与Zhou等[21]的研究结果一致。700~1 000 nm内光谱相对反射率随时间降低,原因可能是贮藏时间延长,肉体腐烂、颜色变暗造成肉体表面反射光强变小,故后续取光谱响应值的相反数拟合微生物生长曲线。此外,本试验还观察到光谱曲线中存在多处波峰或波谷。其中,430、490和560 nm处的峰值可能与呼吸色素血红蛋白有关[22],755 nm处的波谷可能与水分子的O—H键有关[23],800 nm处的波峰可能是水分子中O—H的第一泛音引起的[24],970 nm处的波谷可能归因于水分子的O—H伸缩振动二级倍频[25]。光谱变化通常由牛肉微生物腐败时蛋白质降解与水分子变化引起,代谢物能够指示微生物的特征指纹,故光谱可检测牛肉变质过程微生物的数量变化。
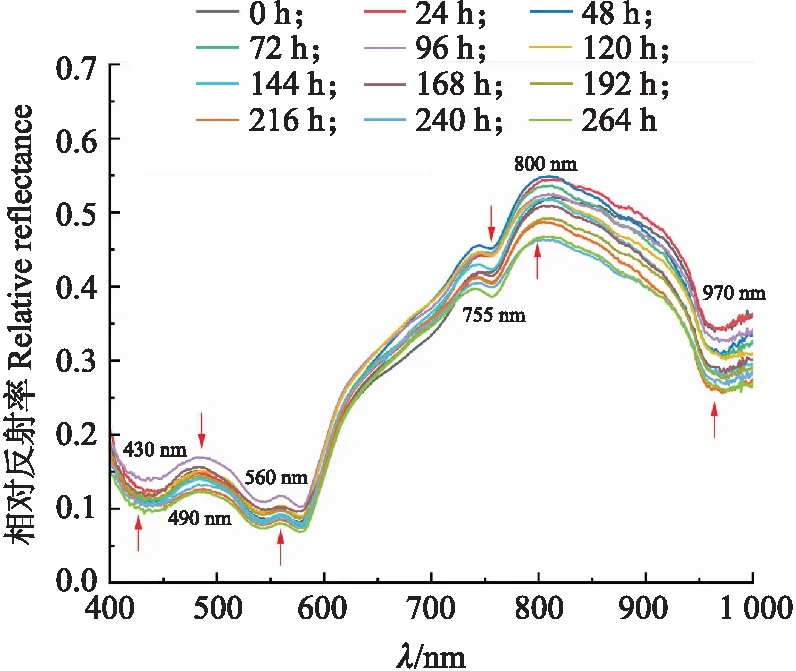
图5 不同贮藏时间牛肉样本的平均光谱值(400~1 000 nm)Fig.5 Mean spectra of beef samples at differentstorage time(400-1 000 nm)
2.3.2 基于高光谱成像技术的生长曲线拟合采用2种方法基于高光谱数据拟合冷鲜牛肉中微生物的生长曲线。方法Ⅰ用不同算法对高光谱数据进行预处理,建立TVC的偏最小二乘回归(PLSR)预测模型,使用最佳PLSR模型所得TVC预测值进行冷鲜牛肉中微生物的生长曲线拟合。方法Ⅱ利用400~1 000 nm内峰值较高的2处光谱值(755和800 nm),表示为方法Ⅱ755 nm和方法Ⅱ800 nm。
由表3可见:比较各个模型的均方根误差、决定系数和相对预测性能(RPD)可知,除2nd Derivative和Autoscale算法外,其余预处理算法的PLSR模型精度均有所提高。最佳模型为MSC-PLSR模型,RPD接近3.0,是比较理想的模型。因此,MSC-PLSR模型的预测值被用于生长曲线拟合(方法Ⅰ)。
由图6可见:基于方法Ⅰ利用Huang模型和Baranyi模型绘制的生长曲线几乎重合,数据点均匀分布在生长曲线附近;基于方法Ⅱ755 nm和Ⅱ800 nm利用Huang模型模拟得到的曲线虽贴近各个数据点,但稳定阶段不明显,Baranyi模型在图中的表现更符合微生物的生长阶段。由表4可知:方法Ⅰ的R2为0.983,RMSE为0.187,AIC为-37.105,其预测精度可与平板计数法相媲美;方法Ⅱ755 nm的RMSE和AIC相对较小,但R2仅为0.75,其模型性能不及方法Ⅰ和平板计数法;方法Ⅱ800 nm的RMSE为0.010和0.009,R2为0.897和0.918,AIC低至-107.389和-109.918,模型预测准确度虽不及平板计数法,但模型R2接近0.90,预测效果良好。
此外,Huang模型和Baranyi模型在方法Ⅰ中表现出良好的参数估计能力,μmax和λ约为0.034 h-1和0.30 h,这与平板计数法的估计值相当。方法Ⅱ755 nm和Ⅱ800 nm中Baranyi模型的μmax值与传统平板计数法一致,但λ值相差较大;而Huang模型的μmax和λ值与平板计数法相比都存在较大差异。另外,基于高光谱信息的冷鲜牛肉中微生物生长模型与平板计数法所得模型之间的相关系数r为0.761~0.998。其中,方法Ⅰ的r值可以达到0.998,高于电子鼻技术中的方法ⅰ和方法ⅱ,表明高光谱技术可能更适用于微生物的生长曲线拟合。即,相比于气味,肉品固有的物理化学属性能更真实地反映肉品质量。方法Ⅱ755 nm的r值0.823和0.822,方法Ⅱ800 nm的r值为0.859和0.761,其模型精度和参数估计准确度仍有很大提升空间。由此可见,高光谱数据的提取方法仍需要改进,以提高模型性能。
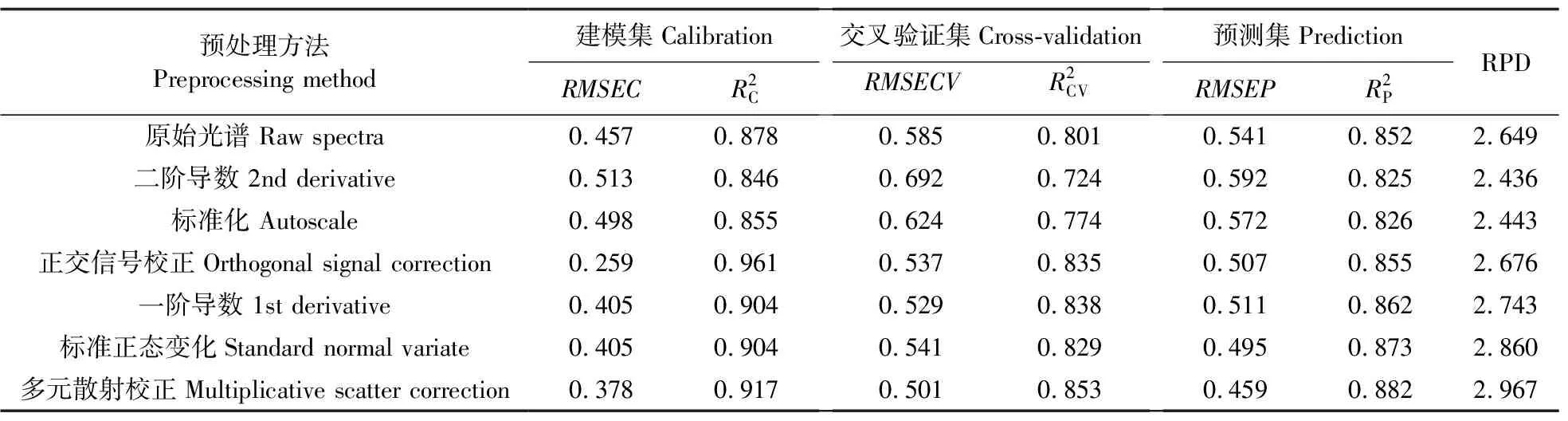
表3 不同预处理算法的冷鲜牛肉中微生物定量偏最小二乘回归(PLSR)预测模型(400~1 000 nm)Table 3 Partial least squares regression(PLSR)quantitative prediction model for microbes inchilled beef with different pretreatment algorithms(400-1 000 nm)

图6 基于高光谱成像技术信息拟合的冷鲜牛肉中微生物的生长曲线Fig.6 Growth curves of microorganisms in chilled beef by hyperspectral imaging technique(HSI)information

表4 基于高光谱成像技术的冷鲜牛肉中微生物动力学参数及模型评价Table 4 Kinetic parameters and model evaluation of the microbes in chilled beef by HSI
2.4 模型验证
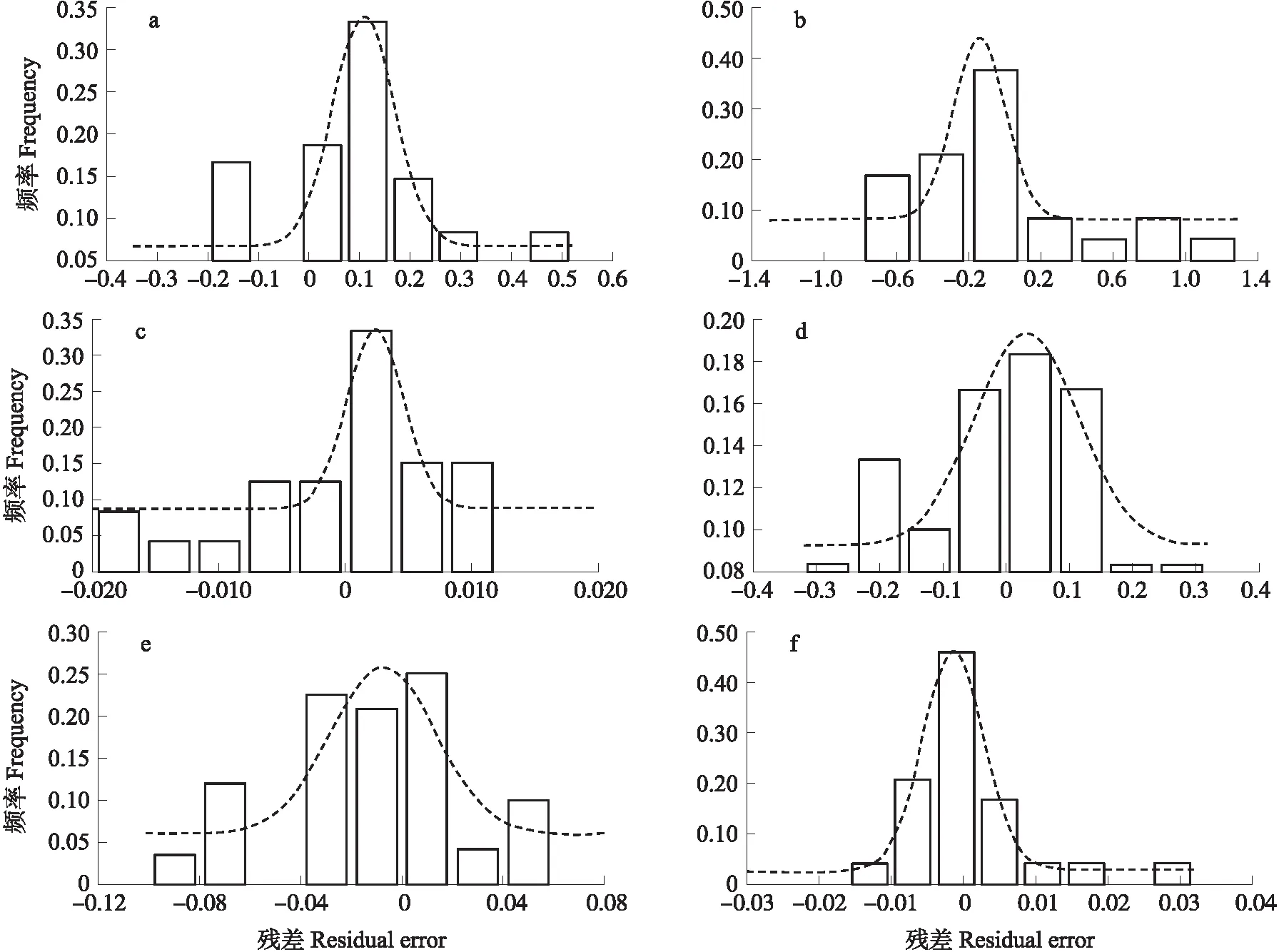
为验证生长模型的准确性和鲁棒性,重复上述牛肉恒温冷藏试验。由图7可知:基于传统平板计数法拟合的冷鲜牛肉中微生物的生长曲线十分贴近验证数据点,预测性能较好,基于电子鼻技术的方法ⅰ和方法ⅱ以及基于高光成像技术的方法Ⅰ、方法Ⅱ755 nm和方法Ⅱ800 nm也具有同样好的预测效果。
一般,1.015 图7 生长模型的验证Fig.7 Validation of growth modelsa.传统平板计数法Plate count method;b.方法ⅰ Method ⅰ;c.方法ⅱ Method ⅱ;d.方法ⅠMethodⅠ;e.方法Ⅱ755 nm Method Ⅱ755 nm;f.方法Ⅱ800 nm Method Ⅱ800 nm. 表5 模型验证结果Table 5 Results of model validation 图8 验证试验残差拟合分布图Fig.8 Distribution of residual errors for the validation experimenta.传统平板计数法Plate count method;b.方法ⅰ Method ⅰ;c.方法ⅱ Method ⅱ;d.方法ⅠMethodⅠ;e.方法Ⅱ755 nm Method Ⅱ755 nm;f.方法Ⅱ800 nm Method Ⅱ800 nm. 本研究通过平板计数采用2种经验模型(修正的Gompertz模型和Logistic模型)及2种机理模型(Huang模型和Baranyi模型)分别拟合了冷鲜牛肉中微生物的生长曲线。经验模型和机理模型侧重点不同,二者的差异较难定义,前者忽略了细胞的生化过程,拟合能力是其被使用的唯一标准,而后者偏向对细胞生化过程及细胞行为的理解[27]。当模型拟合能力可被接受时,机理模型或可认为是首选。因此,本研究采用Huang模型和Baranyi模型基于电子鼻和高光谱成像技术对冷鲜牛肉微生物进行了生长拟合。然而,依据模型评价指标(RMSE、R2和AIC)判断各模型对微生物生长曲线拟合的适宜性时,显示机理模型相对较好,这可能还需要更多试验进一步验证。 基于电子鼻技术采用主成分(方法ⅰ)和相关性(方法ⅱ)分析所建生长模型R2高于0.871,准确度略低于平板计数法,所得μmax值与之略有不同,但二者的相关系数r高达0.917~0.994,表明基于电子鼻构建的生长模型准确度和可信度较好。另外,研究还表明主成分能够反映大多数的电子鼻信息,比单个传感器的响应值更能准确地描述微生物的生长曲线。 对于高光谱成像技术,依据MSC-PLSR模型的预测值(方法Ⅰ)构建的生长模型精度和生长参数(μmax和λ)与平板计数法一致,相关系数r高达0.998。这在一定程度上表明了高光谱成像技术在微生物生长曲线拟合中的优越性高于电子鼻技术。而基于光谱值(方法Ⅱ)的生长模型整体上表现稍差,相关系数r仅为0.761~0.859。验证试验证实了基于电子鼻和高光谱成像技术构建的微生物生长模型的有效性和可靠性。 本研究仅探讨了电子鼻和高光谱成像技术在冷鲜牛肉菌落总数生长曲线拟合上的适用性,其在某一特定微生物或多种微生物间相互作用上的应用仍有待研究,如假单胞菌、热杀索丝菌、气单胞菌等优势腐败菌等。若能从电子鼻和高光谱信息中提取每种微生物的指纹气味或指纹光谱,或可实现依据电子鼻和高光谱拟合任意一种微生物的生长曲线。其次,电子鼻和高光谱各自在菌落总数生长曲线拟合上表现良好,但二者结合后或能更全面地表征微生物以提高拟合优度。 综上所述,电子鼻和高光谱成像技术在冷鲜牛肉微生物生长曲线拟合方面具有巨大潜力,这不仅可以丰富电子鼻和高光谱成像技术在肉品微生物检测研究中的理论和技术,也有助于推广其在肉品质量和安全评价中的应用。但还应注意到,电子鼻和高光谱成像技术在预测微生物学应用方面还有很大的提升空间,如何在消除冗余信息的同时获取有效信息的方法还需深入研究,生长参数的准确性还有待提高。

3 讨论与结论
