水稻抽穗期基因OsFKF1的克隆和互作蛋白筛选
2023-05-29闫晓峰胡渊黄晓龙金涛李海申田云录江玲周时荣万建民
闫晓峰,胡渊,黄晓龙,金涛,李海申,田云录,江玲,周时荣*,万建民,2
(1.南京农业大学作物遗传与种质创新利用全国重点实验室,江苏 南京 210095;2.中国农业科学院作物科学研究所,北京 100081)
抽穗期是决定水稻种植地区适应性、影响产量的重要农艺性状,不仅受内源遗传因素的影响,还与外界环境因素息息相关。其中光周期是影响水稻抽穗期的最关键外界因素之一。作为短日照植物,水稻在短日照条件下提前抽穗,受到与拟南芥GI-CO-FT高度同源的OsGI-Hd1-Hd3a途径以及水稻特有的Ehd1开花促进途径的调控。而在非诱导的长日照条件下,Hd1与其他因子存在遗传互作,表现出抑制抽穗的相反功能[1-2]。Ghd7是开花抑制因子,在长日照条件下通过Ghd7-Ehd1-Hd3a/RFT1途径抑制水稻抽穗[3]。随着越来越多控制抽穗期的主效QTL和主效基因被发掘,已经初步构建了抽穗期基因调控网络,但相关的精细调控机制仍不清楚,进一步克隆新的抽穗期基因,深入发掘已知抽穗期基因的功能,可为实现抽穗期的理性设计提供基因资源和理论依据[4]。
高等植物拥有感知和响应环境的光感受器,能够监测从UV-B到近红外线的光。Zeitlupe 家族的成员(ZTL、FKF1 和 LKP2)是拟南芥的一类蓝光感受器,ZTL、FKF1和LKP2蛋白均含有一个LOV/F-box/Kelch结构域的组合。位于N端的LOV(light,oxygen,or voltage)结构域能感受蓝光,参与光信号的转导,中间的F-box结构域通过形成SKP-Cullin-Rbx-F-box(SCF)E3泛素连接酶复合体,参与蛋白的泛素化降解过程;而位于C端的Kelch重复序列,具有识别底物蛋白的功能[5-7]。这种独特的结构域组合使ZTL/FKF1/LKP2能够通过依赖蓝光的蛋白降解途径影响昼夜节律和光周期调控的开花[8-9]。
在长日照条件下,FKF1与GI相互作用,降解蓝光依赖的转录抑制因子CDF,间接促进CO的转录[10-12]。FKF1也能与COP1互作,通过抑制COP1形成同源二聚体,避免CO被降解,维持CO蛋白的稳定性[13-14]。因此,FKF1可以通过对CO转录和翻译后调节的多重机制,诱导成花素基因FT的转录,促进拟南芥开花。与拟南芥的FKF1相似,OsFKF1也能与OsGI和OsCDF互作[15]。不同的是,OsFKF1不影响Hd1的表达,而是促进Ehd1的表达。这说明在水稻中OsFKF1通过不同于拟南芥的开花调控途径发挥作用,但其诱导Ehd1上调的具体机制仍待发掘。
本研究克隆了水稻抽穗期基因OsFKF1,探究不同光环境下OsFKF1对Ehd1表达的影响,并明确OsFKF1在水稻细胞的定位,进一步筛选OsFKF1的互作蛋白,为深入解析OsFKF1调控水稻抽穗的分子机制奠定基础。
1 材料与方法
1.1 试验材料及种植条件
在粳稻品种‘宁粳2号’经甲基磺酸乙酯(ethyl methane sulfonate,EMS)化学诱变获得的M2代群体中,通过调查抽穗期筛选到2个稳定遗传的晚抽穗突变体lhn2(lateheadinginnaturaldays2)和lhn3(lateheadinginnaturaldays3)。将晚抽穗突变体与‘宁粳2号’杂交,得到F2代分离群体。试验材料均种植于南京农业大学土桥水稻育种实验站,田间管理同大田生产。
1.2 抽穗期表型及农艺性状考察
抽穗期为播种到植株第1穗抽出叶鞘1 cm所需的时间(d),分单株记录数据。株高、分蘖数在植株成熟后田间测量所得。分单株收种后在室内测量穗长、一次枝梗数等性状。粒长、粒宽、千粒重利用万深SC-G考种仪测得。抽穗期、株高和分蘖数取20株的平均值,其他农艺性状均为10株的平均值,一次枝梗数每株选取3穗,共30穗取平均值。
1.3 突变基因的MutMap定位
将晚抽穗突变体lhn2、lhn3与‘宁粳2号’杂交,种植F2并调查抽穗期。在群体中选择30株野生型表型的植株和30株突变体表型的植株,取等量叶片混匀后研磨,用CTAB法提取DNA,构建野生型和突变型2个测序混池。将混池的DNA,连同野生型‘宁粳2号’的DNA送深圳华大基因科技服务有限公司进行二代测序,测序深度至少为30×。测序后的数据按照南京农业大学生物信息分析平台(http://seq.njau.edu.cn)开发的改进型MutMap方法进行分析(未发表)。引物序列见表1。
1.4 实时荧光定量PCR检测基因表达
短日照条件下Ehd1在晨间被诱导表达[16]。为验证OsFKF1对Ehd1表达的影响,在短日照(光照/黑暗时间为10 h/14 h)培养箱内将‘宁粳2号’和lhn2突变体培养至30 d,此时野生型和突变体均处于幼穗发育前的光周期敏感阶段。在第31天上午09:00(开灯时间)将植株转移至冷光源光照培养箱中进行蓝光、红光或黑暗处理,每隔1 h取样1次,共取5次,3个生物学重复。将样品置于液氮中磨碎,使用植物总RNA提取试剂盒[天根生化科技(北京)有限公司]提取样品RNA,并用Vazyme HiScript®Ⅲ 1st Strand cDNA Synthesis Kit(+gDNA wiper)合成cDNA。利用实时荧光定量PCR检测Ehd1的表达。反应体系:10 μL TB GreenPremixExTaq,5 μLEhd1-Q-F/R引物(10 μmol·L-1),5 μL反转录产物。以水稻UBQ基因(LOC_Os03g13170)为内参,每个反应设置3次技术重复。反应在BioRad CFX96 Real Time PCR System仪器上进行,程序为:94 ℃ 30 s;94 ℃ 5 s,60 ℃ 34 s,共39个循环;65~95 ℃制备熔解曲线。用 2-ΔΔCT法计算Ehd1的相对表达量。

表1 本研究所用引物Table 1 The primers used in this study
1.5 水稻原生质体亚细胞定位
设计OsFKF1PAN580GFP-F/R引物(表1),构建 OsFKF1-GFP 融合表达载体,转化大肠杆菌,挑取阳性单克隆于100 mL的 LB液体培养基中过夜培养12~16 h,利用无内毒素质粒大提试剂盒[天根生化科技(北京)有限公司]提取质粒。水稻原生质体制备参照谭嵩娟等[17]的方法,将提取的OsFKF1-GFP质粒与核定位质粒WRKY29-mCherry共转化至水稻原生质体中,转化后置于28 ℃培养箱避光培养12 h,在激光共聚焦显微镜(Leica SP8)下观察GFP和细胞核标签WRKY29-mCherry的荧光。
1.6 酵母双杂交试验
设计pGBKT7-OsFKF1-F/R、pGADT7-HGW-F/R引物(表1),构建pGBKT7-OsFKF1及pGADT7-HGW载体,将上述载体以及空载体pGADT7和pGBKT7转化大肠杆菌,并利用无内毒素质粒小提中量试剂盒[天根生化科技(北京)有限公司]提取质粒。制备酵母AH109感受态细胞,分别将上述质粒转化至酵母菌株中。将转入pGBKT7-OsFKF1和空载体pGADT7质粒的菌液涂布于SD/-Trp-Leu缺陷培养基上,置于30 ℃培养箱中培养,并于3 d后拍照记录。检测pGBKT7-OsFKF1是否存在转录自激活活性。
将单独转入pGBKT7-OsFKF1质粒的菌液涂布于SD/-Trp缺陷培养基上,挑取单克隆置于液体缺陷培养基SD/-Trp中培养,将pGBKT7-OsFKF1菌液与水稻叶片的AD文库菌液混合Mating后涂布于SD/-Trp-Leu-His缺陷培养基上,将生长的单克隆转移到更高筛选强度的SD/-Trp-Leu-His-Ade缺陷培养基上,挑取阳性克隆进行测序分析。
将共转pGBKT7-OsFKF1和pGADT7-HGW质粒的菌液,以及与空载体不同组合的菌液涂布至SD/-Trp-Leu缺陷培养基上,挑取单克隆并用9 g·L-1NaCl 溶液重悬,依次稀释10、100、1 000倍涂布于SD/-Trp-Leu-His-Ade缺陷培养基。置于30 ℃培养箱中培养3~5 d后拍照记录。
1.7 荧光素酶互补试验
设计OsFKF1-nLUC-F/R、HGW-cLUC-F/R引物(表1),构建OsFKF1-nLUC、HGW-cLUC载体,将空载体 nLUC 和 cLUC及构建好的上述载体转化农杆菌。将活化的农杆菌配制成侵染液,注射烟草叶片下表皮。室温放置48 h后置于成像装置(Berthold,NightSHADE LB 985)检测荧光素酶活性。
2 结果与分析
2.1 水稻晚抽穗突变体lhn2和lhn3表型分析
如图1所示,在南京自然长日照条件下,‘宁粳2号’抽穗期为(98.00±1.86)d,2个突变体lhn2、lhn3抽穗期分别为(123.90±1.16)d、(124.95±1.27)d,比‘宁粳2号’晚抽穗26、27 d左右,将这2个突变体分别命名为lhn2(lateheadinginnaturaldays2)和lhn3(lateheadinginnaturaldays3)。

图1 ‘宁粳2号’和突变体lhn2、lhn3在自然长日照条件的表型(A)和抽穗期(B)Fig.1 Phenotypes(A)and heading stage(B)of ‘Ningjing 2’and mutants lhn2,lhn3 plants under natural long dayA. 比例尺为20 cm;B. n=20,**表示‘宁粳2号’与lhn2、lhn3在0.01水平差异显著。下同。A. Bar is 20 cm;B. n=20,**means significant difference at 0.01 level between‘Ningjing 2’and lhn2,lhn3. The same below.
从表2可见,相较于野生型,2个突变体lhn2和lhn3的株高、粒长、粒宽、千粒重、单株产量均显著下降,而分蘖数、每穗粒数与野生型差异不显著。另外lhn2相对于野生型穗长和一次枝梗数显著下降,lhn3结实率相比于野生型显著降低。

表2 ‘宁粳2号’和突变体lhn2、lhn3农艺性状比较Table 2 Comparison of agronomic traits between‘Ningjing 2’and mutants lhn2 and lhn3
2.2 利用F2群体的MutMap定位
按照改进的MutMap程序,通过F2群体中的极端早抽穗(抽穗期≤100 d)和晚抽穗(抽穗期≥120 d)个体DNA混池的高通量测序,对lhn2、lhn3的突变基因进行定位分析。如图2所示,2个突变体均在11号染色体末端存在明显的连锁趋势。通过筛选ED2值较高的位点,发现编号为LOC_Os11g34460的基因在2个突变体中均发生突变。LOC_Os11g34460基因又称OsFKF1,是拟南芥FKF1的同源基因。如图3所示,结合测序分析,lhn2在OsFKF1基因编码区第1 476位插入了9 bp,导致第492位甘氨酸后面插入3个氨基酸。插入位点位于OsFKF1的Kelch重复结构域上,且该位置在物种间高度保守。lhn3在OsFKF1基因编码区第1 109位发生鸟嘌呤(G)到腺嘌呤(A)的突变,导致第370位色氨酸突变为终止密码子,蛋白翻译提前终止。Han等[15]在水稻栽培品种‘Dongjin’中利用T-DNA插入法获得osfkf1突变体,插入位点位于与lhn2、lhn3突变位点相近的位置,osfkf1在自然长日照下较野生型晚抽穗17 d,千粒重和育性显著下降,与本研究中lhn2和lhn3的表型相似。因此,我们认为OsFKF1基因突变导致lhn2和lhn3晚抽穗的表型,所以lhn2和lhn3互为等位突变体。
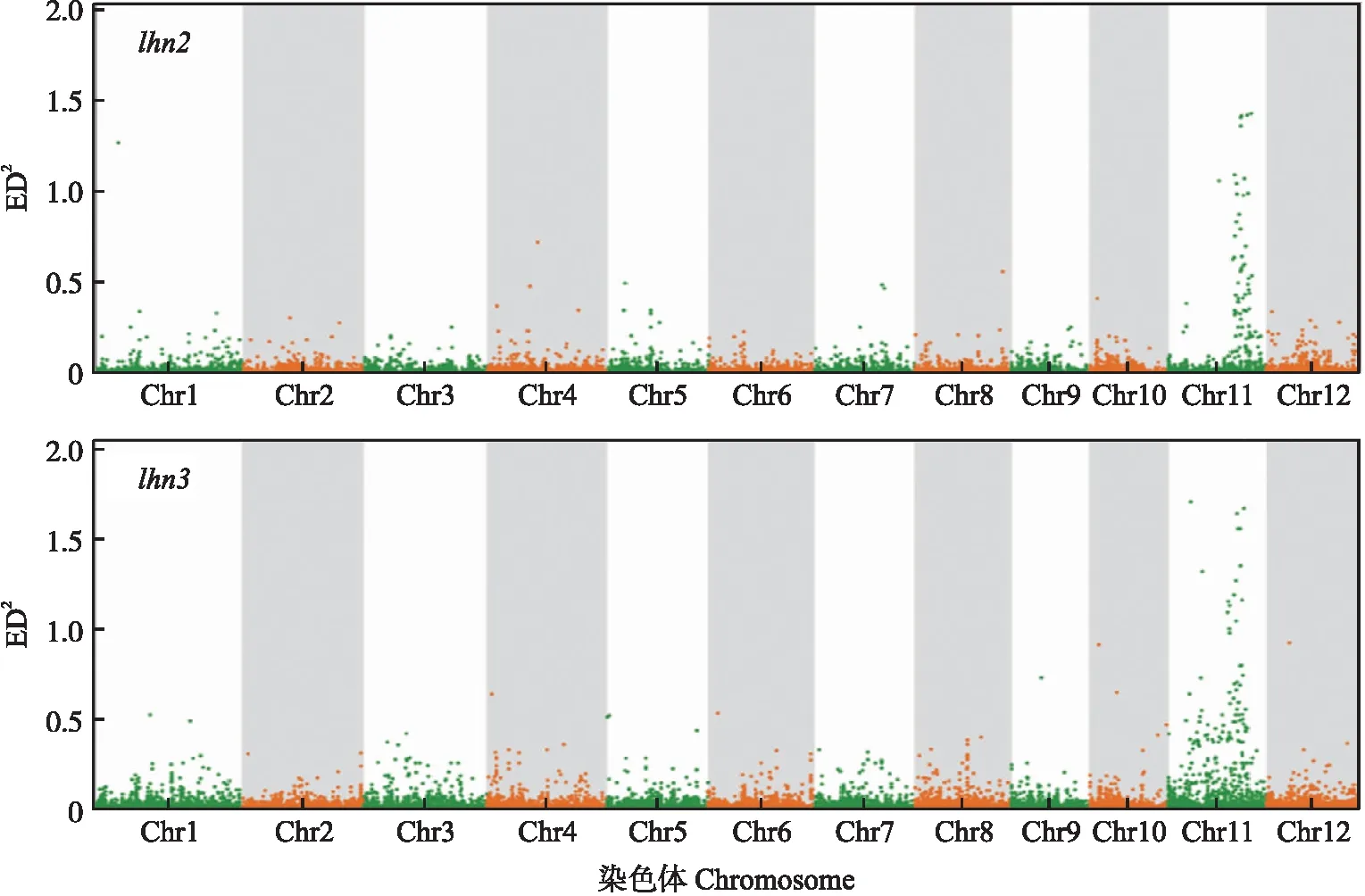
图2 利用改进型MutMap方法分析lhn2和lhn3在全基因组上的连锁Fig.2 Whole genome identification of the linkage site of lhn2 and lhn3 by an improved MutMap methodED(欧式距离)用于计算混池之间的SNP差异并寻找候选区域。ED2=(Amut-Awt)2+(Tmut-Twt)2+(Cmut-Cwt)2+(Gmut-Gwt)2。其中Amut、Tmut、Cmut、Gmut表示ATCG 4种碱基在突变型混池中的频率,Awt、Twt、Cwt、Gwt表示ATCG 4种碱基在野生型混池中的频率。ED(Euclidean distance)is used to calculate SNP differences between pools and find candidate regions. ED2=(Amut-Awt)2+(Tmut-Twt)2+(Cmut-Cwt)2+(Gmut-Gwt)2. Amut,Tmut,Cmut and Gmut represent the frequencies of the four ATCG bases in the mutant pool,and Awt,Twt,Cwt and Gwt represent the frequencies of the four ATCG bases in the wild-type pool.

图3 lhn2和lhn3突变体在OsFKF1上的突变位点Fig.3 Mutation sites of lhn2 and lhn3 mutants in OsFKF1 gene

图4 不同波长光源处理下‘宁粳2号’和osfkf1中Ehd1的表达分析Fig.4 Analysis of the expression of Ehd1 in‘Ningjing 2’and osfkf1 under different wavelengths of light试验材料为在人工短日照条件下(光照/黑暗时间为10 h/14 h)生长30 d的植株,在开灯前ZT(0)时从黑暗转移至不同波长的光照培养箱内。N2为‘宁粳2号’,osfkf1为lhn2突变体。red、blue、dark分别代表红光、蓝光和无光照处理。The experimental material is grown under artificial short daylight conditions(light/dark time is 10 h/14 h)for 30 days,then transfer from darkness to light of different wavelengths at ZT(0)before turning on the lights. N2 is‘Ningjing 2’,osfkf1 is the lhn2 mutant. Red,blue,and dark represent the red light,blue light and no light treatments.
2.3 OsFKF1参与蓝光诱导Ehd1的表达
为方便后续研究,将LHN2基因更名为OsFKF1,相应的突变体称为osfkf1(lhn2)。Han等[15]研究发现在蓝光条件下,OsFKF1能够诱导Ehd1的表达。为验证水稻中是否只有蓝光诱导Ehd1表达,以及OsFKF1对蓝光诱导Ehd1表达的贡献。分别检测蓝光、红光、黑暗条件处理下,野生型和osfkf1中Ehd1的表达量变化。如图4所示,红光处理和黑暗条件下Ehd1的表达量均维持在较低水平,而在蓝光条件下Ehd1被显著诱导表达,且蓝光处理3 h 后Ehd1表达量最高。尽管在osfkf1突变体中Ehd1表达同样特异受到蓝光的诱导,然而其表达量较野生型显著降低。综上,蓝光能够特异诱导Ehd1的表达,而这种诱导作用部分依赖于OsFKF1。
2.4 OsFKF1的亚细胞定位
为了分析OsFKF1在水稻中的亚细胞定位,将OsFKF1-GFP的融合蛋白载体和一个细胞核标签载体WRKY29-mCherry同时转入水稻原生质体中。如图5所示,OsFKF1不仅与核标签共定位于水稻原生质体的细胞核中,在细胞质中也能观察到。表明OsFKF1蛋白定位于细胞质和细胞核中。
2.5 OsFKF1互作蛋白筛选
为进一步挖掘OsFKF1的功能,利用酵母双杂交对水稻叶片cDNA文库进行筛选,寻找OsFKF1的互作蛋白。首先鉴定了OsFKF1的自激活活性,如图6所示,正对照pGADT7和pGBKT7-Ehd4的组合能够在SD/-Trp-Leu和SD/-Trp-Leu-His-Ade缺陷培养基上生长,而pGADT7与pGBKT7,以及pGADT7与pGBKT7-OsFKF1的组合只能在SD/-Trp-Leu缺陷培养基上正常生长。这表明全长OsFKF1不具有转录自激活活性,因而可以利用OsFKF1作为诱饵进行互作蛋白筛选。

图6 OsFKF1转录自激活活性分析Fig.6 Transcriptional activity analysis of OsFKF1pGBKT7-OsFKF1和pGADT7空载体共转化酵母菌株AH109后,分别涂布于二缺(SD/-Trp-Leu)和四缺(SD/-Trp-Leu-His-Ade)培养基上进行培养。点样梯度由左至右依次为10-1、10-2、10-3、10-4。pGBKT7-OsFKF1 vector and pGADT7 vector are co-transformed in the yeast strain AH109. The transformed yeast cells are then plated on DDO(SD/-Trp-Leu)and QDO(SD/-Trp-Leu-His-Ade)plates. Spotting gradients from left to right are 10-1,10-2,10-3,10-4.
从表3可见:共筛选到34个与OsFKF1互作的蛋白,去除冗余后,对应到10个基因,分别编码胁迫相关蛋白、单链核酸结合蛋白DIP、转录因子OsWRKY59、HAD超家族磷酸酶以及重金属相关蛋白等。在这些互作蛋白中,发现一个与水稻抽穗期和粒重调节相关的蛋白HGW。HGW基因编码含有泛素相关结构域UBA(ubiquitin-associated domain)的蛋白,可能具有使泛素化的蛋白定向结合26S蛋白酶体促进蛋白降解的功能[18]。

表3 OsFKF1互作蛋白筛选结果Table 3 Screening results of OsFKF1 interacting proteins
2.6 OsFKF1与HGW互作验证
如图7所示,同时转入pGBKT7-OsFKF1和pGADT7-HGW的菌落在SD/-Trp-Leu和SD/-Trp-Leu-His-Ade缺陷培养基上都能正常生长,单独转入pGBKT7-OsFKF1或pGADT7-HGW的菌落仅能在SD/-Trp-Leu缺陷培养基上生长,说明在酵母中OsFKF1和HGW是互作的。
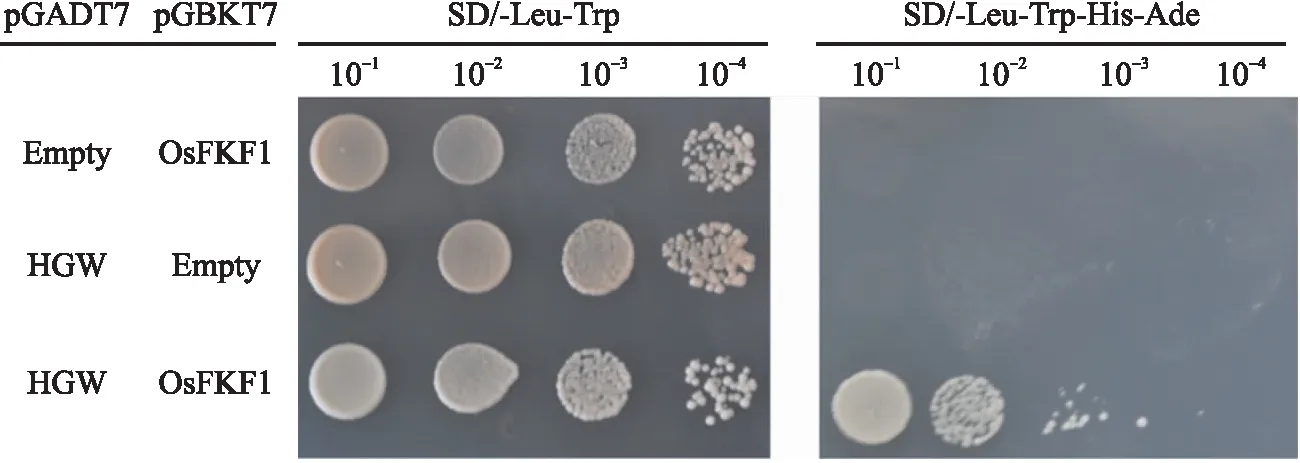
图7 OsFKF1和 HGW在酵母中的互作分析Fig.7 Analysis of the interaction between OsFKF1 and HGW by yeast two-hybrid assaypGBKT7-OsFKF1和pGADT7-HGW载体共转化酵母菌株AH109后,分别涂布于二缺(SD/-Trp-Leu)和四缺(SD/-Trp-Leu-His-Ade)培养基上进行培养。点样梯度由左至右依次为10-1、10-2、10-3、10-4。pGBKT7-OsFKF1 vector and pGADT7-HGW vectors are co-transformed in the yeast strain AH109. The transformed yeast cells are plated on DDO(SD/-Trp-Leu)and QDO(SD/-Trp-Leu-His-Ade)plates. Spotting gradients from left to right are 10-1,10-2,10-3,10-4.
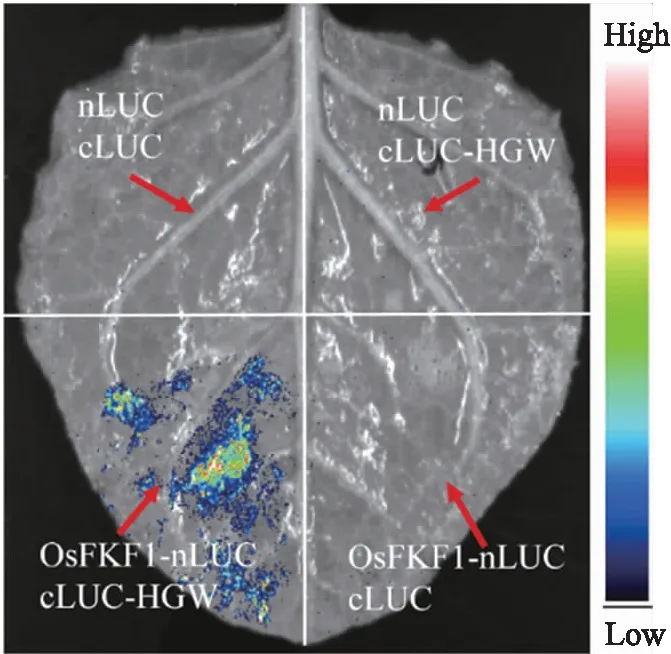
图8 OsFKF1和HGW在烟草叶片中的互作分析Fig.8 Analysis of the interaction between OsFKF1 and HGW in tobacco bladeOsFKF1-nLUC和cLUC-HGW的组合为试验组,OsFKF1、HGW与空载体的组合作为负对照。红色箭头指向注射点,色标由上至下表示荧光强度由高到低。The combination of OsFKF1-nLUC and cLUC-HGW is the experimental group,and the combination of OsFKF1,HGW and empty vector is used as the negative control. Red arrows indicate the injection sites,and the color scale from top to bottom indicates the fluorescence intensity from high to low.
利用荧光素酶互补试验进一步验证OsFKF1与HGW在植物体内的互作。如图8所示,OsFKF1-nLUC和HGW-cLUC的组合能检测到明显的荧光信号,其他组合中则没有荧光产生。说明OsFKF1和HGW在植物体内也是互作的。
3 讨论
本研究在‘宁粳2号’背景的EMS诱变体库中筛选到2个晚抽穗突变体lhn2、lhn3。利用BSA分析方法定位突变基因,确定lhn2、lhn3是水稻抽穗期基因OsFKF1的等位突变体。其中lhn2插入了3个氨基酸,未造成移码突变,但仍表现出与lhn3相同的晚抽穗表型,甚至对其他农艺性状造成更大的影响。可能是由于lhn2插入的3个氨基酸恰好位于OsFKF1的Kelch repeats结构域上,且该位置在物种间高度保守,推测lhn2突变可能使蛋白功能完全丧失。由于lhn2和lhn3抽穗期表型相似,只有少量农艺性状存在差异,我们认为这些农艺性状的差异可能来自EMS诱变产生的其他突变。
本研究中利用不同波长的光处理野生型和osfkf1突变体,证实蓝光依赖下OsFKF1诱导Ehd1的表达,这与前人的报道一致[15]。本研究发现红光处理和黑暗处理均不能诱导Ehd1的表达,OsFKF1特异介导水稻的蓝光信号。在osfkf1突变体中Ehd1的表达仍受蓝光诱导,说明蓝光诱导Ehd1的表达并不完全依赖OsFKF1,也受其他光受体的影响。在拟南芥中,FKF1在光周期调控的开花中发挥主要作用,而ZTL和LKP2表现出部分冗余的功能。研究表明LKP2、ZTL与FKF1之间的互作能通过调节FKF1靶标蛋白的稳定性调控拟南芥非诱导光周期条件下的开花[19]。拟南芥中还存在另一类蓝光受体CRY2,与FKF1相似,CRY2也能够通过抑制COP1的活性维持CO蛋白的稳定,进而诱导FTmRNA的表达,促进拟南芥开花[20]。CIB1、CIB3是同属于bHLH亚家族的转录因子,CIB1和CIB3能够形成异源二聚体结合在GI的启动子上激活GI的表达。研究表明CIB1促进开花的能力依赖于CRY2、ZTL和LKP2,而不依赖于FKF1[21-22],而CIB3独立于CRY2,但以依赖FKF1的方式促进开花[23]。我们推测水稻中不同蓝光受体之间也通过一些因子的相互作用联系到一起,共同调控蓝光信号介导的开花过程。
OsFKF1包含1个F-box结构域,具有E3泛素连接酶活性。本研究通过酵母文库筛选发现1个与OsFKF1互作的蛋白HGW,HGW编码1个具有泛素结合相关结构域的蛋白,能够结合泛素,参与泛素化蛋白降解的过程。与OsFKF1相同,HGW也定位于细胞质和细胞核中,且hgw和osfkf1类似,均有抽穗期延迟、粒重显著下降的表型[18]。我们推测HGW和OsFKF1可能在同一遗传途径中发挥作用,作用于共同的靶标蛋白。研究表明,光敏色素拮抗OsGI介导泛素化降解Ghd7蛋白的过程,但降解Ghd7的E3泛素连接酶尚不清楚[24]。在拟南芥中,FKF1-GI复合体对下游靶蛋白的调控解释了拟南芥感受长日照促进开花的机制[25]。据此,我们推测OsFKF1可能作为Ghd7的E3泛素连接酶,通过与HGW的互作调控Ghd7蛋白水平进而影响水稻在长日照下抽穗,它们之间的确切关系需通过生化和遗传学试验进一步验证。前人研究表明HGW可能直接通过GIF1控制水稻粒径和粒重,并提出了HGW通过泛素依赖的ESCRT-1途径调节细胞壁的形成,从而在籽粒发育过程中调节细胞分裂的假设[18]。OsFKF1是否与HGW的互作调控某个籽粒发育相关因子,是值得探索的方向。本研究为OsFKF1调控水稻粒重提供了思路,作为抽穗期和粒重的关键调节因子,研究OsFKF1和HGW互作的机制有助于理解水稻抽穗期和粒重之间的相关性,从而设计出新的分子育种方法,提高水稻产量的稳定性和潜力。我们还发掘了另外9个潜在的与OsFKF1互作的蛋白,由于本研究主要围绕水稻抽穗期开展,我们未对其他筛选到的互作蛋白进行验证和功能研究。后续研究将通过构建这些蛋白的突变体等遗传材料,考察表型,并进行互作验证和功能分析,发掘OsFKF1调控抽穗期、粒重以及其他性状的分子机制。
