一测多评法同时测定丹参药材中8 种水溶性成分含量*
2023-05-26陈雪琴贾文江周仔莉王敏珍张跃进
陈雪琴,贾文江,周仔莉,李 鹏,贾 卫,柯 园,王敏珍,张跃进
(1. 陕西省商洛市药品检验所,陕西 商洛 726000; 2. 陕西省商洛市农业科学研究所,陕西 商洛 726000;3. 西北农林科技大学,陕西 咸阳 712100)
丹参为唇形科植物丹参Salvia miltiorrhizaBge. 的干燥根和根茎,是历版《中国药典》收录的大宗常用中药材之一,现主要以栽培品入药,主产于陕西(为陕西商洛十大商药之一)、山东、河南、安徽、四川等地。丹参的药物活性成分有上百种,其水溶性成分主要包括丹参素、原儿茶醛、咖啡酸、紫草酸和迷迭香酸及丹酚酸A,B,F,G 等[1],有抗凝血、调血脂、抗肿瘤、抗炎等作用,而水溶性成分有抗氧化、降血压、预防心脑血管疾病等作用,临床常用于治疗冠心病、心绞痛、胸痹心痛等症[2]。然而,在丹参药材的品质控制及等级划分中,水溶性指标性成分控制仅针对丹酚酸B 含量做出了相应规定。使用外标法测定丹参酚酸类成分的含量也存在控制单一、重复性差、操作烦琐、对照品难购买等问题。故本研究中对丹参中的丹参素钠、原儿茶醛、咖啡酸、丹酚酸F、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A等水溶性成分进行了全面研究,对上述8 个成分进行了确认,并采用一测多评(QAMS)法同时测定丹参药材中8种水溶性成分的含量。现报道如下。
1 仪器与试药
1.1 仪器
Waters e2695 型四元梯度高效液相色谱系统(含紫外检测器,沃特世科技<上海>有限公司);Agilent 1260Ⅱ型高效液相色谱仪(含DAD 检测器,美国Agilent公司);Shimadzu LC - 20AT 型高效液相色谱仪(日本Shimadzu 公司);BS224S 型电子分析天平(北京赛多利斯科学仪器有限公司,精度为0.1 mg);SY-800型超声波清洗机(上海宁商超声清洗仪器有限公司);Medium-RS30UVF 型实验室纯水系统(上海和泰仪器有限公司);凌生1000C型多功能粉碎机(永康市红太阳机电有限公司)等。
1.2 试药
丹酚酸B 对照品(批号为111562-201917,含量为96.6%),丹参素钠对照品(批号为110855-201915,含量为97.8%),原儿茶醛对照品(批号为110810 -201909,含量为99.6%),咖啡酸对照品(批号为110885-201703,含量为100%),迷迭香酸对照品(批号为111871-202007,含量为98.1%),均购于中国食品药品检定研究院;丹酚酸A 对照品(批号为B20260,含量为98.0%),丹酚酸F 对照品(批号为B25806,含量为98.0%),紫草酸对照品(批号为B21683,含量为98.0%),均购于上海源叶生物科技有限公司;乙腈为色谱纯,甲醇为分析纯,水为超纯水。丹参药材(来源见表1)经陕西省商洛市药品检验所陈雪琴教授鉴定为正品。
2 方法与结果
2.1 色谱条件
色谱柱:Agilent 5 TC - C18柱(250 mm × 4.6 mm,5 μm);流动相:乙腈- 0.2%磷酸溶液(20∶80,V/V);流速:1.1 mL/min;检测波长:286 nm;柱温:30 ℃;进样量:20 μL。
2.2 溶液制备
取丹参素钠、原儿茶醛、咖啡酸、丹酚酸F、迷迭香酸、紫草酸、丹酚酸B、丹酚酸A 对照品各适量,精密称定,制成含各成分质量浓度分别为55.257,12.848,19.342,24.500,94.176,105.84,75.831,13.524 μg/mL的混合对照品溶液。取药材样品粉末(过3 号筛)约0.15 g,精密称定,置150 mL 具塞锥形瓶中,精密加入80%甲醇溶液50 mL,密塞,称定质量,超声(功率250 W,频率40 kHz)处理45 min,放冷,再称定质量,用80%甲醇溶液补足减失的质量,摇匀,经0.45 μm 微孔滤膜滤过,取续滤液,即得供试品溶液。
2.3 方法学考察
系统适用性试验:取2.2 项下混合对照品溶液、供试品溶液各适量,按2.1 项下色谱条件进样测定,记录色谱图。结果供试品溶液色谱中,在与混合对照品溶液色谱相同保留时间处有相应色谱峰,理论板数按各成分峰计均应大于3 000,分离度大于1.5,基线分离良好。详见图1。

图1 高效液相色谱图1.Sodium Danshensu 2.Protocatechualdehyde 3.Caffeic acid 4.Salvianolic acid F 5.Rosmarinic acid 6.Lithospermic acid 7.Salvianolic acid B 8.Salvianolic acid AA.Mixed reference solution B.Test solutionFig.1 HPLC chromatograms
线性关系考察:分别精密吸取2.2项下混合对照品溶液1,5,10,15,20,25 μL,按2.1项下色谱条件进样测定,记录峰面积。以进样量(X,μL)为横坐标、峰面积为纵坐标(Y)进行线性回归,结果见表2。

表2 线性关系考察结果(n=6)Tab.2 Results of the linear relation test(n=6)
精密度试验:精密吸取2.2 项下混合对照品溶液10 μL,按2.1 项下色谱条件连续进样测定6 次,记录峰面积。结果8 个成分峰面积的RSD分别为1.03%,1.21%,0.98%,1.06%,1.37%,0.87%,0.79%,1.08%,均小于1.5%(n=6),表明仪器精密度良好。
稳定性试验:取2.2 项下供试品溶液适量,分别在室温下放置0,3,6,12,18,24 h 时按2.1 项下色谱条件下进样测定,记录峰面积。结果8 个成分峰面积的RSD分别为1.27%,1.04%,1.18%,0.94%,0.84%,1.29%,1.34%,0.79%,均小于1.5%(n= 6),表明供试品溶液在室温放置24 h内基本稳定。
重复性试验:取样品(编号S5)适量,按2.2 项下方法制备供试品溶液,各6 份,按2.1 项下色谱条件进样测定,记录峰面积并计算含量。结果8 个成分含量的RSD分别为1.42%,1.00%,1.24%,1.37%,1.49%,0.91%,0.97%,1.32%,均小于1.5%(n=6),表明方法重复性良好。
加样回收试验:取已知含量的样品(编号S5,含丹参素钠0.370 mg、原儿茶醛0.160 mg、咖啡酸0.209 mg、丹酚酸F 0.101 mg、迷迭香酸0.719 mg、紫草酸0.510 mg、丹酚酸B 8.609 mg、丹酚酸A 0.039 mg)粉末0.15 g,精密称定,分别加入相应对照品适量,再按2.2 项下的方法制备供试品溶液,按2.1 项下色谱条件进样测定,记录峰面积,并计算加样回收率。结果各待测成分平均加样回收率分别为98.96%,98.94%,99.20%,99.67%,102.43%,99.74%,101.94%,99.37%,RSD分 别 为0.93%,1.02%,1.41%,1.15%,1.30%,1.23%,1.06%,0.88%,均小于1.5%(n=6)。
2.4 相对校正因子(f)的确定
选取丹酚酸B 为内标物,建立丹酚酸B 与其他待测成分(mi,i=1,2,…,7)间的相对校正因子公式为。式中,Ami为某一待测成分的峰面积,Wmi为某一待测成分的质量;A丹酚酸B为丹酚酸B 的峰面积,W丹酚酸B为丹酚酸B 的质量。
取2.2 项下混合对照品溶液1,5,10,15,20 μL,按2.1 项下色谱条件下进样测定,记录峰面积,分别计算以丹酚酸B为内标时其余7个成分的f值,结果见表3。可见,7 个成分f值的RSD均小于1.0%(n= 5),符合试验要求。

表3 各待测成分的相对校正因子Tab.3 Relative correction factors of each component to be tested
2.5 f 的耐用性试验
液相色谱仪和色谱柱:取药材样品(编号S5)适量,精密称定,按2.2项下方法制备供试品溶液,再按2.1项下试验条件,釆用Shimadzu LC-20AT型、Agilent 1260Ⅱ型及Waters e2695 型高效液相色谱系统,分别采用Agilent 5 TC - C18(2)柱、Kromasil 100 - 5 - C18柱,以及Welch Ultimate C18柱(规格均为250 mm × 4.6 mm,5 μm)进样测定,记录峰面积,并计算样品含量。结果表明,色谱系统、色谱柱发生一定变化时本方法能满足试验要求,耐用性良好。详见表4。

表4 不同色谱系统和色谱柱对相对校正因子的影响Tab.4 Effect of different chromatographic systems and chromatographic columns on relative correction factors
柱温:取药材样品(编号S5)适量,按2.2 项下方法制备供试品溶液,再按2.1 项下色谱条件(分别设置柱温为20,25,30,35 ℃)进样测定,记录峰面积并计算样品含量,结果见表5,各成分f值的RSD均小于1.0%,表明在实验室条件下柱温发生一定程度变化时,本方法能满足试验要求,耐用性良好。
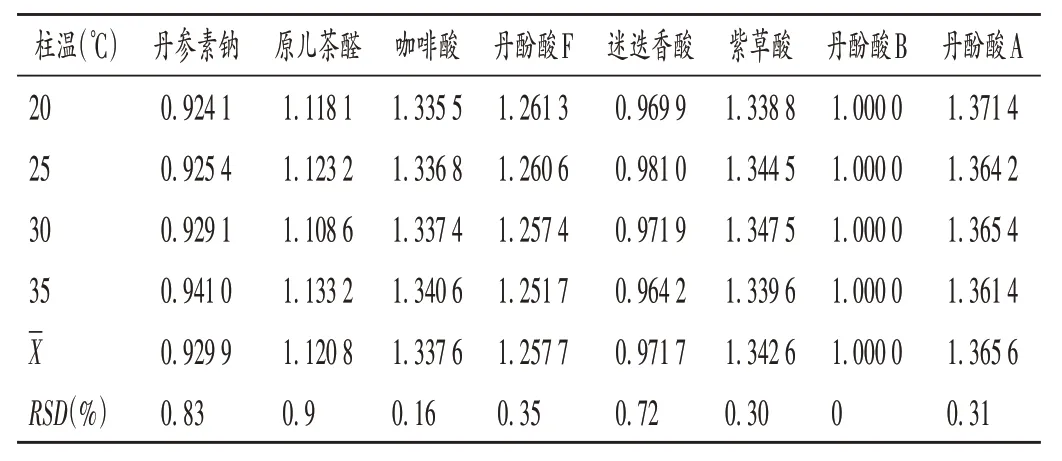
表5 不同柱温对相对校正因子的影响Tab.5 Effect of different column temperatures on relative correction factors
流速:取药材样品(编号S5)适量,按2.2 项下方法制备供试品溶液,再按2.1 项下色谱条件(分别设置流速为1.0,1.1,1.2,1.3 mL/min)进样测定,记录峰面积并计算样品含量,结果见表6,各待测成分f值的RSD均小于1.0%,表明流速发生一定程度变化时,本方法能满足试验要求,耐用性良好。

表6 不同流速对相对校正因子的影响Tab.6 Effect of different flow rates on relative correction factors
2.6 待测成分色谱峰定位
取2.5项下供试品溶液适量,分别注入不同高效液相色谱系统(同2.5 项下色谱仪、色谱柱),计算各成分的相对保留时间[3]。结果的RSD均小于1.00%。详见表7。

表7 各待测成分的相对保留时间Tab.7 Relative retention time of each component to be tested
2.7 QAMS 法与外标法测定结果比较
取16 批药材样品各适量,按2.2 项下方法制备供试品溶液,按2.1项下色谱条件进样测定,记录峰面积,分别采用外标法与QAMS法计算各成分含量,配对t检验结果表明,2种测定方法的结果无显著差异(P>0.05),详见表8和表9。

表8 外标法与QAMS法含量测定结果(mg/g)Tab.8 Results of the content determination of seven components determined by external standard method and QAMS method(mg/g)

表9 配对t 检验分析结果Tab.9 results analyzed by paired t test
3 讨论
3.1 丹参药材样品选择
有研究表明,炮制方式等外部因素会导致丹参药材劣变、药性改变、有效成分损失等问题出现,影响药材的供应和以其为原料的中成药的质量[4-8]。为消除上述干扰因素,对药材样品的选择尤为重要。故预试验中以样品(编号S6)为研究对象,按不同炮制及烘干方式(阴干、晒干、55 ℃烘干、切片阴干、切片晒干、切片55 ℃烘干)处理样品,结果丹参药材中丹酚酸B 含量相比丹参饮片中的高。温度的升高和光照使丹酚酸B部分损失或转化,从而降低其含量[9-12]。阴干法则很好地避免了诸多不利因素,较好地保持了丹参原药材的药性及有效成分,故丹酚酸B 的损失较少。炮制工艺对丹参饮片的质量影响很大。生品饮片相对于原药材,需经洗、晾、焖、润、切等炮制工艺,此过程受物理因素和化学因素的影响,丹酚酸B等水溶性成分的含量流失过多。因此,当丹参入药时,忌冲洗、曝晒,以避免有效成分流失。故本研究中选择丹参药材样品(编号S1 - S16)均以原药材阴干入药,以最大限度地保留丹参有效成分,能更客观全面地反映丹参内在品质。
3.2 丹参QAMS 法质量评价
关于丹参的检验标准方法,2020 年版《中国药典(一部)》规定了丹参酮类成分采用丹参酮ⅡA为参照,以f来计算其他丹参酮类成分的含量。但相对于丹参中丰富的活性成分和广泛的应用,单一质量控制指标不能客观全面地反映丹参中各水溶性成分的含量差异和变化规律。随着近年丹参中的丹酚酸F、丹酚酸G、丹酚酸A等成分被深入研究,其更多潜在应用价值被发现。这些成分的提取方法和测定方法也倍受重视。本研究中因购买不到丹酚酸G 对照品,仅选择丹酚酸F、丹酚酸A等主要活性成分为研究对象[13-14],并采用f计算其他待测成分的含量,较客观地反映了丹参药材(尤其是商洛丹参)中酚酸类成分的分布规律。同时为丹参药材等级划分及道地性差异的研究提供了一种切实可行的研究方法。经耐用性评价和系统适用性试验,该方法可行且高效。QAMS 法测定各成分含量与外标法测定结果无显著差异,表明该方法准确且科学。不仅可弥补对照品昂贵稀缺的不足,简化试验步骤,节省时间和成本,还可以更加科学全面地评价丹参药材的品质和等级,有助于更好地区分药材的道地性差异,为其质量控制提供有力的技术支撑[15-19]。为了更全面地反映丹参药材的质量,今后将对其中的丹酚酸G等成分继续展开研究和分析。
