监管认定所需假劣药检验模式的建立*
2023-05-26黄宝斌洪建文倪维芳张炜敏黄清泉
黄宝斌,洪建文,倪维芳,张炜敏,薛 晶△,黄清泉
(1. 中国食品药品检定研究院,北京 102629; 2. 广东省药品检验所,广东 广州 510663; 3. 浙江省食品药品检验研究院,浙江 杭州 310052)
2015 年8 月启动的药品审评审批制度改革重新调整了药品审评与检验的关系,提出“(以)审评为核心,检验为支撑”的工作模式[1],药品检验机构基于审评需要开展注册检验。上市后的假药、劣药(简称假劣药)认定,相关政策法规将监管与检验“部分解绑”。2019年12月起施行的《药品管理法》要求,假劣药认定需要依法载明检验结论[2]。2020年7月,《国家药监局综合司关于假劣药认定有关问题的复函》(以下简称《复函》)明确了需要和不需要检验支撑的假劣药认定情形[3]。2022 年3 月,中华人民共和国最高人民法院和最高人民检察院(简称“两高”)联合发布《关于办理危害药品安全刑事案件适用法律若干问题的解释》(以下简称《两高司法解释》)[4],进一步明确了检验机构在假劣药认定中应发挥作用的情形。然而,各地药品监管部门和司法部门对“依法载明”理解不同,执行不一,易形成“逢认定必检验”的误解。基于药品监管认定需求和相关法规政策调整,本研究中建立了假劣药认定工作模式,提出其有效运行的基本条件,既能合理有效利用检验资源,又能提高假劣药认定的量与效率。现报道如下。
1 假劣药定义及认定要求
1.1 假劣药定义
《药品管理法》第九十八条重新调整了假劣药定义,删除“按假劣药论处”的形式假劣药,保留以疗效为核心的实质假劣药[5]。详见表1。

表1 《药品管理法》假劣药定义及类型Tab.1 Definitions and types of falsified and substandard drugs in the Drug Administration Law
1.2 法规政策明确假劣药认定要求
《药品管理法》的要求:2015 年4 月修正的《药品管理法》第七十七条规定,“对假药、劣药的处罚通知,必须载明药品检验机构的质量检验结果”[6]。《药品管理法》第一百二十一条规定,“对假药、劣药的处罚决定,应依法载明药品检验机构的质量检验结论”。可见,《药品管理法》重新界定了假劣药认定时的检验支撑作用,实现了从“必须”到“依法”的转变,对检验依赖程度有所减轻。但各地药品监管和司法机关对“依法载明”理解不一,执行尺度不同。
国家药品监督管理局解读:《复函》认为,对假劣药的认定应当以合法、有效、充分的证据为基础,药品质量检验结论并非认定必要依据。其中1种认定为假药的情形及5 种认定为劣药的情形,仅需事实认定,无需检验。详见表2。
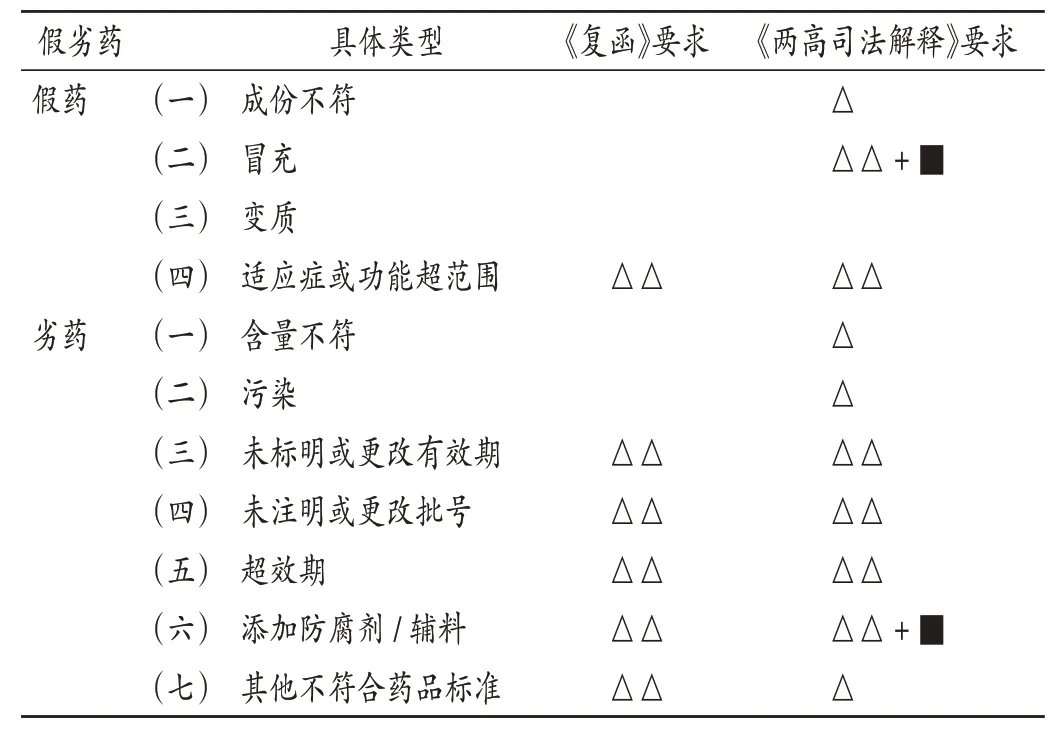
表2 假劣药的监管认定与检验需求Tab.2 Regulation identification and testing requirement for falsified and substandard drugs
“两高”出台法律解释:《两高司法解释》从法律层面明确了假劣药认定程序[7],在《复函》基础上,对于假劣药认定所需检验作出进一步解释。《两高司法解释》第十九条明确了4 种需要检验支撑的情形及6 种不需要检验支撑的情形(但其中2 种情形认定时如存在争议,仍需检验来支撑)。详见表2。
假劣药认定是假劣药案件移送和办理的重要前提,需要兼顾质量与效率,以有效支撑行政执法和刑事司法为最终目标[8]。
2 检验模式的建立
2.1 检验结果用于药品质量判定的局限性
检验是依靠检验标准来得出检验结果,继而形成检验结论。依据检验标准判定药品质量的前提是药品按照核准的处方、生产工艺,在药品生产质量管理规范(GMP)条件下生产。任何违反GMP 或有未经批准添加物质所生产药品,即使符合《中国药典》或按《中国药典》未检出其添加物质或相关杂质,亦不能认为其符合规定。如不符合上述前提条件,正常药品标准就会“失灵”,无法对药品质量作出客观判定。在此情况下,一是可以考虑借助药品补充检验方法[9];二是需要结合其他监管手段提供信息或线索,建立适合的检验方法。由于检验的局限性,如果产品生产过程不规范,会导致检验结论无法反映真实情况,或检验机构无法检验。
2.2 符合法规政策的新要求
《复函》和《两高司法解释》相继明确了假劣药认定中监管部门与检验机构的职责,检验由传统意义上的“必选项”变为新要求下的“可选项”。按照《食品药品行政执法与刑事司法衔接工作办法》要求[10],作为行政执法部门,药品监管部门出具假劣药认定意见,与司法机关直接衔接,检验机构为监管部门出具认定意见提供技术支撑,或是应司法机关请求,监管部门委托检验机构为司法部门提供检验结论。
2.3 借鉴国际假药认定工作实践
世界卫生组织(WHO)疑似假药认定工作指南采取递进式策略开展疑似假药认定工作[11]。首先,药品监管部门开展基于风险的调查,包括生产现场、投诉举报、供应链中异常情况等;然后再通过包装鉴别和实验室检验进行产品认定。为更有针对性地支撑药品监管部门认定工作,WHO建议明确需要检验机构回答的问题,包括是否符合注册证书所载明的注册标准,标准内外的目标成份,不同可疑产品之间是否存在联系,是否有适合的检验标准。
3 新假劣药检验工作模式有效运行的基本条件
3.1 判断产品性质工作
对于在“黑窝点”查获的无功能声称、无标识、无说明书类产品,可按照《药品管理法》第二条药品的定义,从是否用于预防、治疗、诊断人的疾病,是否有目的地调节人的生理机能并规定有适应症或功能主治、用法和用量的物质的角度判断该产品是否属药品。如能初步判断其为非药品,则无须再进行是否属于假劣药的判定。
3.2 明确检验需求
监管部门在已掌握的现场、产品和嫌疑人供诉等信息基础上,对法规要求检验的,可与检验机构进行充分沟通,明确检验需求。确保这些需求确实需要检验来解决,且是检验能解答的问题。可参考WHO 在疑似假药认定程序中提出的需要检验机构来回答的问题。
3.3 划清检验事权
《两高司法解释》第十九条规定,认定所需检验应当由省级以上药监部门设置或确定的药品检验机构承担。国家药品监督管理局规定疑似假劣药案件办理采取分级管理和属地管辖相结合原则[12]。作为监管技术支撑机构,药品检验机构在开展假劣药认定所需检验时,要划清与监管事权相匹配的检验事权。原则上药品监管部门出具假劣药认定意见需要的,应委托同级药品检验机构开展检验。特殊情况下,如果省级药品检验机构尚不具备相关项目的检验资质或能力,可由省级药品监督管理部门或省级药品检验机构委托国家级药品检验机构开展检验。从长期发展来看,省级药品监管部门或药品检验机构应按照《“十四五”国家药品安全及促进高质量发展规划》要求,补齐短板,加强检验机构的能力建设[13]。
3.4 规范检验要素
检验要求有3个方面:样品的真实性和代表性是保障检验结果准确性的重要物质基础。对于规范条件下生产药品的符合性检验[14],样品应满足以下3 项基本要求。1)数量。一般情况下,应为1次检验用量的3倍,特殊情况下可酌情减量,但不得少于1 次检验用量。2)包装与标识。包装完整,有完整标签,标签内容应至少包括名称、批号、规格、有效期、生产单位、特殊贮存条件等信息。3)剩余效期。不得短于2个完整的检验周期。此外,由于疑似假劣药调查性检验的样品来源广泛且复杂,存在数量不足、批次混乱、储运条件不符合要求等影响样品真实性和代表性的问题,特别是样品的真实性。为尽量确保样品满足检验需要,建议药品监管部门或司法机关与检验机构建立有效沟通协调机制,根据检验目的共同商定样品需求。确需抽样的,可请药品监管部门指导,按规范抽样[15]。如样品量仅能满足1次检验,需由监管部门出具“检验不复试,检验结果只供参考”的书面承诺;对于来自“黑窝点”的疑似假药,可接受包装不完整样品;对于过效期样品,如果监管部门明确需要检验标准以外的非法添加成份,检验机构也可以受理。
检验依据要合法合理:检验依据是药品检验机构对样品进行检验时所依据的标准,是得出检验结果,出具检验结论的重要参考。调查性检验的主要目的是识别涉案产品中的嫌疑物质,检验含量和纯度,需有初筛和确证方法。如需进行含量测定,则需要定量方法。对于疑似假劣药,监管部门或司法机关要与药品检验机构共同做好受理合同评审,根据样品特点、监管部门需求,选择或商定合适的检验依据,兼顾法定性与可行性[15-16]。首先,选择法定标准,出具法定检验报告,包括国家药品标准、药品注册标准和药品补充检验项目与方法[17],且前两者不适用时,需考虑使用后者。其次,考虑标准获得的及时性。考虑到行药品补充检验时检验方法的起草、复核、审评批准需要一定时间,不一定能满足监管急需。如无已批准的药品补充检验方法,可考虑使用实验室自建方法,在出具检验结果时提供方法验证资料;再次,药品监管部门或司法机关应提供与样品或违规生产等相关的信息,为检验方法的选择或建立提供线索,尽量确保检验机构能及时开展检验。
检验结论具法律效力:《两高司法解释》第十九条及《药品管理法》第一百一十三条、第一百二十一条均规定,在假劣药认定时需要载明“检验结论”。根据检验依据不同,检验结论分为2 种形式,一是格式化的检验报告书,依据国家药品标准、经核准的注册标准、经批准的药品补充检验方法,出具法定检验报告,给出检验结论;二是检验意见书,在无法定标准,需参照已注册品种标准或国外药典方法,或根据样品掺杂掺假线索新建方法,检验机构以发函形式报告检验结果。另外,虽使用法定方法,如样品不符合质量体系的要求,也可采用检验意见书的形式。但不论是按照质量管理体系要求出具的制式化报告书,还是出具的检验意见书,药品检验机构均应承担相同的法律责任,对出具的结果负责。
4 结语
本研究中提出以监管认定为核心的假劣药检验模式,打破了传统的检验与监管过度“捆绑”的思维定式,可更好地指导药品监管部门按照新的法规政策要求开展假劣药认定工作,既能合理有效利用检验资源,将检验与监管适度“解绑”,又能提高假劣药认定工作的质量与效率,还能实现监管执法与刑事司法的有效衔接。
