GGT1 基因SNP 预测乳腺癌术后EC-T 化疗方案血液系统毒性临床研究*
2023-05-26梁兴忠石祥奎吴昕雨胡书群
沐 宇,彭 瑞,梁兴忠,石祥奎,吴昕雨,胡书群,黄 亭△
(1. 江苏省徐州市妇幼保健院·徐州医科大学附属徐州妇幼保健院,江苏 徐州 221000; 2. 徐州医科大学附属医院,江苏 徐州 221000)
乳腺癌是危害妇女健康的主要恶性肿瘤,全世界每年约有120万女性患者确诊。早期原发灶经手术切除后,辅以化学药物治疗(简称化疗)是消除术中残余和全身散在癌细胞(血源性转移)的有效手段,可显著降低复发概率[1],但必须警惕化疗引起的毒性反应。相关研究表明,遗传因素是增加化疗毒性的重要原因之一[2]。其中,单核苷酸多态性(SNP)是最常见的遗传学改变。谷氨酰转肽酶1(GGT1)基因位于人类第22 号染色体,GGT 通常分布于导管和腺体表面,在肝、肾、胰腺等分泌活跃的细胞上表达较多,GGT 对于维持机体内谷胱甘肽(GSH)和半胱氨酸的稳态至关重要[3]。GSH作为抗氧化剂,能中和氧自由基,保护细胞免受氧化应激,GGT 依赖的促氧化反应能调节细胞的增殖和凋亡,在肿瘤细胞的生长过程中扮演重要角色[4]。GGT 在多种恶性肿瘤中表达异常,促进了肿瘤细胞的增殖,并影响了患者的化疗耐药和预后[5-6]。表柔比星联合环磷酰胺序贯紫杉醇类制剂(EC-T)方案是临床广泛采用的乳腺癌术后辅助化疗的一线方案,但同时会引起许多药品不良反应,其中骨髓抑制是其剂量限制性药品不良反应,常表现为白细胞减少、中性粒细胞减少,制约着化疗剂量和化疗周期的实施,影响肿瘤的缓解率与治愈率[7]。为此,本研究中探讨了乳腺癌患者GGT1基因SNP 与术后EC - T 化疗方案血液系统毒性的相关性,以期为乳腺癌术后化疗患者血液毒性的预防提供参考。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:年龄>18岁且3代以内亲属无乳腺癌病史;经手术治疗,术后病理检查确诊为原发浸润性乳腺癌,至少有1个可测量病灶;美国东部肿瘤协作组(ECOG)评分≤2 分,卡氏(KPS)评分>75 分;化疗前各项临床指标均达标(血红蛋白≥80 g/ L,白细胞计数≥1.5 ×109/L,血小板计数≥100×109/L,丙氨酸氨基转移酶、天门冬氨酸氨基转移酶、血肌酐均不超过正常上限值的1.5 倍,肌酐清除率≥60 mL/ min,心电图示心律正常);术后接受EC-T序贯化疗。
排除标准:已出现远端转移或合并其他恶性肿瘤;患乳腺癌,且既往有化疗、放射治疗或伽马刀等治疗史;妊娠期或哺乳期;对本研究中拟用药物过敏;血液系统疾病或其他严重疾病,包括严重糖尿病、重度高血压,6个月内出现过心力衰竭,以及有心肌梗死史等。
病例选择:收集徐州市妇幼保健院乳腺外科2021年1月至12月接受EC-T 化疗方案的乳腺癌术后患者60例。本研究方案经医院医学伦理委员会批准,患者签署知情同意书。
1.2 基因测序及分型
采集患者外周静脉血2 mL,采用Ezup 柱式血液基因组DNA 抽提试剂盒(生工生物工程<上海>有限公司,简称生工生物公司)提取DNA,严格按试剂盒说明书操作,产物置- 20 ℃冰箱中保存。选取rs5751901 和rs2017869 两个SNP 位点,以rs5751901 上游引物5′ -ACCATAGGCAGAGTAAGGACCTG - 3′和下游引物5′ - AGCAGCCAAGGAAGGCCAA - 3′,rs2017869 上游引物5′-GATGGCAGTTCGGGATGTCATGC-3′和下游引物5′ - ACACCAGGAAGGCTGTGCAAAC - 3′进行聚合酶链式反应(PCR),且目的片段长度均为201 bp,反应体系为10 × Buffer 5 μL(含MgCl2),dNTP 5.0 μL(10 mmol/L),上下游引物各2.5 μL(10 μmol/L),Taq DNA 聚合酶1.0 μL(5 U/μL),DNA 模板9.0 μL。反应条件为94 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,32个循环;72 ℃5 min终止反应。
取PCR 扩增产物5 μL,加1 μL Loading Buffer 混合,加样于2.0%琼脂糖凝胶中进行水平电泳(电压80 V,时间40 min)DNA Marker 为碱基量标准。观察在201 bp处出现条带且其他位置处无干扰条带即为PCR 扩增成功。将PCR 产物进行基因测序(生工生物公司)确定基因型。
1.3 EC-T 序贯化疗方案
均以21 d 为1 个周期。第1~4 个周期,第1 天予注射用盐酸表柔比星(山东新时代药业有限公司,国药准字H20123260,规格为每支10 mg)90 mg/ m2和注射用环磷酰胺(山西普德药业股份有限公司,国药准字H14023686,规格为每支200 mg)600 mg/m2;第5~8 个周期,周期第1 天均予紫杉类药物,包括多西他赛注射液(江苏恒瑞医药股份有限公司,国药准字H20020543,规格为每支20 mg)75 mg/m2;或紫杉醇注射液(扬子江药业集团有限公司,国药准字H20053001,规格为每支30 mg)175 mg/m2;或注射用紫杉醇(白蛋白结合型,江苏恒瑞医药股份有限公司,国药准字H20183378,规格为每支100 mg)260 mg/m2;或注射用紫杉醇脂质体(南京绿叶制药有限公司,国药准字H20030357,规格为每支30 mg)135~175 mg/m2。
1.4 资料收集
收集患者的人口学资料(包括年龄、体质量指数<BMI >、个人疾病史、吸烟史、家族史等)和临床资料(包括TNM 分期、分化情况、淋巴结转移情况、化疗方案等)。记录患者的基因型分布及化疗过程中各项毒性反应(包括中性粒细胞减少、白细胞减少、血红蛋白减少、血小板减少)发生情况,并根据世界卫生组织(WHO)抗癌药物毒性分级标准分级。
1.5 统计学处理
采用SPSS 19.0 统计学软件分析。计量资料以X±s表示,行t检验;计数资料以率(%)表示,行χ2检验。以χ2拟合优度检验验证各SNP 基因型是否符合Hardy -Weinberg 平衡;以χ2检验比较各基因型与不良反应间的关系;以Logistic 回归分析比值比(OR)及其95%置信区间(CI)表示相对危险度(以野生型默认风险为1,分析杂合突变型和纯合突变型的相对风险)。P<0.05 为差异有统计学意义。
2 结果
2.1 GGT1 SNP 基因型分布
GGT1rs5751901 位点共检出2 种等位基因(C,T)和3 种基因型(TT 型、TC 型、CC 型),rs2017869 位点共检出2 种等位基因(C,G)和3 种基因型(GG 型、GC 型、CC 型),基因型分布见表1[基因频率=该基因的总数/(该基因的总数+ 等位基因的总数),其中频率最低的为最小等位基因频率],均符合Hardy - Weinberg 平衡定律(P>0.05)。表明样本来自同一孟德尔遗传群体,具有群体代表性。

表1 GGT1 SNP基因型分布Tab.1 Distribution of genotypes of GGT1 gene with SNP
2.2 GGT1 SNP 与药物毒性严重程度的相关性
出现2 级及以上中性粒细胞减少、白细胞减少、血红蛋白减少、血小板减少的患者分别有43例(71.67%)、48例(80.00%)、34例(56.67%)、8例(13.33%)。
Logistic 回归分析结果显示,对于rs5751901 位点,与TT型+TC型患者比较,CC型患者出现2级及以上中性粒细胞减少的风险显著降低(P<0.05);与TT 型+CC 型患者比较,TC 型患者出现2 级及以上中性粒细胞减少的风险显著升高(P<0.05),但经年龄、BMI、月经状态等因素校正后差异无统计学意义(P>0.05)。详见表2。

表2 GGT1 SNP与中性粒细胞减少严重程度的相关性Tab.2 Correlation between SNP of GGT1 and severity of neutropenia
对于rs5751901 位点,与TT 型+ TC 型患者比较,CC 型患者出现2 级及以上白细胞减少的风险显著降低(P<0.05)。详见表3。

表3 GGT1 SNP与白细胞减少严重程度的相关性Tab.3 Correlation between SNP of GGT1 and severity of leukopenia
对于rs2017869 位点,与GG 型和GG 型+ GC 型患者比较,CC 型患者出现2 级及以上血红蛋白减少的风险显著降低(P<0.05)。详见表4。两位点与血小板减少严重程度无显著相关性。详见表5。
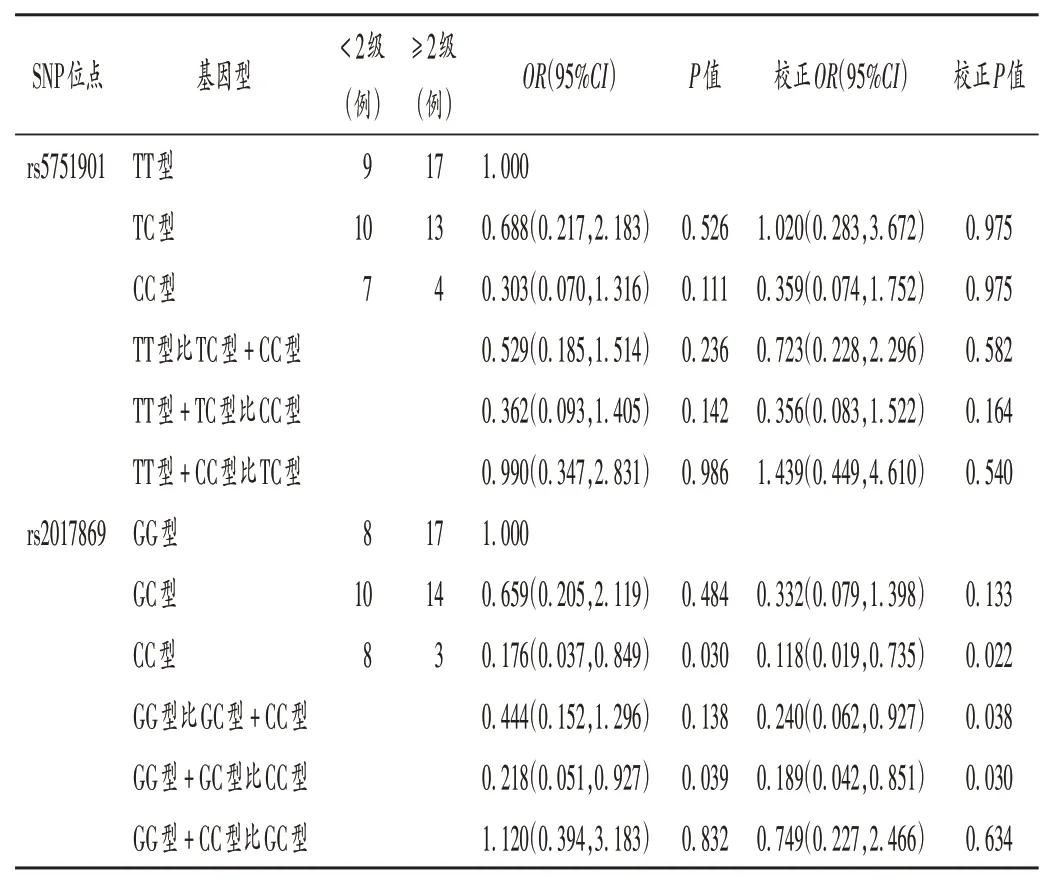
表4 GGT1 SNP与血红蛋白减少严重程度的相关性Tab.4 Correlation between SNP of GGT1 and severity of hemoglobin reduction

表5 GGT1 SNP与血小板减少严重程度的相关性Tab.5 Correlation between SNP of GGT1 and severity of thrombocytopenia
3 讨论
GGT 能将细胞外的GSH 水解为谷氨酸、半胱氨酸和甘氨酸,使细胞回收利用氨基酸[3],GGT/ GSH 为细胞抗氧化防御系统的重要组成部分[8]。GGT 抗氧化和促氧化功能间可能存在平衡,当细胞GGT 过表达或在氧化还原因子的存在下,促氧化作用可能更占优势,其促氧化活性有助于肿瘤组织保持持续的氧化应激状态,并参与细胞增殖/ 凋亡等肿瘤进程,以及产生耐药[9]。在乳腺癌中,GGT 高活性与预后不良因素(雌激素受体阴性、淋巴结转移)显著相关,GGT 阴性的乳腺癌患者预后更好,对于原发性转移性乳腺癌患者,治疗前血清高GGT 水平与较低的5 年总体生存率显著相关[10]。研究表明,血清GGT水平受环境因素和遗传因素双重调控,且其遗传力为61%[11]。全基因组关联研究(GWAS)已在不同种群中证实了GGT1SNP 与血清GGT表达水平间的相关性,SNP 会影响GGT 在组织和血清中的水平,最终影响肿瘤的发生、发展和化疗效果[11-12]。
目前,关于GGT1SNP 的研究多集中在rs5751901,rs2017869,rs8135987 这3 个位点。KHRUNIN 等[13]在卵巢癌化疗患者中研究了GGT1与药物毒性反应的关系,发现在接受顺铂化疗期间,携带rs5751901 TT型的患者发生肾毒性的风险有增加趋势。但鲜有乳腺癌术后化疗中GGT1SNP和化疗毒性是否存在相关性的研究。EC-T方案为乳腺癌术后常用化疗方案,其引起的血液毒性备受临床关注,同时药物基因组学的发展也为EC - T的不良反应研究提供了帮助[14-15]。本研究中,患者化疗后出现的主要血液毒性是中性粒细胞减少、白细胞减少、血红蛋白减少和血小板减少。Logistic 回归分析显示,中性粒细胞减少和白细胞减少主要与rs5751901位点有关,血红蛋白减少主要与rs2017869位点有关,血小板减少与此两位点可能无关。携带rs2017869 CC 型对于乳腺癌术后患者经EC-T 化疗后出现的血红蛋白减少为保护因素;携带rs5751901 CC 型的患者化疗后出现中性粒细胞减少和白细胞减少的风险更低,携带rs5751901 TC 型的患者化疗后出现中性粒细胞减少的风险更低。因此,对于携带rs5751901 TT 型+ TC 型患者,化疗前需严格把握化疗对血液指标的要求,同时化疗过程中应密切监测血常规,警惕3度、4度中性粒细胞减少和白细胞减少出现。MELZER 等[16]研究发现,rs5751901 的CC 型与血清GGT 水平相关,每个少见等位基因会增加0.21个标准差增量,证实了GGT1SNP 与血清GGT 水平间的相关性。根据本研究结论可进一步推论,血清GGT 高水平的患者出现3 度、4 度中性粒细胞减少和白细胞减少的风险较小,这一相似结论在鼠模型中也被证实[17]。不可否认的是,EC-T 化疗方案由于药物自身的特点,引起的血液毒性普遍较严重,而单一的SNP位点对其影响可能有限,或存在假阳性/假阴性的结果,尚需扩大样本进一步验证。
综上所述,乳腺癌术后EC-T 化疗患者GGT1SNP和化疗血液毒性存在一定相关性,GGT1SNP 在血液毒性的预测和尽早干预方面具有潜在价值。本研究中的患者化疗后血小板减少发生率较低,可能与样本量偏小有关,下一步将扩大样本量对上述结果进行证实,并进一步在细胞水平揭示GGT1SNP 对GGT 蛋白功能的影响及其机制。
