丹参酮ⅡA对人肺腺癌细胞A549 生物学行为的影响初探*
2023-05-26袁胜芳项保利张志华牛向欣赵建清
王 布,邹 芳,袁胜芳,项保利,张志华,顾 鑫,牛向欣,赵建清
(河北北方学院附属第一医院呼吸与危重症医学科,河北 张家口 075000)
2020 年全球恶性肿瘤统计数据显示,肺癌是恶性肿瘤患者的主要死因之一,其发病率约为11.4%,仅次于乳腺癌[1]。肺腺癌为非小细胞肺癌(约占肺癌的80%)最常见亚型(约占50%)[2-3]。非小细胞肺腺癌患者早期无特征性表现,确诊时多处于中晚期,且预后较差、生存时间一般较短。现有治疗手段常伴明显的副作用,致使患者机能下降、生活受限。研究中医药的抗肿瘤机制对指导临床用药及开发新的抗肿瘤药物具有积极意义。丹参始载于《神农本草经》,具有活血、散瘀作用[4],其主要成分丹参酮ⅡA可影响多种肿瘤细胞的生物学行为,抑制其增殖、推动程序性死亡[5-8]。本研究中初步探讨了丹参酮ⅡA对人肺腺癌细胞A549 生物学行为的影响及其相关机制。现报道如下。
1 材料与方法
1.1 仪器、试药与细胞
仪器:Eculipse Ts2 型倒置显微镜(日本Nikon 公司);Spectra Max M5 型酶标仪(美国MD 公司);BBD6220型CO2培养箱(美国ThermoFisherScientific公司);AriaⅢ型流式细胞仪(美国BD公司)。
试药:丹参酮ⅡA(北京百灵威科技有限公司,批号为LUC0Q43,含量97%);二甲基亚砜(DMSO,武汉赛奥斯生物科技有限公司,批号为B326BA3887,含量≥99.5%);磷酸盐缓冲液(PBS)、胰蛋白酶(美国Hyclone 公司,批号分别为B01124701,AD24221175);Trizol 试剂盒(美国Invitrogen 公司,批号为15596-026);Annexin V/碘化丙啶(PI)双染试剂盒(美国BD 公司,批号为9312842);胎牛血清(FBS)培养基(美国Gibco 公司,批号为42Q0682K);实时荧光定量聚合酶链反应(RT -qPCR)试 剂 盒( 美 国 Promega 公 司,批 号 为0000497768);Transwell小室(美国Corning公司,批号为3412);四甲基偶氮唑蓝(MTT)溶液(美国Sigma 公司,批号为M2128,质量浓度为5 mg/mL);基质金属蛋白酶(MMP)-2、MMP-9、整合素(integrin)α2、integrin β1、细胞周期蛋白(Cyclin)B1、半胱氨酸蛋白酶3(Caspase-3)的抗体(上海艾博抗有限公司,批号分别为ab181286,ab137867,ab133557,ab136524,ab32072,ab4051)。
细胞:人肺腺癌A549细胞株(上海奥陆生物科技有限公司)。
1.2 方法
细胞培养与分组:将A549 细胞置含10%FBS 的DMEM 培养基(简称培养基)中,在37 ℃、5% CO2培养箱中培养。以酶消化法(0.25%EDTA 胰蛋白酶溶液)传代,培养细胞至对数生长期。实验分为空白对照组(A组,等体积培养基),顺铂组(B 组,10 μg/mL 顺铂),丹参酮ⅡA(临用前以DMSO 溶解)低、中、高剂量组(C1组、C2组、C3组,5,10,20 μmol/L)。
细胞增殖能力:取对数生长期的A549细胞,将细胞密度调整为4×103个/孔,置37 ℃、5%CO2培养箱中培养24 h,细胞贴壁后弃去培养液。各组细胞加入相应药物或培养基10 μL 处理,均设6 个复孔,继续培养24,48,72 h,加入20 μL MTT 溶液培养4 h,弃去上清液,加入100 μL DMSO,振荡10 min,以酶标仪在504 nm 波长处检测吸光度(OD),并计算增殖率。
细胞迁移能力:取对数生长期的A549细胞,将细胞密度调整为3×105个/孔,待细胞贴壁后在孔内划3 条划痕,用PBS 清洗并去除悬浮细胞,各组细胞加入相应药物或培养基处理,平行3 次,用倒置显微镜于0(给药即刻),24 h时取样拍照,并计算迁移细胞数。
细胞侵袭能力:取对数生长期的A549 细胞,用培养基洗涤,将细胞密度调整为1×105个/孔。取200 μL细胞悬液加入Transwell 上室中,各组细胞加入相应药物或培养基处理,平行3 次;取培养基加入Transwell 下室。培养24 h 后,上室内的细胞用棉签擦去,以甲醇固定下室细胞,再用0.1%结晶紫染色,显微镜下随机取5个视野统计并记录侵袭细胞数。
细胞凋亡及细胞周期:采用流式细胞术。各组细胞加入相应药物或培养基处理24 h,取100 μL 细胞悬液,加入10 μL PI、5 μL Annexin V-FITC 混匀,室温下避光培养30 min。加入5 μL PI后继续避光培养10 min。以流式细胞仪检测细胞凋亡情况,并计算凋亡率。用乙醇固定细胞,PI染色处理后的RNA,再以流式细胞仪测定细胞DNA 含量,统计各周期细胞占比。2个实验均平行3次。
mRNA和蛋白表达水平:取经药物或培养基处理后的各组A549 细胞,提取mRNA,严格按RT - qPCR 试剂盒说明书操作。以GAPDH 为内参,检测mRNA表达水平。采用Western blot法,取经相应药物或培养基处理后的各组A549细胞,接种于6孔板中,培养24 h后,收集细胞提取总蛋白,以BCA 法检测蛋白浓度;电泳,转膜,封闭,加入MMP-2(1∶500,V/V),MMP-9(1∶500,V/V),integrin α2(1∶200,V/V),integrin β1(1∶200,V/V),Cyclin B1(1∶200,V/V),Caspase-3(1∶200,V/V)的一抗,4 ℃孵育过夜;磷酸盐吐温缓冲液(PBST)洗膜,加入二抗继续孵育2 h;ECL发光液显色,以凝胶成像仪成像,以β-肌动蛋白(β-actin)为内参检测蛋白表达水平。
2 结果
2.1 细胞增殖情况
与A 组比较,B 组及C1组、C2组、C3组细胞处理24,48,72 h 时的增殖率均显著降低(P<0.05),且增殖率随丹参酮ⅡA质量浓度的增加而降低。详见表1。
表1 各组细胞增殖率比较(±s,%,n=6)Tab.1 Comparison of proliferation rate in each group(±s,%,n=6)
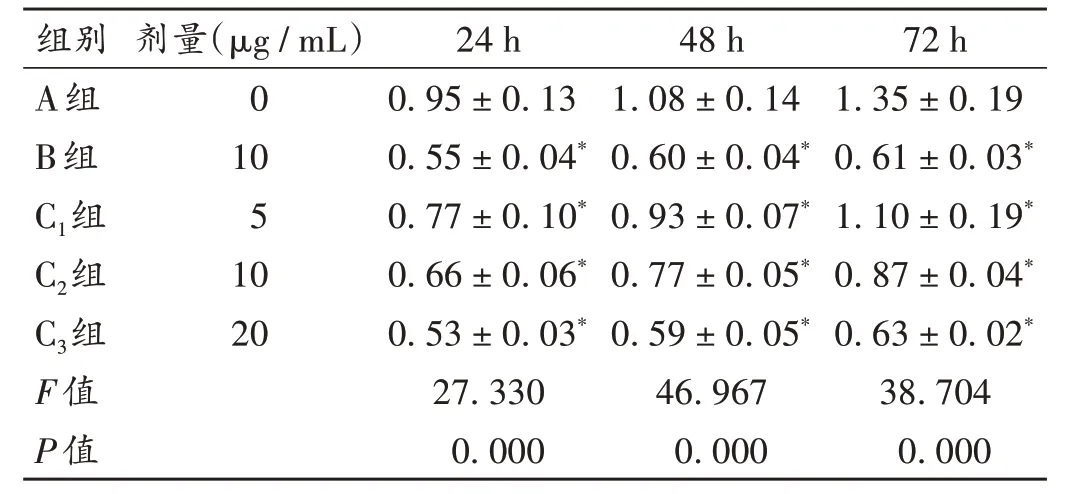
表1 各组细胞增殖率比较(±s,%,n=6)Tab.1 Comparison of proliferation rate in each group(±s,%,n=6)
注:与A组比较,*P <0.05。表2至表5同。Note:Compared with those in the group A,*P <0.05(for Tab.1 - 5).
组别A组B组C1组C2组C3组F值P值72 h 1.35±0.19 0.61±0.03*1.10±0.19*0.87±0.04*0.63±0.02*38.704 0.000剂量(μg/mL)0 10 5 10 20 24 h 0.95±0.13 0.55±0.04*0.77±0.10*0.66±0.06*0.53±0.03*27.330 0.000 48 h 1.08±0.14 0.60±0.04*0.93±0.07*0.77±0.05*0.59±0.05*46.967 0.000
2.2 细胞迁移及侵袭情况
与A 组比较,B组及C1组、C2组、C3组处理24 h的迁移细胞及侵袭细胞数量均显著减少(P<0.05),且两者数量随丹参酮ⅡA质量浓度的升高而减少。详见表2。
表2 各组细胞迁移及侵袭数比较(±s,个,n=3)Tab.2 Comparison of the numbers of migrating and invading cells in each group(±s,cell,n=3)

表2 各组细胞迁移及侵袭数比较(±s,个,n=3)Tab.2 Comparison of the numbers of migrating and invading cells in each group(±s,cell,n=3)
组别A组B组C1组C2组C3组F值P值剂量(μg/mL)0 10 5 10 20迁移细胞数134.50±7.66 62.83±3.19*116.67±5.47*82.33±5.28*65.50±3.45*219.878 0.000侵袭细胞数117.33±6.41 50.17±3.82*95.83±4.26*67.67±4.32*48.83±3.43*257.353 0.000
2.3 细胞凋亡情况
与A 组比较,B 组及C1组、C2组、C3组细胞处理24 h时的凋亡率均显著升高(P<0.05),且凋亡率随丹参酮ⅡA质量浓度的增加而升高。详见表3、图1。

图1 流式细胞图Fig.1 Results of flow cytometry detection
表3 各组细胞凋亡率及细胞周期分布情况比较(±s,%,n=3)Tab.3 Comparison of apoptosis rate and cell cycle distribution in each group(±s,%,n=3)

表3 各组细胞凋亡率及细胞周期分布情况比较(±s,%,n=3)Tab.3 Comparison of apoptosis rate and cell cycle distribution in each group(±s,%,n=3)
组别凋亡率细胞周期剂量(μg/mL)0 10 5 10 20 A组B组C1组C2组C3组F值P值3.63±1.38 48.57±4.50*24.53±3.45*36.12±4.78*49.96±4.48*143.522 0.000 G0/G1期56.42±2.13 83.28±0.85*67.77±1.46*75.54±1.04*84.01±1.25*398.523 0.000 S期26.48±1.36 12.45±0.86*19.06±1.32*15.98±0.96*11.88±1.21*158.429 0.000 G2/M期17.11±1.18 4.27±0.19*13.17±0.97*8.48±0.68*4.12±0.15*338.795 0.000
2.4 细胞周期分布
与A 组比较,B组及C1组、C2组、C3组处理24 h时的G0/G1期细胞占比均显著升高(P<0.05),且细胞占比随丹参酮ⅡA质量浓度的增加而增加;B组及C1组、C2组、C3组的S 期、G2/M 期细胞占比均显著减少(P<0.05),且随丹参酮ⅡA质量浓度的增加而减少。详见表3、图2。

图2 细胞周期分布Fig.2 Distribution of cell cycles
2.5 mRNA 及蛋白表达水平
与A 组比较,B 组及C1组、C2组、C3组的MMP - 2,MMP - 9,integrin α2,integrin β1,Cyclin B1 mRNA 和蛋白表达水平均显著降低(P<0.05),且随丹参酮ⅡA质量浓度的增加而降低;B组及C1组、C2组、C3组细胞Caspase-3的mRNA及蛋白表达水平均显著升高(P<0.05),且随丹参酮ⅡA质量浓度的增加而升高。详见表4、表5、图3。

图3 蛋白表达印迹图Fig.3 Western blot of protein expression
表4 各组细胞mRNA表达水平比较(±s,n=3)Tab.4 Comparison of mRNA expression levels in each group(±s,n=3)

表4 各组细胞mRNA表达水平比较(±s,n=3)Tab.4 Comparison of mRNA expression levels in each group(±s,n=3)
组别A组B组C1组C2组C3组F值P值Caspase-3 1 4.87±0.41*1.87±0.47*3.30±0.30*5.03±0.34*158.582 0.000 MMP-2 1 0.66±0.03*0.92±0.03*0.73±0.12*0.65±0.04*45.319 0.000 MMP-9 1 0.48±0.04*0.93±0.02*0.64±0.03*0.46±0.03*470.624 0.000 integrin α2 1 0.39±0.03*0.65±0.05*0.61±0.02*0.37±0.01*478.055 0.000 integrin β1 1 0.56±0.03*0.94±0.01*0.62±0.02*0.55±0.04*499.374 0.000 Cyclin B1 1 0.36±0.05*0.71±0.09*0.48±0.05*0.36±0.07*129.818 0.000
表5 各组细胞蛋白表达水平比较(±s,n=3)Tab.5 Comparison of protein expression levels in each group(±s,n=3)

表5 各组细胞蛋白表达水平比较(±s,n=3)Tab.5 Comparison of protein expression levels in each group(±s,n=3)
组别A组B组C1组C2组C3组F值P值MMP-2 1.03±0.02 0.61±0.04*0.87±0.03*0.69±0.05*0.63±0.03*149.906 0.000 MMP-9 1.02±0.03 0.40±0.05*0.89±0.02*0.60±0.04*0.41±0.02*395.394 0.000 integrin α2 0.97±0.03 0.37±0.03*0.62±0.04*0.57±0.03*0.34±0.02*421.856 0.000 integrin β1 1.02±0.02 0.49±0.04*0.88±0.03*0.59±0.02*0.48±0.05*304.908 0.000 Cyclin B1 0.98±0.02 0.34±0.04*0.67±0.06*0.46±0.04*0.33±0.06*200.984 0.000 Caspase-3 1.02±0.01 4.97±0.39*1.74±0.42*3.18±0.34*5.12±0.41*168.790 0.000
3 讨论
肺癌由支气管黏膜病变引发,其病因病机复杂。其中非小细胞肺腺癌特征为淋巴细胞浸润密集,且在早期易发生转移。化学药物治疗(简称化疗)、手术切除及放射治疗(简称放疗)是其常规治疗方法。但现有临床治疗方案无法显著改善肺癌患者的生存率,只能延缓病程发展。丹参酮ⅡA作为丹参的活性成分之一,常用于保护心脑血管,近年来发现丹参及其活性成分具有抗肿瘤作用。本研究结果显示,C1组、C2组、C3组A549细胞的增殖率均明显降低,迁移和侵袭细胞数均明显减少,且与丹参酮ⅡA的质量浓度呈负相关;C1组、C2组、C3组A549 细胞的凋亡率均明显升高,且与丹参酮ⅡA的质量浓度呈正相关。在一定程度上证明了丹参酮ⅡA的抗肿瘤作用。
细胞周期分为分裂期和为细胞分裂做准备的分裂间期,分裂间期受基因表达控制可合成多种蛋白对细胞的代谢活动进行调控。在DNA 合成的前中后3 个阶段均有调控细胞周期的重要时间节点,且均配备严格的调控机制[9]。其中Cyclin 蛋白为调控细胞周期的关键机制之一,可通过促进G2/M 期转换,进而加快细胞周期的进展,其表达失控与细胞的恶性增殖关系密切[10]。细胞发生程序性死亡(即凋亡)的过程有助于维持内环境稳定,是机体控制细胞数异常增多的理想方法。Caspase-3 在细胞凋亡中起重要作用,是执行过程的关键酶,可被外源性或内源性路径激活,林晋等[11]的研究发现,可通过升高Caspase - 3 的表达水平来推动人骨肉瘤细胞发生程序性死亡。提示Caspase - 3 的表达上调可诱导A549 细胞凋亡增加,可能也是丹参酮ⅡA发挥抗肿瘤作用的机制之一。肿瘤细胞的侵袭和转移能力使其能转移到除原发病灶外的其他脏器,在肿瘤转移过程中发挥重要作用。有研究显示,MMP - 2 和MMP- 9 水平升高的情况存在于多种肿瘤细胞侵袭转移过程中,且两者的水平变化可影响发生转移的肿瘤细胞数。黄敏等[12]的研究发现,瘤易感性候选基因2(CASC2)可通过降低MMP - 2 蛋白表达而抑制甲状腺癌细胞的增殖、迁移和侵袭,并促进细胞凋亡。左文娜等[13]的研究发现,喉癌组织中MMP-9 呈高表达状态,降低MMP-9 表达水平可抑制喉癌细胞的增殖、迁移、侵袭,促进喉癌细胞的凋亡。熊涛等[14]的研究证明,毛萼乙素可通过调控lncRNA CPS1-IT1表达,减少MMP-2和MMP-9蛋白表达量,抑制膀胱癌细胞的增殖、迁移、侵袭。integrin 作为黏附分子,存在于细胞表面。细胞的生物学行为可通过integrin 传导的双向信号变化来调节。研究表明,integrin α2和integrin β1在前列腺癌[15]、宫颈癌[16]等不同肿瘤细胞株中呈高表达,促进肿瘤细胞生长和侵袭。本研究结果显示,与A组比较,C1组、C2组、C3组A549细胞MMP-2,MMP-9,integrin α2,integrin β1,Cyclin B1 mRNA 表达水平均明显降低,且与丹参酮ⅡA质量浓度呈负相关;Caspase-3 mRNA表达水平明显升高,且与丹参酮ⅡA质量浓度呈正相关。说明丹参酮ⅡA对A549细胞的抗肿瘤作用可能通过调控上述mRNA表达水平实现。
综上所述,丹参酮ⅡA可抑制A549 细胞的侵袭、迁移、增殖,促进其凋亡,其机制可能与下调MMP - 2,MMP - 9,integrin α2,integrin β1,Cyclin B1 的表达和上调Caspase-3的表达有关。
