miR-196b-5p促进成肌细胞增殖分化
2023-05-23吴玲玲张小玉李晓靳建军杨公社史新娥
吴玲玲,张小玉,李晓,靳建军,杨公社,史新娥
研究报告
miR-196b-5p促进成肌细胞增殖分化
吴玲玲,张小玉,李晓,靳建军,杨公社,史新娥
西北农林科技大学动物科技学院,动物脂肪沉积与肌肉发育实验室,陕西省动物遗传育种与繁殖重点实验室,杨凌 712000
MicroRNA (miRNA)是一类由内源基因编码的长度约为22个核苷酸的非编码单链RNA分子,在动植物中参与转录后基因表达调控。大量研究表明,miRNA调控骨骼肌的发育,主要表现在肌卫星细胞的激活及增殖、分化、肌管的形成等生物学过程。本实验室前期对大白猪背最长肌(longissimus dorsi,LD)和比目鱼肌(soleus muscle,Sol)进行miRNA测序,筛选鉴定到一个在不同骨骼肌中差异表达并且序列高度保守的miR-196b-5p,目前miR-196b-5p在骨骼肌方面的研究尚未见报道。本研究进一步设计合成miR-196b-5p mimics和inhibitor对C2C12细胞进行miR-196b-5p过表达及干扰表达,利用蛋白免疫印迹、实时荧光定量PCR检测、流式细胞术、免疫荧光染色等方法探究miR-196b-5p对成肌细胞增殖分化的影响,并利用生物信息学预测和双荧光素酶报告系统鉴定了miR-196b-5p的靶基因。结果显示,过表达miR-196b-5p显著增加细胞周期基因、和的mRNA和蛋白表达水平(<0.05);流式细胞周期检测结果显示,过表达miR-196b-5p显著增加S期细胞比例(<0.05),表明miR-196b-5p能够加快细胞周期进程;EdU染色结果显示,过表达miR-196b-5p显著促进细胞增殖能力;相反,抑制miR-196b-5p的表达可以显著减弱成肌细胞增殖能力。进一步的功能研究发现,过表达miR-196b-5p能够显著增加成肌标志基因、和的表达水平(<0.05);MyHC免疫荧光染色结果显示miR-196b-5p可以促进成肌细胞肌管形成,表明miR-196b-5p可以促进成肌细胞分化。生物信息学预测和双荧光素酶实验证明miR-196b-5p可以靶向基因,抑制该基因的表达。改变表达,不能够挽救miR-196b-5p影响细胞周期的表型,可以减弱miR-196b-5p对成肌细胞分化的促进作用,表明miR-196b-5p通过靶向促进成肌细胞分化。
miR-196b-5p;成肌细胞;增殖;分化;
骨骼肌是机体最大的蛋白质存储器官,同时也是最大的产能器官,能够为机体提供各种生命活动所需的能量。骨骼肌也是人类最主要的蛋白质食物来源,提高肌肉产量及肌肉品质一直是畜牧业生产研究的重点。骨骼肌是一个高度异质性组织,具有很好的可塑性,由不同类型的肌纤维组成[1,2]。骨骼肌的生长一般包括成肌细胞增殖、分化、融合形成肌管,进一步形成成熟的肌纤维。肌生成过程是一个高度有序的过程,受一系列因子的严格调节,例如生肌调节因子(myogenic regulatory factors,MRFs)家族,包括、、和,以及生肌增强因子(myocyte enhancer factors,MEFs)家族等[3,4]。研究揭示,表观遗传调节在肌生成过程中发挥了重要作用,例如组蛋白修饰、DNA甲基化及非编码RNA调控等[5]。因此,研究骨骼肌的发育及其调控过程对于家畜育种具有重要意义。
越来越多的研究证明,非编码RNA在骨骼肌生长过程中发挥了重要作用,主要包括miRNA、lncRNA和circRNA[6,7]。miRNA是一种在真核生物中广泛存在的内源性无编码能力的单链小RNA,长约21~23个核苷酸,具有高度保守、组织特异和时序性的特点[8]。在动物体内,miRNA与靶基因的结合存在完全与不完全结合的情况,完全结合时会降解靶基因mRNA,不完全结合时则会抑制翻译[9]。大量研究表明,miRNA调控骨骼肌细胞增殖、分化和再生等过程[10]。根据miRNA在肌肉中的表达特征,miRNA可分为两种类型:一种是在肌肉中特异性表达,称为myomiRs,包括miR-1-3p、miR-133a-3p、miR-133b、miR-206、miR-208a和miR-499a-5p等[11~13]。MyomiRs在调节肌肉生长、肌再生、肌卫星细胞活化和蛋白质稳态方面至关重要。例如miR-1通过靶向组蛋白脱乙酰酶4(histone deacetylase 4,HDAC4)促进肌生成[14],miR-133通过抑制血清反应因子(serum response factor,SRF)来增强成肌细胞增殖[15],miR-1和miR-206通过靶向pax7和HDAC4抑制牛骨骼肌卫星细胞增殖并促进分化[16];另外一类miRNA在组织中广泛表达,它们也通过多种方式调节骨骼肌的生长。例如miR-24-3p通过直接靶向并调节其下游靶标ID3来促进肌母细胞分化和骨骼肌再生[17],miR-487b-3p降低IRS1的表达水平显著抑制C2C12的增殖和分化,间接影响PI3K/AKT和MAPK/Erk信号通路从而调控骨骼肌发生[18]。
目前,关于miR-196b-5p的研究主要聚焦在参与癌症的调控和脂肪代谢等方面[19,20],在骨骼肌生长过程中的功能并不清楚。研究发现,miR-196b-5p在猪骨骼肌发育不同阶段中显著差异表达[21]。本课题组前期研究发现,miR-196b-5p在猪的背最长肌(longissimus dorsi,LD)和比目鱼肌(soleus muscle,Sol)中差异表达,且在骨骼肌中高表达。因此,本研究旨在初步探究miR-196b-5p对成肌细胞增殖分化的作用,为深入研究其在骨骼肌生长发育中的作用机制提供参考。
1 材料与方法
1.1 材料
选择3头饲养在相同条件下的180日龄的大白猪,肌肉组织采集后迅速放于液氮中冷冻,并在–80℃冰箱长期保存。6只2月龄C57BL/6小鼠分别采集心脏、肝脏、脾脏、肺、肾脏、脂肪以及肌肉组织,迅速放于液氮中冷冻,后放入–80℃冰箱保存,用于RNA样品的提取。由于C2C12成肌细胞系是比较经典的研究肌肉发育过程的细胞,因此本实验选择C2C12成肌细胞系作为研究对象。C2C12细胞系购自中国科学研究院细胞库。
1.2 miRNA测序
按照Trizol说明书方法提取3头180日龄大白猪背最长肌和比目鱼肌组织RNA,由广州锐博公司进行测序。
1.3 miR-196b-5p靶基因GO功能富集分析和Pathway富集分析
miR-196b-5p成熟序列从miRBase (https:// mirbase.org/)上下载获取。运用在线预测网站TargetScan 7.1 Mouse (http://www.targetscan.org)和miRanda (http://www.mirda.org/miRanda/)进行靶基因预测分析,对靶基因功能进行GO分析和KEGG富集分析。靶基因富集分析在线网站为Metascape (https://metascape.org/gp/index.html)。
1.4 mimics、inhibitor设计合成
mmu-miR-196b-5p序列信息:5′-UAGGUAGUUUCCUGUUGUUGGG-3′,miR-196-5p (MIMAT0003813)mimics和inhibitor由上海吉玛制药技术有限公司合成。
1.5 细胞转染
将C2C12细胞接种至6孔或12孔细胞培养板,细胞铺满皿底 30%~40%(增殖)或70%~80%(分化)左右时进行转染。为过表达或干扰miR-196b-5p,采用Lipofectamine 2000分别将miR-196b-5p mimics/ mimics NC(negative control)/miR-196b-5p inhibitor/ inhibitor NC(上海吉玛制药技术有限公司)转染细胞。转染实验设置空白对照组,每组设置3/6个平行孔,将6/12孔细胞培养板置于37℃、5%CO2培养箱(上海福玛公司)中。转染6~8 h后换成不含转染试剂的培养基,继续培养24 h(增殖)/4~6天(分化),收集细胞。
1.6 实时荧光定量PCR检测
应用Primer Premier 5.0软件,按照引物设计的基本原则,设计相关基因的PCR定量引物(表1),由美国Invitrogen公司合成。miR-196-5p引物由广州锐博生物科技有限公司设计合成。PCR扩增按照SYBR Premix ExTM I说明书操作。20 μL扩增体系:cDNA 2 μL,上下游引物各0.5 μL,SYBR Green Mix 10 μL,加ddH2O补充体系至20 μL。扩增程序:95℃预变性30 s,1个循环;95℃ 5 s,60℃ 30 s,40个循环。目的基因的实验数据采用2–ΔΔCt进行相对定量分析。
1.7 蛋白提取和蛋白免疫印迹分析
培养细胞至对数生长期时收取细胞,弃掉培养基,用预冷PBS洗3次;6孔板每孔加150 µL裂解液(含有PMSF等蛋白酶抑制剂),用枪头将贴壁细胞刮下来;将刮下来的细胞和裂解液转移至1.5 mL离心管,冰上静置裂解 30 min;4℃、12,000 r/min离心10 min,将上清液转移到另一个1.5 mL离心管中;5×蛋白上样缓冲液,按照上清液∶缓冲液=4∶1的比例添加;煮沸10 min,–80℃分装保存。配制适宜浓度的SDS-PAGE胶,每孔蛋白上样量为20 μg,进行SDS-PAGE电泳。蛋白转移到PVDF膜上后在5%的脱脂奶粉封闭1 h,TBST清洗3次,一抗摇床过夜孵育(4℃)。一抗孵育结束后用TBST洗脱3次,每次10 min;二抗37℃孵育2 h,TBST洗脱3次,每次10 min,用化学发光成像系统(Bio-Rad)检测目的蛋白。利用Image J软件对蛋白条带进行量化。

表1 实时定量PCR引物信息
F:上游引物;R:下游引物。
1.8 流式细胞周期检测
将生长状态良好的C2C12细胞接种在6孔板中,培养至细胞密度达到50%时进行miR-196b-5p转染。转染至细胞密度为90%左右时用胰酶消化细胞,收集至1.5 mL离心管中,用PBS清洗细胞3次,1000 r/min离心将PBS吸干净,在离心管中加入1 mL预冷的70%无水乙醇,轻轻吹打至细胞呈悬浮状态,避免细胞团块出现,然后放置在4℃冰箱固定过夜。由西安子木生物科技公司进行细胞周期检测。
1.9 EdU染色
将生长状态良好的C2C12细胞以每孔4×103个细胞接种于96孔板中,待细胞密度达到30%~40%左右时进行miR-196b-5p转染。在37℃、5% CO2的培养箱中继续培养24 h,用细胞培养基按1000∶1的比例稀释EdU溶液(试剂A),每孔加入100 µL EdU培养基继续孵育2 h,弃培养基,用PBS清洗两遍后将细胞固定,然后根据广州锐博生物科技有限公司EdU试剂盒(C10310-1)说明书进行染色。染色完成后,立即进行观测。
1.10 CCK-8检测
将猪骨骼肌卫星细胞接种到96孔板中,每孔接种2×103个细胞,每组处理设置3个重复,并且设置空白对照组。观察细胞状态及密度,待细胞状态良好并且密度长到30%~40%左右时进行转染,用miR-196-5p mimics、inhibitor以及对应的NC处理细胞,在37℃、5% CO2的培养箱中继续培养24 h;在避光条件下,向每孔中加入10 μL CCK-8溶液,继续放入培养箱中培养2~4 h。培养2~4 h后,用酶标仪检测并用450 nm吸光度测定吸光值,并进行统计分析。
1.11 细胞免疫荧光
转染miR-196b-5p的C2C12成肌细胞诱导分化6 d,弃去培养基,PBS清洗细胞。利用4%多聚甲醛固定细胞15 min,用0.5%的Triton-100通透15 min,5%的BSA封闭液封闭细胞1 h,用5%的BSA封闭液按100∶1的比例稀释一抗MyHC (R&D Systems,MAB4470),室温孵育2 h,用含荧光标记的二抗避光孵育1 h,DAPI染细胞核10 min,用PBS洗脱3次,最后在荧光显微镜下观察拍照统计。
1.12 分化指数的测定
分化指数确定为MyHC阳性细胞中细胞核在总细胞核中的百分比,计算高倍5~6张图片的成肌细胞分化指数并进行统计。
1.13 双荧光素酶报告实验
以为例,首先需要构建psiCHECK-Sirt1- 3′UTR野生型载体和psiCHECK-Sirt1-3′UTR突变型载体,载体构建示意图参考文献[22](图1),均由通用生物安徽股份有限公司构建。将构建正确的野生型psiCHECK2-3'UTR或突变型psiCHECK2-3′UTR载体分别与miRNAs的模拟物mimics共转染48孔HEK293T细胞,48 h后收取细胞,PBS洗两遍,每孔加100 μL的1×PLB Passive Lysis Buffer,水平摇床裂解20 min,吹打均匀,吸取20 μL细胞裂解液于酶标板,加50 μL Luciferase Assay Buffer I酶标仪立刻检测荧火虫荧光素酶的荧光活性,随后加50 μL Stop & Glo Substrate,立即检测海肾荧光素酶活性。
图1 载体图谱
内切酶旁的数字表示酶切位点。
1.14 数据分析
数据使用GraphPad Prism 8.0.2进行绘图,结果以mean ± SEM表示,使用配对检验进行显著性分析。*<0.05,**<0.01,***<0.001。
2 结果与分析
2.1 miR-196b-5p的鉴定和表达分析
本研究通过对3头180日龄大白猪背最长肌(LD)和比目鱼肌(Sol)的miRNA测序,总共筛选出16个差异表达的miRNAs(Foldchange>1.2,<0.05),其中12个在比目鱼肌中高表达,4个在背最长肌中高表达(图2A)。随机选取8个差异表达的miRNA,利用qRT-PCR进行验证,与测序结果一致(图2B)。其中,miR-146b、miR-217-5p、miR-20b、miR-324和miR-122在成肌细胞增殖、分化以及肌肉再生等过程中发挥了重要作用[23~27]。Mai等[21]研究也发现,miR-196b-5p在猪骨骼肌发育不同阶段中显著差异表达。miR-196b-5p在猪和鼠等不同物种中序列高度保守(表2),组织表达谱分析发现其在猪和小鼠的骨骼肌中高表达(图2C)。进一步对miR-196b-5p的靶基因功能进行GO分析和KEGG富集分析。GO功能富集分析显示,miR-196b-5p靶基因的功能与调节肌球蛋白重链结合、线粒体DNA复制等生物过程有关(图2D);KEGG富集分析显示,miR-196b-5p靶基因的功能富集到胰岛素信号通路、钙离子信号通路等信号通路中(图2D)。这些结果暗示miR-196b-5p在骨骼肌发育过程中发挥关键作用。
2.2 miR-196b-5p对成肌细胞增殖的影响
为了研究miR-196b-5p对成肌细胞增殖的影响,本研究分别过表达和干扰miR-196b-5p,利用流式细胞周期检测、EdU染色、qRT-PCR和Western blotting等方法检测了细胞增殖能力及基因的表达。EdU染色结果表明,超表达miR-196b-5p可以显著促进成肌细胞的增殖(图3A)。流式细胞周期检测显示,超表达miR-196b-5p可以显著增加S期细胞比例(图3B)。Western blotting和qRT-PCR结果显示,超表达miR-196b-5p可以促进细胞增殖基因、和的mRNA及蛋白表达水平(图3,C和D)。相反,干扰miR-196b-5p可以抑制成肌细胞增殖能力(图4,A和B),减少增殖相关基因和的mRNA及蛋白表达水平(图4,C和D)。
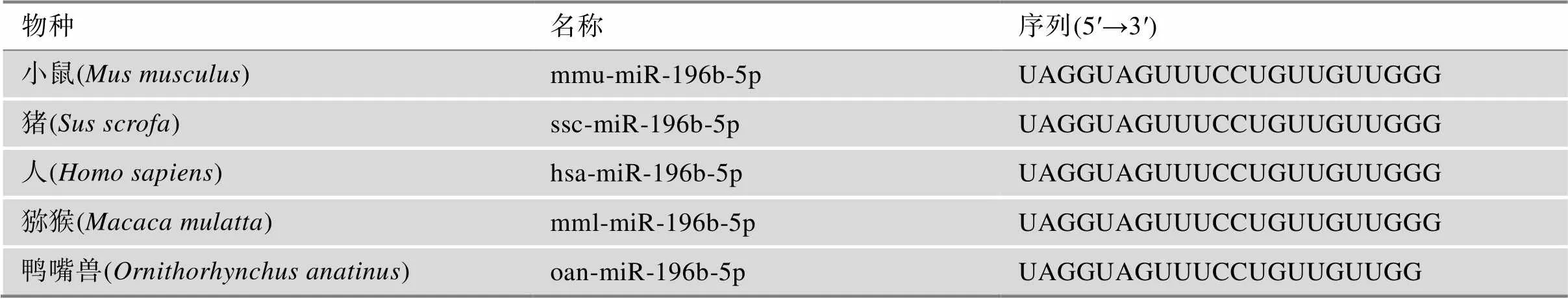
表2 miR-196b-5p保守性分析
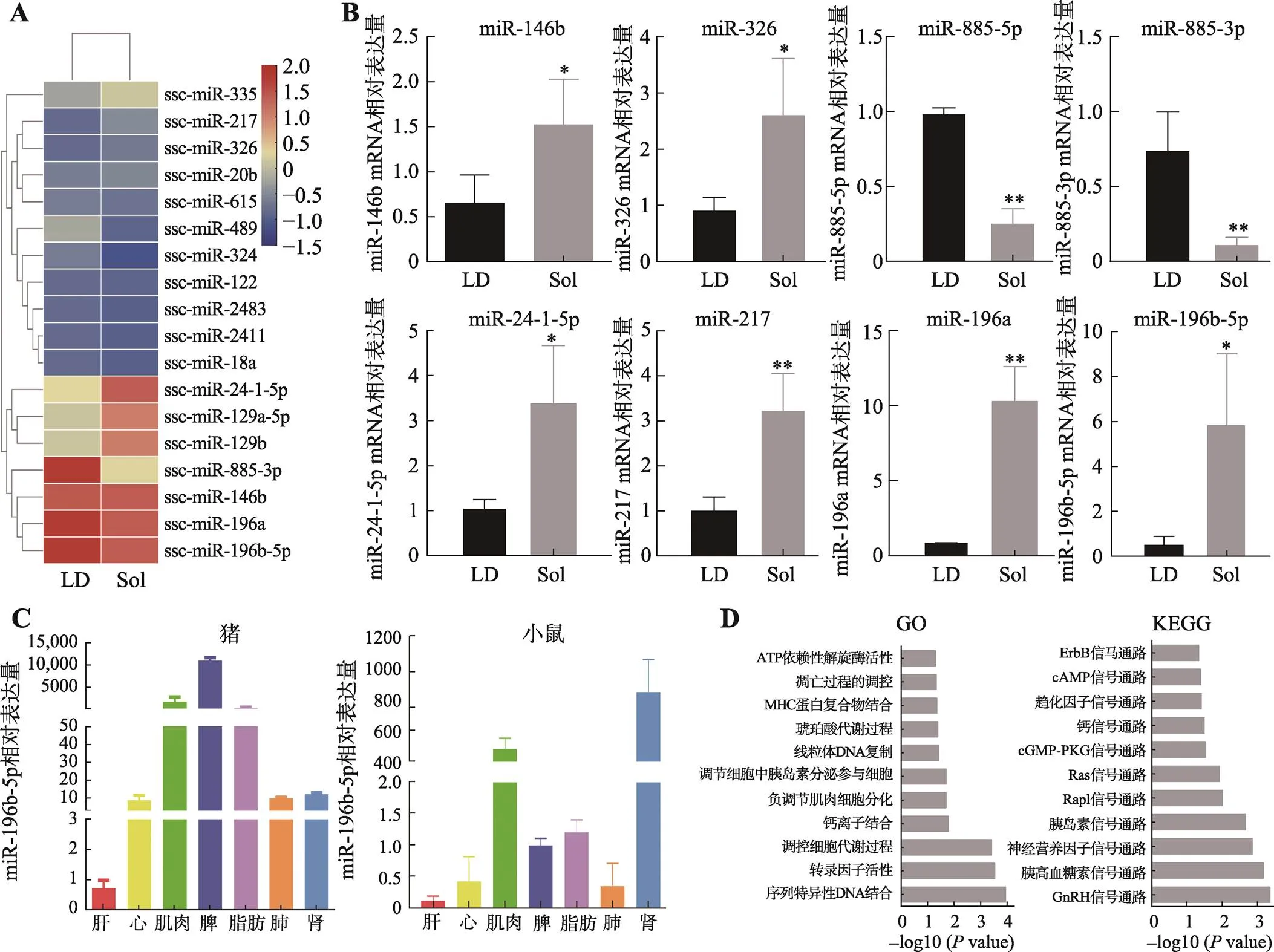
图2 大白猪背最长肌和比目鱼肌microRNA测序结果及验证
A:差异表达microRNA热图。LD:背最长肌(longissimus dorsi);Sol:比目鱼肌(soleus muscle)。B:qRT-PCR 验证LD和Sol中筛选的差异miRNA(内参基因为U6)。结果以平均值±标准误表示,n=3,*<0.05,**<0.01。C:miR-196b-5p在猪和小鼠中的组织表达谱。D:miR-196b-5p靶基因GO和KEGG分析
2.3 miR-196b-5p对成肌细胞分化的影响
为了研究miR-196b-5p对成肌细胞分化的影响,本研究利用miR-196b-5p mimics和inhibitor分别转染C2C12细胞,然后诱导分化6天,利用免疫荧光染色、qRT-PCR和Western blotting检测成肌细胞分化能力。MyHC免疫荧光染色结果显示,超表达miR-196b-5p能显著增加成肌细胞分化,促进肌管的形成(<0.01)(图5A)。qRT-PCR和Western blotting结果显示,超表达miR-196b-5p可以促进成肌分化标志基因、和的mRNA及蛋白表达水平(<0.01)(图5,B和C)。相反,干扰miR-196b-5p可以显著抑制成肌细胞分化(<0.01) (图5D)。降低成肌分化标志基因、和的mRNA表达水平(<0.01)(图5,E和F)。以上结果表明,miR-196b-5p促进成肌细胞分化。
2.4 miRNA-196b-5p靶向Sirt1
miR-196b-5p可以促进成肌细胞增殖和分化,为了进一步探究miR-196b-5p发挥作用的分子机制,本研究利用在线预测软件TargetScan和miRanda预测了miR-196b-5p的靶基因。进一步对预测的靶基因进行筛选,发现基因mRNA的3′UTR包含miR-196b-5p的靶向序列,另外在这些靶基因中只有已经被证明在调节骨骼肌分化中发挥重要作用。有研究表明,通过抑制细胞周期抑制因子的表达促进成肌细胞增殖[28];通过MEF2的去乙酰化抑制成肌细胞分化[29]。miR-196b-5p可能通过靶向调节成肌细胞分化,因此本研究选择作为靶基因进行验证。
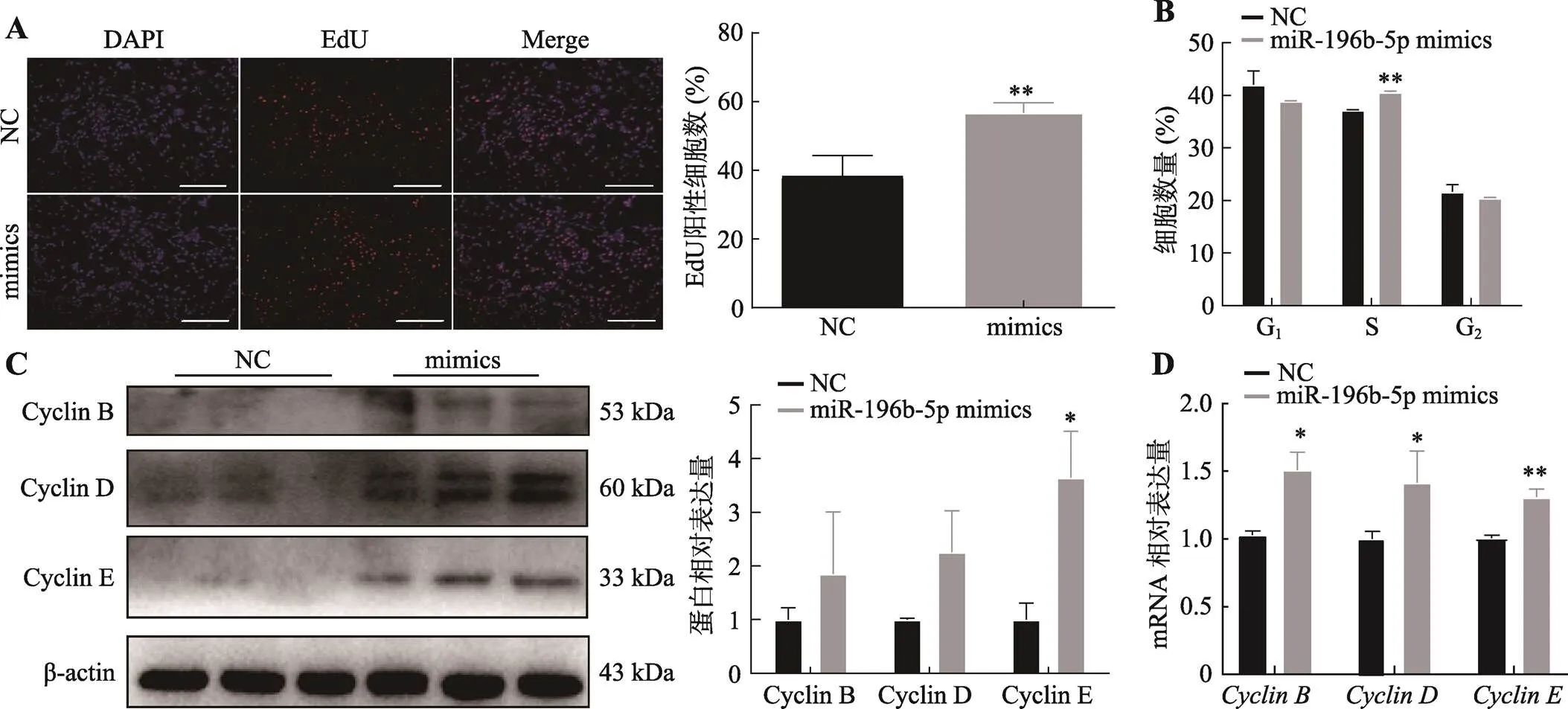
图3 miR-196b-5p过表达对C2C12成肌细胞增殖的影响
A:转染miR-196b-5p mimics后,EdU染色检测C2C12细胞的增殖能力及阳性细胞率统计。*< 0.05,**< 0.01,下同;标尺为200 μm。B:转染miR-196b-5p mimics后,流式细胞术检测细胞周期。C:转染miR-196b-5p mimics后,Western blotting检测增殖相关蛋白表达量及统计结果。D:转染miR-196b-5p mimics后,qRT-PCR检测增殖相关基因mRNA表达量(内参基因为)。
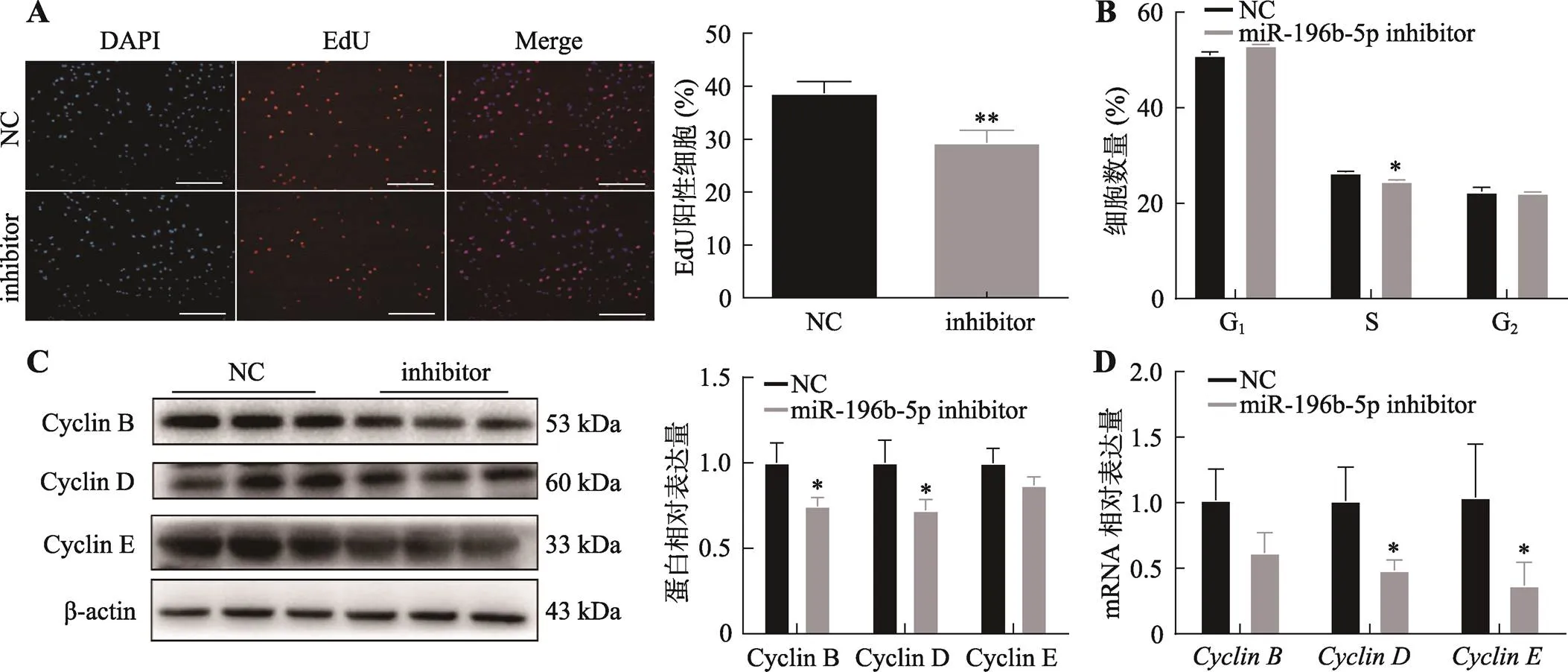
图4 miR-196b-5p干扰对C2C12成肌细胞增殖的影响
A:转染miR-196b-5p inhibitor后,EdU染色检测C2C12细胞的增殖能力及阳性细胞率统计。*< 0.05,**< 0.01,下同;标尺为200 μm。B:转染miR-196b-5p inhibitor后,流式细胞术检测细胞周期。C:转染miR-196b-5p inhibitor后,Western blotting检测Cyclin B、Cyclin D、Cyclin E蛋白表达量及统计结果。D:转染miR-196b-5p inhibitor后,qRT-PCR检测、、mRNA表达量(内参基因为)。
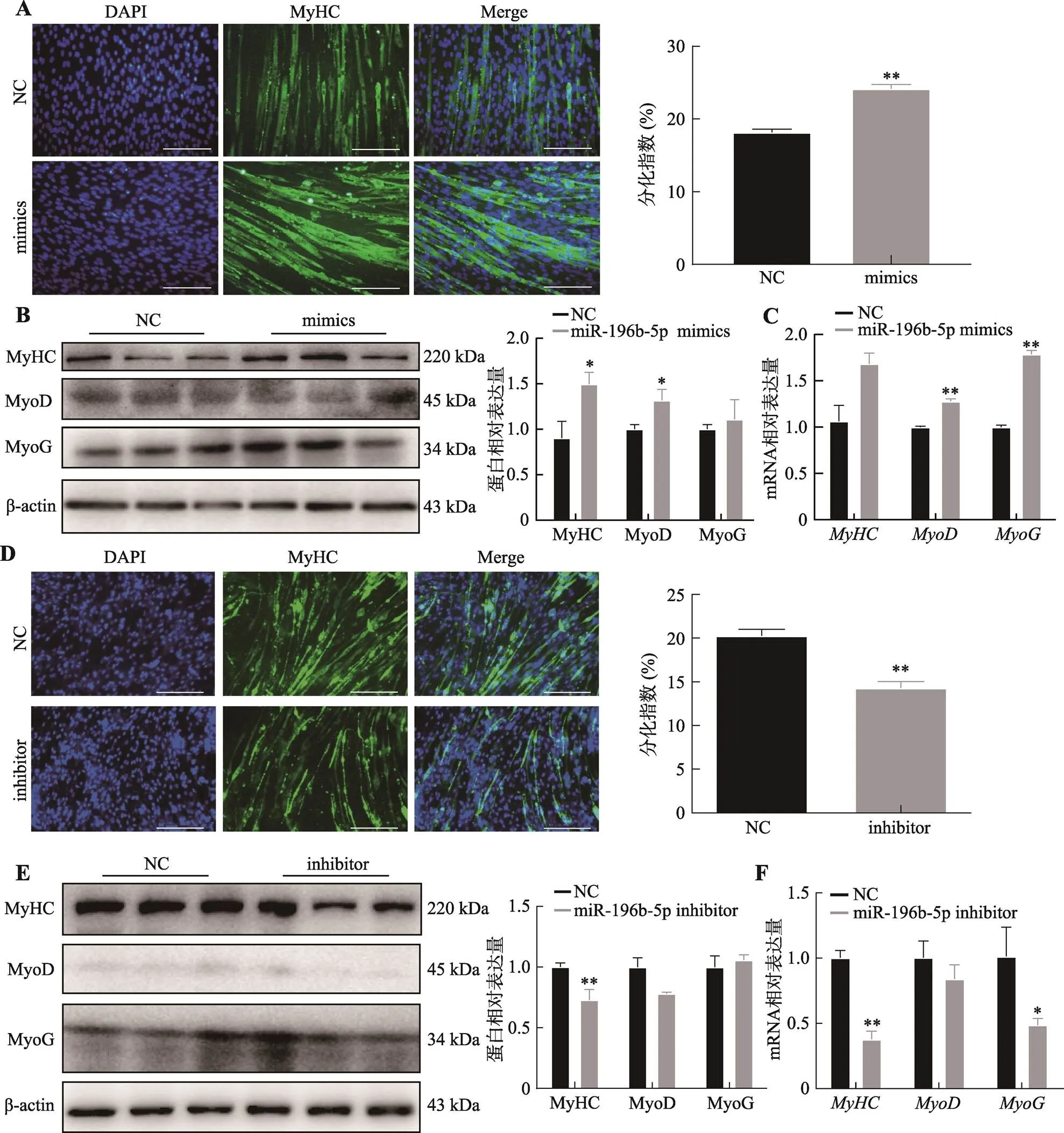
图5 miR-196b-5p过表达和干扰对C2C12细胞分化的影响
A:转染miR-196b-5p mimics后MyHC免疫荧光图及分化指数统计。*< 0.05,**< 0.01,下同;标尺为200 μm。B:转染miR-196b-5p mimics后分化相关蛋白表达量及统计结果。C:转染miR-196b-5p mimics后分化标志基因的表达水平(内参基因为)。D:转染miR-196b-5p inhibitor后MyHC免疫荧光图及分化指数统计。标尺为200 μm。E:转染miR-196b-5p inhibitor后分化相关蛋白表达量及统计结果。F:转染miR-196b-5p inhibitor后分化标志基因的表达水平(内参基因为)。
为了验证miR-196b-5p与靶基因的关系,本研究分别构建了野生型以及miR-196b-5p结合位点突变型的双荧光素酶报告载体(表3)。结果显示,超表达miR-196b-5p能显著抑制野生型载体的荧光活性,而对突变型报告载体的荧光活性没有显著影响(图6A),表明miR-196b-5p可以靶向基因。为了进一步验证miR-196b-5p对的靶向调节作用,本研究检测了超表达miR-196b-5p对靶基因表达水平的影响,结果表明过表达miR-196b-5p能显著抑制Sirt1蛋白表达水平,说明miR-196b-5p靶向了(图6B)。
2.5 miRNA-196b-5p通过靶向Sirt1调节成肌细胞分化
为了验证与miR-196b-5p的靶向关系,将miR-196b-5p mimics和过表达载体共转染C2C12细胞,观察其对增殖和分化的影响。在增殖阶段,和miR-196b-5p对增殖相关基因和在mRNA水平和蛋白水平有相同的促进作用(图7,A和B),改变表达,不能够挽救miR-196b-5p影响细胞周期的表型。在分化阶段,qRT-RCR结果显示,能够显著减弱miR-196b-5p对MyHC和MyoD的促进作用(图7C)。在蛋白水平上,过表达后能显著抑制miR-196b-5p对MyHC和MyoD的促进作用(图7D)。上述结果证明,可以减弱miR-196b-5p对成肌细胞分化的促进作用。

表3 双荧光素酶报告载体序列
3 讨论
miRNAs作为一类微小非编码RNA(20~22nt),通过靶向结合靶基因mRNA的3'UTR序列,导致mRNA的降解或者抑制靶基因mRNA的翻译[30]。大量的研究揭示miRNA在肌肉的生长、再生和肌肉疾病中发挥了关键的作用,例如miR-27、miR-206、miR-143、miR-885等[31,32]。本研究分析了不同骨骼肌miRNA的表达差异,鉴定了16个差异表达miRNA,分析发现这些差异表达miRNA中大部分已有报道在肌肉生长、再生和肌肉疾病中发挥了重要作用,暗示本研究筛选的差异表达miRNA可能参与到肌肉生长过程。在这些差异表达miRNA中miR-196b-5p序列在猪、人和小鼠等物种中高度保守,尽管miR-196b-5p在肿瘤发生和脂肪生成等过程中发挥了重要作用,但是miR-196b-5p在肌肉生长中的作用并不清楚。Liu等[33]对约克夏猪和皖南花猪背最长肌进行了miRNA测序,结果显示miR-196b-5p在皖南花猪中的表达量高于约克夏猪。此外,Mai等[21]研究发现,miR-196b-5p在猪骨骼肌发育不同阶段中显著差异表达。本研究也发现miR-196b-5p在猪和小鼠的骨骼肌中均高表达,因此推测其可能与肌肉的生长有关系。为了进一步验证miR-196b-5p在肌肉生长中的作用,本研究分别超表达和干扰了miR-196b-5p,检测了其对肌生成的影响,结果显示miR-196b-5p促进肌生成。这就表明miR-196b-5p是一个肌肉生长的正调控因子。以上研究为探索miR-196b-5p对肌纤维类型转化的作用奠定了基础,目前我们已有实验证明miR-196b-5p可以促进猪骨骼肌卫星细胞中慢肌纤维的形成,但还需在活体水平上进一步验证。
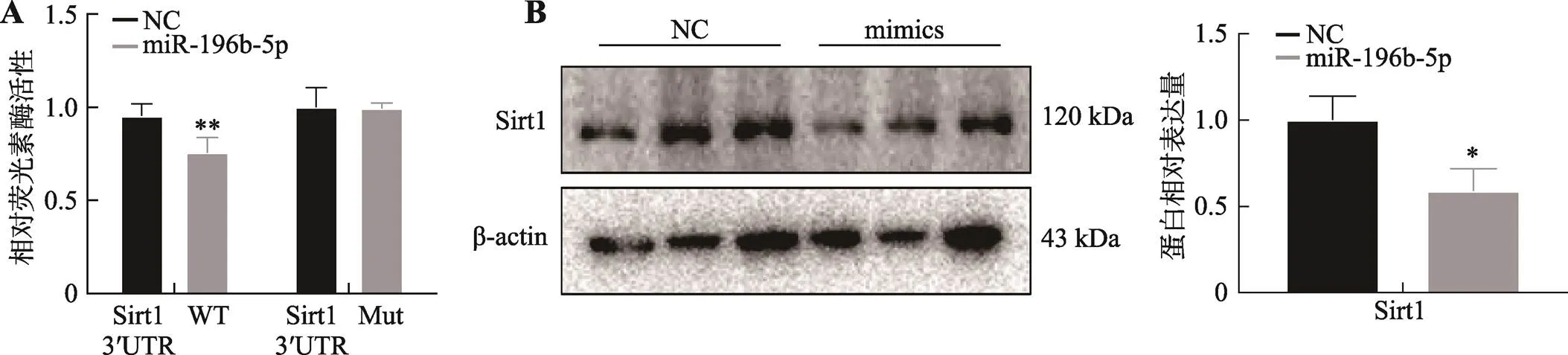
图6 miR-196b-5p靶基因的预测及验证
A:超表达miR-196b-5p对Sirt1野生型及突变型双荧光素酶载体荧光活性的影响;B:Western blotting检测超表达miR-196b-5p对Sirt1蛋白表达水平的影响。*< 0.05,**< 0.01。
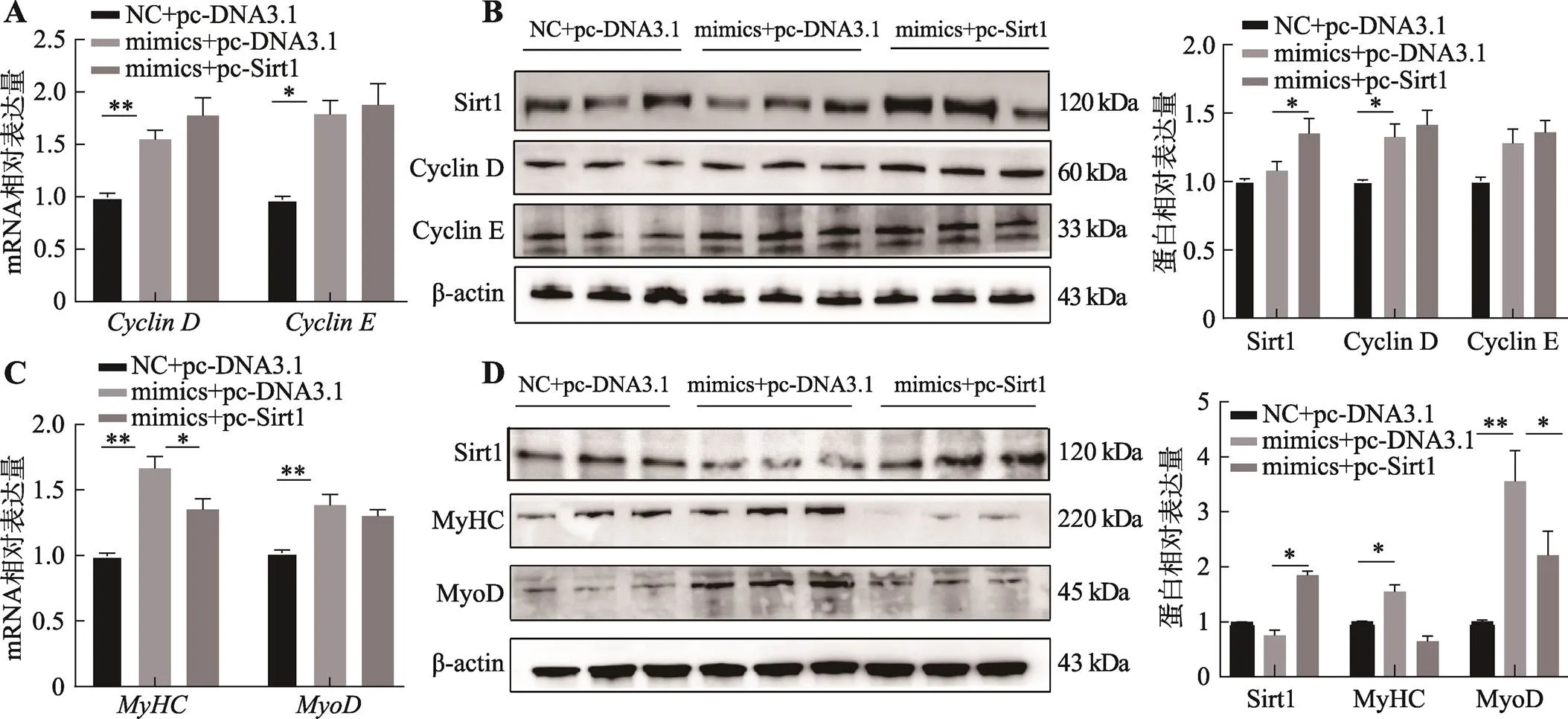
图7 miR-196b-5p过表达和Sirt1过表达对C2C12细胞增殖分化的影响
A:miR-196b-5p mimics和过表达载体共转染之后,qRT-PCR检测和的mRNA表达量(内参基因为);B:miR-196b-5p mimics和过表达载体共转染之后,Western blotting检测Sirt1、Cyclin D和Cyclin E蛋白表达量及统计结果;C:miR-196b-5p mimics和过表达载体共转染之后,qRT-PCR检测和的mRNA表达量(内参基因为);D:miR-196b-5p mimics和过表达载体共转染之后,Western blotting检测Sirt1、MyHC和 MyoD蛋白表达量及统计结果。
为了阐明miR-196b-5p促进肌生成的分子机制,本文利用生物信息学分析预测了其靶基因,筛选了关键靶基因。在肝脏、脂肪、肌肉等多种组织中广谱表达,参与氧化应激、细胞衰老、能量代谢、DNA 修复以及对肌肉、脂肪和肝脏等组织的生理功能的调控。已有研究表明,在成肌细胞中表达,可通过抑制细胞增殖抑制因子p21和p27,促进成肌细胞增殖,进而促进肌生成[28]。通过MSTN信号通路促进成肌细胞的增殖[34]。在成肌细胞中的研究发现肌卫星细胞中缺少导致肌卫星细胞提早分化,活体水平缺乏导致机体基因表达、发育以及肌再生障碍;过表达后抑制成肌标志基因MyoD等基因的表达,但并不是直接与MyoD互作,是通过PCAF/GCNS乙酰转移酶使MyoD脱乙酰化,从而抑制成肌细胞分化;的抑制剂烟酰胺处理后发现成肌细胞分化明显,一系列实验表明能够抑制成肌细胞的分化[29,35]。本研究证明,改变Sirt1表达,不能够挽救miR-196b-5p影响细胞周期的表型, 可以减弱miR-196b-5p对成肌细胞分化的促进作用,表明miR-196b-5p通过靶向促进成肌细胞分化。
[1] Relaix F, Bencze M, Borok MJ, Der Vartanian A, Gattazzo F, Mademtzoglou D, Perez-Diaz S, Prola A, Reyes- Fernandez PC, Rotini A, Taglietti 5th. Perspectives on skeletal muscle stem cells., 2021, 12(1): 692.
[2] Bentzinger CF, Wang YX, Rudnicki MA. Building muscle: molecular regulation of myogenesis.,2012, 4(2): a008342.
[3] Chargé SBP, Rudnicki MA. Cellular and molecular regulation of muscle regeneration.,2004, 84(1): 209–238.
[4] Fan CM, Li L, Rozo ME, Lepper C. Making skeletal muscle from progenitor and stem cells: development versus regeneration., 2012, 1(3): 315–327.
[5] Seaborne RA, Sharples AP. The interplay between exercise metabolism, epigenetics, and skeletal muscle remodeling., 2020, 48(4): 188–200.
[6] Baghdadi MB, Tajbakhsh S. Regulation and phylogeny of skeletal muscle regeneration., 2018, 433(2): 200–209.
[7] Yedigaryan L, Sampaolesi M. Therapeutic implications of miRNAs for muscle-wasting conditions., 2021, 10(11): 3035.
[8] Gross N, Kropp J, Khatib H. MicroRNA signaling in embryo development., 2017, 6(3): 34.
[9] Dey BK, Gagan J, Yan Z, Dutta A. miR-26a is required for skeletal muscle differentiation and regeneration in mice., 2012, 26(19): 2180–2191.
[10] Dey BK, Pfeifer K, Dutta A. The H19 long noncoding RNA gives rise to microRNAs miR-675-3p and miR-675-5p to promote skeletal muscle differentiation and regeneration., 2014, 28(5): 491–501.
[11] McCarthy JJ. MicroRNA-206: the skeletal muscle-specific myomiR., 2008, 1779(11): 682-691.
[12] van Rooij E, Quiat D, Johnson BA, Sutherland LB, Qi XX, Richardson JA, Kelm RJ Jr, Olson EN. A family of microRNAs encoded by myosin genes governs myosin expression and muscle performance., 2009, 17(5): 662–673.
[13] Small EM, O'Rourke JR, Moresi V, Sutherland LB, McAnally J, Gerard RD, Richardson JA, Olson EN. Regulation of PI3-kinase/Akt signaling by muscle-enriched microRNA-486., 2010, 107(9): 4218–4223.
[14] Sempere LF, Freemantle S, Pitha-Rowe I, Moss E, Dmitrovsky E, Ambros V. Expression profiling of mammalian microRNAs uncovers a subset of brain-expressed microRNAs with possible roles in murine and human neuronal differentiation., 2004, 5(3): R13.
[15] Chen JF, Mandel EM, Thomson JM, Wu QL, Callis TE, Hammond SM, Conlon FL, Wang DZ. The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation., 2006, 38(2): 228–233.
[16] Dai Y, Wang YM, Zhang WR, Liu XF, Li X, Ding XB, Guo H. The role of microRNA-1 and microRNA-206 in the proliferation and differentiation of bovine skeletal muscle satellite cells., 2016, 52(1): 27–34.
[17] Dey P, Soyer MA, Dey BK. MicroRNA-24-3p promotes skeletal muscle differentiation and regeneration by regulating HMGA1., 2022, 79(3): 170.
[18] Wang J, Tan J, Qi Q, Yang L, Wang Y, Zhang C, Hu L, Chen H, Fang X. miR-487b-3p Suppresses the proliferation and differentiation of myoblasts by targeting IRS1 in skeletal muscle myogenesis., 2018, 14(7): 760–774
[19] Liang G, Meng W, Huang XJ, Zhu WY, Yin CT, Wang CW, Fassan M, Yu Y, Kudo M, Xiao SS, Zhao CG, Zou P, Wang YM, Li XK, Croce CM, Cui R. miR-196b-5p-mediated downregulation of TSPAN12 and GATA6 promotes tumor progression in non-small cell lung cancer., 2020, 117(8): 4347–4357.
[20] Shi YR, Li F, Wang S, Wang CL, Xie Y, Zhou J, Li XX, Wang BL. miR-196b-5p controls adipocyte differentiation and lipogenesis through regulating mTORC1 and TGF-β signaling., 2020, 34(7): 9207–9222.
[21] Mai MM, Jin L, Tian SL, Liu R, Huang WY, Tang QZ, Ma JD, Jiang AA, Wang X, Hu YD, Wang DW, Jiang Z, Li MZ, Zhou CW, Li XW. Deciphering the microRNA transcripttome of skeletal muscle during porcine development., 2016, 4: e1504.
[22] Niu JQ,Wang YH, Suolang SZ, Changba YZ, Xu YF, Guo M, Cheng LH,Yang SC. Construction of Yak4 gene 3'UTR., 2018, 49(7): 1366–1376.牛家强, 王玉恒, 索朗斯珠, 强巴央宗, 徐业芬, 郭敏, 程玲华, 杨士承. 牦牛4基因3'UTR区双荧光素酶载体构建及与bta-miR-146a的靶向验证.畜牧兽医学报, 2018, 49(7): 1366–1376.
[23] Khanna N, Ge YJ, Chen J. MicroRNA-146b promotes myogenic differentiation and modulates multiple gene targets in muscle cells., 2014, 9(6): e100657.
[24] Zhu MH, Chen G, Yang Y, Yang JT, Qin BG, Gu LQ. miR-217-5p regulates myogenesis in skeletal muscle stem cells by targeting FGFR2., 2020, 22(2): 850–858.
[25] Ding H, Chen C, Zhang T, Chen L, Chen WL, Ling XZ, Zhang GX, Wang JY, Xie KZ, Dai GJ. Identification of miRNA-mRNA networks associated with pigeon skeletal muscle development and growth., 2022, 12(19): 2509.
[26] Han XF, Chen X, Han JQ, Zhong Y, Li QH, An Y. MiR-324/SOCS3 axis protects against hypoxia/reoxygenation- induced cardiomyocyte injury and regulates myocardial ischemia via TNF/NF-κB signaling pathway., 2020, 61(6): 1258–1269.
[27] Ding ZC, Lin JR, Sun YY, Cong S, Liu SH, Zhang YH, Chen QY, Chen JW. miR-122-5p negatively regulates the transforming growth factor-β/Smad signaling pathway in skeletal muscle myogenesis., 2020, 38(2): 231–238.
[28] Shi XY, Du LM. Sirtuin family and its biological functions., 2011, 38(5): 349–355.时小燕, 杜丽敏. Sirtuin家族成员及其生物学特性. 国际药学研究杂志, 2011, 38(5): 349–355.
[29] Wang L, Zhang T, Xi YY, Yang CL, Sun CC, Li DJ. Sirtuin 1 promotes the proliferation of C2C12 myoblast cells via the myostatin signaling pathway., 2016, 14(2): 1309–1315.
[30] Ling YH, Sui MH, Zheng Q, Wang KY, Wu H, Li WY, Liu Y, Chu MX, Fang FG, Xu LN. miR-27b regulates myogenic proliferation and differentiation by targeting Pax3 in goat., 2018, 8(1): 3909.
[31] Koning M, Werker PMN, van der Schaft DWJ, Bank RA, Harmsen MC. MicroRNA-1 and microRNA-206 improve differentiation potential of human satellite cells: a novel approach for tissue engineering of skeletal muscle., 2012, 18(9–10): 889–898.
[32] Zhang WR, Zhang HN, Wang YM, Dai Y, Liu XF, Li X, Ding XB, Guo H. miR-143 regulates proliferation and differentiation of bovine skeletal muscle satellite cells by targeting IGFBP5., 2017, 53(3): 265–271.
[33] Liu LQ, Qian K, Wang CL. Discovery of porcine miRNA-196a/b may influence porcine adipogenesis in longissimus dorsi muscle by miRNA sequencing., 2017, 48(2): 175–181.
[34] Rathbone CR, Booth FW, Lees SJ. Sirt1 increases skeletal muscle precursor cell proliferation., 2009, 88(1): 35–44.
[35] Fulco M, Schiltz RL, Iezzi S, King MT, Zhao P, Kashiwaya Y, Hoffman E, Veech RL, Sartorelli V. Sir2 regulates skeletal muscle differentiation as a potential sensor of the redox state, 2003, 12(1): 51–62.
miR-196b-5p promotes myoblast proliferation and differentiation
Lingling Wu, Xiaoyu Zhang, Xiao Li, Jianjun Jin, Gongshe Yang, Xin’e Shi
MicroRNAs (miRNAs) are a class of non-coding single-stranded RNA molecules about 22 nucleotides in length and are encoded by endogenous genes, and are involved in the regulation of post-transcriptional gene expression in animals and plants. Many studies have shown that microRNAs regulate the development of skeletal muscle, mainly manifested in the activation of muscle satellite cells and biological processes such as proliferation, differentiation, and formation of muscle tubes. In this study, miRNA sequencing screening of longissimus dorsi (LD, mainly fast-twitch fibers) and soleus muscle (Sol, dominated by slow-twitch fibers) identified the miR-196b-5p as a differentially expressed and highly conserved sequence in different skeletal muscles. Studies of miR-196b-5p in skeletal muscle have not been reported. In this study, miR-196b-5p mimics and inhibitor were used in miR-196b-5p overexpression and interference experiments in C2C12 cells. The effect of miR-196b-5p on myoblast proliferation and differentiation was analyzed by western blotting, real-time quantitative RT-PCR, flow cytometry, immunofluorescence staining, and the target gene of miR-196b-5p was identified by bioinformatics prediction and analyzed by dual luciferase reporter assays. The results showed that overexpression of miR-196b-5pcould significantly increase the mRNA and protein expression of,and(<0.05); Cell cycle analysis showed that overexpression of miR-196b-5p significantly increased the proportion of cells in the S phase (<0.05), indicating that miR-196b-5p could accelerate cell cycle progress. Results of EdU staining showed that overexpression of miR-196b-5p significantly promoted cell proliferation. Conversely, inhibition of miR-196b-5p expression could significantly reduce the proliferation capacity of myoblasts. Further, overexpression ofmiR-196b-5pcould significantly increase the expression levels of myogenic marker genes,and(<0.05), thereby promoting myoblast fusion and accelerating C2C12 cell differentiation. Bioinformatics predictions and dual luciferase experiments demonstrated that miR-196b-5p could target and inhibit the expression of thegene. Altering theexpression could not rescue the effects of miR-196b-5p on the cell cycle, but could weaken the promoting effects of miR-196b-5p on myoblast differentiation, suggesting that miR-196b-5p promoted myoblast differentiation by targeting.
miR-196b-5p; myoblasts; proliferation; differentiation;
2023-02-03;
2023-04-03;
2023-04-28
国家重点基础研究发展计划项目(973计划)(编号:2015CB943102)和国家自然科学基金项目(编号: 31772570)资助[Supported by the National Program on Key Basie Research Project of China (973 Program) (No. 2015CB943102) and the National Natural Science Foundation of China (No. 31772570)]
吴玲玲,在读硕士研究生,专业方向:动物遗传育种与繁殖。E-mail: wulingling9806@nwafu.edu.cn
史新娥,博士,教授,研究方向:动物遗传育种研究。E-mail: xineshi@nwafu.edu.cn
10.16288/j.yczz.23-025
(责任编委: 李明洲)
