生酮饮食激活脂肪酸氧化促进ME区的少突胶质细胞前体细胞增殖
2023-05-23王奔李斯吴青峰穆文辉
王奔,李斯,吴青峰,穆文辉
研究报告
生酮饮食激活脂肪酸氧化促进ME区的少突胶质细胞前体细胞增殖
王奔1,李斯2,吴青峰2,穆文辉3
1. 保定市第二中心医院妇产科,保定 071000 2. 中国科学院遗传与发育生物学研究所,北京 100101 3. 内蒙古大学,呼和浩特 010021
下丘脑正中隆起(mdian eminence,ME)是神经元和少突胶质细胞的可能生态位,营养因素可能通过诱导ME区细胞变化而调控下丘脑功能。为了确定生理条件下休眠的下丘脑干细胞是否存在饮食诱导的可塑性,本研究使用正常饲料、高脂饮食和生酮饮食(一种低碳水、高脂肪的饮食)等不同喂养方式,比较了不同饮食条件下小鼠ME区伸展细胞(tanycytes,TCs)和少突胶质细胞前体细胞(oligodendrocyte precursor cells,OPCs)的增殖情况,首次发现生酮饮食可诱导促进ME区OPCs增殖,阻断脂肪酸氧化通路可抑制生酮饮食诱导的OPCs增殖。本研究初步揭示了饮食诱导对ME区OPCs的影响,为进一步研究ME区OPCs的功能提供了启示。
下丘脑;正中隆起;少突胶质细胞前体细胞;生酮饮食
经典的成体神经发生位于侧脑室的室管膜下区(subventricular zone,SVZ)和海马齿状回的颗粒下区(subgranular zone,SGZ)[1]。下丘脑成体神经发生在啮齿动物模型中已被报道,位于第三脑室侧壁的下丘脑区和第三脑室底部也存在成体神经发生,有的也被称为大脑中“第三群成体神经干细胞”。伸展细胞(tanycytes,TCs)是一种特化的室管膜细胞,主要分布于腹侧第三脑室侧壁及其底部正中隆起区,已有研究表明下丘脑正中隆起(mdian eminence,ME)的TCs可能在成体神经发生过程中扮演了重要的角色[2,3]。本课题组在前期的研究中,通过Rax标记伸展细胞进行谱系追踪研究,已经证实了小鼠ME区的TCs具有干细胞类似的自我修复和致瘤能力[4]。目前研究还发现,ME区含有共表达少突胶质细胞祖细胞特异标记物NG2 (neuron-glia antigen 2)和前髓鞘少突胶质细胞特异标记物RIP (receptor interacting protein)的BrdU+新增殖细胞,考虑其为少突胶质细胞前体细胞(oligodendrocyte precursor cells,OPCs)向成熟少突胶质细胞转化的细胞,提示ME区也是少突胶质细胞来源的生态位[5]。
ME区作为神经元和少突胶质细胞的可能生态位,同时是神经系统和内分泌系统交互的界面。在外周和大脑之间代谢信号交换过程中,ME区的TCs和OPCs对维持全身能量稳态有重要作用[6]。在小鼠中,TCs通过感知和转运葡萄糖、胰岛素、瘦素等控制摄食和代谢[6~8]。Kohnke等[9]发现,ME区OPCs增殖会受到摄食的影响,OPCs增殖分化能重塑神经元周围网络(perineuronal nets,PNN),禁食时少突胶质细胞增殖分化变慢,减少PNN形成并维持能量平衡,但在再喂养时会被完全逆转。OPCs还可通过调节弓状核中神经元的瘦素受体状态,从而参与摄食和体重控制[10]。现有研究发现长期高脂饮食可以促进青春期小鼠TCs的神经发生[7]。当使用射线对ME区进行处理后,ME区的细胞增殖下降,高脂饮食的小鼠能量消耗增加,体重减轻[1]。这说明营养因素可能会诱导ME区TCs和OPCs的增殖分化,从而对相关代谢信号进行调控。而目前关于生酮饮食(一种低碳水、高脂肪的饮食)对小鼠ME区TCs和OPCs的增殖影响还没有相关研究报道。
本研究比较了不同饮食条件下小鼠ME区TCs和OPCs的增殖差别,并在单细胞水平上比较了这两种细胞在ME区基因转录水平的差异,证实了生酮饮食可诱导脂肪酸氧化通路促进ME区OPCs增殖,为进一步研究ME区细胞变化和下丘脑功能的关系提供了启示。
1 材料与方法
1.1 实验动物
将成年雌性C57BL/6N小鼠饲养在同一动物设施中,采用12 h光照/黑暗循环,并可自由进食和饮水。所有实验小鼠均由中国科学院遗传与发育生物学研究所动物实验中心饲养。所有程序、饲养和实验均按照中国科学院遗传与发育生物学研究所机构动物护理和使用委员会制定的政策和伦理法规进行。本研究的实验方案获得中国科学院遗传与发育生物学研究所伦理审查委员会批准。
1.2 血糖和游离脂肪酸水平的检测
将成年雌性C57BL/6N小鼠随机分为3组,分别用普通饲料(货号:#F4031,美国Bioserv公司)、高脂肪饮食(high-fat diet,HFD)(货号:#S3282,美国Bioserv公司)、生酮饮食(ketogenic diet,KD)(货号:#F3666,美国Bioserv公司)喂养。每周测量一次小鼠体重。在用特殊饮食喂养45天后,采用血糖仪Accu-Chek Active(美国Roche公司)对随意喂养、禁食过夜16 h、禁食再喂养1 h、2 h和3 h后的小鼠测量血糖水平。
禁食过夜16 h并再进食2 h的小鼠使用游离脂肪酸测定试剂盒测量游离脂肪酸水平(货号:#BC0595,北京索莱宝科技有限公司)。从身体不同部位解剖小鼠脂肪组织,包括腹股沟、附睾、纵隔、腹膜后、腹膜周和棕色脂肪组织,处死后立即称重,评价动物的脂肪重量。
1.3 组织切片制备、EdU处理、免疫组织化学
将实验小鼠用阿佛丁麻醉后,使用含4% PFA 的PB 进行心脏灌注。立即解剖小鼠脑组织,并置于4% PFA中,4℃固定4~6 h。随后依次用20%蔗糖和30%蔗糖脱水至沉底。组织经 Tissue-Tek O.C.T.复合物包埋后,使用莱卡冷冻切片机将组织制备成脑切片(20 μm),室温避光干燥30 min,并储存在–20℃冰箱中。随后,用1×TBS冲洗组织切片,并在室温下用1×TBS++ (含 5%驴血清和0.3% Triton X-100的TBS)封闭1 h,然后换上TBS++稀释的一抗,4℃孵育过夜。一抗孵育后,用1×TBS清洗3次,换上二抗,于常温孵育2 h。本实验所使用的一抗为Sox2 (货号:AF2018,美国R&D Systems公司)和Olig2(货号:AT0681,美国CMCTAG公司)。一抗孵育后,用1×TBS清洗脑切片3次,并在室温下与以下对应二抗Cy5TMAffiniPure Donkey Anti-Goat IgG (H+L) (货号:#705-175-147,美国Jackson ImmunoResearch公司)和Cy2TMAffiniPure Donkey Anti-Rabbit IgG (H+L) (货号:# 711-225-152,美国Jackson ImmunoResearch公司)孵育2 h。
EdU染色检测:小鼠取材前连续3天注射EdU(货号:#AK163060,美国Ark Pharm公司),每天注射1针,注射剂量为50 mg/kg,以标记正在分裂的细胞;进行 EdU染色时,组织切片先用0.5% Triton-X100处理30 min,随后换用EdU染色液孵育30 min。封片后4℃下避光保存静置过夜。使用Image J软件(NIH,美国)处理和分析图像。
1.4 渗透泵注射
用阿佛丁麻醉小鼠,并将钢套管(型号:328OPM/Spc,美国Plastics One公司)利用立体定位仪(深圳市瑞沃德科技有限公司)植入右侧脑室,坐标如下:前囟后方2.0 mm,中线外侧1.0 mm,硬脑膜下方1.5 mm。100 μmol/L依托莫西(Etomoxir)(型号:E1905,美国Sigma公司)稀释在0.9% NaCl中,根据微渗透泵说明(型号:Model 1007D,美国ALZET公司),以0.5 μL/h流速输注7天。脑室内输注7天后,处死动物以收集脑组织同1.3。
1.5 PCR和Q-PCR检测
使用标准乙醇沉淀方案从小鼠尾部提取基因组DNA,组织消化溶液含有1 mg/mL蛋白酶K、50 mmol/L Tris-HCl (pH 8.0)、100 mmol/L EDTA、100 mmol/L NaCl和1%SDS。使用纯化后的基因组DNA和引物,通过PCR检测脂肪酸氧化的关键基因。
从小鼠脑中显微解剖小鼠正中隆起组织,按照试剂盒说明(货号:#B0003,美国EZBioscience公司)反转录获得正中隆起的cDNA。为了定量基因的表达,使用Bio-Rad实时定量PCR系统(CFX 96)进行检测qPCR,95℃变性15 s,58℃退火30 s,72℃延伸30 s,40个循环。通过Bio-Rad实时PCR系统数据分析基因的表达量。
1.6 单细胞解离、RNA文库制备与测序
10只雌性成年C57BL/6 N小鼠中解剖正中隆起组织合并在一起。在10×Genomics平台上进行单细胞RNA测序。相关测序数据和分析方法已公开[4]。
1.7 差异基因表达分析和富集分析
为了识别ME区TCs和OPCs中差异表达的基因,使用“FindAllMarkers”函数中的Wilcoxon秩和检验对细胞组进行差异基因识别,返回组间基因平均表达的对数倍变化值和基于 Bonferroni 校正后的每个被测试基因的值。接着,将差异表达倍数值排序后位于前100的基因列表导出至clusterProfiler软件,用于GO富集分析,所使用的单细胞相关分析方法具体同前[11]。
1.8 数据处理
本研究中所有数据采集和细胞定量均双盲。使用Rstudio、GraphPad Prism(v8)和Microsoft Excel 2016检验协变量和正态性,计算统计学显著性,以及绘制定量图表。组数据显示为条形图,显示平均值±平均值的标准误(SEM)或箱形图,其中箱形图表示四分位距(IQR),须线延伸至±1.5 IQR,点表示离群值,粗黑线表示中位数。使用非配对双尾Student检验或单因素ANOVA和Sidak多重比较检验计算统计分析。
2 结果与分析
2.1 KD饮食诱导可刺激OPCs的增殖,但不刺激TCs的增殖
目前研究表明细胞内代谢信号的改变以及全身可用性能量的变化会调节成体神经干细胞的增殖[2,12]。脂肪酸氧化激活(ty acidFAO)通路也被报道可改善肠道干细胞活性[13,14]。为了确定生理条件下休眠的下丘脑干细胞是否存在饮食诱导的可塑性,本研究使用正常饲料、高脂饮食(HFD)或生酮饮食(KD)喂养的小鼠2个月后进行3天的EdU标记。发现Sox2+Olig2–的TCs在喂食HFD或KD 45天后保持静止(图1,A~E),表明成年后小鼠静息态TCs的膳食诱导可塑性极小。有趣的是,喂食KD的小鼠ME区Sox2+Olig2+的OPCs的有丝分裂行为显著增强(图1F)。
2.2 KD饮食启动脂肪酸氧化激活通路促进OPCs细胞增殖
通过定量PCR分析发现,脂肪酸氧化激活通路中关键基因,如、和,在KD喂养条件下显著上调(图2,A~C)。通过脑室内给予依托莫西(etomoxir,的不可逆拮抗剂)抑制FAO,可抑制KD诱导的OPCs增殖(图2,D~G)。在机体生酮饮食的干预下,细胞内代谢改变,脂肪酸氧化激活通路中涉及的基因上调,但是TCs仍处于增殖静止期,未被激活(图2G)。
2.3 单细胞水平对TCs和OPCs进行差异基因分析
鉴于TCs和OPCs在有丝分裂活性和饮食诱导的可塑性方面的差异,本研究进一步定量比较静止的TCs和活跃的OPCs之间的基因表达,发现有595个基因在OPCs中富集,167个基因在TCs中富集(图3,A~C)。生物过程的基因本体分析和使用STRING的功能蛋白关联网络分析显示,具有有丝分裂活性的OPCs显示出参与蛋白质翻译、代谢途径和细胞骨架动力学的基因的丰富表达,而调节脂质代谢、神经营养信号传导和蛋白质折叠的基因在TCs中富集(图3D,图4)。
3 讨论
研究ME区细胞的饮食调控方式为调节下丘脑功能提供了有价值的工具。了解TCs和OPCs饮食诱导的可塑性,对于维持神经系统和内分泌系统平衡、增强或抑制相关功能具有重要意义。本研究发现TCs不会受到HD饮食和生酮饮食的诱导而发生增殖,但是生酮饮食可诱导促进ME区OPCs增殖,阻断脂肪酸氧化通路可抑制OPCs增殖。这为进一步研究ME区细胞调节下丘脑功能提供了启示。
研究发现脂肪酸代谢参与SVZ区成体神经干细胞的发育,肥胖诱导的高血糖、高胰岛素血症和胰岛素抵抗以及神经炎症等都可能间接影响神经干细胞的稳态[12]。高脂肪饮食(HFD)或富含胆固醇的饮食能直接激活肠道干细胞,改变其功能[14]。ME区的TCs具有成体神经干细胞活性,研究发现小鼠幼年期TCs能够增殖分化出代谢平衡的神经元,在成年期,其增殖速度发生大幅下降[15]。Dietrich等[7]研究发现高脂饮食后青春期小鼠Hu+BrdU+神经元会明显增加,高脂饮食刺激青春期小鼠TCs增殖。本次使用成年小鼠进行实验,发现高脂饮食和生酮饮食均不能刺激成年小鼠TCs增殖。说明青春期小鼠TCs对脂肪代谢的刺激敏感,但不能刺激成年小鼠TCs增殖。
OPCs在发育上具备一定的异质性,可能具备成体干细胞活性。2021年,Chamling等[16]通过单细胞测序对发育中的人类干细胞衍生的少突胶质细胞谱系(oligodendrocyte lineage cells,OLs)进行分析,报道了OPCs的转录异质性。该研究通过体外培养α+reporter-hOLLCs (人干细胞来源少突胶质细胞系细胞),在单细胞水平分析hOLLC的转录组,发现这些细胞主要定义为了OPCs、OLs、星形胶质细胞、神经前体细胞(neural progenitor cells,NPC)和周细胞(pericytes)等,其中OPCs群体还能被进一步划分为5个OPCs亚群和3个少突胶质细胞周期前体细胞亚群。其中OPC1亚群高表达与神经发生和神经元分化相关的(Stathmin2,胞浆磷蛋白2)等基因;OPC3和OPC4有相当一部分与星形胶质细胞共表达的基因。这些研究揭示了OPCs在功能及发育途径上具有异质性,可能发育为神经前体细胞、星形胶质细胞和少突胶质细胞。OPCs是CNS中增殖能力最强的细胞,在整个生命周期中可以分化成少突胶质细胞,成熟的少突胶质细胞产生髓鞘,可加速神经冲动传导并为轴突提供代谢支持,并可能在回路形成和功能中发挥作用[17]。本研究发现生酮饮食诱导脂肪酸氧化通路促进ME区OPCs增殖,也证实了脂肪酸代谢能够影响ME区OLs的生态位。
A:不同饮食干预(Control普通饮食、HFD高脂肪饮食、KD生酮饮食)下小鼠体重的变化。B:不同部位脂肪组织重量变化。C:不同处理组小鼠血糖和游离脂肪酸变化。D:不同细胞标记物对ME区染色结果。标尺:50 μm。E:EdU+细胞百分比定量统计。F:Sox2+Olig2–细胞(TCs)百分比定量统计。G:Sox2+Olig2+细胞(OPCs)百分比定量统计。*<0.05;**<0.01;* **<0.001;N.S.代表无统计学差异。
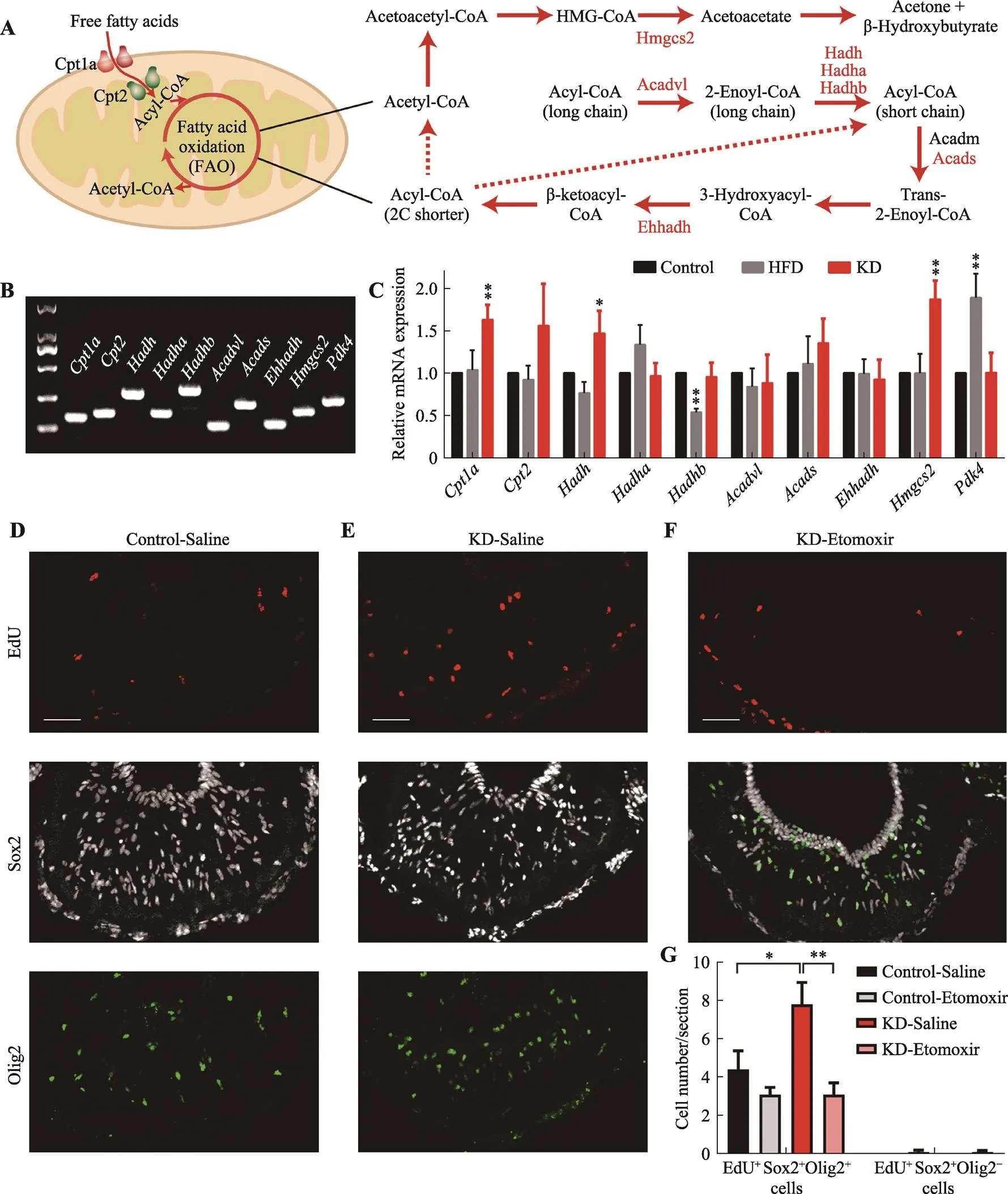
图2 生酮饮食对游离脂肪酸代谢通路的影响
A:游离脂肪酸代谢通路示意图。B:小鼠脂肪酸氧化关键基因检测。C:不同饮食干预下Q-PCR定量检测脂肪酸氧化关键基因的表达。D~F:不同细胞标记物对不同脑室注射干预下ME区染色结果。标尺:50 μm。G:不同干预条件下EdU+Sox2+Olig2+细胞(OPCs)和EdU+Sox2+Olig2–细胞(TCs)百分比定量统计。*<0.05;**<0.01。
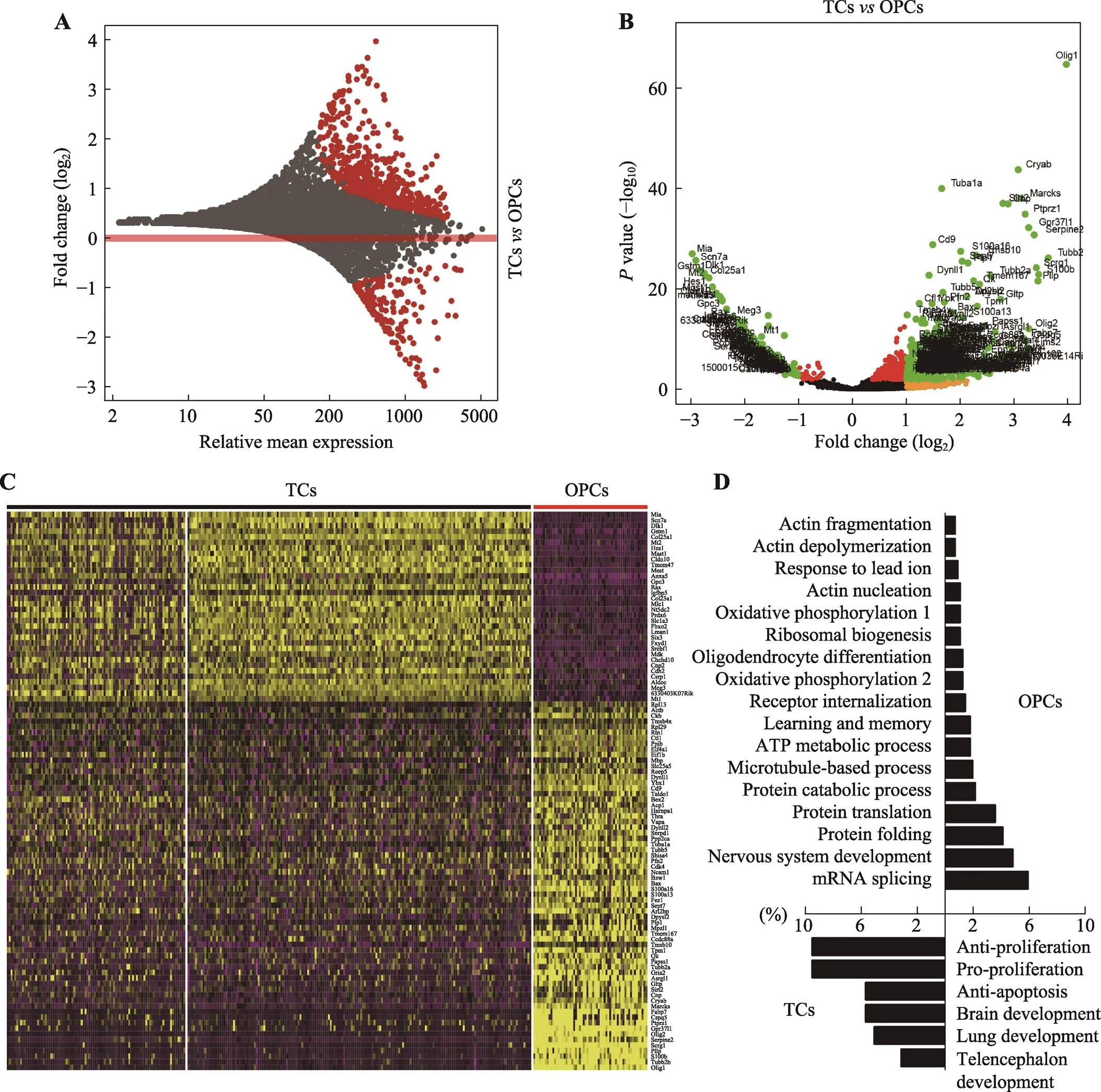
图3 ME区TCs和OPCs差异基因分析
A和B:TCs和OPCs差异基因火山图展示;C:根据TCs和OPCs差异基因表达情况绘制热图;D:对TCs和OPCs差异表达基因进行基因富集分析的结果。
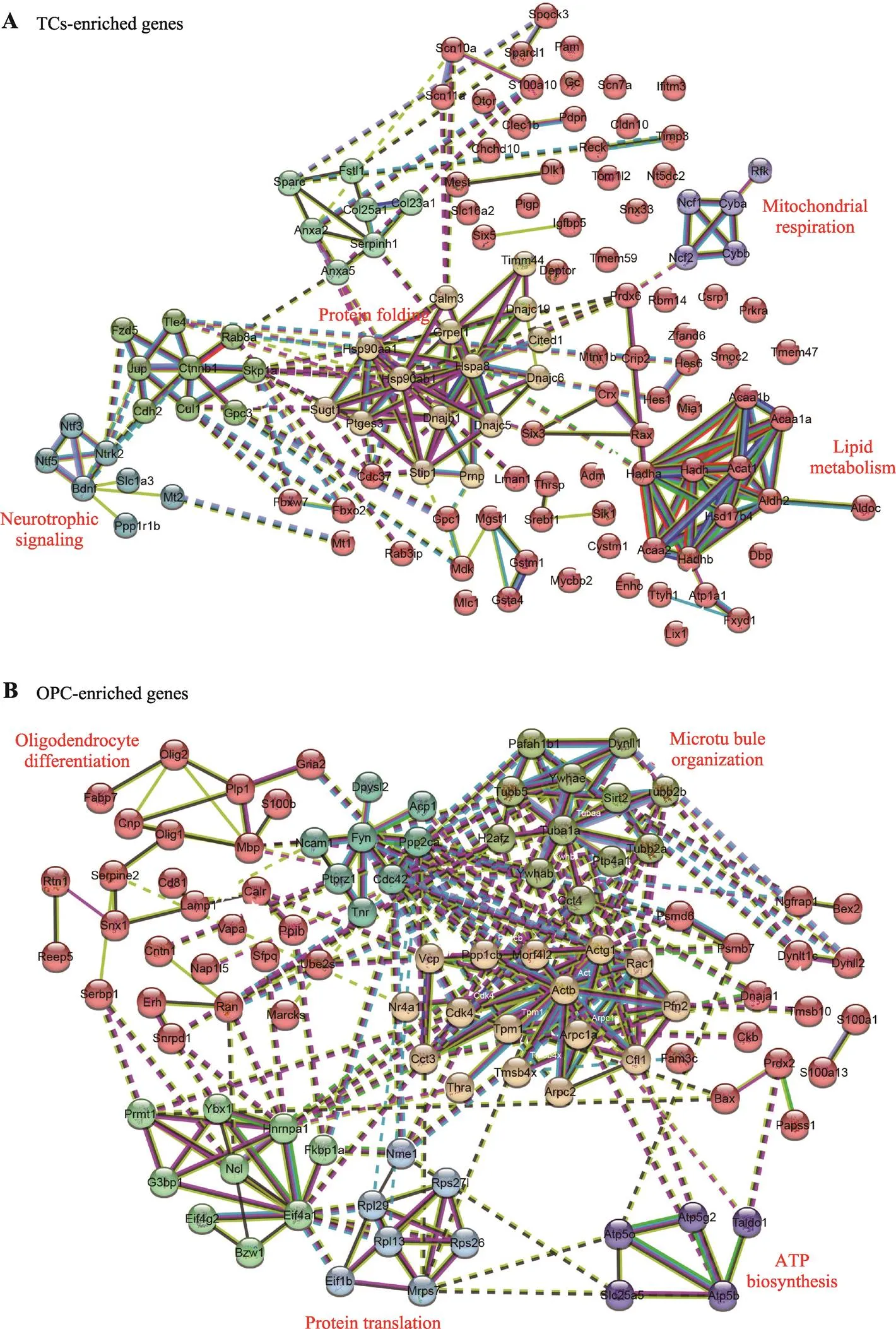
图4 TCs和OPCs功能富集得到的本体交互网络
A:TCs功能富集网络;B:OPCs功能富集网络。
ME区的局部微环境比较特殊。作为神经系统和内分泌系统交互的界面,这里的脉管系统缺乏血脑屏障(blood-brain barrier,BBB),同时还有开窗内皮细胞,便于神经系统感知外界环境,释放激素维持内环境稳态。OPCs是局部环境重要组成部分,OPCs功能障碍和多种老年退行性病变有关[18];OPCs还能和血管细胞能相互影响。研究发现发育中的CNS,OPC会沿着血管迁移,来自内皮细胞的因子如成纤维细胞生长因子2(fibroblast growth factor 2,FGF2)和脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)促进OPCs存活和增殖,而在炎症下,OPCs分泌基质金属蛋白酶-9,其增加血脑屏障渗透性并进而触发进一步的组织损伤如脱髓鞘,导致局部少血管生态位[19]。胶质-神经元通信帮助神经元分化并形成突触,OLs帮助神经元成熟和环路建立[20,21]。而当局部微环境的改变,OPCs的反应也非常迅速。局部增加牛磺酸含量能直接刺激ME区的OPCs的增殖[22]。2022年,Iram等[23]还发现将年轻小鼠的脑脊液输注给老年小鼠,改变老年小鼠的脑脊液环境,居然可以诱导老年小鼠的OPCs增殖和长期记忆的巩固,考虑生成的OPCs能够与神经元相互作用,更好地维护维持大脑记忆功能。这都说明了OPCs对局部微环境组成的重要性,本次研究发现生酮饮食诱导与OPCs增殖的关系,之后需要追踪ME区OPCs的分化情况,进一步评估OPCs和局部微环境如何相互作用维持内环境的稳态。
综上所述,本研究进一步揭示了ME区高脂饮食和生酮饮食对TCs和OPCs的作用,ME区是OPCs的一个重要生态位,这些发现为进一步研究ME区的细胞变化与下丘脑功能关系提供了启示。
[1] Lee DA, Bedont JL, Pak T, Wang H, Song J, Miranda- Angulo A, Takiar V, Charubhumi V, Balord F, Takebayashi H, Aja S, Ford E, Fishell G, Blackshaw S. Tanycytes of the hypothalamic median eminence form a diet-responsive neurogenic niche., 2012, 15(5): 700–702.
[2] Ghosh HS. Adult neurogenesis and the promise of adult neural stem cells., 2019, 13: 1179069519856876.
[3] Haan N, Goodman T, Najdi-Samiei A, Stratford CM, Rice R, Agha EE, Bellusci S, Hajihosseini MK. Fgf10- expressing tanycytes add new neurons to the appetite/ energy-balance regulating centers of the postnatal and adult hypothalamus., 2013, 33(14): 6170–6180.
[4] Mu WH, Li S, Xu JK, Guo XZ, Wu HD, Chen ZH, Qiao LY, Helfer G, Lu FL, Liu C, Wu QF. Hypothalamic Rax+tanycytes contribute to tissue repair and tumorigenesis upon oncogene activation in mice., 2021, 12(1): 2288.
[5] Zilkha-Falb R, Kaushansky N, Ben-Nun A. The median eminence, a new oligodendrogenic niche in the adult mouse brain., 2020, 14(6): 1076–1092.
[6] Nampoothiri S, Nogueiras R, Schwaninger M, Prevot V. Glial cells as integrators of peripheral and central signals in the regulation of energy homeostasis., 2022, 4(7): 813–825.
[7] Dietrich MO, Horvath TL. Fat incites tanycytes to neurogenesis., 2012, 15(5): 651–653.
[8] Duquenne M, Folgueira C, Bourouh C, Millet M, Silva A, Clasadonte J, Imbernon M, Fernandois D, Martinez-Corral I, Kusumakshi S, Caron E, Rasika S, Deliglia E, Jouy N, Oishi A, Mazzon M, Trinquet E, Tavernier J, Kim YB, Ory S, Jockers R, Schwaninger M, Boehm U, Nogueiras R, Annicotte JS, Gasman S, Dam J, Prévot V. Leptin brain entry via a tanycytic LepR-EGFR shuttle controls lipid metabolism and pancreas function., 2021, 3(8): 1071–1090.
[9] Kohnke S, Buller S, Nuzzaci D, Ridley K, Lam B, Pivonkova H, Bentsen MA, Alonge KM, Zhao C, Tadross J, Holmqvist S, Shimizu T, Hathaway H, Li HL, Macklin W, Schwartz MW, Richardson WD, Yeo GSH, Franklin RJM, Karadottir RT, Rowitch DH, Blouet C. Nutritional regulation of oligodendrocyte differentiation regulates perineuronal net remodeling in the median eminence., 2021, 36(2): 109362.
[10] Djogo T, Robins SC, Schneider S, Kryzskaya D, Liu XH, Mingay A, Gillon CJ, Kim JH, Storch KF, Boehm U, Bourque CW, Stroh T, Dimou L, Kokoeva MV. Adult NG2-Glia are required for median eminence-mediated leptin sensing and body weight control., 2016, 23(5): 797–810.
[11] Chen ZH, Li S, Xu MR, Liu CC, Ye HY, Wang B, Wu QF. Single-cell transcriptomic profiling of the hypothalamic median eminence during aging., 2022, 49(6): 523–536.
[12] Cavallucci V, Fidaleo M, Pani G. Neural stem cells and nutrients: poised between quiescence and exhaustion., 2016, 27(11): 756–769.
[13] Chen L, Vasoya RP, Toke NH, Parthasarathy A, Luo S, Chiles E, Flores J, Gao N, Bonder EM, Su XY, Verzi MP. HNF4 regulates fatty acid oxidation and is required for renewal of intestinal stem cells in mice., 2020, 158(4): 985–999.
[14] Mihaylova MM, Cheng CW, Cao AQ, Triathi S, Mana MD, Bauer-Rowe KE, Abu-Remaileh M, Clavain L, Erdemir A, Lewis CA, Freinkman E, Dickey AS, La Sada AR, Huang YM, Bell GW, Deshande V, Carmeliet P, Katajisto P, Sabatini DM, Yilmaz ÖH. Fasting activates fatty acid oxidation to enhance intestinal stem cell function during homeostasis and aging., 2018, 22(5): 769–778.
[15] Maggi R, Zasso J, Conti L. Neurodevelopmental origin and adult neurogenesis of the neuroendocrine hypothalamus., 2014, 8: 440.
[16] Chamling X, Kallman A, Fang WX, Berlinicke CA, Mertz JL, Devkota , Pantoja IEM, Smith MD, Ji ZC, Chang C, Kaushik A, Chen L, Whartenby KA, Calabresi PA, Mao HQ, Ji HK, Wang TH, Zack DJ. Single-cell transcriptomic reveals molecular diversity and developmental heterogeneity of human stem cell-derived oligodendrocyte lineage cells., 2021, 12(1): 652.
[17] Allen NJ, Lyons DA. Glia as architects of central nervous system formation and function., 2018, 362(6411): 181–185.
[18] White CW 3rd, Pratt K, Villeda SA. OPCs on a diet: a youthful serving of remyelination., 2019, 30(6): 1004–1006.
[19] Sherafat A, Pfeiffer F, Nishiyama A. Shaping of regional differences in oligodendrocyte dynamics by regional heterogeneity of the pericellular microenvironment., 2021, 15: 721376.
[20] Romanov RA, Tretiakov EO, Kastriti ME, Zuancic M, Häring M, Korchynska S, Poadin K, Benevento M, Rebernik P, Lallemend F, Nishimori K, Clotman F, Andrews WD, Parnavelas JG, Farlik M, Bock C, Adameyko I, Hökfelt T, Keimema E, Harkany T. Molecular design of hypothalamus development., 2020, 582(7811): 246–252.
[21] Zhou X, Lu YF, Zhao FQ, Dong J, Ma WJ, Zhong SJ, Wang MD, Wang BS, Zhao YQ, Shi YC, Ma Q, Lu T, Zhang J, Wang XQ, Wu Q. Deciphering the spatial- temporal transcriptional landscape of human hypothalamus development., 2022, 29(2): 328–343.
[22] Beyer BA, Fang ML, Sadrian B, Montenegro-Burke JR, laisted WC, Kok BPC, Saez E, Kondo T, Siuzdak G, Lairson LL. Metabolomics-based discovery of a metabolite that enhances oligodendrocyte maturation., 2018, 14(1): 22–28.
[23] Iram T, Kern F, Kaur A, Myneni S, Morningstar AR, Shin H, Garcia MA, Yerra L, Palovics R, Yang AC, Hahn O, Lu NN, Shuken SR, Haney MS, Lehallier B, Iyer M, Luo J, Zetterberg H, Keller A, Zuchero JB, Wyss-Coray T. Young CSF restores oligodendrogenesis and memory in aged mice via Fgf17., 2022, 605(7910): 509–515.
Ketogenic diet promotes the proliferation of oligodendrocyte precursor cells in ME region by activating fatty acid oxidation
Ben Wang1, Si Li2, Qing-Feng Wu2, Wenhui Mu3
Hypothalamic median eminence (ME) is a potential niche for neurons and oligodendrocytes, and trophic factors may regulate hypothalamic function by inducing cellular changes in the ME region. To determine whether diet-induced plasticity exists in hypothalamic stem cells dormant under physiological conditions, we used a combination of a normal diet, a high-fat diet, and a ketogenic diet (a low-carb, high-fat diet) to compare the proliferation of tanycytes (TCs) and oligodendrocyte precursor cells (OPCs) in the ME area of mice under the different diets. The results showed that the ketogenic diet could induce and promote the proliferation of OPCs in the ME area, and blocking the fatty acid oxidation program could inhibit the proliferation of OPCs induced by a ketogenic diet. This study preliminarily revealed the diet-induced effect on OPCs in the ME region and provided enlightenment for further study on the function of OPCs in the ME region.
hypothalamus; median eminence;oligodendrocyte precursor cells; ketogenic diet
2023-02-07;
2023-03-22;
2023-04-04
保定市科技计划(编号:2141ZF027),国家重点研发计划(编号:2019YFA0801900,2018YFA0801104),国家自然科学基金项目(编号:32070972,31771131,31800860,81891002,31921002),中国科学院战略重点研究计划(编号:XDB32020000)和中国科学院百人计划(编号:Z181100001518001)资助[Supported by the Technical Research Program of Baoding City (No. 2141ZF027),the National Key Research & Development Program of China (Nos. 2019YFA0801900, 2018YFA0801104), the National Natural Science Foundation of China (Nos. 32070972, 31771131, 31800860, 81891002, 31921002), the Strategic Priority Research Program of Chinese Academy of Sciences (No. XDB32020000), and the Hundred-Talent Program (Chinese Academy of Sciences) (No. Z181100001518001)]
王奔,博士,研究方向:人类遗传与发育生物学。E-mail: wb111222@sina.com
穆文辉,博士,研究员,研究方向:神经发育与退行性疾病研究。E-mail: wenhuimu1980@163.com
10.16288/j.yczz.23-026
(责任编委: 何淑君)
