生物钟作用机制及其对动物年节律产生的影响
2023-05-23杨阳储明星刘秋月
杨阳,储明星,刘秋月
综 述
生物钟作用机制及其对动物年节律产生的影响
杨阳1,储明星1,刘秋月2
1. 中国农业科学院北京畜牧兽医研究所,农业农村部动物遗传育种与繁殖重点实验室,北京 100193 2. 中国科学院遗传与发育生物学研究所,种子创新研究院,北京 100101
生物钟几乎存在于所有生命体,是生物适应外界环境的每日周期性变化而产生的内部活动。生物钟在体内受转录-翻译-负反馈环路调控,能调节组织、器官的活动,其正常维持对生物的健康、生长、繁殖等具有重要意义。与之相对,由于环境的四季变化,生物也形成了体内的年周期生理变化,如季节性发情、昆虫滞育等。生物的年节律在外部主要受光周期为主的环境因素影响,在体内则与基因表达、激素含量和细胞组织形态的变化有关。褪黑素是识别外部光周期变化的重要信号,而生物钟在垂体解析褪黑素信号并调控下游信号变化中扮演着重要角色,对环境年度变化的识别和机体年节律的产生具有重要指导作用。本文通过介绍昆虫和哺乳动物的昼夜节律和年节律产生的机制,并结合鸟类的年节律,综述了生物钟对年节律产生影响的作用机制研究进展,以期为今后研究年节律的影响机制提供更广泛的思路。
生物钟;年节律;分子机制;昆虫;哺乳动物
地球存在着按周期变化的外部环境,如地球自转造成的昼夜环境变化、地球公转造成的年环境变化以及月球围绕地球公转产生的潮汐变化等。为了使身体更好地适应外界环境的周期性变化,地球上的生物经过长时间的进化产生了对应的生物节律,如近日节律(circadian rhythm,又称为昼夜节律)、月节律(circamensual rhythm)、年节律(circannual rhythm)、近潮汐节律(circatidal rhythm)等。在这些生物节律中,近日节律和年节律研究最广泛,这两种节律的研究对生物的生长发育、健康以及农业生产效率等的改善具有重要意义。研究表明,近日节律和年节律之间存在着紧密联系,近日节律相关分子机制对年节律的产生具有重要的指导作用。年节律的研究不论是在病虫害防治,还是农产品、畜产品的生产中都具有重要的指导意义。因此,本文介绍了生物钟主要运行机制,通过昆虫的滞育、哺乳动物的季节性发情和鸟类的季节性繁殖等年节律生物学现象,阐述了生物钟影响年节律的生物学机制,以期为今后进一步研究两者之间的关系提供参考和思路。
1 近日节律及其形成的机制
近日节律是指生物体行为或生理上出现的接近24小时的周期性振荡现象,广泛存在于不同的物种之中[1]。地球存在接近24小时的自转周期,自转使地球出现昼夜的交替循环,这种昼夜交替使环境产生约为24小时的变化,如光照强度、温度、湿度等。地球环境的变化每天都会不断重复进行,生物会通过外部的环境变化线索来识别时间。为了适应这种环境的变化,生物形成了一套周期约为24小时的内部计时机制,这套内部计时机制被称为生物钟(circadian clock)[2]。这套内部计时机制,即使在没有外部环境线索的情况下,也会自动定义一天的时间,通过转录-翻译-负反馈-降解循环的调节,使生物体形成约为24小时的节律周期[3]。
生物钟存在于大部分生物体内,不论是植物还是动物都受到生物钟的调控。如在哺乳动物中,大到器官、小到细胞都存在内在的生物钟计时系统,且在体内存在多个生物钟起搏器,其中下丘脑视交叉上核(suprachiasmatic nucleus,SCN)是哺乳动物的核心生物钟起搏器[4]。SCN能够接收视网膜感知到的外部明暗变化信息,产生生理信号,之后将信息传递给下丘脑(hypothalamus)和外周起搏器,使机体的外周振荡器能够达到跨器官同步[5]。
1.1 昆虫生物钟形成的分子机制
2017年,诺贝尔生理学或医学奖授予Jeffrey C. Hall、Michael Rosbash和Michael W. Young三位科学家,他们以果蝇()为实验对象,解析了生物钟的重要基因及相关分子机制[6]。果蝇生物钟主反馈环路由()、()、()和()基因构成(图1)。CLK和CYC蛋白形成异二聚体,与DNA上E-box元件结合激活、等基因转录。TIM和PER蛋白积累并形成复合物,转移到细胞核内负反馈抑制CLK/CYC活性,降低自身转录水平[7,8]。之后TIM和PER蛋白逐渐降解,转录激活重新开始。光照是昼夜节律的主要授时因子,能够抑制TIM蛋白水平、促进TIM降解[9]。在这个过程中,TIM并不能直接识别光照变化,隐花色素(cryptochrome,)在其中起着连接作用[10]。CRY蛋白是果蝇的主要光感受器,能够光依赖性的与TIM蛋白互作阻断TIM/PER复合物的功能[11]。在生物钟基因的转录激活中,E75(Eip75B)和UNF(HR51)还能与的调节序列结合,与CLK/CYC共同增强转录[12]。
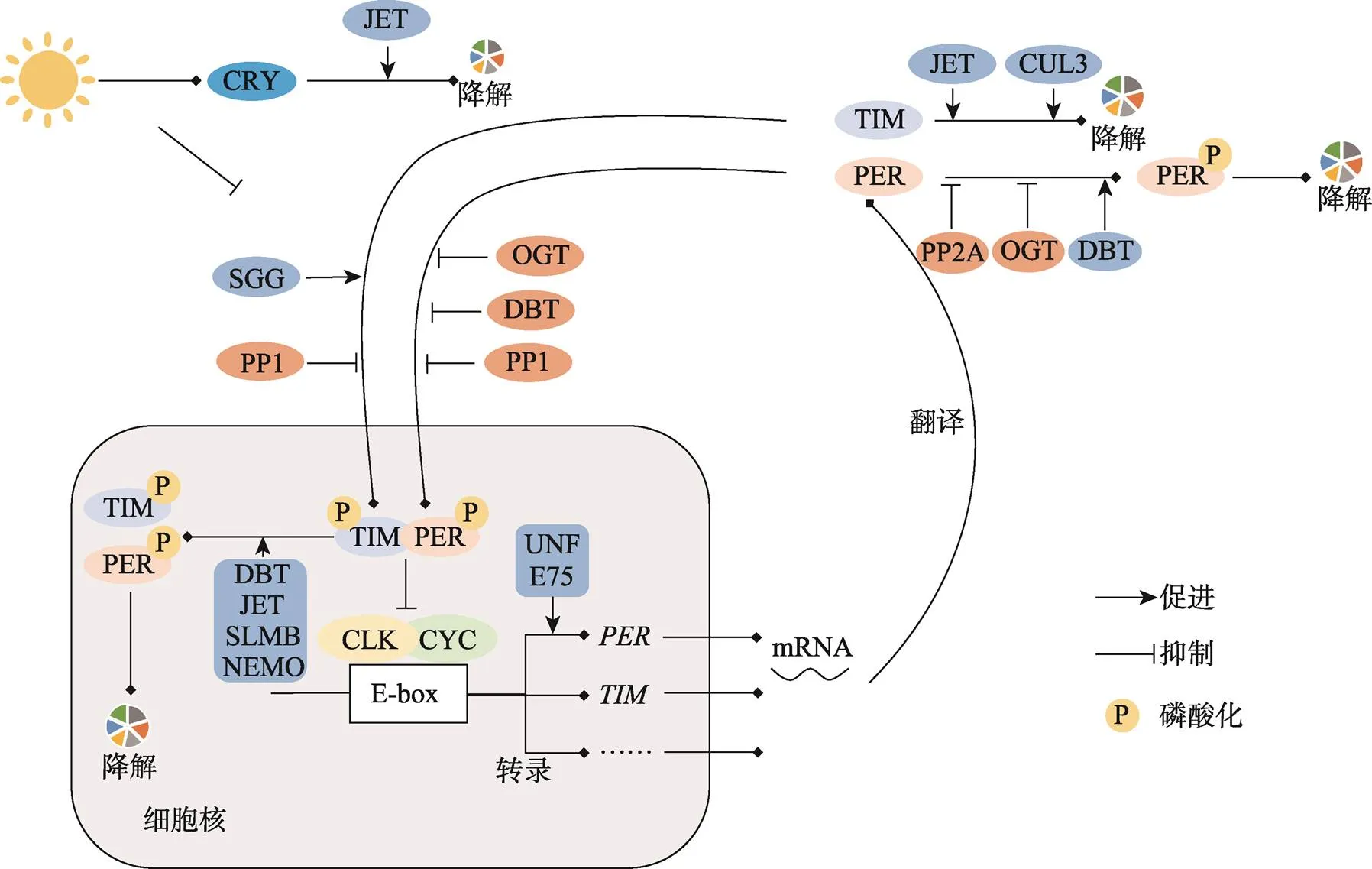
图1 昆虫生物钟分子机制
昆虫生物钟主要由、、和组成,起着连接外界光照和生物钟循环的功能,其他组分则主要通过作用于生物钟基因影响生物钟的维持。
蛋白质的翻译后修饰对于蛋白质生物活性、稳定性、调控能力等具有重要影响,包括磷酸化、泛素化和糖基化等修饰方式[13]。生物钟蛋白的翻译后修饰对近日节律的维持具有重要意义。Double-time (DBT)能够促进PER蛋白的磷酸化和降解,PP1和PP2A则能使PER去磷酸化进而变得稳定[8,9,13~15]。同时,PP1还能去磷酸化TIM使其稳定[16]。Cullin3(CUL3)能够促进非磷酸化TIM降解,SLMB、NEMO则与磷酸化TIM反应促进其降解[17]。这些翻译后修饰抑制了TIM/PER复合物的形成或功能发挥。与之相反,Shaggy(SGG)能够促进TIM的磷酸化并加速TIM/PER复合物进入细胞核,有利于二聚体负反馈抑制功能的发挥[16]。此外,Jetlag(JET)能够促进昆虫CRY和TIM通过泛素-蛋白酶体途径降解[18]。糖基化修饰在生物节律维持过程中也起到关键调节作用。其中O-GlcNAc糖基化作为重要的翻译后修饰,能在蛋白质的丝氨酸(serine,Ser)或苏氨酸(threonine,Thr)残基上以O-糖苷键添加N-乙酰葡萄糖胺修饰,在这个过程中O-GlcNAc转移酶(O-GlcNAc transferase,OGT)和O-GlcNAc酶(O-GlcNAcase,OGA)分别催化单糖的添加和去除,该修饰方式还与Ser的磷酸化修饰存在竞争[19,20]。如在人类()PER2中,Ser662~Ser674区域O-GlcNac糖基化修饰会与该区域的磷酸化产生竞争[20]。在果蝇中,O-GlcNAc转移酶(OGT)对PER蛋白的O-GlcNAc糖基化能够稳定PER,并延迟其进入细胞核的时间[21]。
在生物钟的调节过程中,miRNA发挥了重要作用。在昼夜节律的调节和稳健性(robustness)的维持中,miRNA能够靶向核心生物钟基因调控其本身mRNA降解或蛋白翻译,从而影响其对应的基因功能发挥。在果蝇生物钟中,miR-375、miR-276a、miR-276b都能够靶向,通过影响的表达调节果蝇的昼夜节律和睡眠[22~24]。研究发现,miR-124是果蝇在早晨对光的急性反应所必需的,敲除miR-124能够在不直接靶向作用于核心生物钟基因的前提下,通过影响BMP途径使昼夜节律周期的峰值相位提前5小时[25,26]。
1.2 哺乳动物生物钟形成的分子机制
生物钟控制着哺乳动物50%~80%的转录本表达,因此生物钟的稳定对于哺乳动物具有重要意义[27]。生物钟的外部授时因子主要为光照,而体内维持的主要因素是生物钟基因的转录激活和反馈抑制。哺乳动物的生物钟分子机制是由主反馈环和多个辅助反馈环共同构成,其中主反馈环由、、(包括/)、(包括//)等基因组成(图2)。在哺乳动物中,CLOCK和BMAL1蛋白形成异源二聚体,与DNA上的顺式作用元件E-box结合,激活含E-box元件的基因转录,其中就包含、、和等生物钟基因[28~30]。、翻译成蛋白质后经过二聚化形成复合物,在细胞核内与CLOCK/BMAL1异源二聚体相互作用抑制它们的活性,从而抑制自身转录,之后CRY和PER蛋白被降解,抑制作用减弱,重新开始转录激活,、、、组成了生物钟的主反馈环路[31~34]。表达受到CLOCK/BMAL1复合物调控,同时Rev-erbα能够与RORE序列结合抑制的表达,ROR也能结合RORE序列影响相关基因的表达[30,35]。和基因启动子区也包含RORE序列,因此也会受到和的调控[36,37]。D-box元件是昼夜节律调控中的重要顺式元件,E4BP4与其结合介导转录抑制,DBP、TEF、HLF与D-box结合则会激活转录,、等生物钟基因就包含D-box元件[38~40]。生物钟主反馈环和辅助反馈环之间紧密联系,共同维持哺乳动物生物钟的循环稳定。哺乳动物与昆虫相比,生物钟主反馈环大致相同,但CRY蛋白的作用差异很大。在哺乳动物中,CRY是主反馈环的重要组成部分,而在昆虫中CRY蛋白则扮演着光感受器的角色。
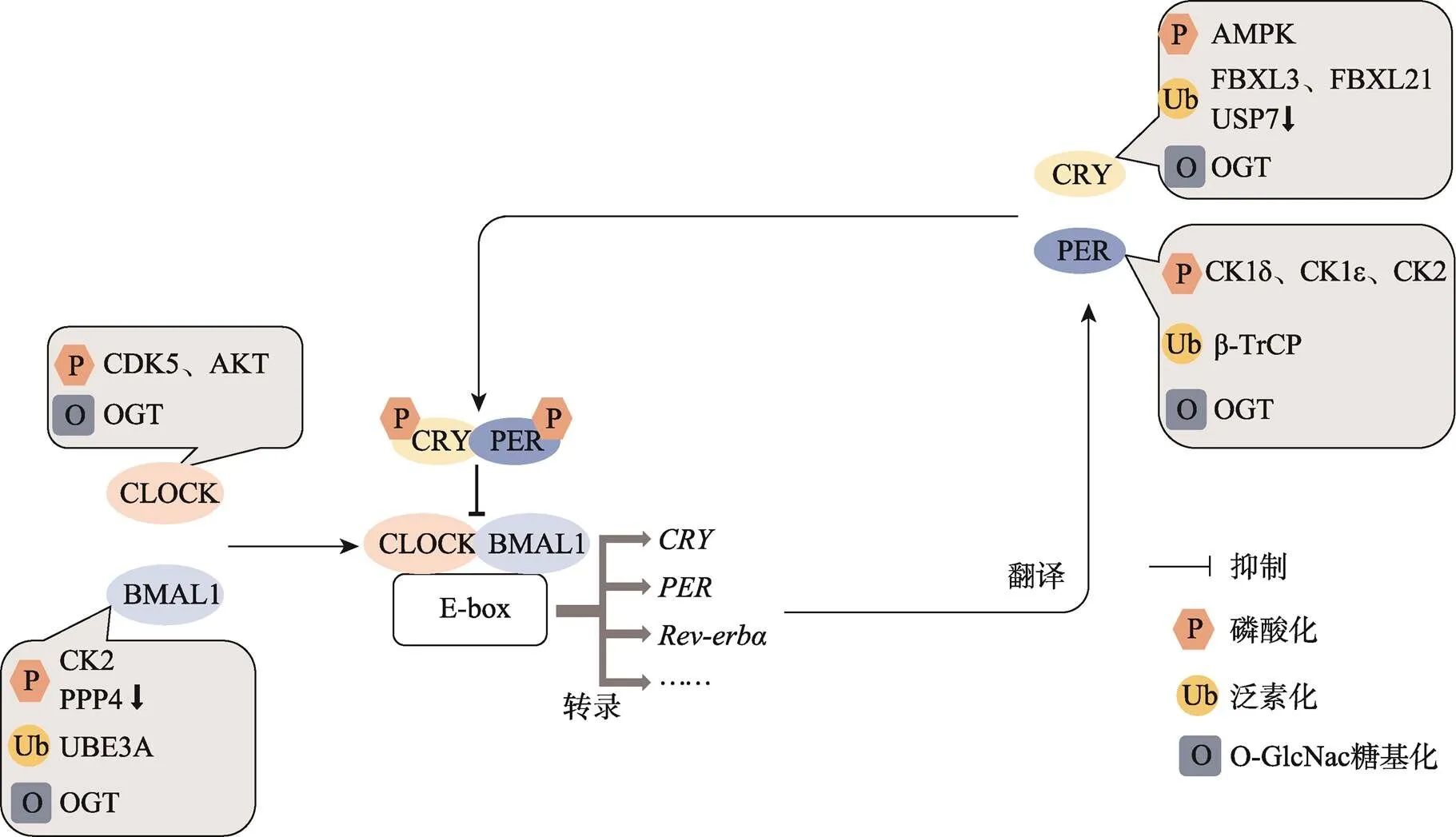
图2 哺乳动物生物钟分子机制
哺乳动物生物钟主要由、、和组成,CLOCK/BMAL1二聚体在细胞核内激活含E-box元件的基因转录,、转录后在细胞质内翻译,之后二者形成的二聚体在细胞核内抑制CLOCK/BMAL1的功能,之后二者降解,重新开始转录激活。⬇表示对相应的蛋白质翻译后修饰起抑制作用。
在哺乳动物生物钟中,泛素化、磷酸化等蛋白质的翻译后修饰对维持其正常水平也极为重要。泛素-蛋白酶体途径能够通过影响关键蛋白的降解来控制细胞的基本生命活动[41]。FBXL3、β-TrCP和UBE3A分别是CRY、PER和BMAL1蛋白泛素化降解途径中的重要组成部分,FBXL21则与FBXL3功能拮抗,能通过参与泛素化途径使CRY蛋白稳定并积累,USP7则能去泛素化CRY使其稳定[35,36,38,40,42]。蛋白质的磷酸化参与多种细胞过程,同样对生物钟蛋白的功能也具有重要意义。如AMPK能够使CRY磷酸化,CK1δ和CK1ε促进PER蛋白磷酸化,这种修饰有利于两种蛋白的泛素化降解[37,39]。此外,CDK5和AKT能够影响CLOCK的磷酸化并影响其亚细胞定位,CK2能够促进BMAL1和PER的磷酸化,PPP4则能够抵消BMAL1的磷酸化作用[43~47]。哺乳动物中O-GlcNAc糖基化修饰主要是通过有节律的修饰BMAL1和CLOCK蛋白影响生物钟,抑制二者的泛素化从而稳定它们,这样能够保证BMAL1/CLOCK复合物靶基因的稳定表达[19]。PER、CRY的O-GlcNAc糖基化修饰,则在稳定生物钟中起着辅助作用[20]。辅助反馈环中的Rev-erbα还能够与OGT形成复合物,调节O-GlcNAc糖基化水平[20,48]。
在哺乳动物的生物钟维持中,miRNA同样发挥着重要调控作用。DICER是miRNAs加工成熟所需的酶,DICER敲除小鼠的miRNA表达降低超过10倍,昼夜节律缩短2小时,产生这种现象是由于的翻译加快导致负反馈抑制提前[49]。另外,miR-24、miR-29、miR-30和miR-96等也都是PER家族的有效抑制剂,能够干扰的翻译并抑制蛋白质的合成[49~51]。除了作用于PER家族,miRNA还能通过影响其他生物钟基因的表达和翻译,破坏生物节律的正常维持。如miR-142-3p和miR-211能够在转录后水平调节的表达,miR-17-5p和miR-455则通过调节的mRNA和蛋白水平,进而影响蛋白的持续合成和昼夜节律的振荡[52~55]。
2 年节律产生的机制及生物钟在其中的调控角色
随着地球的公转,地球的中高纬度地区呈现出四季的变化。相对于低纬度地区,中高纬度地区的环境因素如光照时长、温度和降雨量等在一年中呈现出急剧的变化。一年四季,春夏秋冬,都有规律可循。生活在这些地区的生物经过长期的进化,衍生出了一套内在的时间机制来感知季节性变化,使其生理条件能够适应即将到来的季节。
动物季节性生理机制的产生是由于外部环境因素和机体自身的各个系统之间协同作用的结果,其中外部环境的变化主要包括光照、温度、湿度的年变化。在这些外部因素中,光照是最重要和直接的影响因素。因为相对于温度等条件,光照长度的年周期变化更为稳定,这种一年一度的稳定变化能够提供关键的外部线索[56]。通过光照这个外部线索,机体能够感知所处的季节信息,从而调节自身状态以适应环境变化。如昆虫的季节性滞育、哺乳动物的季节性发情、鱼的季节性洄游、候鸟的季节性迁徙等,这些现象均是年节律的表现。在年节律现象中,昆虫的季节性滞育、哺乳动物的季节性发情和鸟类的季节性繁殖研究较多,前两者也是与农业生产联系最近的两种年节律。
2.1 年节律产生的机制
2.1.1 昆虫的季节性滞育
滞育是指昆虫在不利的季节,其发育和繁殖等活动停止或者变迟缓,代谢率受到抑制,对环境的耐受性增强,以适应环境季节性变化的现象[57,58]。昆虫的滞育可分为滞育前期、滞育期和滞育后期3个阶段,其主要的外部诱导因素是光照和温度的变化,而在体内则会通过一系列的分子机制展现出来[58,59]。例如果蝇的眼缺失基因(eyes absent,)能够解释光周期和温度的变化触发滞育,是果蝇重要的季节传感器[60]。对于昆虫来说,生物钟不仅对昼夜节律至关重要,对季节性滞育的发生也具有重要意义。昆虫的滞育多发生在短光照时,而生物钟基因的RNA干扰(RNA interference,RNAi)会破坏这种光周期反应。如短光照下的RNAi会诱导点蜂缘蝽()的卵巢发育,长光照时的RNAi则会诱导滞育发生[61]。
在昆虫滞育发生中,激素起到了重要的调控作用。滞育激素(diapause hormone,DH)是由食道下神经节(subesophageal ganglion,SG)分泌的激素,其在家蚕()的滞育启动中具有重要意义,同时DH还能够促进棉铃虫()的滞育终止[62,63]。保幼激素(juvenile hormone,JH)是许多昆虫生长、繁殖等过程的重要调节因子,JH的分泌抑制与多数昆虫的滞育发生相关,同时还能诱导雌性的生殖成熟[61,64]。JH的分泌会受到生物钟基因影响,雌性点蜂缘蝽中的RNAi会抑制JH的分泌[61]。Ma等[65]研究发现,JH可能通过耐烯虫酯基因依赖途径(methoprene-tolerant dependent pathway)调节沙葱萤叶甲()的生殖滞育。Batz等[66]发现,白纹伊蚊()胚胎滞育的发生可能与JH表达降低有关。在柑桔大实蝇()中,蜕皮激素(20-hydroxyecdysone,20E)会通过cAMP等信号通路促进其滞育终止的发生[67]。
2.1.2 哺乳动物的季节性发情
在哺乳动物中,光照是影响年节律产生的最重要因素。在季节性光照变化的识别中,临界昼长(critical day length,CDL)是一个重要的概念,它是指动物能够触发自身相应的光周期反应(photoperiodic reaction)所需要的光照持续时间[56]。当达到临界昼长时,生物体会表现出特定的生理现象,这就是光周期反应。如绵羊()是一种短日照发情动物,当光照时长低于临界昼长时就会出现繁殖行为;鹌鹑()作为长日照发情动物,则在光照时长高于临界昼长时出现繁殖行为。
光照是影响哺乳动物季节性发情最重要的外界因素,但机体无法直接识别光照信息,需要将这种外部信息转化为能够识别的生物信号。因此,机体自身的响应机制具有直接指导作用。褪黑素(melatonin,MEL)由松果体(pineal gland)分泌,其合成和分泌受光照抑制。研究表明褪黑素在黑暗后2小时内急剧增加,在光照后2小时内急剧下降[68]。因此,在短日照的冬季褪黑素分泌时间长,夏季则相反。褪黑素是向下丘脑和大脑其他部分传递光周期信息的重要信号,在光照长度变化的识别中发挥着重要作用[69]。在春分前切除西伯利亚仓鼠()的松果体,10周后给予模拟冬季短光照的褪黑素方案,性腺出现退化现象,与正常春季时出现性腺发育的状态相反[70]。Casao等[71]研究发现褪黑素和睾酮都有季节性变化,公羊生育能力的季节性变化涉及褪黑素和抗氧化防御系统之间的相互作用。因此,在哺乳动物体内,光周期的改变通过褪黑素分泌的变化体现,这对哺乳动物的昼夜节律和季节性生理的产生都具有重要意义。同时,光周期信息的传递离不开神经传导途径,该途径中涉及视网膜、视交叉上核以及室旁核(paraventricular nucleus,PVN)等。而某些特定脑核和神经肽(如下丘脑弓状核的kisspeptin细胞)在调节哺乳动物季节性发情中既发挥协同作用,在不同物种中也会存在差异性[72]。
哺乳动物自身繁殖活动的内部决定因素定位在下丘脑-垂体-性腺(hypothalamic-pituitary-gonadal,HPG)轴,该系统内相关激素的变化受到光照周期的调控。这条生理途径的主要机制为:视网膜是哺乳动物的感光器官,视网膜接受外界的光照刺激后产生神经冲动,神经冲动由下视丘传递到SCN,SCN在感知到视网膜识别的外部光照信息变化后,使自身与外界周期同步,并编码光照信息[73]。SCN中不同细胞生成的精氨酸加压素(arginine vasopressin,AVP)、血管活性肠肽(vasoactive intestinal peptide,VIP)和胆囊收缩素(cholecystokinin,CCK)在将自身的光照反应和内部生物钟同步方面具有重要意义[74]。同时,神经PAS蛋白(neuronal Per-Arnt-Sim domain protein 4,)在识别光照变化并夹带SCN周期中扮演着重要角色,如敲除小鼠的节律出现延长并对光的反应能力减弱[74]。SCN作为哺乳动物的核心生物钟起搏器,其产生的信号通过下丘脑室旁核(paraventricular nucleus of hypothalamus,PVN)、脊柱中间外侧节前交感神经,最终使颈上神经节分泌去甲肾上腺素与松果体细胞上的受体结合,激活松果体褪黑素合成,完成将光照信息转化为垂体结节部(pars tuberalis,PT)能够识别的生理信号的改变[75~77]。在不同光照周期的情况下,褪黑素分泌的时长会出现对应的变化,褪黑素生理信号因此能准确反映昼夜的时长并更好地被生物体感应,从而驱动机体产生相应的节律生理学变化[78]。PT表达褪黑素受体(melatonin receptor,MT),在感知到褪黑素表达的变化后,通过抑制PT中cAMP途径影响生物钟基因表达[79,80]。PT区一系列复杂的光照信号分子变化后分泌促甲状腺激素(thyroid stimulating hormone,TSH),导致下丘脑基底部(medio-basal hypothalamus,MBH)II型脱碘酶(type II thyroid hormone deiodinase,DIO2)与III型脱碘酶(type III thyroid hormone deiodinase,DIO3)表达的变化。DIO2能够促进四碘甲状腺原氨酸(tetraiodothyronine,T4,甲状腺激素(thyroid hormone,TH)的前体形式)转化为三碘甲状腺原氨酸(triiodothyronine, T3,TH的活性形式),DIO3则使T3转变为无活性的形式,进而会影响下丘脑中促性腺激素释放激素(gonadotropin releasing hormone,GnRH)分泌的变化[81~83](图3)。在短日照繁殖动物绵羊中,T3会使下丘脑GnRH的脉冲式释放关闭,启动休情生理机制[82,84]。而在长日照繁殖的西伯利亚仓鼠中,T3则会促进其发情[85]。
在上述生理途径中,PT分泌的TSH是HPG轴激活的重要元素。TSH由α亚基和β亚基组成,其中(又称为)表达在长短光照无显著差异,在长光照下显著增加,促进了TSH的产生[82]。因此,在长光照生理产生中扮演重要角色。在PT中,眼缺失基因3(eyes absent 3,)是一种强烈的长光照激活基因,在转入长光照后即被激活转录[84]。褪黑素能够影响PT中的表达,EYA3通过和SIX1协同激活表达,进而影响后续下丘脑中TSH参与的T3、T4转化,因此是影响TSH的重要因子[86](图3)。除了,针对影响哺乳动物季节性发情的其他相关基因,科研人员也进行了深入探索。例如在不同光照时长下,垂体的血管内皮生长因子A (vascular endothelial growth factor A,)受到褪黑素影响,两种重要的可变剪接体的表达出现相反的变化,影响垂体血管生成(增多或减少),进而影响绵羊的季节性发情性状[87]。另外,、、等基因被证明在哺乳动物季节性发情的调控中也具有重要作用[88~91]。
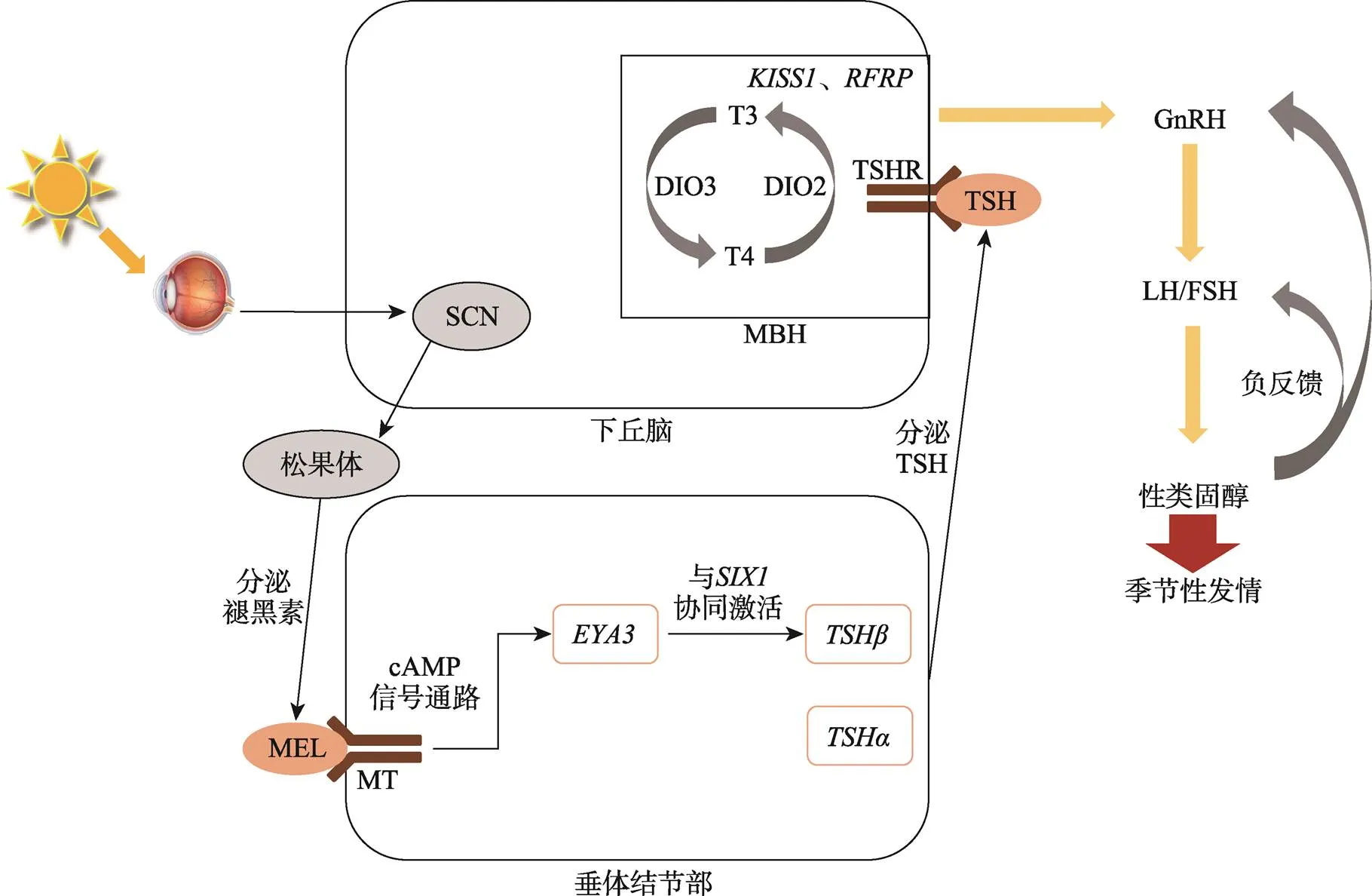
图3 外界环境对哺乳动物季节性发情性状的调控
外界环境的主要影响因素为光照,生物体通过褪黑素分泌的变化体现光照周期的变化,垂体结节部褪黑素受体感应褪黑素分泌变化,并通过一系列分子机制,影响生物体的下丘脑-垂体-性腺(HPG)轴中激素分泌的变化。SCN:视交叉上核;MBH:下丘脑基底部;MEL:褪黑素;MT:褪黑素受体;:眼缺失基因3;TSH:促甲状腺激素;/:促甲状腺激素α/β亚基;TSHR:促甲状腺激素受体;DIO2:脱碘酶 2;DIO3:脱碘酶 3;T3:三碘甲状腺原氨酸;T4:四碘甲状腺原氨酸,:亲吻促动素1;:RF氨酸相关肽;GnRH:促性腺激素释放激素;LH:促黄体素;FSH:促卵泡素。
2.1.3 鸟类的季节性繁殖
在脊椎动物中,鸟类的节律调控与哺乳动物存在很多相似之处。在生物钟分子调控机制上鸟类与哺乳动物中保守性很高,也是通过BMAL1/CLOCK激活含E-box元件的基因转录,PER/CRY复合体负反馈抑制转录,但在鸟类中暂未发现的同源基因[92]。哺乳动物中,视网膜是唯一的光感受器,SCN是生物钟核心起搏器。而鸟类还存在脑深部光感受器,如下丘脑、松果体等,研究发现鹌鹑的眼睛和松果体摘除并不会完全影响光照反应,另外视网膜、SCN和松果体相互作用形成的组合单元同时能够发挥核心起搏器的功能[93]。
在鸟类中,下丘脑基底部(MBH)被认为是季节性繁殖产生的重要部位,下丘脑内表达的脊椎动物古视蛋白(vertebrate ancient,VA)、视蛋白5(opsin 5,OPN5)、黑视蛋白(melanopsin,OPN4)是几个重要的脑深部光感受分子,它们能够通过脑脊液(cerebrospinal fluid,CSF)接触神经元直接投射到PT正中隆起的外部区域,诱导PT内TSH的产生和分泌,TSH诱导第三脑室(the third ventricle,3V)腹外侧壁的伸长细胞中的表达,DIO2促进T4转化为具有生物活性的T3。MBH中长时间诱导的T3会导致GnRH神经末梢和胶质细胞过程的形态学改变,并诱导GnRH分泌,进而通过下丘脑-垂体-性腺轴影响鸟类的发情状态[94~96](图4)。
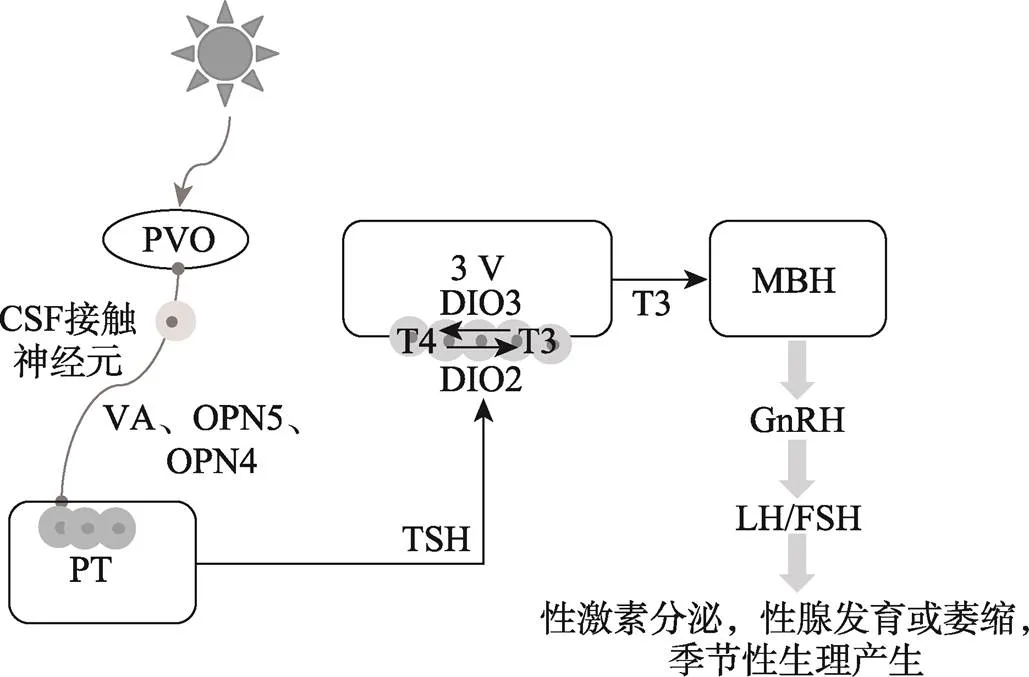
图4 鸟类脑深部光感受器影响季节性发情的机制
VA:脊椎动物古视蛋白;OPN5:视蛋白5;OPN4:黑视蛋白;3V:第三脑室。
2.2 生物钟影响年节律作用模型的提出
生物钟能够为生物体提供准确的计时机制,使生物能够更准确地进行一系列重要行为和生理进程,对于生物的生长发育、繁殖和健康等具有重要意义。年节律能使生物在不利季节调整自身生理状态,使其顺利度过物质匮乏季节,如绵羊的季节性发情能够使后代在适宜的季节出生,有利于提高后代的存活率[97]。
在季节性光周期的识别中,生物钟扮演了重要角色。年度光周期的变化为季节的识别提供了稳定的外部线索,而内源性的光周期计时器则能够让生物正确识别外部线索的变化。生物钟作为生物体的一种计时机制,一直被认为对生物的季节识别具有重要意义。早在1936年,Bünning就提出了光周期响应的外部重合模型:当在光周期的光敏期(超过临界昼长的时间段内,日照时长缩短光敏阶段会被黑暗覆盖)施加额外的光照刺激,会诱发相应的光周期反应[56]。如图5所示,在鸟类中,如果在特定的光敏期给予光刺激能够刺激睾丸的发育[98]。该结果与外部重合模型相符,表明影响生物体产生光周期反应的重要因素是光照刺激作用的时间点而不是暴露于光照下的总时长,暗示内源生物钟可能参与了光周期的时间测量[56,98]。
同时,还有研究提出生物体识别光周期变化的内部模型:该模型认为机体存在多个内部昼夜节律振荡器,其中一个的变化能够与黎明重合,一个与黄昏重合,光的作用是夹带两个振荡器,两者的相位关系决定了机体对光周期变化的识别[99]。在哺乳动物PT中,生物钟基因在白天达到表达高峰,的表达是在夜间早期达到高峰[100]。有研究者推测,和基因在不同光照时长下表达水平的相位迁移及其蛋白与蛋白之间的相互作用,是PT识别光周期变化的一种潜在机制[99~101]。这种分子机制与内部模型相吻合,暗示和可能分别作为黎明和黄昏振荡器,而PT在连接褪黑素信号和后续HPG轴中扮演着重要角色,是生物产生年节律的重要诱导部位,这些结果表明生物体内部的分子计时机制对光周期的识别可能具有指导作用。在两个作用模型中,都把生物钟的作用放在了重要位置,认为其在连接外界光周期变化和内部季节性生理机制转换中扮演着重要的纽带作用。
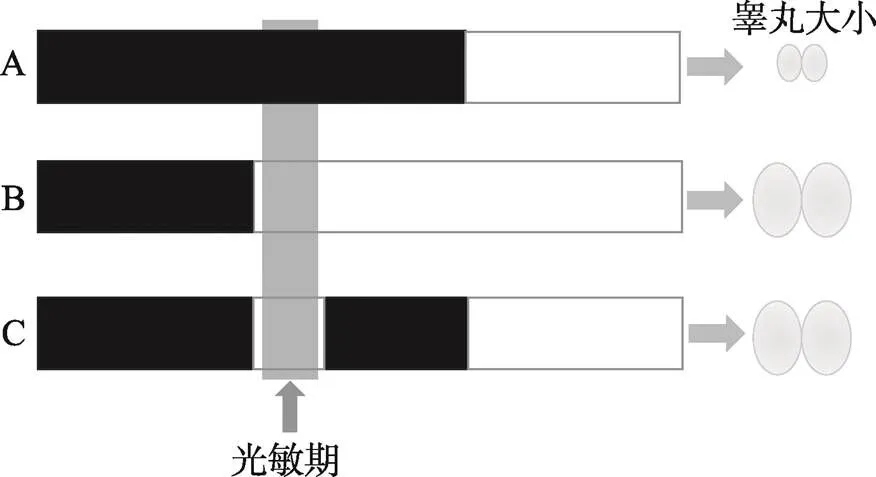
图5 鸟类光敏期施加光刺激促进睾丸生长
A:短光照处理(光敏期被黑暗覆盖);B:长光照处理;C:短光照处理,但在光敏期施加光照刺激。白色部分代表光照,黑色部分代表黑暗。
2.3 生物钟对年节律影响的研究进展
2.3.1 昆虫中生物钟对年节律的影响
果蝇存在季节性滞育现象,其在短光照和低温下会触发这种生理机制[102]。在这种季节性生理现象中,()基因参与了光周期和温度变化的识别[60]。在果蝇中EYA蛋白受到()的调节,TIM能够在蛋白水平稳定EYA;基因的无效突变会导致果蝇冬季滞育发生率降低,在长光照下过表达则会导致滞育的出现[60]。Pegoraro等[103]发现果蝇的生物钟基因突变体per、tim、Clk的昼长(主观白天的长度)测量会受到影响,per突变体的临界昼长比野生型短几个小时,导致对季节的识别出现变化,这会使per突变体在更短的光照下才能触发滞育现象。这些结果表明,在果蝇中生物钟基因与昼长测量存在着密切联系,能够为季节识别提供重要信息。在蟋蟀()中,CRY蛋白能够参与昼长的测量,诱导对应的长光周期和短光周期反应产生[104]。生物钟基因的变化影响昆虫滞育除了涉及相应的基因,这一过程可能还会涉及到与滞育相关的激素。Cui等[105]研究发现,敲除家蚕基因会通过降低蛹期DH的表达水平和作用能力,减少蚕蛹滞育的发生。
2.3.2 哺乳动物中生物钟对年节律的影响
在哺乳动物中,下丘脑视交叉上核是整个机体生物钟的核心起搏器。同时,视交叉上核在光信息传递中也具有重要作用,能够接收和感知视网膜识别的光照变化并编码光周期信息,在使自身与外界光照信息同步后,将光照信息以生物信号的形式依次传递到松果体、垂体结节部、下丘脑,影响HPG轴等激素分泌系统,使生物体产生季节性生理变化,从而调节哺乳动物的年节律[106]。研究发现,SCN切除的动物无法产生光周期反应[107]。而且,不论是长日照繁殖动物还是短日照繁殖动物,如果SCN出现损伤,都会使对应的短光照生理机制无法触发[108,109]。
在先前研究中,和基因的表达模式与哺乳动物光周期识别的内部模型相符,暗示了生物钟在年节律的调控中具有重要意义。和促甲状腺激素β亚基(thyrotrophin β subunit,)作为两个重要的长光照诱导因子:其中转录起始位点附近有D-box元件;基因转录起始位点前的500 bp存在1个D-box和3个E-box元件(图6)[77,110]。E-box和D-box是调节昼夜节律环路中的重要顺式调控元件,含有这两种元件的基因表达会出现昼夜节律性的周期变化[111]。这两个元件的存在,表明和的表达会受到生物钟的调控,暗示生物钟及相关基因对年节律的产生具有调控作用。
此外,有研究发现,昼夜节律相关因子在绵羊休情和发情机制的激活中扮演着重要角色。Wood等[112]发现在长光照(夏季)时,垂体结节部(PT)诱导生物钟基因以依赖于CLOCK/BMAL1二聚体的方式,作用于EYA3和TSH途径触发绵羊夏季休情;在短光照时(冬季),褪黑素分泌时间延长,这样会诱导等昼夜节律抑制因子的表达,抑制上述长光照激发的通路,使生物体无法触发休情,从而产生冬季发情的生理机制(图7)。褪黑素对生物识别光照周期变化具有重要意义,在PT中能够通过抑制cAMP途径影响生物钟基因表达,黎明时褪黑素分泌的减少解除了cAMP途径的抑制,因此对的表达高峰出现至关重要[80]。而和作为生物钟负反馈抑制的重要元件,在PT中二者表达的相位关系可能在褪黑素和BMAL2/BMAL1/CLOCK复合体影响表达中起着连接作用。本课题组在之前的研究中发现基因存在错义突变位点,在常年发情绵羊中以突变型为主,在季节性发情绵羊中以野生型为主,并认为这可能是影响绵羊季节性发情触发的重要突变[113]。FBXL3蛋白作为泛素连接酶E3的组成部分,能够促进CRY蛋白的泛素化降解,影响生物钟反馈环路,是昼夜节律维持的重要调控基因[44]。Naval-Sanchez等[114]在分析绵羊的驯化和表型多样性时,比较了野生摩弗伦羊()和43个现代绵羊品种(野生摩弗伦羊相对家养绵羊品种季节性性状表现更明显)的基因组序列,发现在中存在的错义突变位点可能在控制绵羊的季节性方面发挥作用。综上所述,生物钟环路内的基因及其调控基因在年节律的触发中扮演了重要角色,其对光周期变化的识别具有重要意义。
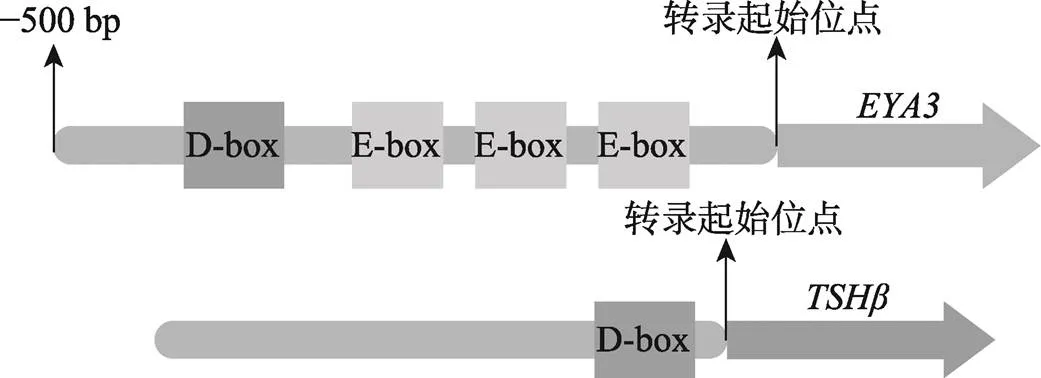
图6 TSHβ和EYA3启动子区的D-box和E-box元件
(上)和(下)是垂体结节部(PT)两种重要的长光照诱导因子,在触发动物的长光照生理(如季节性发情绵羊的夏季休情)中扮演了重要角色。两者的启动子区包含E-box和D-box两种顺式作用元件,表明两者的表达会受到生物钟的调控。
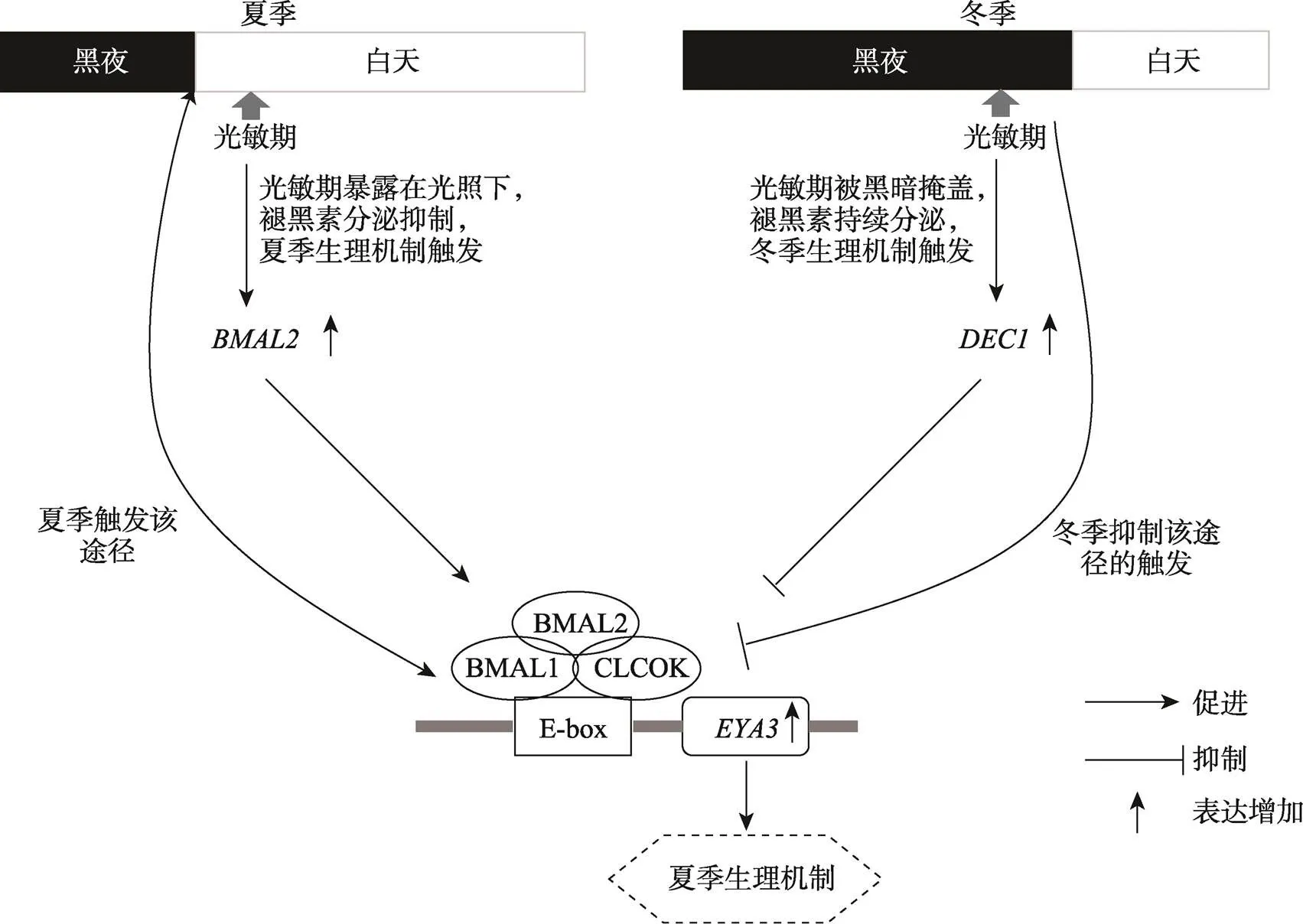
图7 绵羊长短光周期下的遗传调控
因含有E-box元件,表达会受到生物钟调控。夏季(长光照)时,(生物钟重要成员)能够依赖性地触发EYA3途径,使动物产生休情;冬季(短光照)时,该途径会受到抑制,休情无法触发,出现发情。
3 结语与展望
大部分生物为了适应外部环境的周期性变化,经过长期进化形成内在的节律系统以调节自身状态,最常见的是由于昼夜变化形成的昼夜节律和季节变化形成的年节律,它们与生命的生长发育、健康、繁殖等息息相关。如今人们对于昼夜节律的机制研究已经有了很大的进展,动植物的相关分子机制已有较完善的解析。年节律产生机制的研究也已经有了一些进展,如昆虫中DH、JH等激素,绵羊中T3、T4的转化和PRL、FSH、LH等激素分泌的变化,以及(昆虫中为)、等基因都被认为参与了季节性生理机制的激活。
自光周期识别的外部和内部模型的提出开始,生物钟对年节律的产生具有指导作用就是一项不可忽视的方向。如褪黑素作为哺乳动物反应外部光照变化的生理信号,能够反应外部光照时长的变化,在昼夜节律和年节律的指导中都扮演了重要角色。生物钟相关通路通过顺式作用元件影响了体内大部分基因的表达,目前也有研究表明相关基因的变化(如绵羊、果蝇)在不同季节的生理机制触发中起到一定的指导作用,部分突变也会对年节律的产生造成影响。但是,生物钟通路内各基因之间关系密切,而其对年节律影响的研究仅为少数几个基因,大多数生物钟基因在年节律产生中是否扮演了一定的角色还尚未报道,或者研究仅在猜测阶段,相关详细的机制尚未有较深入的研究。因此,依据现有的生物钟与动物季节识别关系的研究,进一步研究生物钟通路内其他基因和相关调控基因对年节律产生的影响机制及一些重要突变是否在相关性状(如绵羊季节性发情)中起到积极意义,对年节律进行更细致的解析,进而能够为在基因层面改善农业病虫害和部分家养动物的季节性发情性状等提供新思路。
[1] Shui K. Systematic study of the regulatory mechanism and function of circadian rhythm [Dissertation]. Huazhong University of Science and Technology, 2020.税珂. 近日节律的调控机理与功能的系统生物学研究[学位论文]. 华中科技大学, 2020.
[2] Roenneberg T, Merrow M. The circadian clock and human health., 2016, 26(10): R432–R443.
[3] Virshup DM, Forger DB. After hours keeps clock researchers CRYing Overtime., 2007, 129(5): 857–859.
[4] Lowrey PL, Takahashi JS. Mammalian circadian biology: elucidating genome-wide levels of temporal organization., 2004, 5: 407–441.
[5] Musiek ES, Holtzman DM. Mechanisms linking circadian clocks, sleep, and neurodegeneration., 2016, 354(6315): 1004–1008.
[6] Huang RC. The discoveries of molecular mechanisms for the circadian rhythm: the 2017 Nobel Prize in Physiology or Medicine., 2018, 41(1): 5–8.
[7] Peschel N, Chen KF, Szabo G, Stanewsky R. Light- dependent interactions between thecircadian clock factors cryptochrome, jetlag, and timeless., 2009, 19(3): 241–247.
[8] Kivimäe S, Saez L, Young MW. Activating PER repressor through a DBT-directed phosphorylation switch., 2008, 6(7): e183.
[9] Kloss B, Rothenfluh A, Young MW, Saez L. Phosphorylation of period is influenced by cycling physical associations of double-time, period, and timeless in theclock., 2001, 30(3): 699–706.
[10] Emery P, So WV, Kaneko M, Hall JC, Rosbash M. CRY, aclock and light-regulated cryptochrome, is a major contributor to circadian rhythm resetting and photosensitivity., 1998, 95(5): 669–679.
[11] Krishnan B, Levine JD, Lynch MK, Dowse HB, Funes P, Hall JC, Hardin PE, Dryer SE. A new role for cryptochrome in acircadian oscillator., 2001, 411(6835): 313–317.
[12] Jaumouillé E, Machado Almeida P, Stähli P, Koch R, Nagoshi E. Transcriptional regulation via nuclear receptor crosstalk required for thecircadian clock., 2015, 25(11): 1502–1508.
[13] Lu H, Li YC, Huang XS. Mechanistic studies of post-translational modifications on the proteasome., 2021, 37(6): 710–719.卢慧, 李衍常, 黄学石. 蛋白酶体翻译后修饰功能机制研究. 中国生物化学与分子生物学报, 2021, 37(6): 710–719.
[14] Edery I, Zwiebel LJ, Dembinska ME, Rosbash M. Temporal phosphorylation of theperiod protein., 1994, 91(6): 2260–2264.
[15] Price JL, Blau J, Rothenfluh A, Abodeely M, Kloss B, Young MW. Double-time is a novelclock gene that regulates PERIOD protein accumulation., 1998, 94(1): 83–95.
[16] Fang YS, Sathyanarayanan S, Sehgal A. Post-translational regulation of thecircadian clock requires protein phosphatase 1 (PP1)., 2007, 21(12): 1506–1518.
[17] Grima B, Dognon A, Lamouroux A, Chélot E, Rouyer F. CULLIN-3 controls TIMELESS oscillations in thecircadian clock., 2012, 10(8): e1001367.
[18] Koh K, Zheng XZ, Sehgal A. JETLAG resets thecircadian clock by promoting light-induced degradation of TIMELESS., 2006, 312(5781): 1809–1812.
[19] Li MD, Ruan HB, Hughes ME, Lee JS, Singh JP, Jones SP, Nitabach MN, Yang XY. O-GlcNAc signaling entrains the circadian clock by inhibiting BMAL1/CLOCK ubiquitination., 2013, 17(2): 303–310.
[20] Kaasik K, Kivimäe S, Allen JJ, Chalkley RJ, Huang Y, Baer K, Kissel H, Burlingame AL, Shokat KM, Ptáček LJ, Fu YH. Glucose sensor O-GlcNAcylation coordinates with phosphorylation to regulate circadian clock., 17(2): 291–302.
[21] Kim EY, Jeong EH, Park S, Jeong HJ, Edery I, Cho JW. A role for O-GlcNAcylation in setting circadian clock speed., 2012, 26(5): 490–502.
[22] Zhang R, Du J, Zhao X, Wei L, Zhao Z. Regulation of circadian behavioural output via clock-responsive miR-276b., 2021, 30(1): 81–89.
[23] Xia XJ, Fu XN, Du J, Wu BB, Zhao XG, Zhu JS, Zhao ZW. Regulation of circadian rhythm and sleep by miR-375-timeless interaction in., 2020, 34(12): 16536–16551.
[24] Chen X, Rosbash M. Mir-276a strengthenscircadian rhythms by regulating timeless expression., 2016, 113(21): E2965–E2972.
[25] Zhang Y, Lamba P, Guo PY, Emery P. MiR-124 regulates the phase ofcircadian locomotor behavior., 2016, 36(6): 2007–2013.
[26] Garaulet DL, Sun KL, Li WH, Wen JY, Panzarino AM, O'Neil JL, Hiesinger PR, Young MW, Lai EC. MiR-124 regulates diverse aspects of rhythmic behavior in., 2016, 36(12): 3414–3421.
[27] Liu ZX, Selby CP, Yang YY, Lindsey-Boltz LA, Cao XM, Eynullazada K, Sancar A. Circadian regulation of c-MYC in mice., 2020, 117(35): 21609– 21617.
[28] Griffin EA Jr, Staknis D, Weitz CJ. Light-independent role of CRY1 and CRY2 in the mammalian circadian clock., 1999, 286(5440): 768–771.
[29] Kume K, Zylka MJ, Sriram S, Shearman LP, Weaver DR, Jin X, Maywood ES, Hastings MH, Reppert SM. mCRY1 and mCRY2 are essential components of the negative limb of the circadian clock feedback loop., 1999, 98(2): 193–205.
[30] Preitner N, Damiola F, Lopez-Molina L, Zakany J, Duboule D, Albrecht U, Schibler U. The orphan nuclear receptor REV-ERBalpha controls circadian transcription within the positive limb of the mammalian circadian oscillator., 2002, 110(2): 251–260.
[31] Vitaterna MH, Selby CP, Todo T, Niwa H, Thompson C, Fruechte EM, Hitomi K, Thresher RJ, Ishikawa T, Miyazaki J, Takahashi JS, Sancar A. Differential regulation of mammalian period genes and circadian rhythmicity by cryptochromes 1 and 2., 1999, 96(21): 12114–12119.
[32] Matsuo T, Yamaguchi S, Mitsui S, Emi A, Shimoda F, Okamura H. Control mechanism of the circadian clock for timing of cell division in vivo., 2003, 302(5643): 255–259.
[33] Kondratov RV, Shamanna RK, Kondratova AA, Gorbacheva VY, Antoch MP. Dual role of the CLOCK/ BMAL1 circadian complex in transcriptional regulation., 2006, 20(3): 530–532.
[34] Liu AC, Welsh DK, Ko CH, Tran HG, Zhang EE, Priest AA, Buhr ED, Singer O, Meeker K, Verma IM, Doyle FJ 3rd, Takahashi JS, Kay SA. Intercellular coupling confers robustness against mutations in the SCN circadian clock network., 2007, 129(3): 605–616.
[35] Etchegaray JP, Lee C, Wade PA, Reppert SM. Rhythmic histone acetylation underlies transcription in the mammalian circadian clock., 2003, 421(6919): 177–182.
[36] Crumbley C, Burris TP. Direct regulation of CLOCK expression by REV-ERB., 2011, 6(3): e17290.
[37] Dierickx P, Zhu K, Carpenter BJ, Jiang CJ, Vermunt MW, Xiao Y, Luongo TS, Yamamoto T, Martí-Pàmies Í, Mia S, Latimer M, Diwan A, Zhao JJ, Hauck AK, Krusen B, Nguyen HCB, Blobel GA, Kelly DP, Pei LM, Baur JA, Young ME, Lazar MA. Circadian REV-ERBs repress E4bp4 to activate NAMPT-dependent NAD+biosynthesis and sustain cardiac function., 2022, 1(1): 45–58.
[38] Yamajuku D, Shibata Y, Kitazawa M, Katakura T, Urata H, Kojima T, Takayasu S, Nakata O, Hashimoto S. Cellular DBP and E4BP4 proteins are critical for determining the period length of the circadian oscillator., 2011, 585(14): 2217–2222.
[39] Ohno T, Onishi Y, Ishida N. A novel E4BP4 element drives circadian expression of mPeriod2., 2007, 35(2): 648–655.
[40] Yoshitane H, Asano Y, Sagami A, Sakai S, Suzuki Y, Okamura H, Iwasaki W, Ozaki H, Fukada Y. Functional D-box sequences reset the circadian clock and drive mRNA rhythms., 2019, 2: 300.
[41] Chen K, Cheng HH, Zhou RJ. Molecular mechanisms and functions of autophagy and the ubiquitin-proteasome pathway., 2012, 34(1): 5–18.陈科, 程汉华, 周荣家. 自噬与泛素化蛋白降解途径的分子机制及其功能. 遗传, 2012, 34(1): 5–18.
[42] St John PC, Hirota T, Kay SA, Doyle FJ 3rd. Spatiotemporal separation of PER and CRY posttranslational regulation in the mammalian circadian clock., 2014, 111(5): 2040–2045.
[43] Lee C, Etchegaray JP, Cagampang FR, Loudon AS, Reppert SM. Posttranslational mechanisms regulate the mammalian circadian clock., 2001, 107(7): 855–867.
[44] Busino L, Bassermann F, Maiolica A, Lee C, Nolan PM, Godinho SIH, Draetta GF, Pagano M. SCFFbxl3controls the oscillation of the circadian clock by directing the degradation of cryptochrome proteins., 2007, 316(5826): 900–904.
[45] Dardente H, Mendoza J, Fustin JM, Challet E, Hazlerigg DG. Implication of the F-Box protein FBXL21 in circadian pacemaker function in mammals., 2008, 3(10): e3530.
[46] Lamia KA, Sachdeva UM, DiTacchio L, Williams EC, Alvarez JG, Egan DF, Vasquez DS, Juguilon H, Panda S, Shaw RJ, Thompson CB, Evans RM. AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation., 2009, 326(5951): 437–440.
[47] Schmalen I, Reischl S, Wallach T, Klemz R, Grudziecki A, Prabu JR, Benda C, Kramer A, Wolf E. Interaction of circadian clock proteins CRY1 and PER2 is modulated by zinc binding and disulfide bond formation., 2014, 157(5): 1203–1215.
[48] Berthier A, Vinod M, Porez G, Steenackers A, Alexandre J, Yamakawa N, Gheeraert C, Ploton M, Maréchal X, Dubois-Chevalier J, Hovasse A, Schaeffer-Reiss C, Cianférani S, Rolando C, Bray F, Duez H, Eeckhoute J, Lefebvre T, Staels B, Lefebvre P. Combinatorial regulation of hepatic cytoplasmic signaling and nuclear transcripttional events by the OGT/REV-ERBα complex., 2018, 115(47): E11033–E11042.
[49] Chen R, D'Alessandro M, Lee C. MiRNAs are required for generating a time delay critical for the circadian oscillator., 2013, 23(20): 1959–1968.
[50] Yoo SH, Kojima S, Shimomura K, Koike N, Buhr ED, Furukawa T, Ko CH, Gloston G, Ayoub C, Nohara K, Reyes BA, Tsuchiya Y, Yoo OJ, Yagita K, Lee C, Chen Z, Yamazaki S, Green CB, Takahashi JS. Period2 3'-UTR and microRNA-24 regulate circadian rhythms by repressing PERIOD2 protein accumulation., 2017, 114(42): E8855–E8864.
[51] Zhou L, Miller C, Miraglia LJ, Romero A, Mure LS, Panda S, Kay SA. A genome-wide microRNA screen identifies the microRNA-183/96/182 cluster as a modulator of circadian rhythms., 2021, 118(1): e2020454118.
[52] Bu Y, Yoshida A, Chitnis N, Altman BJ, Tameire F, Oran A, Gennaro V, Armeson KE, McMahon SB, Wertheim GB, Dang CV, Ruggero D, Koumenis C, Fuchs SY, Diehl JA. A PERK-miR-211 axis suppresses circadian regulators and protein synthesis to promote cancer cell survival., 2018, 20(1): 104–115.
[53] Cha S, Wang JY, Lee SM, Tan Z, Zhao Q, Bai D. Clock-modified mesenchymal stromal cells therapy rescues molecular circadian oscillation and age-related bone loss via miR142-3p/Bmal1/YAP signaling axis., 2022, 8(1): 111.
[54] Gao Q, Zhou L, Yang SY, Cao JM. A novel role of microRNA 17-5p in the modulation of circadian rhythm., 2016, 6: 30070.
[55] Cheng QY, Fan XY, Liu YT, Xu LR, Dong PJ, Song LW, Qian RZ. MiR-455-5p regulates circadian rhythms by accelerating the degradation of clock mRNA., 2022, 74(3): 245–258.
[56] Guh YJ, Tamai TK, Yoshimura T. The underlying mechanisms of vertebrate seasonal reproduction., 2019, 95(7): 343–357.
[57] Koštál V, Štětina T, Poupardin R, Korbelová J, Bruce AW. Conceptual framework of the eco-physiological phases of insect diapause development justified by transcriptomic profiling., 2017, 114(32): 8532–8537.
[58] Ren S. Mechanism of summer diapause induction of(Diptera: Anthomyiidae) [Dissertation]. Chongqing University, 2018.任爽. 葱蝇(Diptera:Anthomyiidae)夏滞育诱导机理研究[学位论文]. 重庆大学, 2018.
[59] Saeed MM, Tougeron K, Raza ABM, Afzal M, Aqueel A, Le Goff GJ, Renoz F, Pirotte J, Hance T. Transgenerational phenotypic plasticity of diapause induction and related fitness cost in a commercial strain of the parasitoidHaliday., 2021, 28(3): 780–792.
[60] Abrieux A, Xue YB, Cai Y, Lewald KM, Nguyen HN, Zhang Y, Chiu JC. EYES ABSENT and TIMELESS integrate photoperiodic and temperature cues to regulate seasonal physiology in., 2020, 117(26): 15293–15304.
[61] Ikeno T, Tanaka SI, Numata H, Goto SG. Photoperiodic diapause under the control of circadian clock genes in an insect., 2010, 8: 116.
[62] Yamashita O. Diapause hormone of the silkworm,: structure, gene expression and function., 1996, 42(7): 669–679.
[63] Xu WH, Denlinger DL. Molecular characterization of prothoracicotropic hormone and diapause hormone induring diapause, and a new role for diapause hormone., 2003, 12(5): 509–516.
[64] Jindra M, Palli SR, Riddiford LM. The juvenile hormone signaling pathway in insect development., 2013, 58: 181–204.
[65] Ma HY, Li YY, Li L, Tan Y, Pang BP. Juvenile hormone regulates the reproductive diapause through Methoprene- tolerant gene in., 2021, 30(4): 446–458.
[66] Batz ZA, Brent CS, Marias MR, Sugijanto J, Armbruster PA. Juvenile hormone III but not 20-hydroxyecdysone regulates the embryonic diapause of., 2019, 10: 1352.
[67] Dong YC, Chen ZZ, Clarke AR, Niu CY. Changes in energy metabolism trigger pupal diapause transition ofafter 20-hydroxyecdysone application., 2019, 10: 1288.
[68] Thrun LA, Moenter SM, O'Callaghan D, Woodfill CJ, Karsch FJ. Circannual alterations in the circadian rhythm of melatonin secretion., 1995, 10(1): 42–54.
[69] Karsch FJ, Bittman EL, Foster DL, Goodman RL, Legan SJ, Robinson JE. Neuroendocrine basis of seasonal reproduction., 1984, 40: 185–232.
[70] Butler MP, Turner KW, Park JH, Schoomer EE, Zucker I, Gorman MR. Seasonal regulation of reproduction: altered role of melatonin under naturalistic conditions in hamsters., 2010, 277(1695): 2867–2874.
[71] Casao A, Cebrián I, Asumpção ME, Pérez-Pé R, Abecia JA, Forcada F, Cebrián-Pérez JA, Muiño-Blanco T. Seasonal variations of melatonin in ram seminal plasma are correlated to those of testosterone and antioxidant enzymes., 2010, 8: 59.
[72] Weems PW, Goodman RL, Lehman MN. Neural mechanisms controlling seasonal reproduction: principles derived from the sheep model and its comparison with hamsters., 2015, 37: 43–51.
[73] Ralph MR, Foster RG, Davis FC, Menaker M. Transplanted suprachiasmatic nucleus determines circadian period., 1990, 247(4945): 975–978.
[74] Xu P, Berto S, Kulkarni A, Jeong B, Joseph C, Cox KH, Greenberg ME, Kim TK, Konopka G, Takahashi JS. NPAS4 regulates the transcriptional response of the suprachiasmatic nucleus to light and circadian behavior., 2021, 109(20): 3268–3282.
[75] Pandi-Perumal SR, Srinivasan V, Maestroni GJM, Cardinali DP, Poeggeler B, Hardeland R. Melatonin: nature's most versatile biological signal?, 2006, 273(13): 2813–2838.
[76] Brainard GC, Hanifin JP, Greeson JM, Byrne B, Glickman G, Gerner E, Rollag MD. Action spectrum for melatonin regulation in humans: evidence for a novel circadian photoreceptor., 2001, 21(16): 6405–6412.
[77] Xia Q, Liu QY, Wang XY, Hu WP, Li CY, He XY, Chu MX, Di R. The molecular mechanism of sheep seasonal breeding and artificial regulatory techniques for estrus and mating in anestrus., 2018, 40(5): 369–377.夏青, 刘秋月, 王翔宇, 胡文萍, 李春艳, 贺小云, 储明星, 狄冉. 绵羊季节性繁殖分子机制及休情季节诱导绵羊发情配种技术. 遗传, 2018, 40(5): 369–377.
[78] Kang SW, Thayananuphat A, Bakken T, El Halawani ME. Dopamine-melatonin neurons in the avian hypothalamus controlling seasonal reproduction., 2007, 150(1): 223–233.
[79] Johnston JD, Tournier BB, Andersson H, Masson-Pévet M, Lincoln GA, Hazlerigg DG. Multiple effects of melatonin on rhythmic clock gene expression in the mammalian pars tuberalis., 2006, 147(2): 959–965.
[80] Von Gall C, Garabette ML, Kell CA, Frenzel S, Dehghani F, Schumm-Draeger PM, Weaver DR, Korf HW, Hastings MH, Stehle JH. Rhythmic gene expression in pituitary depends on heterologous sensitization by the neurohormone melatonin., 2002, 5(3): 234–238.
[81] Dardente H, Lomet D, Robert V, Decourt C, Beltramo M, Pellicer-Rubio MT. Seasonal breeding in mammals: from basic science to applications and back., 2016, 86(1): 324–332.
[82] Hanon EA, Lincoln GA, Fustin JM, Dardente H, Masson-Pévet M, Morgan PJ, Hazlerigg DG. Ancestral TSH mechanism signals summer in a photoperiodic mammal., 2008, 18(15): 1147–1152.
[83] Ono H, Hoshino Y, Yasuo S, Watanabe M, Nakane Y, Murai A, Ebihara S, Korf HW, Yoshimura T. Involvement of thyrotropin in photoperiodic signal transduction in mice.2008, 105(47): 18238-18242.
[84] Dupré SM, Miedzinska K, Duval CV, Yu L, Goodman RL, Lincoln GA, Davis JR, McNeilly AS, Burt DD, Loudon AS. Identification of EYA3 and TAC1 as long-day signals in the sheep pituitary., 2010, 20(9): 829–835.
[85] Henson JR, Carter SN, Freeman DA. Exogenous T₃ elicits long day-like alterations in testis size and the RFamides Kisspeptin and gonadotropin-inhibitory hormone in short-day Siberian hamsters., 2013, 28(3): 193–200.
[86] Masumoto KH, Ukai-Tadenuma M, Kasukawa T, Nagano M, Uno KD, Tsujino K, Horikawa K, Shigeyoshi Y, Ueda HR. Acute induction of Eya3 by late-night light stimulation triggers TSHβ expression in photoperiodism., 2010, 20(24): 2199–2206.
[87] Castle-Miller J, Bates DO, Tortonese DJ. Mechanisms regulating angiogenesis underlie seasonal control of pituitary function., 2017, 114(12): E2514–E2523.
[88] Carcangiu V, Vacca GM, Mura MC, Dettori ML, Pazzola M, Luridiana S, Bini PP. Relationship between MTNR1A melatonin receptor gene polymorphism and seasonal reproduction in different goat breeds., 2009, 110(1–2): 71–78.
[89] Huang DW, Wang JX, Liu QY, Chu MX, Di R, He JN, Cao GL, Fang L, Feng T, Li N. Analysis on DNA sequence of TSHB gene and its association with reproductive seasonality in goats., 2013, 40(2): 1893–1904.
[90] He XY, Zhang ZB, Liu QY, Chu MX. Polymorphisms of the melatonin receptor 1A gene that affects the reproductive seasonality and litter size in Small Tail Han sheep., 2019, 54(10): 1400–1410.
[91] Simonneaux V. A Kiss to drive rhythms in reproduction., 2020, 51(1): 509–530.
[92] Woller A, Gonze D. The bird circadian clock: insights from a computational model., 2013, 28(6): 390–402.
[93] Siopes TD, Wilson WO. Extraocular modification of photoreception in intact and pinealectomized coturnix., 1974, 53(6): 2035–2041.
[94] Halford S, Pires SS, Turton M, Zheng L, González- Menéndez I, Davies WL, Peirson SN, García-Fernández JM, Hankins MW, Foster RG. VA opsin-based photoreceptors in the hypothalamus of birds., 2009, 19(16): 1396–1402.
[95] Nakane Y, Ikegami K, Ono H, Yamamoto N, Yoshida S, Hirunagi K, Ebihara S, Kubo Y, Yoshimura T. A mammalian neural tissue opsin (Opsin 5) is a deep brain photoreceptor in birds., 2010, 107(34): 15264–15268.
[96] Chaurasia SS, Rollag MD, Jiang G, Hayes WP, Haque R, Natesan A, Zatz M, Tosini G, Liu C, Korf HW, Iuvone PM, Provencio I. Molecular cloning, localization and circadian expression of chicken melanopsin (Opn4): differential regulation of expression in pineal and retinal cell types., 2005, 92(1): 158–170.
[97] Di R, He JN, Song SH, Tian DM, Liu QY, Liang XJ, Ma Q, Sun M, Wang JD, Zhao WM, Cao GL, Wang JX, Yang ZM, Ge Y, Chu MX. Characterization and comparative profiling of ovarian microRNAs during ovine anestrus and the breeding season., 2014, 15(1): 899.
[98] Tamai TK, Yoshimura T. Molecular and neuroendocrine mechanisms of avian seasonal reproduction., 2017, 1001: 125–136.
[99] Pittendrigh CS. Circadian surfaces and the diversity of possible roles of circadian organization in photoperiodic induction., 1972, 69(9): 2734–2737.
[100] Lincoln G, Messager S, Andersson H, Hazlerigg D. Temporal expression of seven clock genes in the suprachiasmatic nucleus and the pars tuberalis of the sheep: evidence for an internal coincidence timer., 2002, 99(21): 13890–13895.
[101] Ikegami K, Yoshimura T. Circadian clocks and the measurement of daylength in seasonal reproduction., 2012, 349(1): 76–81.
[102] Si FL. Cloning and expression of thegene during diapause in the maggot,[Dissertation]. Chongqing Normal University, 2011.司风玲. 葱蝇基因的克隆及在滞育时期的表达[学位论文]. 重庆师范大学, 2011.
[103] Pegoraro M, Gesto JS, Kyriacou CP, Tauber E. Role for circadian clock genes in seasonal timing: testing the Bünning hypothesis., 2014, 10(9): e1004603.
[104] Ueda H, Tamaki S, Miki T, Uryu O, Kamae Y, Nose M, Shinohara T, Tomioka K. Cryptochrome genes mediate photoperiodic responses in the cricket., 2018, 43(4): 285–294.
[105] Cui WZ, Qiu JF, Dai TM, Chen Z, Li JL, Liu K, Wang YJ, Sima YH, Xu SQ. Circadian clock gene Period contributes to diapause via GABAeric-diapause hormone pathway in., 2021, 10(9): 842.
[106] Coomans CP, Ramkisoensing A, Meijer JH. The suprachiasmatic nuclei as a seasonal clock., 2015, 37: 29–42.
[107] Nishiwaki-Ohkawa T, Yoshimura T. Molecular basis for regulating seasonal reproduction in vertebrates., 2016, 229(3): R117–R127.
[108] Bittman EL, Bartness TJ, Goldman BD, DeVries GJ. Suprachiasmatic and paraventricular control of photoperiodism in Siberian hamsters., 1991, 260(1 Pt 2): R90–R101.
[109] Maurel D, Boissin-Agasse L, Roch G, Herbuté S, Boissin J. Suprachiasmatic nucleus lesions abolish photoperiod- induced changes in the testis function and GnRH immunoreactivity in the mink, a short-day breeder., 1991, 54(2): 103–110.
[110] Dardente H, Wyse CA, Birnie MJ, Dupré SM, Loudon ASI, Lincoln GA, Hazlerigg DG. A molecular switch for photoperiod responsiveness in mammals., 2010, 20(24): 2193–2198.
[111] Shi GS. The roles ofin regulating circadian clock [Dissertation]. Nanjing University, 2014.时广森.对近日节律作用机制的研究[学位论文]. 南京大学, 2014.
[112] Wood SH, Hindle MM, Mizoro Y, Cheng Y, Saer BRC, Miedzinska K, Christian HC, Begley N, McNeilly J, McNeilly AS, Meddle SL, Burt DW, Loudon ASI. Circadian clock mechanism driving mammalian photoperiodism., 2020, 11(1): 4291.
[113] Yang Y, Zhong YJ, Jiang Y, Chu MX, Liu QY.gene expression and correlation analysis between its polymorphism and seasonal estrus in sheep ()., 2022, 30(1): 75–84.杨阳, 钟英杰, 姜雨, 储明星, 刘秋月. 绵羊基因表达及其多态性与季节性发情的相关性分析. 农业生物技术学报, 2022, 30(1): 75–84
[114] Naval-Sanchez M, Nguyen Q, McWilliam S, Porto-Neto LR, Tellam R, Vuocolo T, Reverter A, Perez-Enciso M, Brauning R, Clarke S, McCulloch A, Zamani W, Naderi S, Rezaei HR, Pompanon F, Taberlet P, Worley KC, Gibbs RA, Muzny DM, Jhangiani SN, Cockett N, Daetwyler H, Kijas J. Sheep genome functional annotation reveals proximal regulatory elements contributed to the evolution of modern breeds., 2018, 9(1): 859.
The mechanism of circadian clock and its influence on animal circannual rhythm
Yang Yang1, Mingxing Chu1, Qiuyue Liu2
The circadian clock exists in almost all life forms, and is an internal activity generated by organisms adapting to the daily periodic changes of the external environment. The circadian clock is regulated by the transcription-translation-negative feedback loop in the body, which can regulate the activities of tissues and organs. Its normal maintenance is important for the health, growth, and reproduction of organisms. In contrast, due to the season changes of the environment, organisms have also formed annual cycle physiological changes in their bodies, such as seasonal estrus, etc. The annual rhythm of living things is mainly affected by environmental factors such as photoperiod, and is related to gene expression, hormone content, morphological changes of cell and tissues. Melatonin is an important signal to recognize the changes of photoperiod, and the circadian clock plays an important role in the pituitary to interpret the signal of melatonin and regulate the changes of downstream signals, which plays an important guiding role in the recognition of annual changes in the environment and the generation of the body's annual rhythm. In this review, we summarize the progress of research on the mechanism of action of circadian clocks in influencing annual rhythms, by introducing the mechanisms of circadian and annual rhythms generation in insects and mammals, and in the context of annual rhythms in birds, with the aim of providing a broader range of ideas for future research on the mechanism of annual rhythms influence.
circadian clock; circannual rhythm; molecular mechanism; insect; mammals
2023-01-09;
2023-04-14;
2023-04-24
国家自然科学基金项目(编号:32172704),中国农业科学院科技创新工程(编号:CAAS-ZDRW202106,ASTIP-IAS13),财政部和农业农村部国家现代农业产业技术体系(编号:CARS-38)和中国科学院战略性先导科技专项(A类)(编号:XDA24030205)资助[Supported by the National Natural Science Foundation of China (No. 32172704), the Agricultural Science and Technology Innovation Program of China (Nos. CAAS-ZDRW202106, ASTIP-IAS13), the China Agriculture Research System of MOF and MARA (No. CARS-38), and the Strategic Priority Research Program of Chinese Academy of Sciences (No. XDA24030205)]
杨阳,硕士,专业方向:动物繁育原理与技术。E-mail: yy176362@163.com
刘秋月,博士,副研究员,研究方向:羊优异繁殖性状分子机理。E-mail: qyliu@genetics.ac.cn
储明星,博士,研究员,研究方向:羊优异繁殖性状分子机理。E-mail: mxchu@263.net
10.16288/j.yczz.23-008
(责任编委: 徐璎)
