氮添加对杉木凋落物分解过程中酶活性的影响1)
2023-05-23费裕翀伍丽华陈义堂叶义全曹世江郑宏林开敏曹光球
费裕翀 伍丽华 陈义堂 叶义全 曹世江 郑宏 林开敏 曹光球
(福建农林大学,福州,350002)(福建省洋口国有林场)(福建农林大学)(福建省洋口国有林场)(福建农林大学)
凋落物是森林生态系统内,由地上植物产生并归还到林地表面的生物组分,其分解过程是森林生态系统物质循环和能量流动的重要一环[1]。碳(C)和氮(N)元素的化学计量比(w(C)∶w(N))不仅能够表征植物吸收营养同化碳的效率,还反映微生物分解凋落物的难易程度,具有重要的生态学价值。有关研究发现,底物质量较差的凋落物在分解初期阶段普遍存在氮富集现象,凋落物初始w(C)∶w(N)比与分解速率具有显著线性关系[2]。当凋落物木质素质量分数和w(C)∶w(N)比较高时,土壤氮元素贫乏将导致凋落物分解周期较长,森林生态系统养分周转较慢[3]。当凋落物w(C)∶w(N)值大于30时,无机氮发生固持;当凋落物w(C)∶w(N)值小于30时,氮发生矿化,说明凋落物分解过程的w(C)∶w(N)比存在临界值[4-6]。当凋落物自身w(C)∶w(N)比高于临界值时,氮元素的缺乏阻碍了微生物胞外酶的分泌,使得分解速率较慢,微生物需要通过吸收外源氮满足自身生长需要,也是底物质量较差的凋落物在分解初期常常出现养分富集现象的原因[7]。因此,立足于w(C)∶w(N)比研究凋落物的分解,对于森林生态系统碳循环过程具有重要意义。现有研究普遍采用混合凋落物以及喷施外源氮的方式提高凋落物的氮质量分数,往往只关注处理措施对凋落物氮源的供给情况,而忽视了凋落物自身的底物质量以及研究区域的环境条件[8],氮添加对森林地表凋落物分解的效应仍具有不确定性。
杉木(Cunninghamialanceolata)属于亚热带常绿乔木,具有生长快、材质好、病害少等优点,是我国南方最重要的速生用材树种之一[9]。杉木木质纤维素比例较高,分解周期缓慢,以及长期的纯林造林模式,杉木人工林生态系统普遍存在固氮菌、纤维素分解菌、氨化细菌等微生物类群退化和数量减少[10],导致林分凋落物的大量堆积。森林凋落物的分解主要是在土壤微生物酶解作用下完成[11],且纤维素酶、漆酶和过氧化物酶等多种酶均与凋落物质量损失率密切相关性[12]。纤维素酶是重要的水解酶(将纤维素水解为纤维二糖与葡萄糖),对凋落物的分解贡献较大[13];多酚氧化酶可以催化邻苯二酚氧化成邻苯二醌,是木质素的生物降解过程中的主要酶类,能够酶解凋落物中较难分解的酚类和木质素[14]。吴建波等[15]研究发现,氮的输入降低了多酚氧化酶活性;Saiya-Cork et al.[16]认为氮沉降使密歇根北部森林中凋落物的酚氧化酶活性增加了63%,阻碍了凋落物中木质素的分解。本课题组前期研究发现,不同林下植被管理,杉木林土壤理化性质和微生物群落结构均存在着较大差异,林下植被保存和林下植被去除相比,林下植被保存改善了土壤的理化性质,显著提升了多种土壤酶活性[17]。因此,本研究在林下植被保留和林下植被去除的杉木人工林下,以杉木凋落叶为研究材料,根据所预设的凋落叶的w(C)∶w(N)比,研究不同林分环境杉木凋落物分解动态及酶活性的变化规律。
1 试验地概况
研究区位于福建省南平市顺昌县洋口国有林场南山工区(117°92′~118°648E,26°87~27°13N),该地系武夷山脉南部,属低山丘陵区,海拔252~339 m,坡度26°~32°。土壤为山地红壤,土层深厚肥沃。年太阳辐射量4 057~45 891 MJ·m-2,日照时间1 668~1 972 h,无霜期254~305 d;平均气温为18.6 ℃,极端最高气温41.4 ℃,极端最低气温-5.8 ℃;年降水量1 600~1 900 mm,年蒸发量为1 308~1 587 mm,相对湿度为78%~82%,属于中亚热带季风湿润气候。
2 研究方法
2.1 试验材料
试验材料取自福建省洋口国有林场南山工区的杉木林(林分密度1 050株·hm-2,林龄18 a),在杉木林下,收集尚未分解的凋落叶,带回试验室自然风干后备用。经测定[17],杉木凋落叶初始全氮质量分数(w(N))为8.10 mg·g-1,全碳质量分数(w(C))为482.54 mg·g-1,全磷质量分数(w(P))为0.33 mg·g-1,w(C)∶w(N)为60.86,w(C)∶w(P)为1 393.19,w(N)∶w(P)为23.86。
2.2 样地设置
2018年10月在福建省洋口国有林场南元管护站的杉木人工林设置样地,样地杉木人工林造林时间为1984年,种苗来源为杉木第1代种子园的优良家系壮苗,初植密度为2 505株·hm-2,1997年进行间伐,间伐强度约为50%,保留株数为1 187株·hm-2。
根据海拔、坡度、坡向等立地条件基本一致的原则,选择林下植被保留(记为UP)和林下植被去除(记为UR)共2种林下植被管理方式的杉木人工林。2018年11月在2种林分内分别设置3个20 m×20 m样地,并在样地的4个角均打下水泥桩作标记。
林下植被保留:林分自1997年间伐后采取近自然状态管理,林分密度为958株·hm-2,平均树高22.83 m,平均胸径31.89 cm;土壤密度为1.21 g·cm-3,土壤含水率为25.43%,土壤有机质质量分数为32.72 g·kg-1,土壤全氮质量分数1.62 g·kg-1,土壤全磷质量分数0.48 g·kg-1,土壤全钾质量分数13.65 g·kg-1。林下灌木层主要为粗叶榕(Ficushirta)、杜茎山(Maesajaponica)和大叶紫珠(Callicarpakochiana)等;草本主要为薄盖短肠蕨(Allantodiahachijoensi)、金毛狗(Cibotiumbarometz)和观音莲座蕨(AngiopterisfokiensisHieron)等,草本层生物量6.70 t·hm-2,林下植被总盖度92%。
林下植被去除:林分自2012年7月起,每年进行1次林下植被清理,林下灌木清除采用割灌机,林下草本采用镰刀手工割除,林分密度为983株·hm-2,平均树高22.29 m,平均胸径27.19 cm;土壤密度为1.24 g·cm-3,土壤含水率为24.73%,土壤有机质质量分数为29.83 g·kg-1,土壤全氮质量分数1.58 g·kg-1,土壤全磷质量分数0.54 g·kg-1,土壤全钾质量分数11.48 g·kg-1。
2.3 落叶分解袋的预处理、放置和取样
根据相关文献[6,18],本研究设置4种不同初始w(C)∶w(N)的杉木凋落叶,w(C)∶w(N)比分别为60.9(CK)、40.6(N1)、30.5(N2)、20.3(N3)。
称取各样品的杉木凋落叶10 g,将其整齐、紧凑地平铺于牛皮纸上。根据前期预实验,以溶液形式将不同浓度的NaNO3溶液均匀喷施于叶面,待其风干后测定w(C)∶w(N),重复几次,直至各处理样品的杉木凋落叶w(C)∶w(N)达到实验要求。将各处理的杉木凋落叶样品分别装入网眼0.5 mm的尼龙分解袋中,于2018年12月分别放置于预设样地内。放置时去除地表凋落物层,贴上标签,用竹钉固定四角在地表,保证分解袋紧贴表层土壤,各处理间设置3 m的缓冲带,每块样地内每个处理放置35袋。
分解袋放置60、120、180、240、300 d后分别取样,每个样地每个处理取6袋,取样时戴一次性手套,每个分解袋均单独装入自封袋中,其中,3袋用于计算杉木凋落叶残留率和化学性质,3袋置于小型便携冰柜中带回试验室,用于凋落叶酶活性的测定。每次取样时,去除各分解袋上新鲜凋落物和林下植被,去除林分中新近生长的林下植被。
分解袋取回后,用刷子清除凋落叶所附着的沙土和植物根系等杂质。用于测定干质量剩余率的样品,分别称质量后装入信封,做好标记,于烘箱中80 ℃烘干至恒质量,称量各信封内凋落叶残留质量。用于测定酶活性样品,用经酒精消毒的剪刀,将凋落叶剪碎装入自封袋并编号,置于冰箱中-80 ℃保存,并尽快进行测定。
不同菌株的生长速度测定参考蔡守平等[11]的方法,以中心接种的方式将不同菌株接种于PPDA平板培养基中心,然后置于(25±1) ℃的恒温培养箱中培养,用十字交叉法每5 d测量1次菌株直径(以纵横直径的平均值作为菌落直径),15 d后待菌落产孢充分后以打孔器在菌落上取一定面积的菌落,使用0.03%的吐温-80溶液进行稀释,最后用血球计数板计数并换算成单位面积的产孢量。每个菌株设置3个重复,产孢量测定每个菌落取3个菌落块,共重复9次。
2.4 凋落叶酶活性测定
纤维素酶、脲酶、酸性磷酸酶、多酚氧化酶和过氧化物酶活性采用苏州科铭生物技术有限公司的试剂盒测定。以纤维素酶催化羧甲基纤维素钠降解生成的还原糖含量,在620 nm波长下的吸光度表征纤维素酶的活性高低;以脲酶水解尿素时所生成的氨态,在强碱介质中和苯酚钠及次氯酸钠反应所生成的蓝色靛酚,在578 nm波长下的吸光度表征脲酶的活性高低;以酸性磷酸酶催化对硝基苯磷酸二钠水解生成4-硝基苯酚,在405 nm波长下的吸光度增长率表征酸性磷酸酶的活性高低;以多酚氧化酶在有氧的条件下催化一元酚和二元酚氧化生成的醌,在525 nm波长下的吸光度表征多酚氧化酶的活性高低;以过氧化物酶催化H2O2氧化的特定底物,在470 nm波长下的吸光度增长率表征过氧化物酶的活性高低。
2.5 累积酶活性计算
累积酶活性计算公式为:S=(0.5y0+y1+…yn-1+0.5yn)/xn。式中:S为累积酶活性,y为酶活性,x为分解时间,n为取样次数。在表征酶活性的总累积酶活性时,先将各分解时间的酶活性数值进行0~1标准化,再进行加和,从而得到各处理的总累积酶活性[19]。
2.6 凋落叶质量损失率计算方法
总质量损失率的计算公式为:Dt=((W0-Wt)/W0)×100%。式中:Dt为凋落叶总质量损失率,W0为凋落叶分解初始干质量,Wt为分解t时间后剩余的凋落叶干质量。
干质量剩余率的计算公式为:y=1-Dt。式中:y为凋落叶干质量剩余率。
分解过程中各分解阶段质量损失率的计算公式为:Ds=((Wn-1-Wn)/Wn-1)×100%。式中:DS为本次分解期间凋落叶质量损失率,Wn-1为上次取样凋落叶干质量,Wn为本次取样凋落叶干质量,n为取样次数,n=1时,Wn-1为凋落叶分解初始干质量。
Olson指数衰减模型为:y=(Wt/W0)×100%=100e-kt。式中:k为凋落叶分解速率系数,t为分解时间。
凋落叶半衰期(50%分解)的计算公式:T0.5=ln0.5/(-k)。
2.7 数据处理
应用Microsoft Excel 2010和SPSS 19.0软件进行数据整理和分析;采用LSD和Duncan多重比较法检验其显著性;采用双因素方差分析比较林分类型和不同处理及其交互作用对酶活性和凋落叶干质量剩余率的影响;采用相关性分析和回归分析,分析分解期间凋落叶质量损失率与酶活性的相关性和线性方程。
3 结果与分析
3.1 杉木凋落叶分解的干质量剩余率变化动态
由表1、表2可知,无论是UP还是UR林分中,杉木凋落叶分解试验前期(0~120 d)和后期(241~300 d)的分解较慢,中期(121~240 d)分解较快。林分类型对干质量剩余率不具有显著影响,但林分类型与氮添加处理之间具有极显著的交互作用。
由表3可知,林下植被保留林分中,与CK处理相比,N1、N2处理的杉木凋落叶分解半衰期分别减少了1、4 d,N3处理的杉木凋落叶分解半衰期增加了111 d;N1、N2处理的杉木凋落叶分解周转期分别减少了2、64 d,N3处理的杉木凋落叶分解周转期增加了482 d。

表1 杉木凋落叶干质量剩余率动态变化

表2 林分类型和氮添加处理对干质量剩余率的交互作用(F值)

表3 杉木凋落叶干质量剩余率的Olson指数衰减模型
林下植被去除林分中,与CK处理相比,N1、N2处理的杉木凋落叶分解半衰期分别减少了24、16 d,N3处理的杉木凋落叶分解半衰期增加了51 d;N1、N2处理的杉木凋落叶分解周转期分别减少了104、68 d,N3处理的杉木凋落叶分解周转期增加了221 d。
林下植被去除林分中,除N3处理外,其余处理的杉木凋落叶半衰期和周转期均高于林下植被保留,因此林下植被保留林分更有利于凋落物分解。但N1和N2处理在林下植被保留林分中,与对照相比对杉木凋落叶分解的促进作用较低,N3处理对杉木凋落叶具有较强的抑制作用。
3.2 杉木凋落叶分解过程的酶活性
由表4、表5可知,各处理下的杉木凋落叶纤维素酶活性在60~180 d分解期间快速上升,随后保持高水平波动;酸性磷酸酶、过氧化物酶和多酚氧化酶活性总体随分解时间延长呈上升趋势。其中,过氧化物酶和多酚氧化酶活性在240~300 d分解期间有所下降;脲酶活性变化较为复杂,并未表现出较为一致的时间规律。

表4 林下植被保存(UP)各处理杉木凋落叶分解过程酶活性变化动态

表5 林下植被去除(UR)各处理杉木凋落叶分解过程酶活性变化动态
UP和UR林分中,氮添加处理均提升了杉木凋落叶分解过程中纤维素酶活性,降低了酸性磷酸酶、过氧化物酶和多酚氧化酶活性。氮添加处理对于脲酶活性在不同林分中具有不同效应,在UP林分中,分解60 d时,氮添加处理降低了杉木凋落叶分解过程中脲酶活性;而UR林分中,N1和N2处理对于脲酶活性则具有提升作用。
由表6可知,林分类型和氮添加处理均极显著的影响纤维素酶、脲酶、过氧化物酶和多酚氧化酶活性,酸性磷酸酶活性则不受林分类型的显著影响,但仅有纤维素酶和酸性磷酸酶活性受二者极显著的交互作用影响。

表6 林分类型和氮添加处理对酶活性的交互作用(F值)
由表7可知,林下植被保留林分林分中,随着施氮量的增加,杉木凋落叶分解过程总累积酶活性均呈下降趋势,N1、N2和N3处理与CK相比分别降低了6.04%、22.44%和47.03%,CK处理与N2和N3处理总累积酶活性差异达到显著水平(P<0.05)。林下植被去除林分中,N1处理的杉木凋落叶总累积酶活性最高,与CK相比提高了3.45%,N2和N3处理与CK相比分别降低了10.86%和41.68%。可见在林下植被去除林分中,N1处理对于杉木凋落叶分解过程总累积酶活性具有一定的提升作用。
表8表明,各处理的凋落叶分解过程累积酶活性林下植被保留林分均高于林下植被去除林分,可见林下植被保留林分有利于提高凋落叶酶活性。

表7 各处理杉木凋落叶累积酶活性
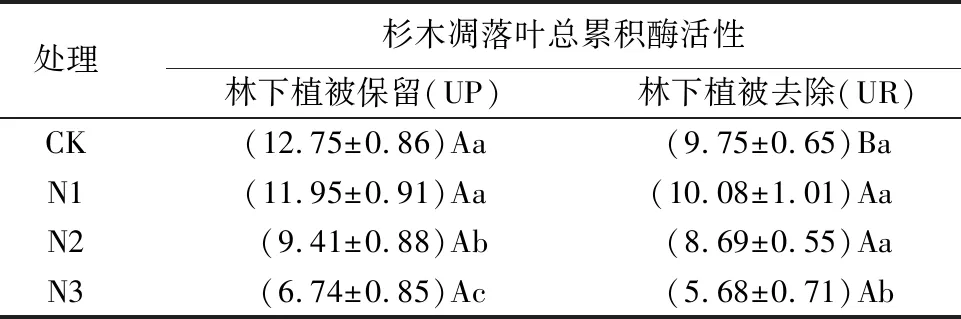
表8 不同林分管理方式杉木凋落叶总累积酶活性
3.3 杉木凋落叶分解速率与酶活性的相关性与数学模型拟合
由表9可知,UP和UR林分中,杉木凋落叶分解过程中质量损失率与纤维素酶、脲酶、过氧化物酶和多酚氧化酶均呈极显著正相关;在UP林分中,酸性磷酸活性与质量损失率为显著正相关。UP和UR林分中,纤维素酶、过氧化物酶和多酚氧化酶与质量损失率呈极显著的一元线性函数关系,说明纤维素酶、过氧化物酶和多酚氧化活性的提高有利于杉木凋落叶的分解,其中以纤维素酶活性与失重率方程拟合效果最好;脲酶和酸性磷酸酶活性与质量损失率方程拟合效果相对较差。但在UR林分中,酸性磷酸酶与质量损失率拟合方程未达到显著水平,表明酸性磷酸酶在杉木凋落叶分解过程中不具有显著的促进作用。

表9 杉木凋落叶各分解期间质量损失率与酶活性的相关性与回归拟合
4 讨论
4.1 氮添加对杉木凋落叶分解和酶活性的影响
本研究试验中期杉木凋落叶的分解较快,前期和后期分解较慢,这是因为试验开始于12月份,分解中期为夏季,水热条件能较好,微生物活性的增强更有利于凋落叶的分解。本研究结果表明氮添加提升了杉木凋落叶分解过程中的纤维素酶活性。固氮菌与纤维素分解菌存在着互生关系,纤维素分解菌为固氮菌提供丰富的碳源,固氮菌为纤维素分解菌提供氮元素,纤维素酶活性的提升易受氮元素的限制[20-22],因此,氮添加有利于纤维素酶活性的提升。氮添加对于杉木凋落叶分解过程中过氧化物酶和多酚氧化酶活性则具有明显抑制作用。主导木质素分解的酶主要有多酚氧化酶和过氧化物酶[23],当外源氮的输入量过高时,会对分泌木质素酶的白腐真菌的生长产生抑制作用,从而降低了过氧化物酶和多酚氧化酶的活性[24-25]。在两种林分中,纤维素酶、多酚氧化酶和过氧化物酶活性与杉木凋落叶失重率均呈极显著的一元线性函数关系,证实了纤维素酶、多酚氧化酶和过氧化物酶活性与杉木凋落叶的分解密切相关。其中以纤维素酶活性与杉木凋落叶失重率方程拟合效果最佳,与杉木凋落叶分解周期长,而本试验分解期间尚短,杉木凋落叶中纤维素含量仍处于较高水平,其分解速率受纤维素酶活性的影响较大有关。随着分解时间的增加,纤维素等多糖类物质被大量分解,木质素、酚类等难分解物质含量不断累积,与该类有机物分解有关的酶活性在分解过程中逐渐提高[26],主导木质素分解的多酚氧化酶和过氧化物酶的活性对杉木凋落叶分解的支配作用进一步提升。此外,结合杉木分解速率,当氮添加对木质素酶活性的抑制作用大于纤维素酶活性所受到的促进作用时,随着分解时间的延长,杉木凋落叶分解速率明显变缓,说明了N1和N2处理对于杉木凋落叶分解具有促进作用较,而N3处理则具有抑制作用的重要原因。
在杉木凋落叶分解过程中,N1处理对脲酶活性具有一定的促进作用,这与其他研究结果相同[27],而氮添加抑制杉木凋落物分解过程中酸性磷酸酶活性的特征,则是氮添加致使凋落叶微环境趋于酸化,磷元素流失,从而引起酸性磷酸酶活性降低[28]。脲酶和酸性磷酸酶活虽不是凋落物分解的主要酶类,但结合相关性分析和线性回归分析,两者与杉木凋落叶质量损失率同样具一定相关关系。由于杉木凋落物底物质量较差,根据Moorhead et al.[29]的分解集团理论,分解木质纤维素的专性分解者在外源养分的输入下具有更高的活性,而脲酶和酸性磷酸酶的分泌有利于凋落叶和周围环境中氮磷养分的矿化,在其分解过程中与其他酶类存在一定的协同作用。
4.2 林下植被管理对杉木凋落叶分解和酶活性的影响
在UP林分中,氮添加对杉木凋落叶分解过程中总累积酶活性具有抑制作用,N1和N2处理对杉木凋落叶分解的促进作用微弱,N3处理下的杉木凋落叶半衰期和周转期明显高于林UR林分,这与两种林分中土壤养分含量差异有关。与UR林分相比,UP林分中土壤的有机质、全氮和全磷质量分数较高,氮添加并未起到促进UP林分中凋落物分解的作用,反而促进凋落物微环境的酸化,不利于微生物的分解活动。对于UR林分,氮的添加则能快速为微生物的分解活动提供氮源,从而加速UR林分中凋落物的分解。在UP林分中,杉木凋落叶分解过程中的各类酶活性普遍高于UR,这与大量研究结果一致[30-31]。除N3处理外,UP林分中杉木凋落叶干质量剩余率普遍低于UR林分中的相同处理。相比于UR,UP林分的土壤中,参与碳氮循环的微生物种群相对丰度较高[17],这进一步佐证了通过对林下植被进行保留,使得群落结构单一的杉木人工林生态系统趋于复杂,为分解者提供了更为适宜的环境[32-33],有利于杉木人工林生态系统的物质循环和能量流动。
5 结论
本研究表明N1和N2处理下的氮添加有利于杉木凋落叶的分解,对杉木凋落叶分解过程中纤维素酶、脲酶活性具有一定的促进作用,对酸性磷酸酶、过氧化物酶和多酚氧化酶活性具有抑制作用。相比于林下植被去除,林下植被保留更有利于凋落叶分解和各类酶的活性累积量增加,但氮添加输入量过高对凋落叶分解和各类酶活性易产生抑制作用。此外,分解过程中酶活性的变化可用于解释杉木凋落叶的分解速率,纤维素酶、多酚氧化酶、过氧化物酶和酸性磷酸酶活性的增高有利于杉木凋落叶的分解。
