非生物胁迫诱导拟南芥中防御基因表达的分子机制1)
2023-05-23金太成闵菲李一荻丁晓月韩晗石淼杨丽萍
金太成 闵菲 李一荻 丁晓月 韩晗 石淼 杨丽萍
(吉林师范大学,四平,136000)
DNA甲基化是真核生物基因组中最常见的一种DNA共价修饰形式,对植物生长发育具有重要的调控作用。近年来研究表明,植物中小干扰RNA(siRNA)介导的DNA甲基化(RdDM)在调节基因表达、调控转座子的活性和防御病毒等外源DNA过程中发挥重要作用[1-2]。这类siRNA生物合成需要依赖于DNA的RNA聚合酶Ⅳ(Pol Ⅳ),依赖于RNA的RNA聚合酶2(RDR2)和DCL3蛋白共同完成[3]。合成的24nt siRNA与AGO4蛋白结合,并招募甲基化转移酶DDM1/2、MET1和CMT3等对靶标DNA进行从头甲基化和甲基化的维持[4]。
DNA去甲基化包括主动去甲基化和被动去甲基化[5]。DNA甲基转移酶缺失导致DNA甲基化降低,是一种被动DNA去甲基化过程[6]。主动DNA去甲基化过程依赖DNA去甲基化酶的催化作用[7]。拟南芥(Arabidopsisthaliana)有4个双功能的5-甲基胞嘧啶(5-mC)DNA糖基化酶,包括沉默抑制因子1(ROS1)、DME、DML2和DML3,均属于DNA去甲基化酶。其中ROS1,DML2和DML3在植物各个组织中均有表达,在主动DNA去甲基化过程中起作用。已有研究表明,ROS1能够负调控RdDM途径[7-8]。ROS1介导的DNA去甲基化有利于维持基因组DNA甲基化模式[9]。
水杨酸(SA)是植物防御反应的一个重要的信号分子,能诱导防御基因的表达并获得系统抗性[10]。SA的上游调控因子至少有3类,促细胞死亡因子(ACD6)属于第2类SA上游调控因子。ACD6基因的功能获得突变体(acd6-1)能够导致基因ACD6-1、EDS1、PAD4和NPR1表达的提高,并能诱导SA积累水平的升高[11-17]。植物中SA途径能够被DNA病毒和RNA病毒激活[1]。甜菜严重曲顶病毒(Beetseverecurlytopvirus,BSCTV)编码的C2蛋白通过抑制S-腺苷甲硫氨酸脱羧酶1(SAMDC1)的降解,影响植物内源基因的DNA甲基化[18]。进一步研究揭示C2影响了21/24nt的siRNA的积累,在植物SA途径上游调控基因AtACD6启动子区域DNA去甲基化过程中起作用,并转录激活SA途径防御基因的表达[19]。
我们之前的研究表明烟草脉带花叶病毒(tobaccoveinbandingmosaicvirus,TVBMV)编码的基因沉默抑制子HC-Pro,在拟南芥植物SA途径上游调控基因AtACD6启动子DNA去甲基化过程中起作用,并诱导SA途径下游防御基因的表达[20],阐明病毒激活SA途径基因表达的分子机制。为了研究调控基因AtACD6是否能够应答非生物胁迫,我们对干旱、低温和盐胁迫处理的拟南芥Col-0植物中AtACD6表达水平进行了检测分析。研究结果证实,非生物胁迫能够诱导AtACD6基因启动子DNA去甲基化,而转录激活调控基因AtACD6及下游防御基因AtPR5的表达。进一步研究揭示,ROS1在AtACD6基因启动子DNA去甲基化过程中起重要作用,阐明植物SA途径防御基因应答非生物胁迫的表观调控机制。
1 材料和方法
非生物胁迫处理拟南芥:本试验以拟南芥(Arabidopsisthaliana)生态型Col-0为材料,用84消毒液和无水乙醇消毒后,无菌水清洗2~3次,种子播种于MS培养基。幼苗生长约15 d后,转移到温度为24 ℃,16 h光照、8 h黑暗循环的环境中,继续培养15 d。将拟南芥植物移栽到无菌的土壤中,置于温室中进行培养,分别选取20株拟南芥生态型Col-0进行低温胁迫(4 ℃,24 h)、盐胁迫(150 mmol/L NaCl,72 h)和干旱胁迫(缺水处理7 d),同时选取未处理的植物为对照组。
此外,以拟南芥生态型Col-0、DNA去甲基化酶ROS1突变体ros1、DNA去甲基化酶三突ros1dml2dml3(rdd)为材料,进行低温胁迫(4 ℃,24 h)处理。
相关基因表达的检测分析:分别取等量的低温胁迫、盐胁迫、干旱胁迫和对照组的野生型拟南芥Col-0,使用Trizol试剂分离拟南芥的总RNA,然后利用逆转录试剂盒(Takara)进行反转录获得cDNA,再利用cDNA作为模板进行实时荧光定量多聚核苷酸链式反应(RT-qPCR)检测,具体方法参照Yang et al.[21]的方法,分别检测了防御基因AtACD6和AtPR5的表达水平。
此外,以RdDM途径DNA甲基化转移酶突变体met1和cmt3为材料,进行RT-qPCR检测防御基因AtACD6和AtPR5的表达水平。
亚硫酸盐测序技术:利用十六烷基三甲基溴化铵(CTAB)法提取非生物胁迫处理的拟南芥植物和未处理植物的总DNA,使用DNA纯化试剂盒进行纯化。使用亚硫酸氢盐转化试剂盒对纯化后的DNA进行亚硫酸盐处理。处理后的DNA作为模板,进行AtACD6基因启动子重复序列PCR扩增。回收产物连接PMD18-T载体后,转化感受态细胞DH5α,利用菌落PCR筛选阳性克隆进行测序分析。此外,以拟南芥生态型Col-0、DNA去甲基化酶ROS1突变体ros1、DNA去甲基化酶三突ros1dml2dml3(rdd)为材料,低温胁迫(4 ℃,24 h)处理后提取基因组DNA,并进行亚硫酸盐测序。
简并引物设计:F(AtACD6),5′-AAGTTTATTGATGAAAGGAG-3′;R(AtACD6),5′-CTTACTT(G/A)TCTT CATCAA-3′。AtACD6启动子区域1 000 bp之内高甲基化序列(325 bp):TCTCTCTGAGAAGCGGTATCTTGGTAGCTTTAACTGATAGCTCAACTCACT-CAATCCGTAGTCATCGAACACCGACTTCACAAGCT-TGTCGTGCGTTATTTCCGTATCTATTTGCACAACTC-TACACCATTTATCGACGGTGTTAAATACAAATTCTT-TACCCAATCGTATCGAGAGAAGGATGAAAGAAGA-ATGAGGAAGACGGTGATGAATTGGAAATTCCGAT-GATGTGAAAAACTCATGTGAAGAAGACGAGTTGA-AAAAAAAAACGTTTCGTATTTCCTTTGATGATGAT-GACATGGACTGTTGCATCCGACATCATTTTT。
数据处理:利用国外网站(www.cymate.ogr.cymate.html)分析基因启动子区域DNA序列甲基化水平,利用OriginPro8(http://www.originlab.com)完成测序结果的数据处理。
2 结果与分析
2.1 干旱处理后的拟南芥生态型Col-0植物表型变化
分别选取20株拟南芥生态型Col-0进行干旱、低温和盐胁迫处理。其中,低温处理24 h和盐胁迫处理1~3 d的植物没有明显的表型变化。拟南芥小苗进行干旱(缺水)处理7 d,连续观察植物的表型变化。与对照组拟南芥Col-0(图1A)相比,干旱处理3 d,植物叶片出现轻微黄化和皱缩现象(图1B、C);干旱处理5 d,叶片有少量花青素积累,少量叶片呈现黄化现象(图1D、E);干旱处理7 d时,叶片中花青素积累显著增加,大量叶片表现黄化枯萎(图1F)。
2.2 非生物胁迫激活防御基因的表达
为了揭示非生物胁迫是否能够影响SA途径防御基因AtACD6和AtPR5的表达,我们分别提取低温胁迫、盐胁迫和干旱胁迫处理的拟南芥生态型Col-0和对照处理Col-0的总RNA,并进行基因表达的比较分析。实时荧光定量PCR结果表明,与对照组拟南芥Col-0中相关基因表达量相比,在这3种非生物胁迫处理的拟南芥Col-0中,SA途径防御基因AtACD6和AtPR5表达量显著增加(表1)。结果证实,3种非生物胁迫能够诱导SA途径防御基因的表达。
A为对照组的拟南芥Col-0植物;B、C为干旱处理3 d的拟南芥Col-0;D、E为干旱处理5 d的拟南芥Col-0;F为干旱处理7 d的拟南芥Col-0。

图1 干旱胁迫处理的拟南芥Col-0植物表型
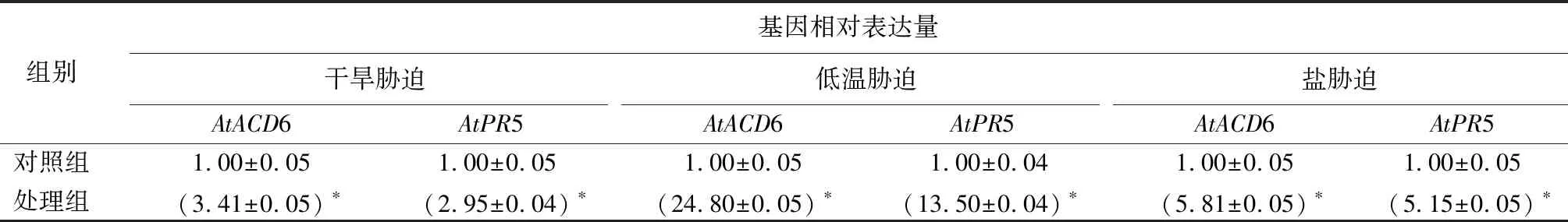
表1 非生物胁迫激活拟南芥Col-0中防御基因的表达量
植物对逆境胁迫的适应过程中,并不是单一激素发挥作用,而是多种激素互相作用的结果。已有大量研究表明,脱落酸(ABA)途径在植物应答干旱、寒冷等逆境胁迫过程中起重要作用[22-23]。近年来,人们越来越关注植物水杨酸信号途径在抗病防御过程中的重要作用[10]。2013年,我们通过研究揭示了SA信号途径防御基因被BSCTV病毒激活的分子机制,研究结果表明,BSCTV病毒编码C2蛋白,在植物SA途径上游调控基因AtACD6启动子区域DNA去甲基化过程中起作用,并转录激活SA途径相关防御基因的表达[19]。而我们对SA信号途径防御基因在植物应答非生物胁迫过程中的作用还知之甚少。本研究结果证实,非生物胁迫包括干旱(缺水处理)、低温和盐胁迫,能够诱导拟南芥生态型Col-0植物中SA途径AtACD6启动子区域DNA去甲基化,而转录激活SA途径上游调控基因AtACD6的表达。AtACD6是SA途径上游调控基因[15-17],因此,AtACD6表达的激活能够进一步促进下游防御基因AtPR5的表达。
2.3 非生物胁迫诱导AtACD6基因启动子DNA去甲基化
非生物胁迫(干旱、低温、盐胁迫)处理后,对拟南芥Col-0中AtACD6基因启动子区域的3种位点(包括CG位点、CNG位点和CHH位点)的甲基化进行测序和分析(图2)。干旱处理后,甲基化水平有不同程度的下降,其中CG位点由78.30%下降至62.03%,CNG位点由21.67%下降至8.11%,CHH位点则由13.51%下降至5.80%;低温处理后,拟南芥Col-0中AtACD6基因启动子区重复序列总体甲基化水平下降13.46%,3个甲基化位点的DNA甲基化水平有不同程度的下降,其中CG位点由78.30%下降至57.77%,CNG位点由21.67%下降至7.56%,CHH位点则由13.51%下降至5.36%;与对照(Col-0)相比,盐胁迫处理后拟南芥Col-0中AtACD6基因启动子区重复序列总体甲基化水平下降11.23%,其中CG位点由78.30%下降至67.46%,CNG位点由21.67%下降至8.26%,CHH位点则由13.51%下降至6.85%(表2)。
A为拟南芥生态型Col-0植物中AtACD6启动子区域甲基化水平作为对照;B为低温处理后Col-0植物中AtACD6启动子区域甲基化水平;C为缺水处理后AtACD6启动子区域甲基化水平;D为盐胁迫处理后AtACD6启动子区域甲基化水平。

图2 AtACD6启动子区域(320 bp)3种位点DNA甲基化分析结果
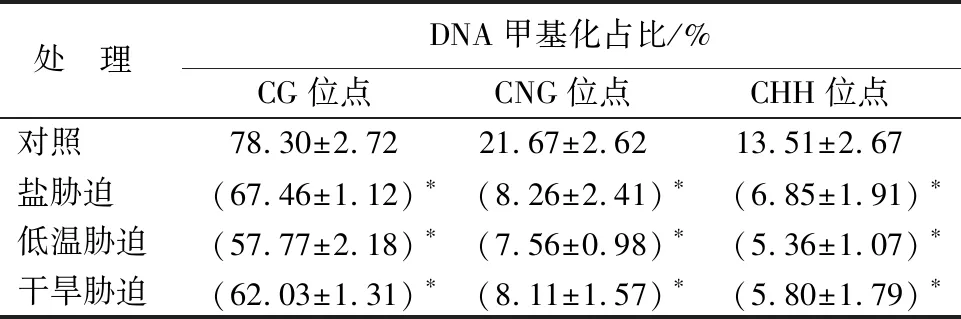
表2 不同处理的拟南芥Col-0中AtACD6启动子区域DNA甲基化情况
利用RT-qPCR进一步检测DNA甲基化途径(RdDM)突变体中相关基因的表达水平,检测结果证实,RdDM途径中,关键作用元件突变体ago4、DNA甲基化转移酶突变体met1和cmt3中,AtACD6基因表达显著增加。以拟南芥Col-0中相关基因表达量作为对照(表3),结果表明,AtACD6是RdDM途径的靶基因,而且RdDM途径中主要功能蛋白AGO4、DNA甲基化转移酶MET1和CMT3在维持拟南芥Col-0AtACD6基因低转录过程中起重要作用。
植物中siRNA介导的DNA甲基化(RdDM)在调节基因表达等过程中发挥重要作用[1-2]。本研究表明,RdDM途径DNA甲基化转移酶突变体met1和cmt3中,AtACD6基因表达显著增加(p<0.05),证实这些基因是RdDM途径的靶基因,而且RdDM途径在维持AtACD6基因的低转录过程中起作用。植物中DNA去甲基化酶ROS1参与调控主动DNA去甲基化,并能够负调控RdDM途径[24]。

表3 RdDM途径突变体ago4、met1和cmt3中AtACD6的表达水平
2.4 非生物胁迫条件下ROS1介导AtACD6基因启动子区域的DNA去甲基化
已有研究表明,ROS1在RdDM靶向区域的DNA去甲基化作用在调控基因表达过程中具有重要意义[25]。为了调查研究ROS1是否参与调控AtACD6基因的表达,我们比较分析了低温处理的拟南芥Col-0、DNA去甲基化酶缺失突变体ros1和DNA去甲基化酶ROS1、DML2和DML3的三突植物ros1dml2dml3(rdd)中AtACD6基因表达水平。与对照组的Col-0植物中基因表达量相比,低温处理后,AtACD6表达水平显著提高(p<0.05),然而,低温处理的DNA去甲基化酶缺失突变体ros1和rdd植物中,AtACD6表达量的增加被严重抑制(表4)。这些结果表明,非生物胁迫条件下,DNA去甲基化酶ROS1、DML2和DML3在调控AtACD6基因转录激活过程中起重要作用。
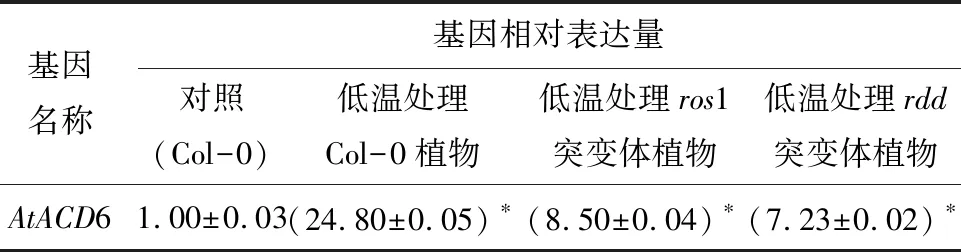
表4 低温处理的不同植物中AtACD6基因表达情况
为了进一步研究DNA去甲基化酶ROS1是否在AtACD6基因启动子区域的DNA去甲基化过程中起作用,我们比较分析了低温处理的DNA去甲基化酶缺失突变体ros1和未处理的Col-0植物中AtACD6基因启动子区域的DNA甲基化水平。测序结果及数据(表5)分析证实了,低温处理拟南芥Col-0植物中AtACD6基因启动子DNA甲基化水平显著降低(p<0.05),包括CG、CNG和CHH位点;而低温处理的突变体ros1植物中,AtACD6基因启动子DNA甲基化水平的降低被部分抑制,表明ROS1介导了的AtACD6基因启动子区域的DNA甲基化的降低,并参与调控防御基因AtACD6的表达,进而适应低温胁迫。通过比较分析低温处理的野生型Col-0植物和突变体ros1植物中AtACD6基因表达水平,发现突变体ros1中该基因表达的增加被显著抑制,表明ROS1参与调控非生物胁迫条件下防御基因AtACD6的转录激活。
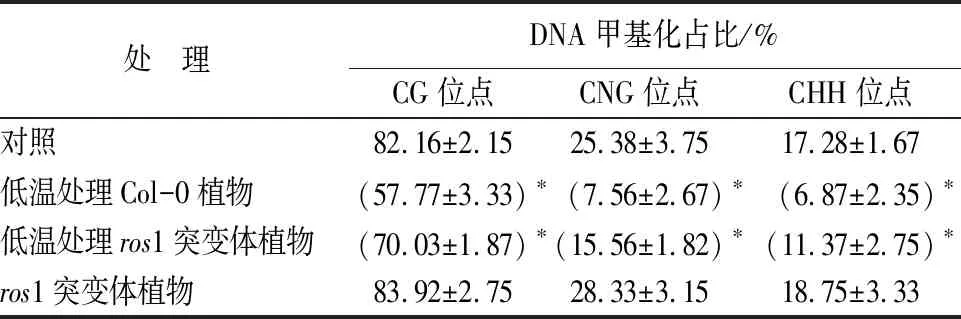
表5 低温处理的不同植物中AtACD6启动子区域DNA甲基化情况
生物胁迫和非生物胁迫影响着植物DNA甲基化的变化,DNA甲基化的水平和模式的改变调控着逆境应答基因的表达,进而提高植物对胁迫的抗性[26]。已有研究表明,ROS1介导的DNA去甲基化能够作用于3种甲基化位点,包括CG、CNG和CHH位点[27]。我们进一步通过测序结果证实,低温胁迫条件下,突变体ros1植物中AtACD6基因启动子区域的DNA甲基化的降低(包括CG、CNG和CHH位点)被明显抑制。这些结果证实,ROS1介导的DNA去甲基化参与调控低温胁迫条件下AtACD6基因的转录激活。非生物胁迫条件下SA途径防御基因表达水平的显著增加,暗示了这些防御基因在增强植物适应非生物胁迫过程中发挥重要作用。
本研究揭示,非生物胁迫诱导植物SA途径调控基因AtACD6及下游防御基因AtPR5表达的分子机制,证实ROS1介导的主动DNA去甲基化在低温诱导AtACD6基因表达的过程中起作用,进而适应低温胁迫。由于表观遗传调控机制的复杂性,植物通过表观遗传调控应答非生物胁迫的分子机制尚需要深入研究。
3 结论
各种非生物胁迫包括干旱(缺水处理7 d)、低温(4 ℃,24 h)和盐胁迫(150 mmol/L NaCl,72 h),能够诱导AtACD6基因启动子DNA去甲基化,进而转录激活拟南芥(Arabidopsisthaliana)植物中水杨酸防御途径上游调控基因AtACD6表达,调控基因AtACD6表达的增加进一步上调了下游防御基因AtPR5的表达。进一步研究揭示,拟南芥植物中ROS1介导的主动DNA去甲基化在低温诱导AtACD6基因表达的过程中起重要作用,进而适应低温胁迫,阐明了拟南芥中水杨酸防御途径调控基因AtACD6和防御基因AtPR5应答非生物胁迫的分子机制。
