吲哚-3-乙酸对不同遮光条件下红丁香幼苗生长及光合的影响1)
2023-05-23金梦然刘雅兰赵丹袁航刘煜光史宝胜
金梦然 刘雅兰 赵丹 袁航 刘煜光 史宝胜
(河北农业大学,保定,071000)
红丁香是河北省特色的优良野生花灌木,花期在紫丁香、白丁香之后,暴马丁香之前,能够弥补丁香花期上的空缺。身为丁香属中的狭域种[1],虽然有研究表明红丁香抗性强健,对寒冷[2]、干旱[3]、盐碱[4]等耐受等级均较高,但是对不同光照环境的适应性却报道较少。经观测发现,在华北地区,夏季露地种植的红丁香幼苗生长缓慢、叶片卷曲焦边,日灼现象明显。因此,探究适宜的生长环境对在华北地区和其他高温、高光照地区引种红丁香具有重要意义。
光对植物的生长和发育至关重要,不仅因为它为光合作用提供能量,同时还为植物提供了所处环境的信息[5]。环境中的光信号可以驱动植物进入下一个发育阶段,如发芽和开花等;而植物自身在面对不断变化的、甚至有时是不利的环境时会不断改善自身发育状态以适应环境[6]。相关研究表明,光环境的改变对植株生长发育状态有深远影响[7-8]。而植物这种响应光环境变化从而引起生长和发育的可塑性很大程度上是通过光调节生长素信号系统实现的[9]。
生长素是植物生长发育的核心调节因子,在器官发育、组织模式和趋向性反应中发挥重要作用[10]。吲哚-3-乙酸(IAA),作为一种天然生长素,常被用来促进植株生长。同时,相关研究表明,外源IAA对逆境胁迫(如弱光、高温、盐碱等)起到缓解作用[11-13]。光和生长素之间的联系能够引发植物的局部反应、信号传导以及地上部和根系之间的协调生长等[14]。因此,光信号和生长素在植物生长发育中缺一不可,探究它们之间的相互作用对调控植物生长发育具有重要意义。
1 材料与方法
1.1 试验材料
试验材料为1年生红丁香幼苗,于2019年4月盆栽于25 cm×18 cm的花盆中,栽培基质为V(珍珠岩)∶V(蛭石)∶V(园土)=1∶1∶2的混合基质。培养环境为河北农业大学风景园林示范基地苗圃,年平均气温12.7 ℃,年日照时间2 560 h,年均降水量575.4 mm,年平均蒸发量1 760 mm,无霜期200 d。
1.2 试验方法
自2019年7月8日—8月28日对试验材料进行处理,为期50 d。试验材料分为3大组,分别为对照组(CK全光照)、遮光处理组(LS为25%轻度遮光;MS为50%中度遮光;SS为75%重度遮光)和遮光+IAA喷施处理组(LS+IAA;MS+IAA;SS+IAA,简称外施IAA组),每个小组18株幼苗,7个小组共计126株。处理组花盆上方2 m处搭上遮光率分别为25%、50%及75%的遮阴网,喷施质量浓度为100 mg·L-1的IAA,全株喷施至溶液滴落,每隔2 d喷施1次,连续喷施10次;对照组喷施等体积的清水。每10 d收集相同位置的叶子(从上往下数第5或第6片成熟的叶子),用于叶绿素、可溶性糖和内源激素的测定,每个样本一式3份。
1.3 指标测定
形态指标的测定。(1)株高:用卷尺测量幼苗出土位置至主茎的顶端,每处理重复3次,下同。(2)地径:用游标卡尺测量植株出土位置上方5cm处的茎粗。(3)平均节间长:每处理组统计3株植株的节间数,同一植株的株高/节间数得出平均节间长度,再求取平均值。(4)叶面积:参考欧宇丹等[15]画纸称质量的方法。(5)叶片数量:对各个处理组的3株植物的全株叶片进行人工计数并求取平均值。(6)根冠比:每个处理随机选取3株幼苗,将全株从花盆里移出,分为地上部和地下部,清除地下部携带的土壤。于85 ℃烘干至恒质量,称量地上部和地下部的干质量,根冠比为地下部干质量/地上部干质量。
生理指标的测定。叶绿素的测定采用体积分数90%乙醇浸提法[16];可溶性糖采用蒽酮比色法[17]测定;植物激素(GA3、IAA、ABA)的测定参考邓文红等[18]方法测定。
光合指标的测定。采用美国生产的CIRAS-3便携式光合测定仪进行光合参数的测定,每10 d进行一次。测定时间为晴天上午的08:00—10:00,测定叶片为上数第4~5片功能叶。测定指标:净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)、胞间CO2摩尔分数(Ci)。每处理5次重复。
1.4 数据处理
通过SPSS 17.0软件对所有数据进行方差分析,利用Duncan’s法进行显著性分析(P<0.05)。
2 结果与分析
2.1 外源IAA对不同遮光度下红丁香幼苗形态的影响
处理50 d后各组红丁香整株形态与叶片大小如图1所示,株高、地径、平均节间长、叶面积、叶片数量的测量结果如表1所示。结果显示,遮光对红丁香幼苗生长有促进作用,随遮光度的增加,株高显著增加,分别较CK增加了8.0%、19.9%、9.8%;外源IAA对不同遮光度下红丁香幼苗的株高同样有促进作用,但在SS下不显著。同样的,遮光和喷施IAA对地径、平均节间长、叶面积和叶片数量均有显著的促进作用。整体来看,遮光组的促进效果由大到小表现为MS、SS、LS、CK;外施IAA组的促进效果由大到小表现为MS+IAA、SS+IAA、LS+IAA,外施IAA组的促进效果均强于遮光组。

CK.对照;LS.25%轻度遮光;MS.50%中度遮光;SS.75%重度遮光;LS+IAA、MS+IAA、SS+IAA分别表示不同遮光条件下外施吲哚-3-乙酸(IAA)。
另外,外源IAA还促进了不同遮光度下红丁香幼苗生物量的积累(表2)。遮光和喷施IAA处理对根系干质量和地上部干质量均有影响。随遮光度的增加,根系干质量、地上部干质量呈现先升高后降低的趋势,且均高于CK;根冠比则随遮光度的增加呈下降趋势,且均显著小于CK;其中,LS+IAA、MS、MS+IAA的根系干质量显著高于CK,分别是CK的2.15、2.25、3.94倍;地上部干质量与根系干质量的变化规律一致。
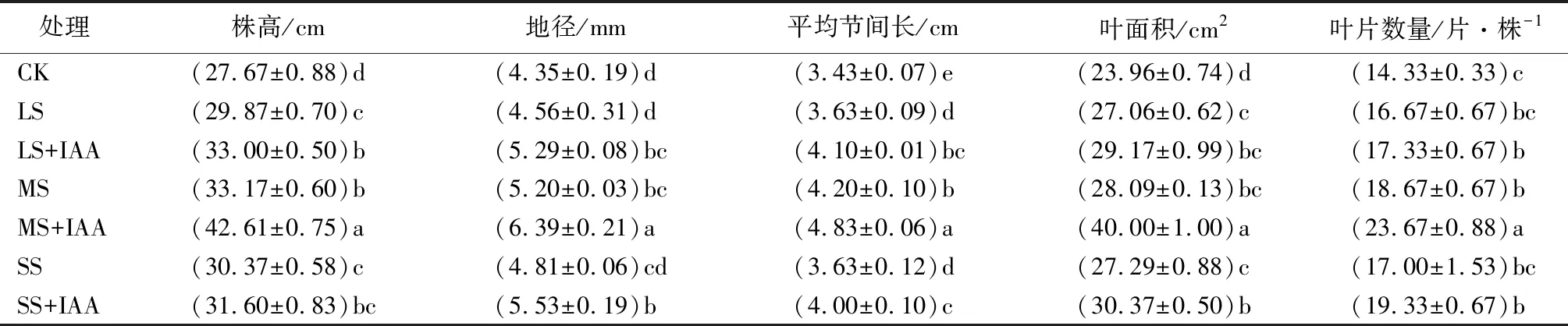
表1 不同遮光度下外施吲哚-3-乙酸(IAA)时红丁香幼苗生长的情况

表2 不同处理时根系和根冠比
2.2 外源IAA对不同遮光度下红丁香幼苗生理特性的影响
2.2.1外源IAA对不同遮光度下红丁香叶绿素质量分数的影响
各处理组叶绿素质量分数随时间进程表现为先升高后降低的趋势,遮光及喷施 IAA 处理后不同阶段的叶绿素质量分数均高于CK,在处理的第20天,各处理组均达到了最大值。此时,CK较第10天上升了19.20%,其他处理组依次比CK升高了18.64%、19.49%、50.00%、61.84%、90.68%、42.37%;遮光处理显著增加了叶绿素质量分数,随遮光度增加,叶绿素质量分数由大到小表现为SS、MS、LS、CK;在LS和MS处理下,喷施IAA对叶绿素质量分数影响并不显著,但在SS处理下,喷施IAA却使叶绿素质量分数显著降低(表3)。
2.2.2外源IAA对不同遮光度下红丁香可溶性糖质量分数的影响
7个处理组可溶性糖质量分数随生长进程均呈现为先升高后降低的趋势,且均在处理至30 d时达到最大值,此时,除LS外,各处理组均与CK差异显著,可溶性糖质量分数最高的处理组为MS+IAA,相比CK升高了25.74%,其次依次为SS+IAA、SS、MS、LS+IAA、LS、CK;同一遮光度下,MS+IAA处理至30 d时与MS出现显著差异,比MS升高了10.01%,处理至40和50 d时,差异增大,分别比MS升高了12.39%和13.66%;LS、SS处理下喷施IAA对红丁香幼苗可溶性糖质量分数的影响并不显著(表3)。

表3 不同处理时红丁香幼苗叶绿素和可溶性糖质量分数
2.2.3外源IAA对不同遮光度下红丁香幼苗内源激素质量分数的影响
由表4可知,各处理组内源赤霉素(GA3)质量分数随处理时间均呈现先升高后降低的趋势,在处理的各个时间,遮光组与外施IAA组的GA3质量分数均高于CK,且外施IAA组的GA3质量分数均高于遮光组。遮光和IAA处理均对内源IAA质量分数造成了显著的影响。遮光处理后内源IAA质量分数的变化由大到小为MS、SS、LS、CK;外施IAA处理后内源IAA质量分数由大到小为MS+IAA、SS+IAA、LS+IAA、CK;处理至30 d时,各处理组达到本组最大值,此时MS和MS+IAA内源IAA质量分数分别较CK提高了29.17%和73.70%。另外,遮光组和外施IAA组ABA质量分数均显著低于CK,随着处理进程,CK中ABA质量分数一直升高,第50天时ABA质量分数是第10天时的4.02倍,其他处理组中ABA质量分数的变化趋势为先升高后降低;随遮光度的增加,ABA质量分数变化趋势由大到小为CK、LS、MS、SS;同一遮光度下,外施IAA降低了ABA质量分数,处理至30 d时,LS+IAA比LS降低了17.92%,MS+IAA比MS降低了27.02%,SS+IAA比MS降低了11.31%。

表4 不同处理时红丁香幼苗内源激素质量分数
2.3 外源IAA对不同遮光度下红丁香幼苗光合作用的影响
净光合速率(Pn)反映了植物在单位时间内积累有机物的量,由表5可知,遮光和外施IAA均能使Pn增大;处理初期(第10天),各处理组的Pn已经与CK发生了显著变化,此时CK的Pn为3.68 μmol·m-2·s-1,其他处理组依次比CK高出57.61%、79.35%、81.52%、117.39%、52.72%、76.09%;处理中期(第30天)与初期时Pn的变化规律大致相同,此时各处理组的Pn均达到最大值,Pn最大的处理组为MS+IAA(14.30 μmol·m-2·s-1),是CK的2.42倍;处理末期(第50天),各处理组Pn均有所下降,但仍显著高于CK。遮光后蒸腾速率(Tr)较CK升高,MS和SS处理下Tr处于较高水平且与CK差异显著;同一遮光度下,外施IAA对Tr有促进作用。随遮光度的增加,胞间CO2摩尔分数(Ci)表现为先降低后升高,在MS处理下出现最低值;同一遮光度下外施IAA对Ci影响并不显著。气孔导度(Gs)随遮光度的增加呈现由大到小的规律为MS、SS、LS、CK;同一遮光度下外施IAA进一步提高了Gs值,且在MS下效果较为显著。
3 讨论与结论
3.1 遮光促进红丁香幼苗生物量的积累
遮荫条件主要引起红光与远红光的比例和光合有效辐射(PAR)两种信号因子的变化。当植物暴露在荫蔽环境时,它们表现出耐荫和避荫两种不同的策略[19-20]。耐荫反应优化了植物对光的捕获和利用,包括增大叶面积、增多分枝、增加叶绿素质量分数等,这些都有助于叶片中有机物的增加。避荫反应植物则常常通过光感受器信号调控网络增加茎的伸长,从而使叶片最大限度地捕捉光能。因此,有避荫反应的植物为了竞争阳光而长得又高又细,茎、叶、根的能量分配发生了变化,导致叶片的发育受阻。

表5 不同处理时红丁香幼苗光合指标
由于植物对遮光会产生上述两种不同的反应,因此,遮光后形态的变化也是有差别的。根据前人研究结果来看,差别的产生源于植物本身是否耐荫或者喜荫。相关研究证明,如大豆[21]、水稻[22]、小麦[23]、马铃薯[24]等农作物遮光后光合作用降低,能量分配偏向于茎秆的伸长而导致徒长,严重影响其产量。而也有研究结果显示,遮光可以减少高温和高光的损伤从而促进幼苗的生长发育。张文慧等[25]通过遮光处理探究小粒咖啡(Coffeaarabica)幼树的最佳光照条件发现,轻度遮光增加了叶绿素总量、光合速率以及光能利用效率,使得总生物量显著提高。陈青等[26]对橡胶树组培苗进行遮光处理,得出了90%遮光有利于橡胶树组培苗的生长,显著提高了株高、叶面积和叶绿素质量分数。由此可知,遮光对植株生长发育的影响与植株对光的需求密切相关,而对光的需求又因植物种类、植株发育时期的不同而差异明显。但可以确定的是,处于幼苗期的植株更容易受到高温或者高光的胁迫[27-28]。
本研究中,弱光处理,甚至是重度遮光,红丁香幼苗并未表现出受到弱光胁迫的表征。遮光后红丁香幼苗的茎确实伸长,但茎粗也有所增加,且叶片、根的生物量积累也显著增加。这就意味着,遮光并没有让红丁香幼苗产生避荫反应,恰恰相反,遮光为红丁香幼苗营造了一个更为舒适的生长环境,使得整个植株相比CK表现出生长发育更为旺盛的情况,且生物量的积累在根、茎、叶等部位均衡分布,没有出现以牺牲根和叶片发育为代价而徒长的现象。从形态上来看,遮光处理后红丁香幼苗的株高、地径、节间长、叶面积和叶片数量均较CK有所提高,其中以MS(50%中度遮光)效果最好;另外,遮光处理增加了红丁香幼苗地上部和根系的干质量,使得总生物量的积累得到了增加。并且,由CK与SS(75%重度遮光)的长势可知,即使是重度遮光(75%重度遮光),红丁香幼苗都没有表现出弱光胁迫,株高、叶面积等均大于CK;叶绿素质量分数在4种遮光度中最高,说明75%重度遮光并没有抑制红丁香叶绿素的合成;GA3和IAA两种促生长型植物激素质量分数较CK增加;净光合速率(Pn)、气孔导度(Gs)反映光合作用的指标也均好于CK;反而是CK,植株的发育不良,较低的Pn、Gs以及较高的ABA质量分数推测其受到强光胁迫。已有很多研究证实重度遮光会抑制光合作用从而减弱植株的长势[29-30]。红丁香幼苗没有出现这种情况的原因可能是具有较强的耐荫性。综上所述,不同程度的遮光处理通过提高叶绿素质量分数和气孔导度(Gs)促进了光合作用,并且促生长型激素吲哚-3-乙酸(IAA)和赤霉素(GA3)质量分数显著增加,从而促进了生物量积累。
3.2 IAA协同遮光对红丁香幼苗生物量积累起正调控作用
适宜质量浓度的IAA具有促进植株生长的作用,这毋庸置疑并且得到了很多研究的验证[31]。有研究认为,外源IAA能够促进叶绿素的合成从而增强光合作用进而提高生物量的积累[32],此途径IAA发挥作用的机理类似于遮光引起的效果。王忠[33]发现生长素能够促进气孔张开,推测Pn的提高可能是由于外源IAA诱导的Gs增大引起的。还有研究认为,外源IAA能够引起GA3质量分数的增加,而GA3有利于气孔的开合从而增强光合作用[34]。类似的,外源IAA通过降低植物体内ABA的质量分数缓解环境胁迫,进而减弱ABA对Gs的抑制作用[35]。外源IAA还对油菜素内酯(BR)的合成有正向调控作用从而促进植株的生长[36]。这些都是通过影响内源激素合成进而对植株形态进行调控的。另外,IAA作为一种信号因子,通过影响类黄酮、木质素等次生代谢产物的合成积累同样可以达到调控植株形态和生物量积累的作用[37-39]。而在本研究中,喷施IAA后GA3以及IAA的质量分数增加,ABA质量分数减少,这与前人研究结果基本一致,也从侧面说明了光与生长素调控植株生长发育的机制较为复杂,存在着多种成分间的相互作用。
目前,对于光和IAA同时调控植株生长发育的研究较少。苗永美等[40]对甜瓜进行遮光试验发现,其生长和叶绿素合成受到抑制,非气孔限制因素引起光合作用下降;而喷施IAA能显著提高株高、叶面积以及地径,同时促进叶绿素的合成,促进植株生物量积累;有趣的是正常光下IAA对甜瓜植株光合能力有一定的抑制作用,表现为Ci明显上升,Pn和水分利用效率下降,Gs则无明显变化,在弱光条件下才会促进光合使Pn显著升高。同样的,李益清等[41]研究发现Ca2+可增强番茄植株对弱光胁迫的耐受性,而IAA可增强Ca2+的正调控作用,即IAA与Ca2+同时对弱光胁迫的缓解作用比单独施加Ca2+的效果好。外施IAA后处于弱光胁迫下的番茄的株高、茎粗及干物质积累均显著提高,可溶性糖质量分数、可溶性固形物以及糖酸比等均显著增加,植株长势、单果质量及单株产量等甚至高于不遮光处理的番茄。从前人研究结果来看,IAA在遮光环境下起促进生长的作用,这与本研究结果一致。但与本研究不同的是,甜瓜、番茄等喜光植物,它们需要一定光照来维持植株生长发育,尤其是果实的发育,遮光处理于它们而言是弱光胁迫,不利于生长,甚至影响果实产量。而外源IAA能保护弱光胁迫下植株的光合机构,使其能维持较高的光合能力,从而促进物质的积累,因此外源IAA则起到了缓解弱光胁迫的作用。目前已有很多研究证明了IAA在调控植物逆境胁迫中起重要作用[42-45]。而在本研究中,外源IAA作为遮光后红丁香幼苗生长发育的正调控因子,与遮光协同促进了幼苗的形态建成与生物量的积累,推测外源IAA通过增强促生长型激素(IAA、GA3等)的合成达到促进不同遮光条件下红丁香幼苗生长发育的效果,然而内在的作用机制需要进一步的组学手段进行验证。
