黄精双向液体发酵的菌种优选及培养基优化研究
2023-05-22马绪民孙加龙韩春超顾正位
马绪民,孙加龙,韩春超,顾正位
(1.山东中医药大学,山东 济南 250355; 2.泰安市东麒健康产业有限公司,山东 泰安 271000)
黄精(Polygonati Rhizoma)药材来源于百合科黄精属植物黄精,是传统的药食同源中药,具有很好的药用和食用价值[1-2]。 鸡腿菇[Coprinus comatus(Muell.ex Fr.) Gray],学名毛头鬼伞,是16 种珍稀食用菌之一[3]。 蛹虫草[Cordyceps militaris (L.) Link],又称北虫草,为药食两用真菌,含有丰富的药理活性物质,现代研究多集中于其保健和药用方面[4-5]。秀珍菇[Pleurotus pulmonarius (Fr.) Quél]学名肺形侧耳,又名小平菇,属于食用真菌,具有丰富的营养价值[6-7]。
近年来,中药双向液体发酵技术受到了广泛关注。 中药液体发酵是将营养物质溶解在液体中制备培养基,随后在其中接入菌种进行培养得到目标产物的发酵技术[8]。 双向发酵是以中药材为基质,以药用或食用真菌作为发酵菌种,其中中药材为真菌的生长提供营养,同时中药材因真菌的分解作用而产生新的成分[9]。 本研究将二者结合,以鸡腿菇、蛹虫草、秀珍菇为发酵菌种,对黄精进行双向液体发酵,通过考察菌丝体得率、抗氧化活性而优选出发酵黄精的最优菌种,并且对优选出的菌种液体培养基进行优化,为黄精深层次的开发以及增加鸡腿菇发酵产物提供参考。
1 材料与仪器
1.1 材料与试剂
鸡腿菇菌种R2000,山东省农业科学院提供;蛹虫草菌种CICC14013,山东省农业科学院提供;秀珍菇菌种LD1,山东省农业科学院提供。
1,1-二苯基-2-三硝基苯肼(DPPH,上海麦克林生物科技有限公司,CAS#1898-66-4);总抗氧化能力(T-AOC)试剂盒、羟自由基测定试剂盒(南京建成 生 物 工 程 研 究 所,A105/A018);NaH2PO4·2H2O、Na2HPO4·12H2O(分析纯,天津市大茂化学试剂厂);无水乙醇、葡萄糖、果糖、麦芽糖(分析纯,天津科密欧化学试剂有限公司);琼脂、蛋白胨、酵母膏、硫酸铵、酪蛋白胨(北京奥博星生物科技有限责任公司);蔗糖、乳糖、KH2PO4、MgSO4(分析纯,国药集团化学试剂有限公司)。
1.2 培养基
鸡腿菇斜面培养基:20%土豆,2%葡萄糖,0.1%KH2PO4,0.1% MgSO4,2.5%琼脂。 种子液培养基:20%土豆,2%麸皮,2%葡萄糖,0.1% KH2PO4,0.1% MgSO4。发酵培养基中基础的碳源、氮源和磷酸盐:2%葡萄糖,0.1% KH2PO4,1% MgSO4。
蛹虫草斜面培养基同鸡腿菇菌种。 种子液培养基:2%葡 萄 糖,1%蛋 白 胨,0.05% KH2PO4,0.05%MgSO4。 发酵培养基中基础的碳源、氮源和磷酸盐:2%葡萄糖,2%蛋白胨,0.05% KH2PO4,0.05% MgSO4。
秀珍菇菌种培养基同鸡腿菇菌种。 种子液培养基:20%土豆,2%麸皮,0.5%蛋白胨,0.2% KH2PO4,0.049% MgSO4。 发酵培养基中基础的碳源、氮源和磷酸盐:2.5%葡萄糖,0.5%蛋白胨,0.102% KH2PO4,0.039% MgSO4。
1.3 仪器与设备
洁净工作台:SW-CJ-1D,上海苏静实业有限公司;高压灭菌锅:YX-280D,宁波久兴医疗器械有限公司;分光光度计:UV-6100S,上海美谱达仪器有限公司;电热鼓风干燥箱:101,北京市永光明医疗仪器有限公司;电子天平:FA2004N,上海菁海仪器有限公司;恒温振荡:TS-2012C,上海印溪仪器仪表有限公司。
2 研究方法
2.1 菌种的发酵
从鸡腿菇斜面培养基勾取约0.1 cm2菌落的菌丝体,勾取5 次。接种于种子培养基。26 ℃,160 r/min振摇4 d[10]。
从蛹虫草斜面培养基勾取约0.1 cm2菌落的菌丝体,勾取3 次,接种于种子培养基,26 ℃,160 r/min振摇6 d,制备蛹虫草种子液[11]。
从秀珍菇斜面培养基勾取约0.1 cm2菌落的菌丝体,勾取3 次,接种于种子培养基,26 ℃,160 r/min振摇11 d[12]。
3 种不同的真菌进行黄精双向液体发酵,用500 mL 的锥形瓶,加入相应菌种发酵培养基中的基础营养物质,装样量300 mL,黄精浓度7.5 mg/mL,接种量10%,温度26 ℃。 鸡腿菇160 r/min 振摇5 d,蛹虫草静置7 d,秀珍菇140 r/min 振摇7 d。 平行3次,将菌丝体抽滤,40 ℃烘干,称量。
2.2 菌种的优选
将3 种菌丝体煎煮3 次,每次2 h,与发酵液混合,浓缩至20 mg/mL,作为最终的发酵产物,4 ℃保存备用。 干燥的黄精(40~60 目)与蒸馏水以1∶10 的比例煎煮3 次,每次3 h,浓缩至20 mg/mL 备用。
2.2.1 DPPH 自由基清除试验[13]
按照表1 的操作步骤加入蒸馏水,无水乙醇,样品和DPPH 混合均匀之后,避光反应30 min,于517 nm测吸光度(OD)值,按照下列公式计算清除率。

表1 DPPH 自由基清除试验操作步骤
表2 黄精发酵后抗氧化活性(s)

表2 黄精发酵后抗氧化活性(s)
注:DPPH 为1,1- 二苯基-2- 三硝基苯肼。 与黄精水提液比较,*P<0.01。
组别 个数黄精水提液 3黄精鸡腿菇发酵 3黄精蛹虫草发酵 3黄精秀珍菇发酵 3 DPPH 自由基清除率/% 羟自由基抑制力/(U/mL) 总抗氧化能力/(U/mL)39.96±2.98 69.88±9.54 1.04±0.20 89.17±2.04* 78.12±9.02 9.37±1.56*83.40±3.21* 29.84±3.13 2.15±0.64 92.15±0.76* 65.79±9.44 1.80±0.31
注:OD0 为空白参比吸光度值;OD1 为样品与DPPH 自由基反应后的吸光度值;OD2 为样品本身吸光度值。
2.2.2 羟自由基抑制能力测定[14]
按照羟自由基测定试剂盒(A018)说明书,用维生素C(VC)在相同浓度下对比。 取0.2 mL 样品,于550 nm处,双蒸水调零,测定OD 值,按照公式计算。
2.2.3 总抗氧化能力测定[15]
按照T-AOC 测定试剂盒说明书,用VC 在相同浓度下对比,取0.2 mL 样品,于520 nm 处,双蒸水调零,测定OD 值。 按照下列公式计算。
2.3 黄精液体发酵培养基的优化
2.3.1 黄精液体发酵质量浓度的考察
在基本营养成分不变的前提下,考察黄精质量浓度为0 mg/mL、5 mg/mL、10 mg/mL、15 mg/mL、20 mg/mL、25 mg/mL 的液体发酵情况,每个浓度平行3 次,以生物量(g/L)为指标,优选黄精最佳的液体发酵浓度[16]。采用500 mL 的锥形瓶,装样量300 mL,140 r/min 振摇3 d,将菌丝体抽滤,40 ℃烘干,称量。
2.3.2 碳源种类和含量的考察
参考张疏雨等[17]的方法,并做适当修改。 首先以相同浓度的2%的葡萄糖、蔗糖、果糖、麦芽糖和乳糖,每种碳源平行3 次,优选出碳源后再进行浓度的优化。 设置5 个浓度:0%、2%、4%、6%、8%。 用100 mL的锥形瓶,装样量50 mL,140 r/min 振摇3 d,将菌丝体进行抽滤,40 ℃烘干,称量。
2.3.3 氮源种类和含量的考察
参考孟丽君等[18]的方法,并做适当修改。 首先以相同浓度的5%的麸皮、蛋白胨、酵母膏、酪蛋白胨和硫酸铵作为氮源,优选出氮源后再进行浓度的优化。设置5 个浓度:0%、2.5%、5%、7.5%、10%。 采用100 mL的锥形瓶,装样量50 mL,发酵3 d,平行3 次,将菌丝体抽滤,40 ℃烘干,称量。
2.3.4 正交试验
根据单因素试验结果,以合适的碳源、氮源以及黄精浓度作为试验的三个因素,每个因素设三个水平,另外设置空白因素和空白水平项,设计L9(34)因素水平表,按照该表进行试验,平行3 次,取平均值,以生物量(g/L)为指标,确定最优培养基配方[19]。见表3、表4。
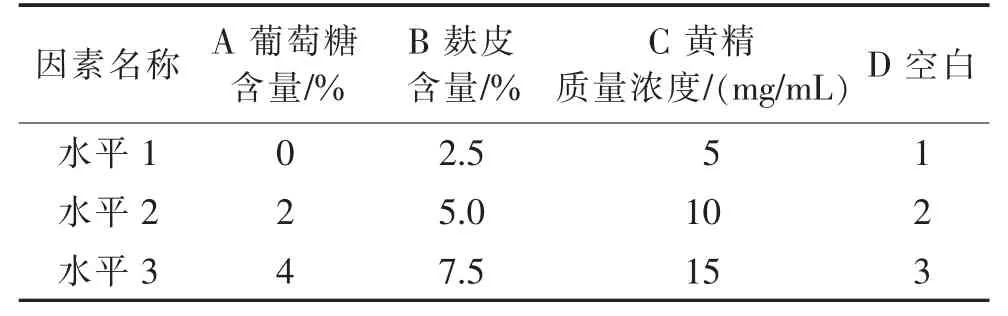
表3 黄精鸡腿菇发酵工艺因素水平
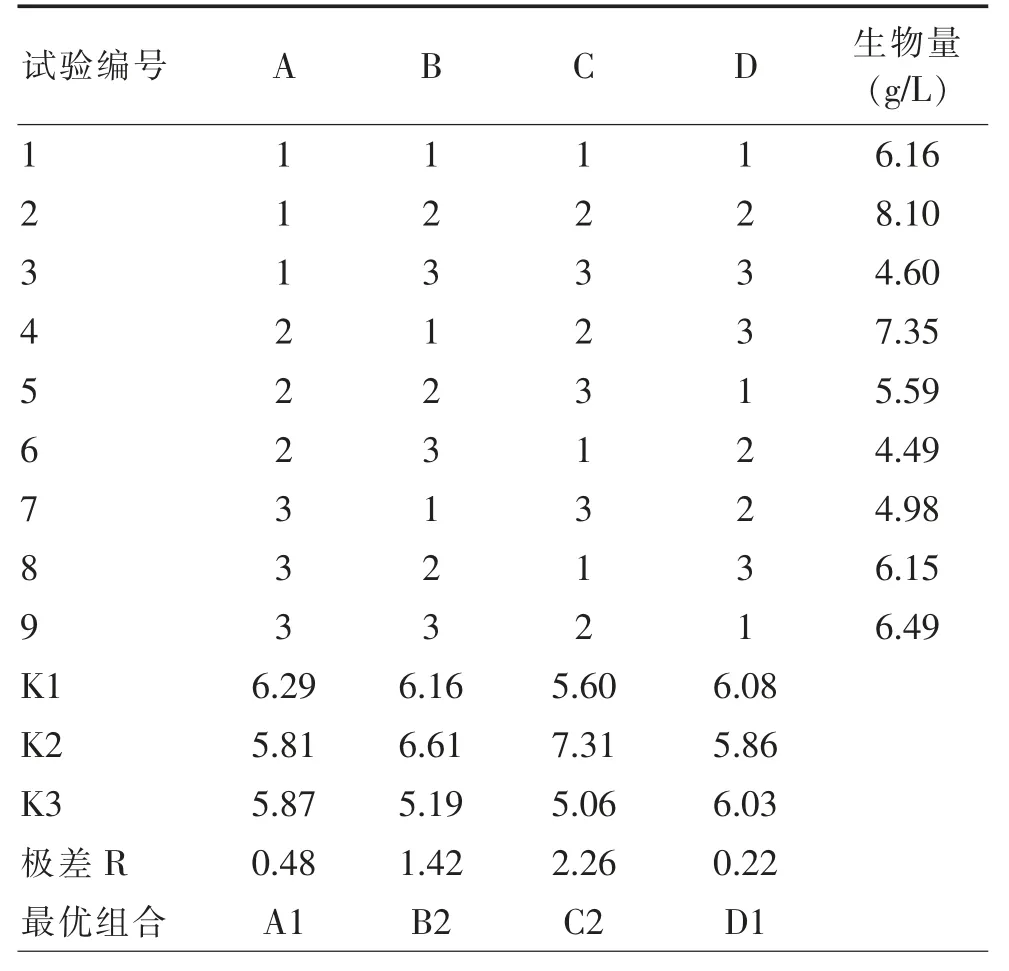
表4 黄精鸡腿菇发酵正交试验结果
2.4 统计学处理
3 结果与分析
3.1 菌丝体得率
以生物量(g/L)为纵坐标,黄精发酵后与普通发酵后生物量比较见图1。 黄精均可使用3 种菌种进行液体发酵且发酵后菌丝体的得率均显著增加,黄精鸡腿菇液体发酵后生物量最多,为8.47 g/L,与自身普通发酵比较差异具有统计学意义(P<0.05)。 黄精蛹虫草液体发酵后生物量增加的最多,发酵后生物量为7.56 g/L,与自身普通发酵比较差异具有统计学意义(P<0.01)。
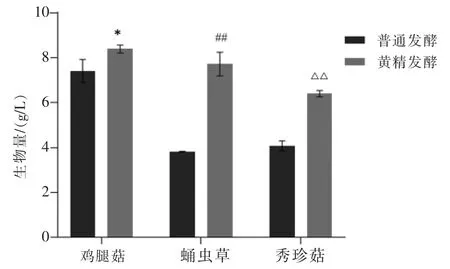
图1 黄精发酵后菌丝体的得率
3.2 菌种的优选
由表2 可知,黄精和不同菌种液体发酵后,发酵后的产物DPPH 清除力比黄精水提液均有显著增加。其中以秀珍菇发酵后DPPH 清除率最高,各发酵组与黄精水提液组比较差异具有统计学意义(P<0.01)。在羟自由基清除试验中,黄精经过蛹虫草和秀珍菇发酵后,羟自由基抑制能力反而有显著降低,黄精鸡腿菇发酵后略有上升,可达到(78.12±9.02)U/mL。在总抗氧化能力方面,经过发酵后,黄精鸡腿菇发酵比黄精水提液显著增强,两组疗效比较差异具有统计学意义(P<0.01)。
综合考虑,选择鸡腿菇对黄精进行液体发酵,并对其液体发酵培养基进行优化。
3.3 黄精液体发酵培养基的优化
3.3.1 黄精发酵浓度
以生物量(g/L)为纵坐标,结果见图2-A,黄精在发酵质量浓度为5 mg/mL、10 mg/mL、15 mg/mL 时,生物量比普通发酵显著性增加,10 mg/mL 时生物量最多。 因此,并不是黄精浓度越大提供的营养越多,真菌生长最好。
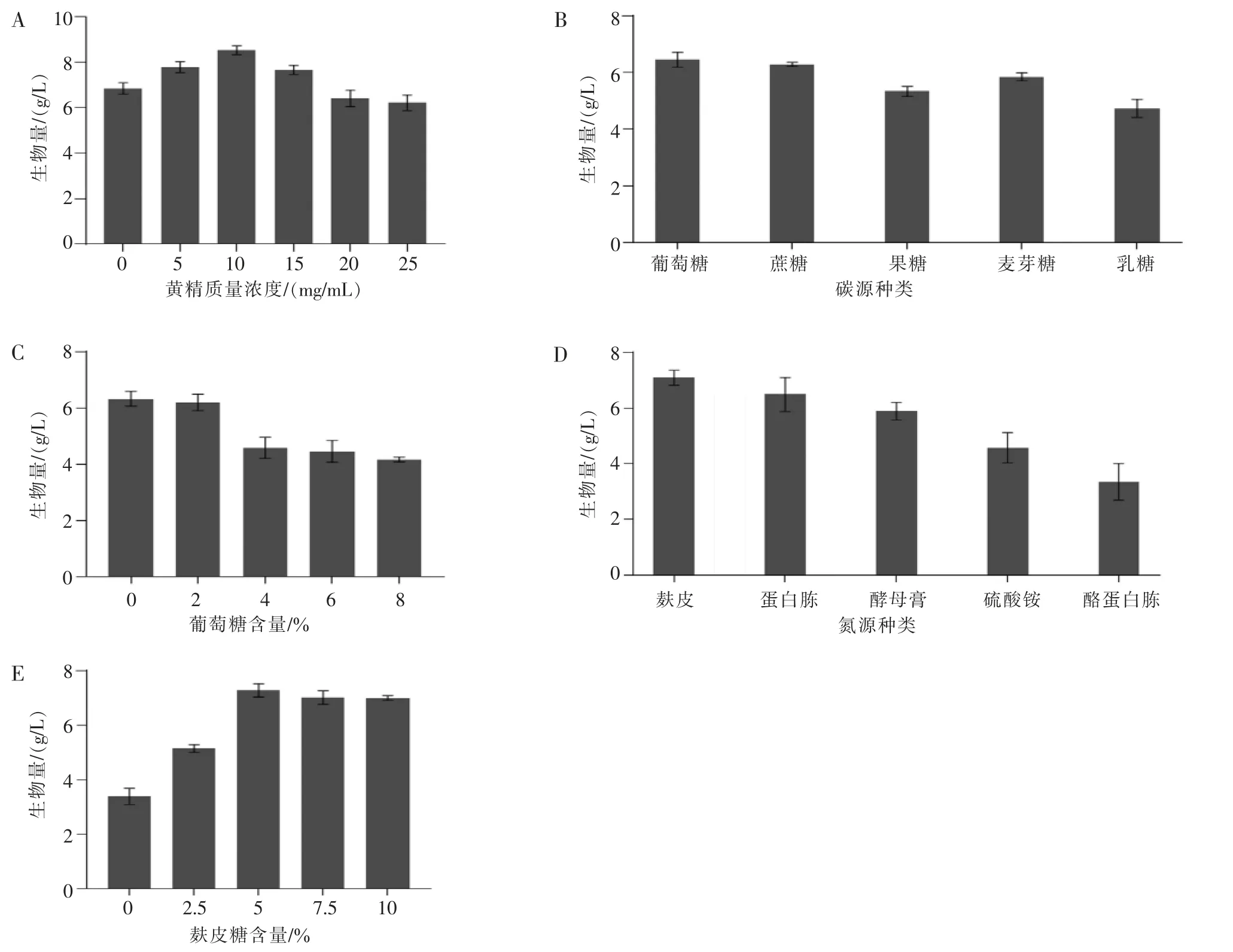
图2 培养基条件单因素考察
3.3.2 碳源的种类和浓度
以生物量(g/L)为纵坐标,结果见图2-B。果糖和乳糖作为碳源时,其生物量比其他碳源的显著减少,生物量最大的碳源是葡萄糖,因此选择葡萄糖作为黄精液体发酵培养基中的碳源。
以生物量(g/L)为纵坐标,结果见图2-C。当葡萄糖含量太高时,其生物量反而显著减少;当葡萄糖含量为0%和2%时,其生物量相差不大;0%的葡萄糖含量时,黄精发酵生物量反而高。
3.3.3 氮源种类和浓度
以生物量(g/L)为纵坐标,结果见图2-D,麸皮作为氮源时,生物量最多,酵母膏、硫酸铵和酪蛋白胨作为氮源时生物量显著减少,因此麸皮更适合应用在黄精液体发酵中。
以生物量(g/L)为纵坐标,结果见图2-E,与不加麸皮比较,其他含量时的黄精发酵生物量均显著增加,麸皮5%的含量时生物量最多,浓度增大时生物量趋于平缓。
结果如表4 所示,各因素对黄精液体发酵培养影响的顺序为:黄精浓度>氮源含量>碳源含量。由表5 方差分析数据可知,氮源和黄精浓度对黄精鸡腿菇发酵具有显著影响,而碳源的含量则对其双向液体发酵工艺无显著影响。 由分析结果可知,最佳培养基为葡萄糖0%,麸皮含量为5%,黄精质量浓度为10 mg/mL,土豆20%,KH2PO40.1%,MgSO40.1%,按照该条件进行发酵,进行验证试验,菌丝体得率为(8.06±0.20)g/L。
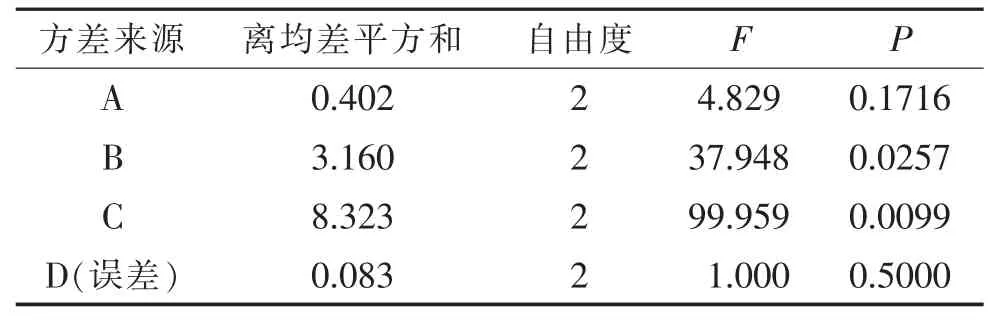
表5 黄精鸡腿菇发酵不同工艺因素水平下方差分析结果
4 讨论
黄精在用三个菌种进行双向液体发酵后,生物量均有显著增加,以鸡腿菇为菌种进行发酵时,菌丝体得率最高。 此外,鸡腿菇-黄精液体发酵后DPPH清除率和总抗氧化能力较其他菌种发酵后高,且羟自由基抑制能力也略有提高。 因此综合考虑选择鸡腿菇作为对黄精进行液体发酵的菌种。
真菌的生长繁殖离不开适宜的生长条件,在合适的生长条件下,真菌的生长代谢活动才能正常进行[20]。 各种营养是微生物生长的先决条件,并且各种营养物质只有在适宜的浓度时才能对真菌的生长繁殖起到最佳效果。 所以培养基的优化需要在单因素的基础上通过正交试验筛选出营养物质的最佳配比。 结果表明,最佳培养基为葡萄糖0%,麸皮含量5%,黄精质量浓度10 mg/mL,土豆20%,KH2PO40.1%,MgSO40.1%。 此外由单因素结果可知,当黄精含量持续升高时,生物量反而降低,说明并不是黄精含量越多发酵过程越好,黄精-鸡腿菇双向发酵应在适宜的含量范围内进行,超出一定的限度反而会阻碍发酵过程。
由正交试验结果猜测,黄精在液体发酵过程中,其水提液为鸡腿菇的生长繁殖提供了一定的基础营养物质,特别是碳源所具备的营养,此过程符合中药双向液体发酵的定义。 此外,黄精和鸡腿菇中的主要成分为多糖类物质,相关研究表明黄精多糖和鸡腿菇多糖具有很好的抗氧化作用[21-22]。 在鸡腿菇发酵黄精后抗氧化能力显著提升,说明发酵后的产物具有更好的抗氧化能力,原因可能是发酵后产生了具有良好抗氧化能力的多糖。 本研究为开发黄精发酵产品提供了新思路,为接下来鸡腿菇双向发酵黄精在保健品和化妆品领域的应用提供了一定参考。但是对于鸡腿菇发酵黄精后新产生的活性物质还有待进一步的研究和探索,这也是日后研究工作的重点关注内容。
