基于哺乳动物细胞表达S1蛋白的猪流行性腹泻病毒单克隆抗体
2023-05-21李虎林颜仁和陈泽典仇珍珍李堪贺马曼欣毛莹莹李建军吕宗吉李红卫
李虎林 颜仁和 陈泽典 仇珍珍 李堪贺 马曼欣 毛莹莹 李建军 吕宗吉李红卫,★
猪流行性腹泻(Porcine epidemic diarrhea,PED)是由猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)引起的一种、临床上以猪的急性肠炎、呕吐、水样腹泻、脱水为特征的高度接触性肠道传染病,哺乳仔猪的死亡率可高达100%[1]。该病毒在70 年代初首次在英国发现[2],我国从80 年代初开始相继报道,并于2010 年开始大面积流行,给我国养猪业造成了重大的经济损失[3]。因此建立快速、敏感、特异性强的检测方法,对于该病的防控显得尤为重要。
PEDV属于冠状病毒科,α冠状病毒属成员,其基因组是大小约为28 kb 的单股正链RNA,主要编码4个结构蛋白,包括纤突(Spike,S)蛋白、膜(Membrane,M)蛋白、包膜(Envelope,E)蛋白、核衣壳(Nucleocapsid,N)蛋白,3 个非结构蛋白(复制酶1a和1b,ORF3)[4]。其中,S 蛋白是位于病毒粒子表面的纤突糖蛋白,参与病毒与宿主细胞的吸附和融合,同时它也是诱导宿主产生中和抗体的主要抗原分子。另外,S 基因位于PEDV 基因组的高变异区,PEDV 经典毒株和变异毒株的核苷酸序列的主要差别也位于S 基因,因此S 基因可用于PEDV 毒株的鉴别诊断[5-6]。本研究在课题组前期研究基础上[7-8],利用哺乳动物细胞表达的S1重组蛋白免疫小鼠,制备抗S1 蛋白的单克隆抗体,为猪流行性腹泻病毒血清学检测方法的建立奠定基础。
1 材料与方法
1.1 细胞、毒株、实验动物
哺乳动物细胞表达的重组PEDV S1 蛋白,猪流行性腹泻病毒(PEDV,GDS10 毒株),猪伪狂犬病毒(Porcine pseudorabies virus,PPRV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)、猪圆环病毒2 型(Porcine circovirus 2,PCV2)、猪细小病毒(Porcine parvovirus,PP),猪瘟病毒石门株(Classical swine fever virus,CSFV),Vero 细胞等均由广州伯尼兹生物科技有限公司和佛山科学技术学院制备或保存。6~8 周龄BALB/C 小鼠购自南方医科大学实验动物中心。
1.2 试剂
弗氏完全佐剂、弗氏不完全佐剂、HAT、HT试剂购自Sigma 公司,HRP 标记的羊抗鼠IgG,FITC-羊抗鼠IgG;双组分TMB 显色液购自北京索莱宝科技有限公司。二氨基联苯胺购自上海迈瑞尔化学技术有限公司;二甲基亚砜;0.25%胰蛋白酶、DMEM 培养基及南美胎牛血清均为Hyclon公司产品。
1.3 重组PEDV S1 抗原制备及免疫小鼠
293T 细胞表达的重组PEDV S1 蛋白为广州伯尼兹生物科技有限公司生产纯化,并与佐剂充分混合制备抗原。
将重组S1 抗原与等体积的弗氏完全佐剂充分乳化后,以每只小鼠50 μg 的量皮下注射BALB/c小鼠,一次免疫后,每隔两周,按同样方法将同等剂量的抗原与弗氏不完全佐剂乳化后分别进行两次加强免疫。三次免疫10 天后小鼠尾静脉取血。以重组S1 抗原包被,ELISA 检测血清效价。取效价大于1∶105的小鼠,用100 μg 的抗原加强免疫,并于免疫后3 天取小鼠脾细胞与骨髓瘤细胞进行细胞融合。
1.4 杂交瘤细胞的制备和筛选
将免疫小鼠的脾细胞悬液与对数生长期的小鼠骨髓瘤细胞株SP2/0 按1∶1 的比例混合,在50%PEG 的作用下进行细胞融合。将融合细胞置于含20%血清的HAT-DMEM 培养基中,调节细胞数量,分至96 孔板中,每孔200 μL。培养三天后,观察细胞融合情况,更换一半HAT 培养液,连续数日,直至有克隆形成,更换HT 培养液培养一天,更换DMEM 完全培养基。间接ELISA 法检测细胞培养上清,选择效价较高的阳性克隆杂交瘤细胞,并用有限稀释法连续克隆化2~3 次,直至100%细胞阳性率,最后获得稳定分泌抗PEDV S1 蛋白单克隆抗体细胞株。将克隆化后阳性率达100%的细胞扩增培养后液氮冻存。
1.5 单克隆抗体抗体的Western Blot 鉴定
将重组PEDV S1 蛋白及空白组HEK-293 细胞培养上清用1×SDS 裂解缓冲液裂解后进行SDSPAGE,然后后用Bio-Rad 电转移装置将蛋白转移至PVDF 膜上,5%脱脂奶封闭过夜,用纯化的PEDV S1 蛋白单克隆抗体为一抗,羊抗小鼠IgG为二抗,进行Western Blot 反应。
1.6 单抗的制备纯化及亚型鉴定
将杂交瘤细胞株在150 mm 细胞培养皿中用DMEM 完全培养基培养生长至细胞密度达到80%以上进行扩大培养,一个150 mm 培养皿细胞用无血清培养基传代5 个150 mm 培养皿细胞,培养96 h 后收集无血清培养基,并更换等量新鲜无血清培养基继续培养96 h,再次收集细胞上清液合并后进行纯化。采用亲和色谱法Protein G Sepharose Fast Flow 纯化单克隆抗体,并通过Sepharose S-200 分子筛脱盐,PBS 洗脱,以SDS-PAGE 测定单克隆抗体的纯度。
单克隆抗体采用Hbt 公司的鼠单抗亚型鉴定试剂盒鉴定杂交瘤细胞株的亚型。间接ELISA 的方法[8]检测杂交瘤细胞DMEM 培养上清液和无血清培养基上清的抗体效价
1.7 单抗的稳定性试验
将冻存的杂交瘤细胞复苏后连续传代20 代。并收集每代的细胞培养液,用间接ElisA 的方法测定第2、5、10、15、20 代的细胞培养液抗体效价,以分析杂交瘤细胞分泌抗体的稳定性。
1.8 间接免疫染色试验及单克隆抗体敏感性检测
将PEDV 病毒稀释后接入提前长成单层Vero细胞的96 孔板中,培养48 h。弃去培养液,PBS 洗涤2 次,加入预冷的固定液(冰丙酮:乙醇=2∶3),室温固定20 min;PBST 洗涤2 次后加入羊血清37℃封闭30 min;加入10%脱脂奶稀释的单克隆抗体,置于37℃温箱中孵育1 h;用PBST 漂洗三次,二抗用10%脱脂奶按1∶1 000 稀释,每孔100 μL,37℃避光放置1.5 h;PBST 洗涤后每孔加入适量的DAB,室温作用10 min,用蒸馏水洗3 次,倒置显微镜下观察结果并拍照。同时设不接毒的正常细胞为阴性对照。
取单克隆抗体按100、500、1 000、2 000、4 000、8 000 倍进行稀释,按上述方法进行免疫染色实验,然后置显微镜下观察并拍照。同时设正常细胞为空白对照
1.9 单克隆抗体特异性的测定
采用上述建立的间接ELISA 方法检测筛选得到的单克隆抗体与PEDV、PPRV、PRRSV、PCV2、PP 和CSFV 等是否发生交叉反应,以正常SP2/0 细胞培养上清为阴性对照,验证单克隆抗体的特异性检测。
2 结果
2.1 杂交瘤细胞株的筛选
免疫小鼠的脾细胞和SP2/0 骨髓瘤细胞融合后,经多次克隆及亚克隆筛选,共得到5 株能与PEDV S1 蛋白产生特异性反应的单抗表达细胞株。分别命名为:12D14H4、13F5B9、10D2B10、11A7C9 和14E6F5,其分泌的抗体效价分别为:1∶51 200、1∶25 600、1∶12 800、1∶12 800、1∶3 200。
2.2 单克隆抗体能与PEDV-S 蛋白特异性结合
Western Blot 结果显示,5 株单抗与PEDV S1蛋白反应后,均在130 KDa 附近出现清晰条带。见图1。
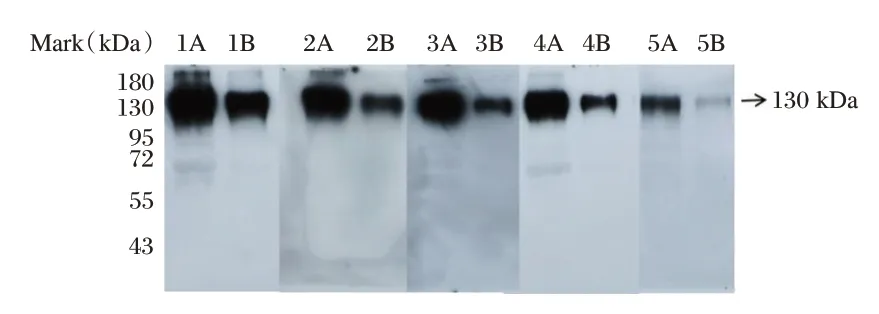
图1 单克隆抗体与PEDV-S1 蛋白的Western-Blot 鉴定图Figure 1 Western blot analysis of PEDV S1 monoclonal antibody
2.3 单抗的纯化
单克隆抗体培养上清经Protein G 亲和层析法纯化后的单克隆抗体进行SDS-PAGE 电泳,结果显示,无血清培养液中的单克隆抗体杂蛋白较少,纯化后目的蛋白在55 KDa 和25 KDa 附近出现清晰条带,无杂带,纯化后单抗纯度95%以上。见图2。
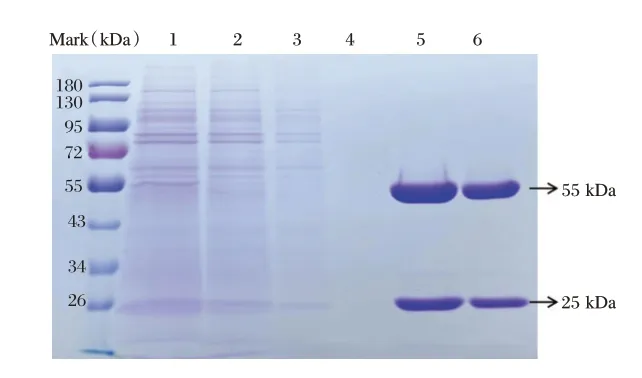
图2 PEDV 单克隆抗体纯化结果图Figure 2 Purification of the PEDV S1 monoclonal antibody
2.4 抗体亚型及效价测定
通过多次亚克隆筛选出1 株稳定分泌抗PEDV S1 单克隆抗体的效价最高的杂交瘤细胞株,命名为PEDV-12D14H4。经ELISA 方法鉴定,该杂交瘤细胞株的DMEM培养上清及无血清培养上清产生的抗体效价分别为1∶51 200 和1∶1 024 000。经过鼠单抗亚型鉴定试剂盒鉴定,PEDV-12D14H4分泌抗体的亚型为IgGⅠ型,轻链为k 链。
2.5 杂交瘤细胞稳定性分析
分别选取杂交瘤细胞株PEDV-12D14H4 第2、5、10、15、20 代培养上清,进行抗体的效价测定,结果显示,不同代次的杂交瘤细胞分泌的抗体效价基本一致。见表1。

表1 杂交瘤细胞分泌抗体的稳定性分析结果Table 1 Stability of the hybridoma cells secreting antibody
2.6 PEDV 间接免疫染色检测方法的建立
PEDV 感染Vero 细胞后加入单抗后按间接免疫染色(DAB)方法进行染色,结果表明,接种PEDV 的Vero 细胞有明显的特异性显色,而阴性对照组(不接毒的正常细胞)未见显色。见图3。
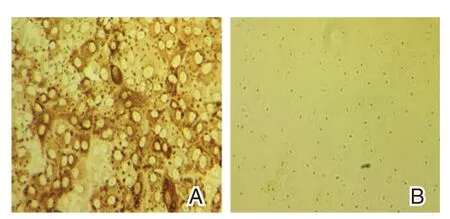
图3 PEDV 间接免疫染色图(DAB,×100)Figure 3 PEDV infection by indirect immunofluorescent assay(DAB,×100)
2.7 单克隆抗体敏感性检测
接种PEDV 病毒液的细胞中加入不同稀释度(1∶100,1∶500,1∶1 000,1∶2 000,1∶4 000,1∶8 000)的Cy-3-12D14H4 单克隆抗体,同时设正常细胞为空白对照,在倒置显微镜下观察,结果表明,将单抗稀释至4 000 倍仍可观察到典型的特异性显色。见图4。

图4 间接免疫染色敏感性检测(100×)Figure 4 Sensitivity detection of the McAb by indirect immunofluorescent assay(100×)
2.8 单克隆抗体特异性测定
以猪PEDV、PPRV、PRRSV、PCV2、PP 和CSFV为包被抗原,检测单克隆抗体的特异性。间接ELISA 结果显示,PPRV、PRRSV、PCV2、PP 和CSFV 均不与12D12H4 杂交瘤细胞分泌的单抗发生交叉反应,与阴性对照组基本一致。见表2。
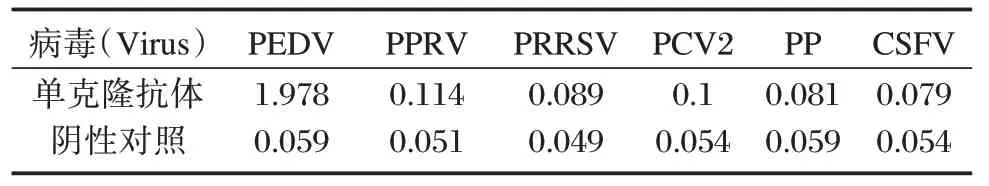
表2 单克隆抗体的特异性分析Table 2 specificity analysis of the MAb
3 讨论
根据研究报道,我国的养猪业因病毒感染而导致腹泻的主要三大类病毒中,PEDV 占46%,PRV 占8%,TGEV 占15%,PEDV 俨然已成为当前国内猪群腹泻流行的最主要原因[9]。由于PED与TGE 等其他腹泻疾病在流行病学、临床症状等方面表现非常相似,加上病毒变异,给PED 的快速诊断与防治都带来了一定困难[10]。因此亟需制备一种针对PEDV 的高滴度、高特异性抗体,用于病毒的血清学检测。制备成功纯度高、抗原性好的PEDV 抗原蛋白是获得高质量抗体单克隆抗体的前提和基础。而PEDV 体外分离培养难度高,感染细胞病变不明显,抗体滴度较低,纯化过程比较繁琐且纯度不高。原核细胞表达的蛋白由于不具备翻译后修饰过程,重组蛋白制备的单克隆抗体用于检测天然蛋白时出现假阴性几率较高,因此很难在临床上进行推广。目前,蛋白的表达系统主要包括大肠杆菌表达系统、昆虫细胞表达系统、酵母表达系统、哺乳动物细胞表达系统等,我们课题组前期实验证明,哺乳动物表达的蛋白,结构更接近于天然蛋白,具有更好的免疫原性,免疫动物后能产生高水平的特异性抗体[11-12]。
本研究利用哺乳动物细胞表达纯化的PEDV S1 重组蛋白与佐剂一起乳化并免疫BABL/C 小鼠,取免疫小鼠的脾细胞与SP2/0 细胞进行杂交融合,经间接ELISA 检测筛选,获得5 株抗体效价高、特异性强、稳定性好的抗PEDV 单克隆抗体。单克隆抗体的体外生产相较于腹水生产具有显著优势:一、可大规模制备,降低生产成本;二、避免其它鼠源抗体的干扰,易于得到高纯度的单抗;三、质量可控。本研究得到的单抗采用杂交瘤细胞培养,上清中抗体效价可达1∶51 200,更换为无血清培养基后,进一步避免了血清中的蛋白质以及各种大分子物质对单抗的影响,使得单抗的纯度及回收率大大提高,效价可达到1∶1 024 000。无血清培养基的应用也降低了常规血清培养基的生产成本及不稳定性,为单抗的大规模应用提供了基础。本研究制备的PEDV 单克隆抗体具有较高的特异性,该单抗的成功研制,为PEDV 免疫诊断、表位识别及蛋白研究奠定了良好基础。
