不同施肥措施对饲用燕麦土壤细菌群落多样性的影响
2023-05-17靳建刚田再芳郑敏娜康佳惠
靳建刚, 田再芳, 郑敏娜, 康佳惠
(1.山西农业大学生态农牧研究所,山西 朔州 037200; 2.山西农业大学高寒区作物研究所,山西 大同 037008)
21 世纪以来,牧区家畜饲养量逐步减少,牛羊肉和奶类生产的重心逐渐向农区和农牧交错区转移,畜牧业的这一发展趋势极大地促进了农区-农牧交错区人工草地的快速发展,人工草地的建设已成为草业发展中特别重要的组成部分[1]。近年来,随着国家草产业政策的积极推进,饲用燕麦(Avena sativaL.)作为一种优质禾本科牧草,其建立的人工草地在黄土高原农牧交错区得到了较快发展,种植范围逐步扩大,产业效应已初步显现。饲用燕麦起源于地中海红燕麦及其祖先野红燕麦[2],是牧区和农牧交错区广泛种植的一年生草料兼用作物,具有适应性强、营养价值高、耐盐碱等优良特性[3],主要以燕麦青(干)草、青贮燕麦和燕麦籽实等方式被家畜利用[4],在农牧交错区的畜牧业生产和生态经济建设中发挥着重要作用。相对于其他禾本科牧草,饲用燕麦具有更高的产量和应用前景,相应地也需要更加合理的营养水平来保障其营养品质和产量。
在现阶段饲用燕麦人工草地的生产中,施肥是草地建植和田间管理中重要的管理措施之一。当肥料(包括无机肥和有机肥)等外源物质输入到土壤后,会对土壤的营养状态和微生物群落产生显著的影响。合理施肥不仅可以改善土壤结构[5-7],还可以丰富微生物群落和微生物活性[8],提高肥料利用率[9]。然而,在生产中为了追求高产,农户经常过量施用化肥,不仅严重污染土壤资源,影响土壤养分库和微生物多样性的可持续发展,还会威胁食品安全、影响全民健康[8]。因此,在饲草燕麦草地生产中,对无机肥、有机肥的施用必须找到一个平衡点,以实现干旱半干旱区饲用燕麦人工草地土壤生态系统的可持续发展。
目前,国内燕麦主产区关于无机-有机肥配施对土壤理化性状影响的研究较多,但对燕麦根际土壤微生物群落的研究较少。因此,为研究晋北生态区不同施肥措施对燕麦根际微生物多样性的影响,以不同施肥处理下饲用燕麦的根际土壤微生物为研究对象,采用高通量测序技术,探讨不同施肥处理下燕麦根际土壤细菌群落的多样性及其结构组成,并结合土壤养分状况和饲用燕麦植株的生物产量,拟优选出最佳施肥模式,为晋北地区燕麦饲草的种植和提质增效提供参考。
1 材料与方法
1.1 试验概况
试验于2021年在山西农业大学生态农牧研究所的野外试验基地(39°33′—41°14′N、113°14′—114°44′E)进行。试验地是典型的北方农牧交错区,海拔1 350 m,属大陆性季风气候,农业区划为中温带干旱区。试验地耕层土壤(0—20 cm)容重1.48~1.53 g·cm-3,pH 8.46,土壤有机质含量14.61 g·kg-1。
1.2 试验材料
选用饲用燕麦品种‘甜燕麦’为试验材料,由国家燕麦产业体系大同试验站提供。试验所用肥料包括常规商用化肥和自制有机肥,其中,商用化肥分别为尿素(CO(NH2)2, 含N≥46%)、过磷酸钙(含P2O512.0%)和氯化钾(含K2O 60.0%);自制有机肥以牛粪为主要原料(有机质含量16.5%),添加1%的腐熟剂处理后制成,其N、P2O5、K2O含量分别为0.046 3、 0.021 0、 0.060 1 g·kg-1。
1.3 试验设计
试验以不施肥处理为对照(CK),分别设置仅施用商用化肥(T2)及商用化肥与有机肥分别按照 9∶1(T3)、8∶2(T4)、7∶3(T5)、6∶4(T6)和 5∶5(T7)的比例配施,共计7个处理,每处理3次重复,总计21个小区。其中,T2处理氮、磷、钾的施用量分别为180、90和90 kg·hm-2;T3、T4、T5、T6、T7处理氮的总用量与T2处理一致,其有机肥施用量按照配施比例计算,磷和钾的不足部分用相应化肥补足,具体施用量见表1。试验处理按照完全随机的方式排列,小区面积4 m×5 m,小区间间隔1 m。
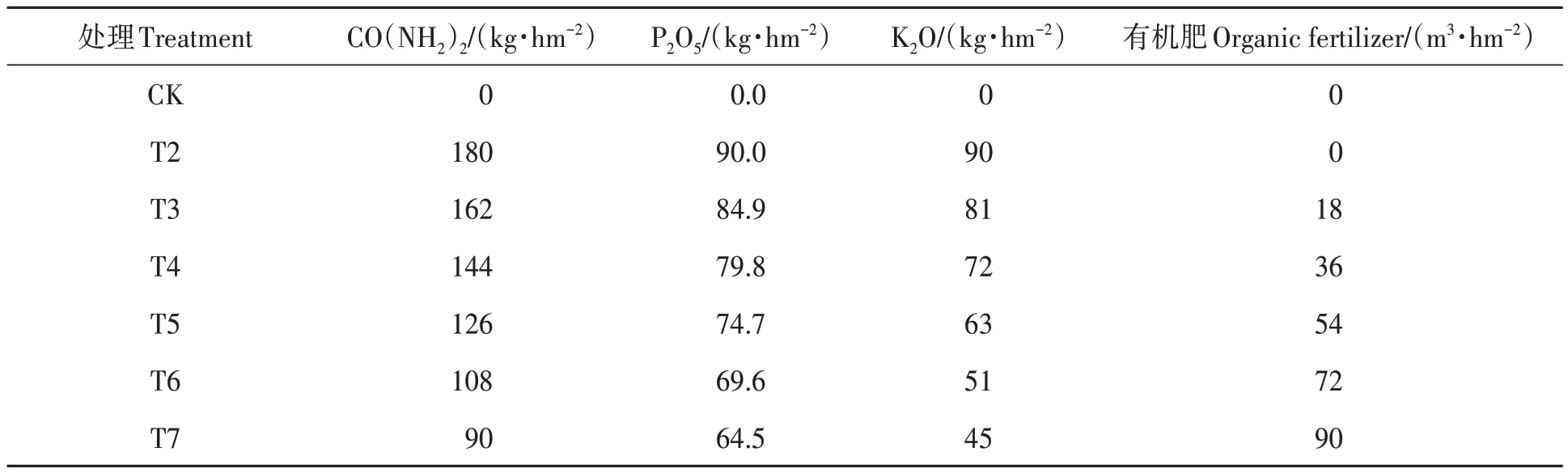
表1 试验各处理的肥料施用量Table 1 Specific information processed by the experiment
饲用燕麦于2021年5月25日条播,播种量150 kg·hm-2,行距25 cm,播种深度4~5 cm。各肥料均采用撒施的方式施入,其中氮肥分别于播种前和拔节期按6∶4的比例分2次施入;磷肥、钾肥和有机肥均于播种前一次性施入。试验期间各小区其他管理措施基本一致,播前灌水1次,生育期内人工除草,于乳熟期采集土壤样品和植株样品。
1.4 样品采集与测定
1.4.1 株高和干草产量测定 于2021年8月20日(乳熟期)进行取样、测产。每个小区去除小区两侧边行,随机选择10株植株,从植株主茎的地表至穗顶部(不含芒)测量株高(plant height,HP);并随机选择3个2 m样段齐地面刈割,称其鲜重,然后于105 ℃烘箱中杀青30 min,65 ℃下烘干至恒重,测定干草产量(yield,Y),以kg·m-2为单位计算。
1.4.2 土壤样品采集和测定 于2021年8月18日采集土壤样品。各小区按对角线采样法,每个小区选取6点用土钻取0—20 cm土层样品及植物根际0~10 mm的土样,各样品混匀后采用四分法取0.5 kg土样,3次重复。取样后,将其分为2份,1份装入离心管液氮封存用于土壤微生物分析;另1份风干后用于土壤pH、有机质(soil organic matter,SOM)、全氮(total nitrogen,TN)、全磷(total phosphorus,TP)、全钾(total potassium,TK)速效氮(available nitrogen,AN)、速 效 磷(available phosphorus,AP)、速 效 钾(available potassium,AK)、有机碳(soil organic carbon,SOC)和可溶解性盐(soluble salt,SS)含量等土壤理化性质的测定,各指标参照鲍士旦[10]的方法进行测定。
1.4.3 土壤总DNA提取及基因扩增 使用MN NucleoSpin 96 Soil(MN,germany)试剂盒进行土壤细菌DNA的提取,每个样品重复3次,采用PacBio测序平台的通用引物(正向27F和反向1492R)以细菌16S rRNA基因全长序列(V3~V4)为目的片段进行PCR扩增,扩增体系参照郑敏娜等[8]的方法。扩增合格样品送北京百迈克生物有限公司进行PacBio平台测序分析。
1.5 生物信息学分析
对原始下机subreads进行校正得到CCS(circular consensus sequencing)序列(SMRT link,version8.0),使用lima(v1.7.0)软件得到符合要求的高质量CCS序列,并进行生物信息学分析。利用QIIME软件对优质序列在相似性≥97%的水平上进行 OUT(operation taxonomic unit)聚类,基于OTU分析结果,对样品在各个分类水平上进行分类学分析;利用Mothur v.1.30软件和R语言工具进行α多样性分析[9];利用软件QIIME进行β多样性分析[9]等;通过R语言分析作图。使用SPSS 22.0进行统计分析。
2 结果与分析
2.1 不同施肥处理对土壤养分及饲用燕麦地上生物量的影响
不同施肥处理下饲用燕麦根际土壤理化特性和生物产量测定结果如表2所示。不同施肥处理对土壤全氮、速效氮和有机碳含量无显著影响,各处理间差异不显著;对土壤速效钾和速效磷含量有显著影响。各处理的速效钾含量在189.36~298.99 mg·kg-1,其中T7处理最高,显著高于其他处理;T4处理次之。各处理的速效磷含量在8.49~11.09 mg·kg-1,其中T4 处理最高,显著高于其他处理;T5处理次之,但与其他处理间差异不显著。不同施肥处理对土壤可溶解性盐含量影响显著,随着有机肥施入量的增加,土壤中可溶解性盐含量逐渐降低,其中CK显著高于施肥处理;T4、T5、T6、T7处理间差异不显著,但显著低于其他处理。此外,T4处理饲用燕麦的株高为107.32 cm,显著高于除T5处理外的其他处理;干草产量为9 245.52 kg·hm-2,显著高于除T5和T6处理外的其他处理。
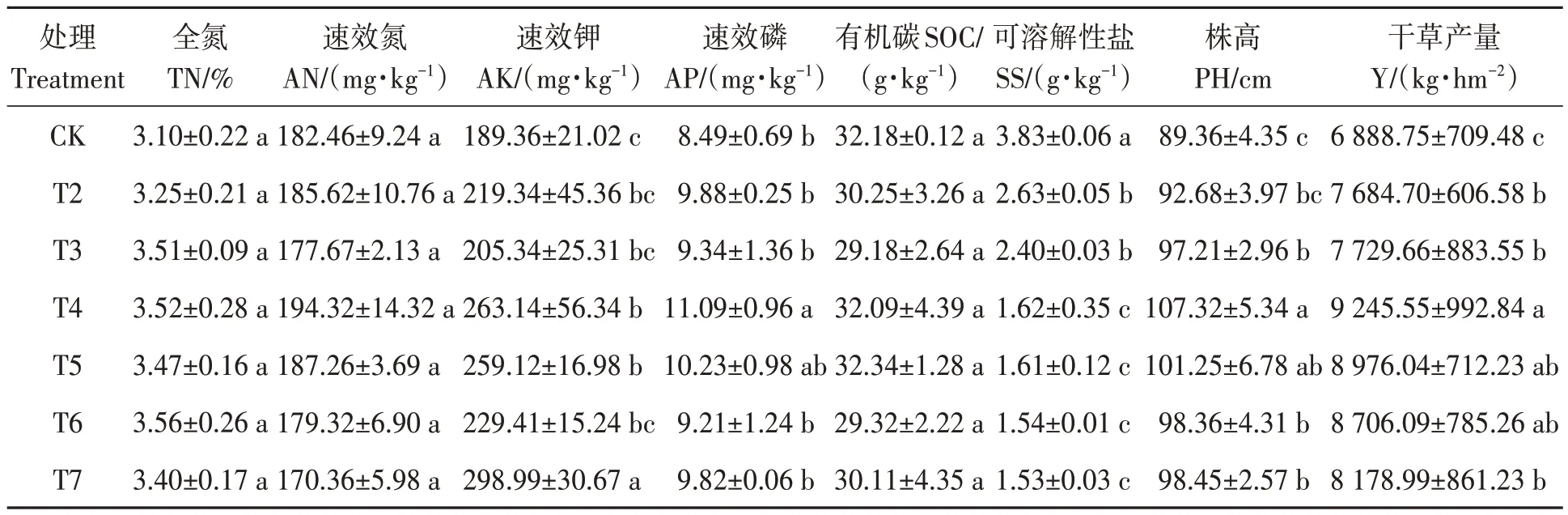
表2 不同处理下土壤理化性质和干草生物量Table 2 Physical and chemical properties of soil and biomass of oats under different treatments
2.2 土壤细菌序列及其多样性指数
利用PacBio平台测序结果显示,所有土壤样品共获得1 605 355个序列读数,基于97%的相似性共获得5 902个OTU,样本文库的覆盖度达99.0%以上。分类学分析将细菌群落划分为28个门,73个纲,187个目,347个科,533个属。
从表3可知,T2和T4处理样品中检测到的OTU数量较CK显著增加14.02%和9.59%。不同施肥处理下饲草燕麦根际土壤细菌群落的Ace指数和Chao 1指数分别表现为:T4>T6>T5>T2、T3、CK和T6、T4>T5>T2、T3、CK;T6处理细菌群落的Shannon指数显著高于除T7处理外的其他处理。
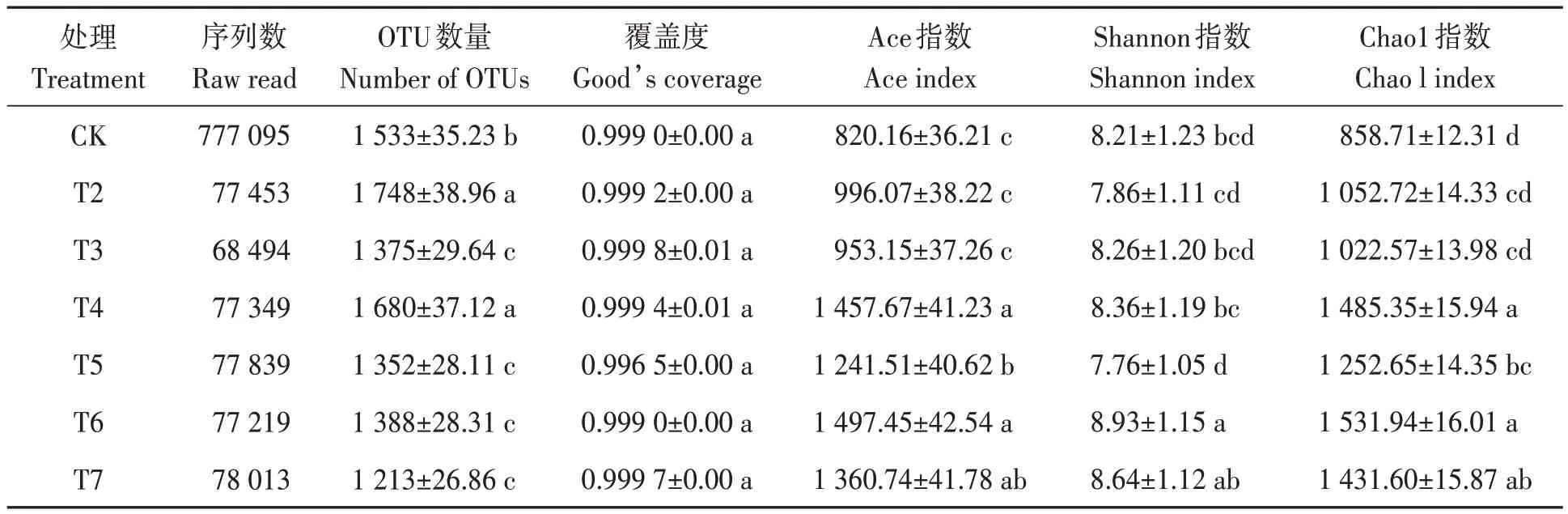
表3 不同改良措施处理下土壤细菌测序及群落α 多样性指数Table 3 Bacterial sequencing and community α diversity index of soil treated with different improvement measures
2.3 不同施肥处理土壤细菌的群落组成
在门水平上,7个处理的土壤细菌群落共检测到28个类群,其中变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、蓝藻细菌门(Cyanobacteria)的相对丰度较高,累计相对丰度在84.81%以上,为优势菌门(图1A)。对不同施肥处理进行比较,变形菌门在T2处理中的相对丰度最高,为40.10%,在T7处理中最低,为20.08%;厚壁菌门在T7处理中的相对丰度最高,为26.08%,显著高于除T6处理外的其他处理;拟杆菌门在 T7、T6和T5处理的相对丰度较CK处理分别提高10.32%、9.78%和9.73%;放线菌门在T4处理中的相对丰度最高,为17.68%,显著高于其他处理;绿弯菌门在T5、T6、T7处理中的相对丰度显著低于CK处理;酸杆菌门在T2处理中的相对丰度最高,为11.14%;蓝藻细菌门在T4处理中的相对丰度最高,为12.06%。
在属水平上,7个处理的饲草燕麦根际土壤细菌群被划分为533个类群,其中相对丰度大于1%的细菌类群包括鞘脂单胞菌属(Sphingomonas)、uncultured_bacterium_c_Subgroup_6、uncultured_bacterium、乳 酸 杆 菌(Lactobacillus)、uncultured_bacterium_f_A4b(图1B)。鞘脂单胞菌属为第1优势菌属,在CK处理中的相对丰度最高,为 5.39%;uncultured_bacterium_c_Subgroup_6在CK、T2、T3处理中的相对丰度较高,均超过5.50%;uncultured_bacterium、乳酸杆菌、uncultured_bacterium_f_A4b在T7和T6处理中的相对丰度较高,显著高于其他处理。
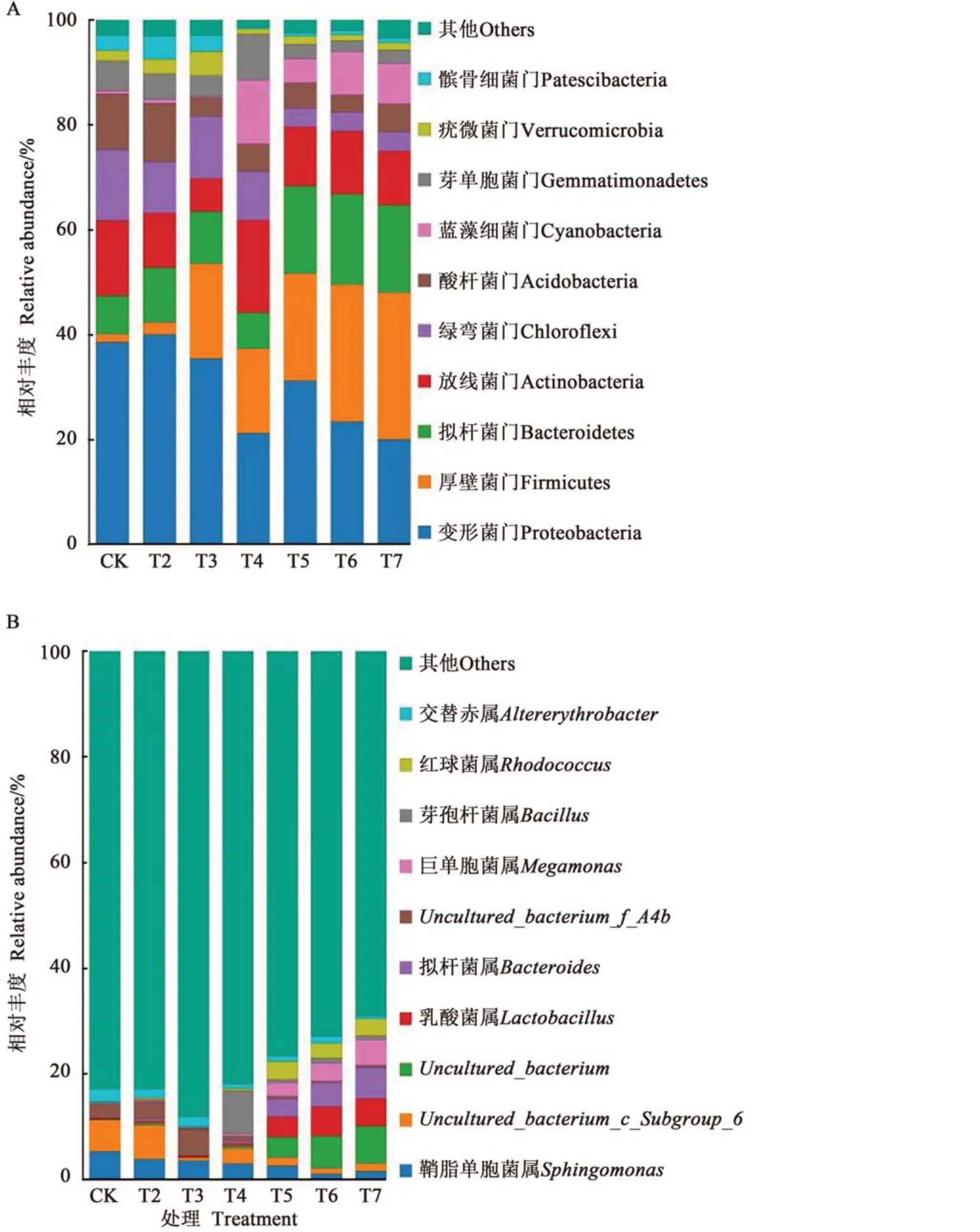
图1 不同施肥处理下细菌的结构组成Fig. 1 Composition and structure of bacterial under different fertilization treatments
2.4 不同处理间细菌的群落差异
主 坐 标 分 析(principal coordinat analysis,PCA)结果(图2)显示,不同施肥处理形成了不同的细菌群落。第1坐标(PC1)物种累积百分比方差占33.36%,第2坐标(PC2)物种累积百分比方差占18.97%,累计52.33%,物种差异可用这2个轴来解释。由图2可知,T4、T5、T6、T7处理与CK、T2、T3处理间差异较大。
为了进一步确定与不同施肥处理相关的特定细菌类群,根据分类学组成,使用线性判别分析效应大小(linear discriminant analysis effect size,LEfSe)比较了7个处理的细菌群落组成。结果(图3)显示,根据设定的筛选标准(LDA>4)共发现58个类群在统计学上有显著差异(P<0.05),其中,T4处理中检测到24个,主要包括放线菌门(微球菌科Microscillaceae)、绿藻门(束鞘藻目、Coleofasciculaceae和念珠藻目Nostocales)和芽单胞菌门(芽孢菌目Bacillales);T5处理检测到21个,包括微菌杆科(Microbacteriaceae)、类芽孢菌科(Paenibacillaceae)等; CK则富集了较多拟杆菌目(Bacteroidales)的细菌菌群。
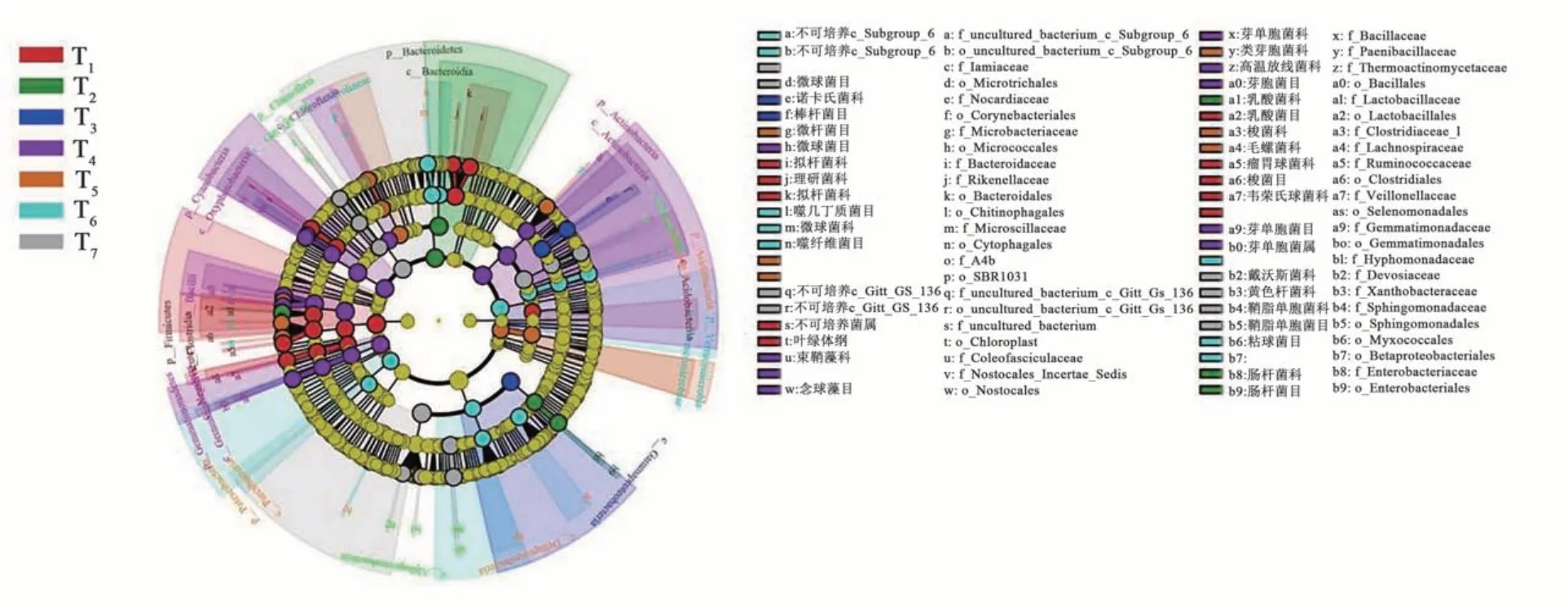
图3 不同改良措施下土壤细菌群落系统发育树Fig. 3 Cladogram of soil bacterial community under different treatments
2.5 不同处理的细菌群落结构与其环境因子的关系
在属水平,采用冗余分析(redundancy analysis,RDA)进一步分析了差异物种与主要环境因子之间的关系,结果(图4)表明,第1个成分(RDA 1)解释了细菌菌群总变异的21.63%,第2个成分(RDA 2)解释了细菌菌群总变异的12.71%,累积解释率34.34%。此外,RDA 表明不同环境因子对细菌群落的影响不同。相关分析结果(表4)表明,TN、AN、SOC和AP含量与戴沃斯氏菌属(Devosia)、交替赤菌属(Alterythrobacter)、芽单胞菌属(Gemmatimonas)、鞘氨醇单胞菌属(Bacilllus Sphingomonas)的相对丰富度呈极显著正相关(P<0.01),与红球菌属(Rhodococcus)、藤黄单胞菌属(Luteimonas)、短波单胞菌属(Brevundimonas)呈显著负相关(P<0.05);AK含量与短波单胞菌属(Brevundimonas)、芽单胞菌属(Gemmatimonas)的相对丰度呈显著正相关(P<0.05),与红球菌属(Rhodococcus)、藤黄单胞菌属(Luteimonas)呈显著负相关(P<0.05)。
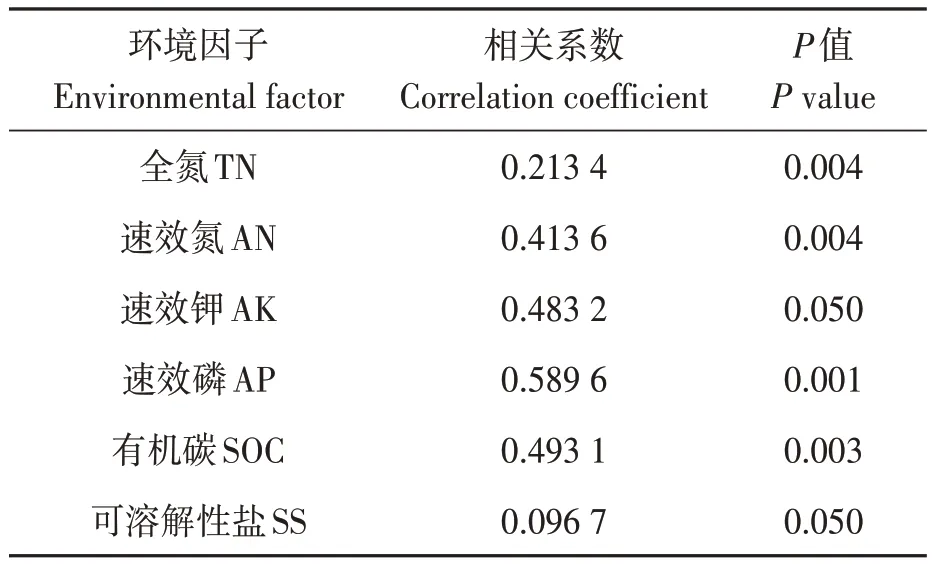
表4 基于属水平的细菌群落和环境因子之间相关分析Table 4 Correlation analysis between bacterial communities and environmental factors at the genus level
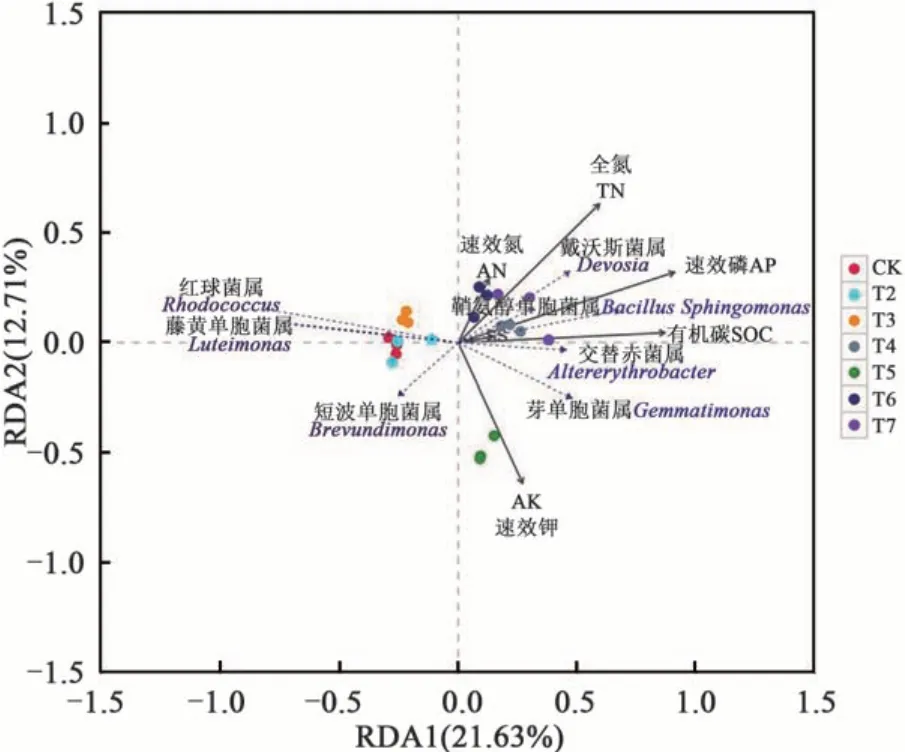
图4 属水平上不同施肥处理下土壤细菌的相对丰度和土壤环境因子间的RDA分析Fig. 4 RDA analysis of soil bacteria relative abundance and among soil environmental factors under different fertilization
3 讨论
人工草地是我国重要的畜牧业生产基地。目前,在人工草地的建植与管理中,化肥施用量偏高,有机肥投入不足,从而造成耕地土壤退化,耕性变差,草产品品质下降等问题。因此,在饲用燕麦的生产过程中探索合理高效的有机-无机配施比例有助于土壤和草地的可持续发展。研究发现,在草地农业生产中增施有机肥可提高土壤中有效钾和有效磷含量[9,11-12];但对土壤全氮、有效氮和有机碳含量影响较小[13-14],这与本研究结果一致。本研究表明,随着有机肥施用量的增加、无机肥施用量的减少,土壤中可溶解性盐含量逐渐降低,表明增施有机肥可有效改善土壤结构,降低土壤中盐分含量;而研究中土壤有机质含量未发生显著变化,可能是有机肥施用时间较短,商丽荣等[9]也得出类似的结论。此外,本研究T4处理下的饲用燕麦株高和生物产量最高,一方面可能是由于施用有机肥改善了土壤生态;另一面该处理下施用的有机、无机肥用量保障了饲用燕麦的正常生长发育,且氮素利用率达到最大化。
农业管理措施(例如施肥)作为对土壤扰动的一种重要方式,也会给微生物群落的生物多样性和丰富度带来显著影响[15-18]。本研究表明,不同比例的无机-有机肥配施对细菌群落的多样性指数和丰富度指数均有明显影响,这可能是因为随着有机肥施用量的增加,改善了土壤结构,促进了有机物的分解,从而影响了微生物种群结构。对微生物群落结构和组成的分析结果表明,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidota)、放线菌门(Actinobacteriota)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteriota)、蓝藻细菌门(Cyanobacteria)为优势菌门,但其在不同处理中的相对丰度又存在差异,与前人研究结果一致[8,19-24]。绿弯菌门(Chloroflexi)含有绿色色素,能够通过光合作用产生能量[9],Lino等[25]研究表明,其菌群数量与植物地上生物量呈显著正相关。酸杆菌门 (Acidobacteriota) 是近年来新分离的细菌类群[8],其作用还有待进一步研究。
土壤微生物群落会在不同程度的扰动下表现出不同的响应策略[8]。本研究也表明,不同处理下土壤细菌的群落组成存在差异,其中Microscillaceae、节杆菌属(Arthrobacter)、芽单胞菌属(Gemmatimonas)、第 三 节 类 芽 胞 杆 菌(Paenibacillaceae)在T4和T5处理中的相对丰度较高,较CK处理的增幅均在5.42%以上;乳酸杆菌(Lactobacillales)是有机物降解的重要参与者,其在T2处理中的相对丰度较高;而Chitinophagales可代谢碳水化合物,是碳代谢的重要参与者[26],其在CK处理中的相对丰度较高。此外,不同无机-有机肥配施处理引起的环境因素变化对不同微生物群的影响不同,土壤TN、AP、SOC和AK含量对细菌群落有着更为显著的影响。
综上所述,无机肥与有机肥按照8∶2的比例配施不仅能够有效降低土壤中可溶解性盐含量,还能提高土壤中有效钾和有效磷含量,且增加土壤细菌群落的多样性指数,使其优势菌群更有利于土壤正向演替,增加植物地上部生物产量。未来,对于不同比例无机-有机肥配施对土壤菌群及微环境的影响机理还有待进一步深入研究。
