高通量技术分析‘砂蜜豆’甜樱桃不同组织内生细菌多样性
2023-05-17赵柏霞闫建芳
赵柏霞, 闫建芳
(1.大连市农业科学研究院,辽宁 大连 116036; 2.大连民族大学生命科学学院,辽宁 大连 116600)
甜樱桃(Prunus aviumL.)源于欧洲,因其果实具有鲜艳的色泽、较高的营养价值及上乘的口感备受消费者喜爱,且其果实发育期短、成熟期早、种植效益高,现已经在全世界范围内广泛栽植。近些年,甜樱桃在中国也发展迅速,种植面积和产量都已经超过世界排名第一的土耳其,成为一些地区的支柱性产业[1]。
植物内生细菌存在于宿主植物组织[2],且表现出多种生物活性,如促生长、抗旱、耐热、抗病虫害、拮抗病原体、溶磷、解钾、固氮等[3-10],还具有降解环境中污染物和生物修复的功能[11-12]。研究表明,植物内生细菌广泛存在于多种粮食作物和水果、蔬菜及药用植物中[13-16],已报道的约有50多个属,上百个种[17]。然而,对于甜樱桃内生细菌方面的研究在国内外鲜有报道。
目前对于甜樱桃内生菌的研究仅停留在分离培养和功能菌株筛选方面,张立新等[18]、郗良卿等[19]在‘红灯’和‘美早’甜樱桃果实中分离到了具有拮抗樱桃病害的内生细菌。郭建伟等[20]在樱桃树皮、1年生枝条及叶片中分离到了21株内生细菌,其中8株具有拮抗流胶病能力,不同组织内生细菌的种群密度表现为树皮(主干)>叶>枝(1年生)。但是,大部分内生菌为不可培养或难以培养,因此,通过传统分离培养方法获得的内生细菌具有较大的局限性,其试验结果不能全面地反映植物内生细菌的群落组成。近年来,高通量测序技术发展突飞猛进,相比传统的分离培养法,该技术具有通量高、速度快、准确性高等优势,可以全面揭示供试微生物的种群结构和多样性。目前,利用高通量测序技术对甜菜、蚕豆种子、棕榈科种子等组织的内生细菌群落进行了研究[21-23],揭示了内生细菌群落在不同物种、不同生长发育时期间都呈现出一定差异。
本试验以‘砂蜜豆’甜樱桃根、主干树皮及1年生枝条为研究对象,采用高通量测序技术,分析大连地区‘砂蜜豆’甜樱桃不同组织内生细菌物种组成、群落结构及多样性的变化规律,旨在更加全面、准确地反映内生细菌在不同组织中的分布和差异,丰富和完善‘砂蜜豆’甜樱桃内生菌资源,为进一步探讨内生菌的抗逆、促生等生态功能提供理论依据。
1 材料与方法
1.1 试验材料
‘砂蜜豆’植株样品采自辽宁省大连市农业 科 学研 究 院 甜 樱桃 试 验园(38°59′32″N,121°25′00″E),砧木为‘马哈利’,树龄7年。从每株上分别取根(SG)、枝条(SZ)和主干树皮(SP)样品,每3棵树样品均匀混样后四分法作为1个重复,每个处理设5个生物学重复。
采集到的样品放入无菌样品袋中,带回实验室。先用自来水流水冲洗10 min,无菌滤纸吸干水分,用75%无水乙醇处理4 min,经无菌水洗涤后,用3%次氯酸钠浸泡5 min,再用无菌水冲洗3~5遍,最后1遍无菌水洗涤液经涂板检测无菌后,无菌条件下进行内生细菌DNA的提取。
1.2 总DNA提取及16S rRNA基因序列扩增
样品总基因组DNA提取根据PowerSoil DNA分离试剂盒(MO BIO Laboratories)操作流程进行。选用通用引物338F和806R扩增16S rRNA V3~V4区,PCR扩增和后续分析在Illumina HiSeq 2500平台(北京百迈客生物科技有限公司)上进行。
1.3 数据处理和统计分析
测序结束后,经过长度过滤、去除嵌合体得到优化序列,然后进行聚类,划分操作分类单元(operational taxonomic unit,OTU),相似性≥97% 的有效序列被聚为相同的OTU。根据OTU的序列组成与微生物参考数据库进行比对,进行物种注释及分类学分析。基于OTU结果,对样品在各分类水平上进行分类学分析。通过Alpha多样性研究单个样品内部物种的多样性,通过Beta多样性来比较不同样品间在物种多样性方面存在的差异 。 采 用 PICRUSt(phylogenetic investigation of communities by reconstruction of unobserved states)软件进行功能和代谢途径预测,将现有的16S rRNA基因测序数据与KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库对比,比较功能基因在生物代谢通路上的丰度差异,从而获得‘砂蜜豆’甜樱桃不同组织内生细菌群落功能预测信息[24]。
2 结果与分析
2.1 甜樱桃不同组织内生细菌多样性指数
从供试样品中共获得有效序列9 665 813条,每条序列平均长度401.07 bp。供试样品Alpha多样性指数如表1所示。根部样品内生细菌的Shannon指数、Simpson指数、Chao1指数和ACE指数均高于主干树皮和枝条,而主干树皮和枝条样品间无显著差异。因此,大连地区‘砂蜜豆’甜樱桃不同组织部位内生细菌以根部多样性及丰富度最高,其他组织部位的多样性及丰富度减少。
2.2 甜樱桃不同组织内生细菌OTU 分布
在97%的序列相似度下,‘砂蜜豆’甜樱桃3个组织部位的内生细菌共划分为1 386个OTUs(图1)。3个组织部位获得的OTU 数量分别为1 302(SG)、1 301(SP)和1 229(SZ),各部位样品中获得的OTU数量差异不显著;其中,共有OTU分别占各部位内生细菌OTU总量的86.3%、86.4%和91.5%,由此表明,3个组织样品中共有的OTU占比较高,特有的OTU占比较少。‘砂蜜豆’甜樱桃不同组织间特有的内生细菌群落组成有着较大差异,部分细菌种群表现出组织专一性。其中,根部内生细菌的特有OTU 数量最多,为36个;枝条和树皮中分别为17和11个。除共有物种和特有物种外,不同组织间均有相同或相似物种。
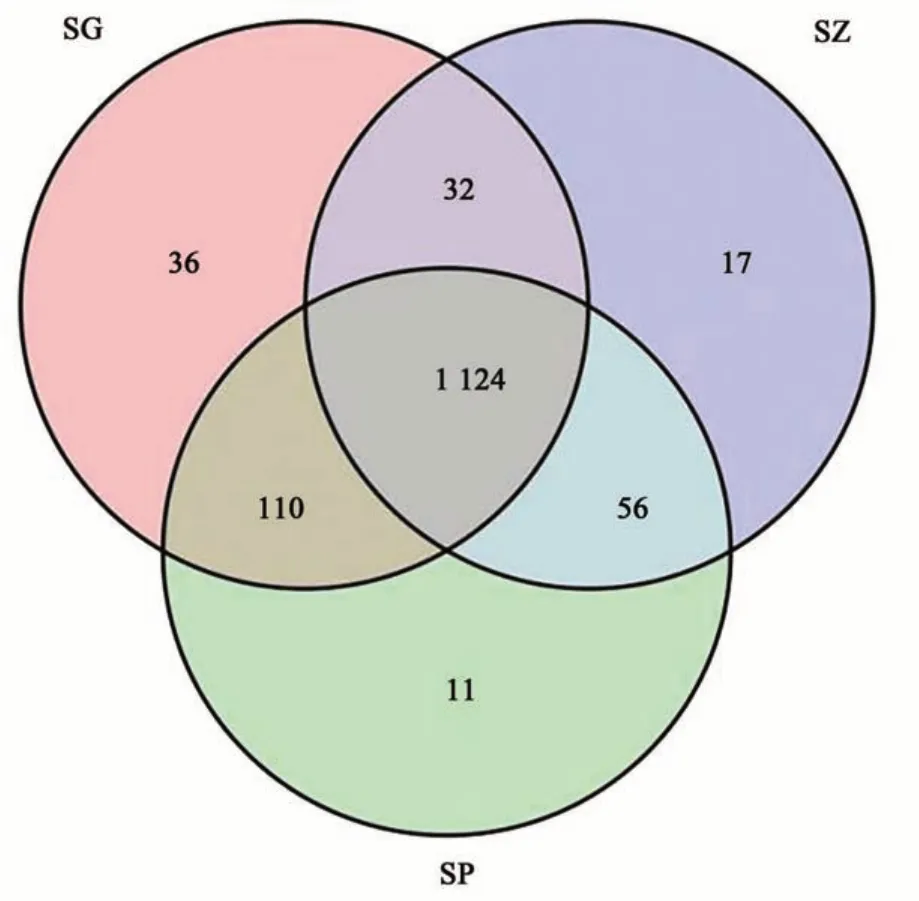
图1 甜樱桃3个组织部位内生细菌OTU 水平韦恩图Fig. 1 Venn of endophytic bacteria at OTU level in three tissues of sweet cherry
2.3 甜樱桃不同组织部位细菌的组成和群落结构
‘砂蜜豆’甜樱桃3个组织部位的样品共检测到20个门、43个纲、79个目、162个科和346个属,不同组织中的各级细菌分类阶层总数也存在差异,其中,根中的内生细菌种类最多;枝条次之;主干树皮的内生细菌种类最少(表2)。
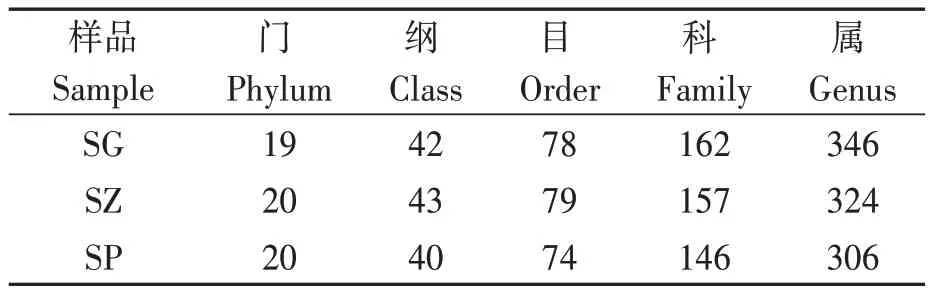
表2 ‘砂蜜豆’甜樱桃不同组织内生细菌群落细菌学分类阶层总数Table 2 Total numbers of bacterial taxa detected in different tissues of ‘Summit’
在门水平上,对于丰度高于0.1%的门进行统计(图2),其中变形菌门(Proteobacteria)是‘砂蜜豆’甜樱桃内生细菌的最优势菌门,在SG、SP和SZ中的相对丰度分别为49.76%、60.34%和55.06%;其次是厚壁菌门(Firmicutes)(平均丰度18.49%)、拟杆菌门(Bacteroidetes)(平均丰度12.18%)及放线菌门(Actinobacteria)(平均丰度10.71%)。这4个菌门的相对丰度达95%以上。而不同组织部位内生细菌的组成比例也存在一定差异,放线菌门在SG中的相对丰度为22.61%,明显高于SZ和SP(3.71%和5.81%);厚壁菌门在SG中的相对丰度为13.96%,明显低于SZ和SP(24.02%和17.49%)。从门水平上的物种组成可以看出,‘砂蜜豆’甜樱桃不同组织间内生细菌的群落组成具有一定差异。
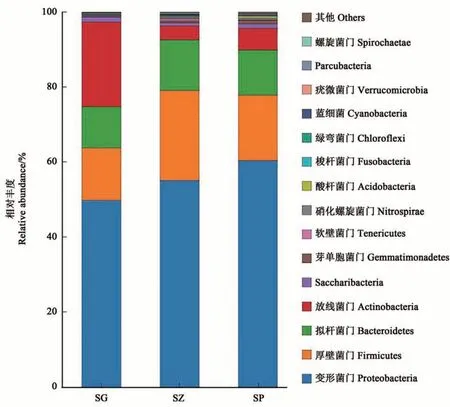
图2 3个组织部位内生细菌门水平上物种组成Fig. 2 Abundance of endophytic bacteria at phylum level in three tissues of sweet cherry
在纲水平,α-变形菌纲(Alphaproteobacteria)是3个组织部位内生细菌的优势菌纲(图3),但在不同组织部位中的相对丰度存在差异,其中,在SP中的相对丰度最高(43.14%);在SZ中次之(39.04%);在SG中最低(27.24%)。除α-变形菌纲外,放线菌纲在SG内生细菌中的相对丰度也较高,为20.26%,而在SP和SZ中的相对丰度则较低,分别为4.14%和2.79%。
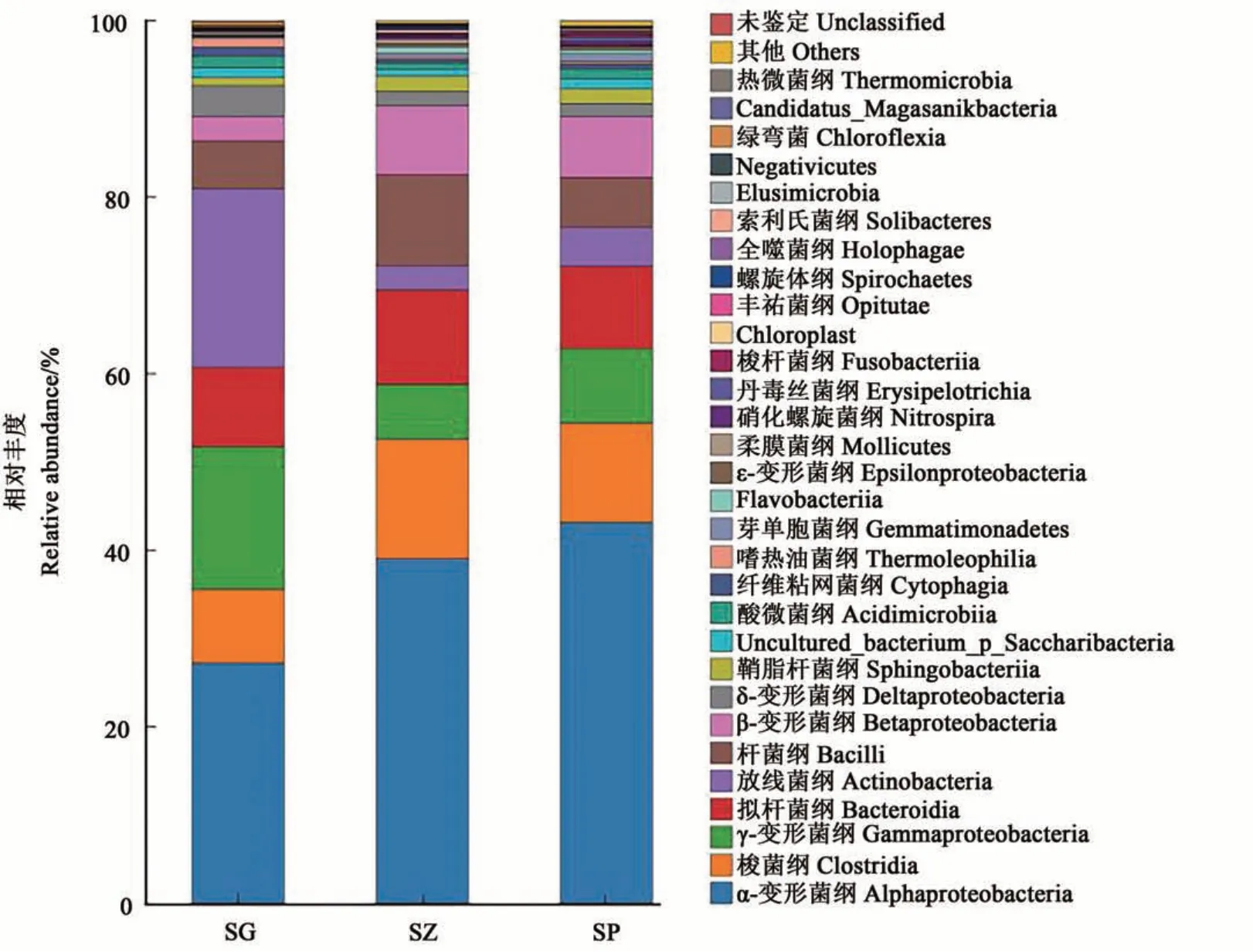
图3 3个组织部位内生细菌纲水平上物种组成Fig. 3 Abundance of endophytic bacteria at class level in three tissues of sweet cherry
在属水平上,供试样品中未知种类菌属的相对丰度最高(图4)。在SG中,除未知菌属外,链霉菌属(Streptomyces)的相对丰度较高,为6.10%;其次为类固醇杆菌属(Steroidobacter)(5.62%)和乳酸杆菌属(Lactobacillus)(4.67%)。在SZ中,鞘氨醇单胞菌属(Sphingomonas)的相对丰度较高,为7.71%,但其在SP和SG中的相对丰度较低,分别为3.13%和2.76%。在SP中,拟杆菌属(Bacteroides)的相对丰度较高。
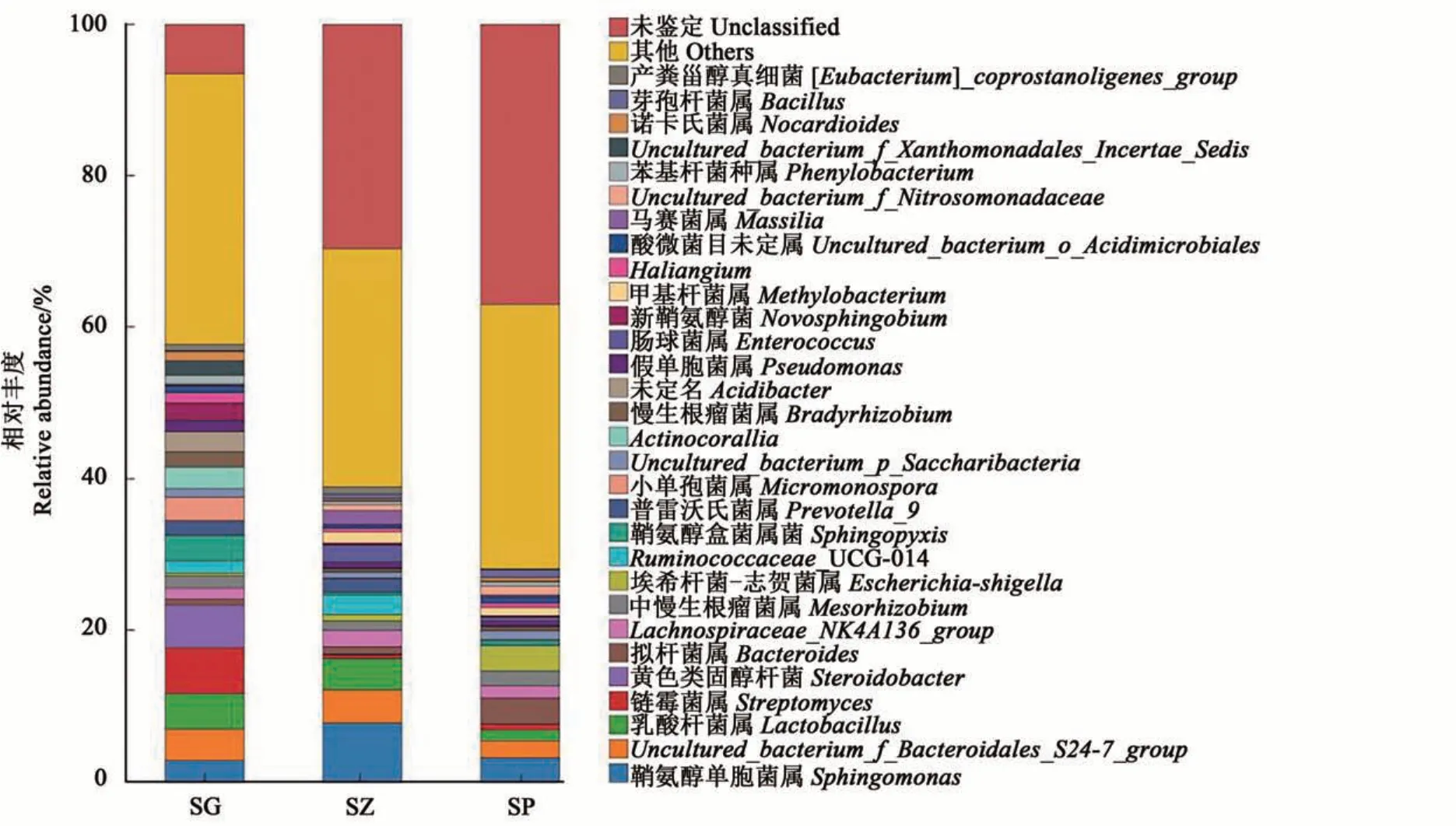
图4 3个组织部位内生细菌属水平上物种组成Fig. 4 Abundance of endophytic bacteria at genus level in three tissues of sweet cherry
2.4 甜樱桃不同组织内生细菌差异分析
为进一步探究甜樱桃不同组织内生细菌的差异,对供试样品进行了LEfSe(line discriminant analysis effect size)分析,在SG中,具有显著差异的菌门是变形菌门和放线菌门;在SZ中,具有显著差异的菌门为厚壁菌门;在SP中,具有显著差异的菌门为变形菌门(图5)。由此表明,甜樱桃不同组织部位内生细菌的菌群存在显著差异,以根部内生细菌最为丰富。

图5 各样品细菌差异LEfSe 分析图Fig. 5 Bacterial taxa significantly differentiate responding to the different tissues using LEfSe
设定LDA(line discriminant analysis)值>4条件下,SG内生细菌有30个差异显著单元;SZ的差异显著单元为7个;SP的差异显著单元最少,仅2个(表3)。SG内生细菌差异显著单元中有19个分布在变形菌门,其中黄单胞菌目(Xanthomonadales)9个,根瘤菌目(Rhizobiales)3个,鞘脂单胞菌目(Sphingomonadales)3个,红螺菌目(Rhodospirillales)2个,粘球菌目(Myxococcales)1个;11个分布在放线菌门,其中链孢囊菌目 (Streptosporangiales) 3个,小单孢菌目(Micromonosporales) 3个,链霉菌目(Streptomycetales) 3个。SZ内生细菌的7个差异显著单元中6个分布在厚壁菌门,1个为拟杆菌门,其中厚壁菌门中4个属于乳酸杆菌目(Lactobacillales),另2个属于肠球菌科(Enterococcaceae)。SP内生细菌的2个差异显著单元均为变形菌门的根瘤菌目(Rhizobiales)。

表3 LEfSe统计检验结果Table 3 Results of LEfSe statistical test

表3 LEfSe统计检验结果Table 3 Results of LEfSe statistical test 续表 Continued

表3 LEfSe统计检验结果Table 3 Results of LEfSe statistical test 续表 Continued
2.5 3个组织部位内生细菌群体聚类分析
采用非度量多维标定法(non-metric multidimensional Scaling,NMDS)比较甜樱桃3个不同组织部位样本间群落结构的相似性,如图6所示。NMDS1把SG、SP和SZ分成不同的组。SP组样品中的2个样品点有些偏离,没有聚到SP组,这说明取样时具有一定的误差,但是该图的胁强系数为0.137 6(<0.2),说明该分析具有一定的可靠性,可以解释样品中所含内生细菌的真实情况。由此表明,‘砂蜜豆’甜樱桃根部组织内生细菌与主干树皮和枝条部位的内生细菌存在明显差异,而主干树皮的内生细菌群落与枝条的内生细菌群落更为相近。
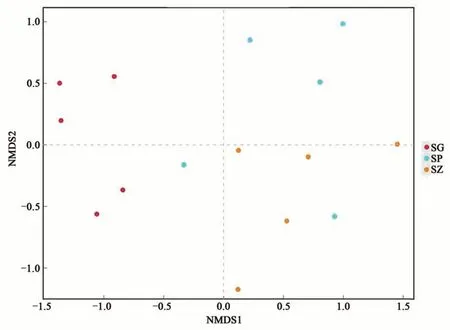
图6 甜樱桃内生细菌的NMDS二维排序图Fig. 6 Two-dimensional sorting map of endophytic bacteria in sweet cherry by NMDS analysis
2.6 不同组织甜樱桃内生细菌功能基因预测
采用PICRUSt 软件预测内生细菌的功能基因,所有基因序列注释的功能可以分为6大类,主要涉及新陈代谢、遗传信息处理、环境信息处理、人类疾病、细胞过程及有机系统。其中,新陈代谢相关基因的数量最多,占总数的73.45%~75.18%,主要包括碳水化合物、氨基酸、能量、辅酶因子和维生素、类脂物代谢等。环境信息处理相关基因的数量占总基因数的8.0%~9.83%,主要涉及膜运输和信号传导。遗传信息处理相关基因的数量占总基因数的8.35%~9.04%,主要为复制、修复机制及翻译机制。
3 讨论
本文利用高通量测序技术分析了‘砂蜜豆’甜樱桃内生细菌的群落特征及不同组织部位间的差异,结果表明,‘砂蜜豆’甜樱桃不同组织的内生细菌具有丰富的多样性,且不同组织部位中的群落结构存在差异,其中根部内生细菌的多样性以及丰富度最高,且特有OTU数量也较多;主干树皮和枝条部位的多样性及丰富度较低。内生菌是由土壤、空气中微生物入侵宿主,然后与宿主协同进化而来,这些因素共同造成了内生细菌分布的专一性。变形菌门(Proteobacteria)是3个组织部位内生细菌的最优势菌门,在根部、主干树皮、枝条中的相对丰度分别为49.76%、60.34%和55.06%。变形菌门在植物体内广泛分布,其物种和遗传多样性极为丰富,已应用于植物病虫害防治、土壤修复、生物固氮等方面[25-27]。厚壁菌门、拟杆菌门和放线菌门在3个组织中相对丰度也较高,其中放线菌门在根中相对丰度明显高于在其他部位,而厚壁菌门在根部的相对丰度较低。芽孢杆菌是厚壁菌门中一类在自然界中分布广泛的革兰氏阳性化能异养菌,在水产养殖、发酵饲料添加剂以及植物病虫害生物防治方面应用较多[28-29]。放线菌门细菌是一类非常重要的生防微生物,可以在生长过程中产生大量且种类繁多的抗生素[30]。
在属水平上,未分类细菌的相对丰度最高,这说明甜樱桃中含有丰富的未知种类细菌。除未知细菌外,在根部样品中,链霉菌属的相对丰度最高;在枝条样品中,鞘氨醇单胞菌属的相对丰度最高;在主干树皮样品中,拟杆菌属和鞘氨醇单胞菌属的相对丰度较高。链霉菌、鞘氨醇单胞菌、乳酸杆菌及芽孢杆菌在‘砂蜜豆’甜樱桃各组织中的相对丰度均较高,这可能是由于他们均具有抗逆、促生等性能,可促进甜樱桃的生长和防治病虫害。菌群丰度变化为挖掘甜樱桃具有特定应用价值的微生物种资源指明了方向。研究表明,链霉菌属在细菌界中不仅数量最多,而且也是产生生物活性物质种类最多的一类细菌[31],该属的功能主要有分泌多种具促生长和拮抗病原菌的代谢物、增强植物抗逆性、改善土壤结构等[32]。近年来,各国学者不断研究挖掘新的天然生物活性物质,鞘氨醇单胞菌是报道较多的一种重要微生物资源,它能够合成生物聚合物、降解芳香族化合物,在环境生物领域显现出巨大潜力[33-34];芽孢杆菌具有产生生长素、解磷、解钾、固氮及抗菌等功能[35];乳酸杆菌则具有拮抗病原菌、降解污染物等功能[36-37]。此外,在不同组织中还含有大量未知种属的微生物类群,这些未知微生物类群为挖掘在促生、抗逆、土壤修复、环境、医药等方面有重要应用价值的新有益微生物资源提供了广阔发展空间。
研究发现,植物内生细菌群落变化动态受多方面因素的影响,包括宿主植物种类[38-39]、宿主植物生长发育阶段[16,40]、地理位置及宿主植物组织器官[41]等。本研究通过NMDS分析表明,‘砂蜜豆’甜樱桃组织器官类型影响内生细菌的群落组成,主干树皮和枝条部位内生细菌的群落结构更为相近,而根部组织内生细菌与其他2个部位的内生细菌群落结构则具有明显差异。这与郭建伟等[20]研究结果一致,表明甜樱桃组织部位是影响其内生细菌种群结构与多样性变化的因素之一。
PICRUSt基因功能预测分析表明,甜樱桃内生细菌中与新陈代谢相关的功能基因相对丰度最高,在其生长过程中发挥着重要作用。由于甜樱桃果实中含有丰富的糖类、有机酸、维生素和微量元素[42],因此,其内生细菌基因功能涉及氨基酸类、脂类、多糖、维生素、萜类、酮类及其他次生代谢产物合成等有关通路。这说明甜樱桃内生细菌可能参与甜樱桃中各种营养物质的代谢,为植株生长发育提供必需的养分[43]。因此,通过获得不同组织中内生细菌与甜樱桃中有效化学成分合成的相关信息,为协调甜樱桃中营养成分的生物合成和运输分解、充分挖掘甜樱桃的内生细菌资源、提升其果实品质提供参考依据。根部组织中调控各种代谢的内生细菌物种的相对丰度较高,这与群落多样性研究结果一致。
此外,本研究表明,‘砂蜜豆’甜樱桃不同组织部位内生细菌的群落构成有着较大差别,同时又有着一定的共性,各组织内均存在大量的未知菌种,这给微生物资源挖掘和差异基因的功能分析提供了新的资源和线索,值得进一步深入研究。后续研究将在本研究基础上,通过改良菌株培养基成分、培养方法等手段,尽可能多的分离出这些内生细菌菌株,对其进行功能评价,发掘和筛选在促生效应、病虫害生物防治以及环境治理等方面具有较大应用潜力的微生物菌株。
