肾阳虚带状疱疹后遗神经痛大鼠模型的建立与评价
2023-05-16丘雅丹黄佳敏付梦思
丘雅丹,谢 芳,黄佳敏,付梦思,唐 挺,2★
(1.贵州中医药大学,贵州 贵阳 550002;2.贵州中医药大学第一附属医院皮肤科,贵州 贵阳 550001)
带状疱疹后遗神经痛(postherpetic neuralgia,PHN)是一种复杂且特殊的慢性神经病理性疼痛,其发病机制非常复杂,目前仍未完全阐明。诸多研究表明,中医药单独使用或与其他疗法联合使用,在临床痛症相关疾病的治疗中发挥着重要作用。建立合理、科学、可行的中医证候疾病模型,有助于基于中医基础理论深入探究疾病的发病机制。本研究为更好地模拟临床患者体质,拟构建肾阳虚PHN 大鼠模型,并对其进行评价。
1 材料与方法
1.1 实验动物及分组
SD 健康雄性大鼠30 只,SPF 级,体重300 ~350 g/只,购自长沙市天勤生物技术有限公司,动物许可证号:SCXK(湘)2019-0014。将大鼠分笼饲养,自由饮食,室内湿度、温度恒定,12 h/12 h 明暗周期。适应性饲养1 周后进行耳钉标记编号,称取并记录大鼠的体重。随机将大鼠分为空白对照组和模型组,每组各15 只。
1.2 实验主要药品及试剂
甲巯咪唑片〔默克制药(江苏)有限公司,进口药品注册证号J20171078〕;Vero 细胞(非洲绿猴肾细胞)(武汉普诺赛生命科技有限公司,CL-0242);苏木素- 伊红(HE)染液;cAMP ELISA Kit(武汉伊莱瑞特生物科技股份有限公司);cGMP ELISA Kit(武汉伊莱瑞特生物科技股份有限公司)。
1.3 实验主要仪器
10 μL 微量注射器(Hamilton);Von Frey 电子测痛仪(上海玉研科学仪器有限公司);YLS-21A 型智能冷热板测痛仪(天津诺雷信达科技有限公司);RM2235 石蜡切片机(德国徕卡公司);CO2培养箱(美国Thermal Fisher Scientific 公司)。
2 实验方法
2.1 无细胞水痘-带状疱疹病毒(VZV)悬液的制备
当镜下观察到Vero 细胞贴壁生长且形态正常,细胞密度达80% 时,加入VZV 标本液,吸附2 h 后,加入含有2% FBS 的MEM 完全培养基,每日观察Vero 的形态变化。当80% 细胞出现致细胞病变效应(Cytopathic effect,CPE)时,用细胞刮将细胞刮下,并用移液器进行吹打,随后分装收集至冻存管中,置于-80 ℃冰箱中反复冻融3 次后收集培养液,在4 ℃下离心30 min(转速3500 r/min),收集上清液即得无细胞病毒悬液。采用蚀斑法检测VZV 滴度后,置于-80 ℃冰箱中贮藏、备用。
2.2 肾阳虚PHN 大鼠模型的构建
首先参照文献[1-2]中的方法,给予模型组大鼠甲巯咪唑混悬液10 mg/kg(溶液现用现配)灌胃,给药体积为10 mL/kg;给予空白对照组大鼠同体积生理盐水灌胃。连续灌胃15 d 后,评估并筛选出建立成功的肾阳虚大鼠模型,同时参照文献[3]中的方法构建肾阳虚PHN 大鼠模型:运用自制大鼠固定器固定好大鼠后,暴露大鼠右后足,用微量注射器于大鼠右足蹼底部皮下注射50 μL 病毒接种液,空白对照组大鼠右足蹼底部皮下注射50 μL 生理盐水。
2.3 肾阳虚PHN 大鼠模型的评估
2.3.1 一般情况观察及肾阳虚动物模型症状体征的评价 参照肾阳虚动物模型症状体征评估[4]标准,密切观察两组大鼠的一般情况,包括精神状态、活动情况、皮毛状态、饮食饮水、二便等情况,并记录。
2.3.2 大鼠体质量及肛温的测量 分别于肾阳虚大鼠模型建立前及造模完成后,称量并记录两组大鼠的体质量,并采用电子肛温仪对其肛温进行测量。
2.3.3 肾阳虚动物模型客观指标的检测 末次灌胃结束且禁食12 h 后,经腹腔注射10%水合氯醛(0.3 mL/100 g)麻醉,用一次性无菌采血针采集股静脉血,静置20 min 后于4 ℃下离心15 min(转速3000 r/min),收集上清血浆,采用酶联免疫吸附(ELISA)法及配套的试剂盒检测血浆中的cAMP、cGMP 水平,并计算cAMP/cGMP。
2.3.4 大鼠疼痛行为学检测 分别于建模前及注射VZV 悬液后的第3、7、14、21、28 d,在观察完各组大鼠的一般情况后,运用Von Frey 电子测痛仪测量各组大鼠的机械缩爪阈值(PawWithdrawalThreshold,PWT)和热撤回潜伏期(ThermalWithdrawalLatency,TWL;也叫热痛缩足阈值)。
2.3.4.1 PWT 检测(Von Frey 试验)参照Vivancos 等[5]的方法,将各组大鼠分批放入带丝网层的塑料笼中,等待30 min 让其安静,然后使用Von Frey 电子测痛仪以“上、下”的方法,刺激大鼠的后爪内侧皮肤,力度为使大鼠脚爪轻度弯曲,持续1.5 s,当大鼠出现嘶吼、舔足、甩尾及弹腿任一行为时即为阳性疼痛反应,记录此时电子Von Frey 测痛仪的数值,该数值即为PWT。每只大鼠均重复测量3 次,中间间隔5 min,将3 次测量的平均值作为PWT。
2.3.4.2 TWL 检测(热痛敏试验)参照Hargreaves 等[6]的方法,测量各组大鼠的TWL。每次PWT 测量结束30 min 后,将各组大鼠分批置于智能冷热板测痛仪上,温度保持为(50±2)℃。当大鼠出现后爪抬起、舔足及甩尾任一行为时,记录此时大鼠在热板上所用的时间,该时间即为TWL。每只大鼠均重复测试3 次,中间间隔10 min,取其平均值。
2.3.5 大鼠脊髓组织病理形态的观察 在注射VZV 悬液3 d 后,每组随机抽取5 只大鼠进行脊髓组织的采集,并进行HE 染色。
3 统计学方法
使用SPSS 26.0 软件及GraphpadPrism9 程序进行统计分析,计量资料用均值± 标准差(±s)表示,P<0.05 认为差异具有统计学意义。
4 结果
4.1 一般情况观察
4.1.1 肾阳虚动物模型症状体征的评价结果 在实验过程中,空白对照组大鼠精神状态良好,活动机警灵敏,皮毛光亮柔顺,饮食、饮水及二便均无异常表现。造模完成后,模型组大鼠与空白对照组大鼠比较,出现精神萎靡、毛色枯燥、喜扎堆蜷缩等表现。
4.1.2 两组大鼠造模前后体质量的比较 空白对照组、模型组大鼠造模前的体质量比较(P>0.05)。造模后,模型组大鼠的体质量较空白对照组低,其体质量总增长量显著小于空白对照组大鼠(P<0.05)。详见表1。
表1 两组大鼠造模前后体质量的比较(g,± s)

表1 两组大鼠造模前后体质量的比较(g,± s)
注:*与空白对照组比较,P <0.05。
组别 造模前体质量 造模15 d 后体质量 体质量总增长量空白对照组(n=15)332.60±9.95 486.20±29.46 153.60±20.47模型组(n=15)335.30±8.45 422.70±30.28* 95.00±13.57*
4.1.3 两组大鼠造模前后肛温的比较 造模前,两组大鼠的肛温比较(P>0.05)。造模后,与空白对照组大鼠比较,模型组大鼠的肛温显著降低(P<0.05)。详见表2。
表2 两组大鼠造模前后肛温的比较(℃,± s)
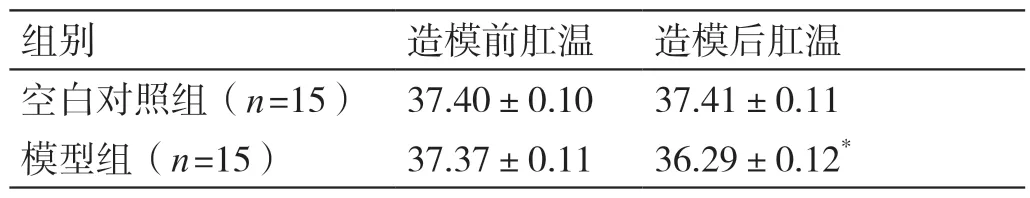
表2 两组大鼠造模前后肛温的比较(℃,± s)
注:*与空白对照组比较,P <0.05。
组别 造模前肛温 造模后肛温空白对照组(n=15)37.40±0.10 37.41±0.11模型组(n=15)37.37±0.11 36.29±0.12*
4.2 两组大鼠血浆中cAMP、cGMP 含量的比较
采用ELISA 法检测两组大鼠血浆中cAMP 和cGMP 的含量,结果显示,与空白对照组大鼠比较,模型组大鼠的血浆cAMP 含量、cAMP/cGMP 显著降低,血浆cGMP 含量显著升高(P<0.05)。详见表3。
表3 两组大鼠血浆中cAMP、cGMP 含量的比较(± s)

表3 两组大鼠血浆中cAMP、cGMP 含量的比较(± s)
注:*与空白对照组比较,P <0.05。
组别 cAMP(pmol/mL)cGMP(pmol/mL)cAMP/cGMP空白对照组(n=15)15.79±1.22 2.77±0.26 5.75±0.71模型组(n=15)9.48±2.42* 6.24±0.42* 1.52±0.36*
4.3 两组大鼠PWT 的比较
注射VZV 之前(D0),两组大鼠的PWT 比较(P>0.05)。VZV 注射3 d 后,与空白对照组大鼠相比,模型组大鼠的 PWT 明显降低(P<0.05)。第7 ~14 d,模型组大鼠的PWT 下降最快(P<0.05),至第21 d 时,模型组大鼠的PWT 降至最低(P<0.05)。空白对照组大鼠的PWT 在观察期内无明显变化(P>0.05)。详见图1。
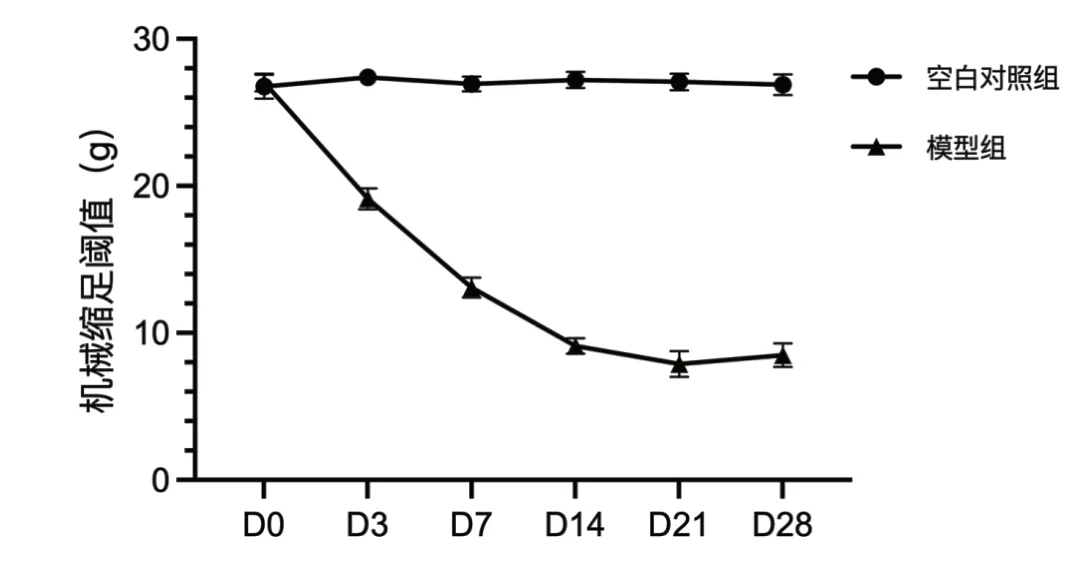
图1 两组大鼠PWT 的比较
4.4 两组大鼠TWL 的比较
注射VZV 之前(D0),两组大鼠的TWL 比较(P>0.05)。VZV 注射3 d 后,与空白对照组大鼠相比,模型组大鼠的TWL 明显降低(P<0.05)。第7 ~14 d,模型组大鼠的TWL 下降最快(P<0.05),至第21 d 时,模型组大鼠的TWL 降至最低(P<0.05)。空白对照组大鼠的TWL 在观察期内无明显变化(P>0.05)。详见图2。
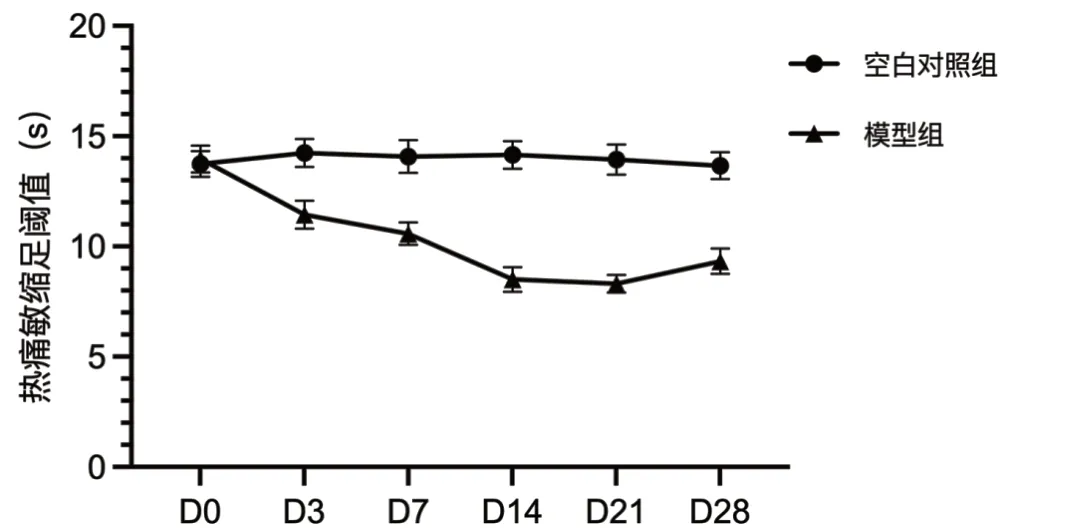
图2 两组大鼠TWL 的比较
4.5 大鼠脊髓组织病理形态学的观察
模型组:可见髓鞘变性肿胀,脂质空泡形成,并可观察到病毒感染神经元的包涵体,呈嗜酸性、散在的、局部的炎症细胞浸润,小灶性出血;空白对照组:可见脊髓正常神经细胞及胶质细胞,血管出血并见少量散在的炎症细胞浸润。如图3 所示。
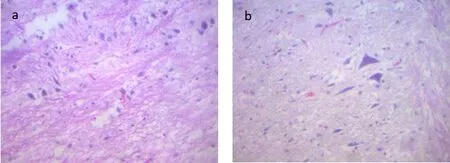
图3 大鼠的脊髓组织病理切片
5 讨论
目前,构建肾阳虚大鼠模型的方法主要有中医传统病因法、药物造模法、手术造模法和多因素联合造模法[7-8]。其中,药物造模和手术造模主要是通过药物或手术手段使大鼠对应的靶腺体功能紊乱[9],从而达到造模的目的。与手术造模相比,药物造模操作相对简单,且大鼠的伤亡率低,故应用较为广泛。在药物造模方法中,常用的药物包括糖皮质激素、抗甲状腺药、性激素、羟基脲和腺嘌呤等[1]。本研究结合研究目的及药物对PHN 的影响,选择甲巯咪唑灌胃的方式建立肾阳虚大鼠模型,并在此基础上进行PHN 大鼠模型的构建。PHN 大鼠模型目前主要有VZV 模型、树脂毒素(Reziniferatoxin,RTX)模型、Ⅰ型单纯疱疹病毒(HSV-1)模型、氯仿皮肤痛敏模型及猴水痘病毒(Simian Varicella virus,SVV)模型,其中应用较多的是VZV 模型、RTX 模型[10]。Fleetwood-Walker 等[11]在前人研究的基础上,单次将高滴度VZV 接种到大鼠足垫中,发现大鼠出现了可测量和长期存在的疼痛行为指标,其中大鼠出现的长期行为变化模拟了PHN 发生后机械性异常疼痛及热痛觉过敏的特征,而这种造模方式现已被许多的研究小组成功复制。另外,在大鼠的胡须垫中接种VZV 也会出现可测量的疼痛指标,但考虑到疼痛发生的部分及检测方式受限,故本研究中不采用此种造模方式。将RTX 注入大鼠单侧腹膜内建立的神经病理性疼痛动物模型也可以缓慢形成机械痛觉过敏及异常疼痛,也具有热痛觉阈值升高且不能用抗病毒药物进行拮抗的特点。似乎该模型更适合作为PHN 的理想动物模型,但是其发病因素很难解释PHN 的病因和诱发因素。因此,本实验选择参照Dalziel 等[3]的方法,在肾阳虚大鼠模型的基础上,于大鼠足蹼部位接种VZV,并观到类似的结果,大鼠出现了持续性的痛觉过敏,且异常痛敏持续至第28 d 左右。
综上所述,通过甲巯咪唑灌胃15 d 联合大鼠足蹼部注射VZV 构建肾阳虚PHN 大鼠模型是可行的。
