雌性红莱菔及莱菔叶浓缩原粉溶解痛风石的效果观察
2023-05-16赵云玲索德宝程立岩张瑞君
赵云玲,索德宝,程立岩,张瑞君★
(1.沈阳和平抗风竤中医门诊部,辽宁 沈阳 110001;2.沈阳抗风竤痛风研究院,辽宁 沈阳 110001)
痛风石是一种沉积在关节附近的以尿酸盐结晶为主要成分的结节[1]。一般来说,有8 年以上痛风病史的患者,有50% 会形成痛风石[2-3]。痛风石不仅会破坏关节外形的美观,还会影响关节功能,甚至引起关节破坏、强直等严重后果[4]。目前,尚没有针对痛风石的特效药,现行的有溶解痛风石效果的药物不但效果不明显,还容易对患者的其他器官产生损伤[5]。田驰等[6]报道雌性红莱菔浓缩原粉能减轻急性痛风性关节炎(AGA)模型大鼠踝关节的肿胀度。梁再赋等[7]报道红莱菔浓缩原粉能减轻AGA 模型大鼠踝关节的炎症反应。张汭钧等[8]报道雌性红莱菔具有溶解痛风石的效果。本研究采用雌性红莱菔及莱菔叶浓缩原粉对已形成痛风石的痛风患者进行治疗,观察其溶解痛风石的效果,现将研究过程及结果报道如下。
1 资料与方法
1.1 临床资料
选取2020 年度来我门诊就诊的第一跖趾关节有痛风石的痛风患者63 例为研究对象,以随机数字表法将其分为对照组、试验组和联合组,每组各21 例。三组患者的性别、年龄、病程资料详见表1,组间比较差异无统计学意义(P>0.05),可进行对照研究。本研究通过痛风研究院医学伦理委员会审核。
表1 三组患者基本资料的比较
1.2 诊断标准
参照《中国高尿酸血症与痛风诊疗指南(2019)》[9]和《痛风和高尿酸血症病证结合诊疗指南》[10]制定本研究的诊断标准:(1)有痛风伴痛风石病史,且痛风石出现在跖趾关节;(2)受累关节肿胀、疼痛、活动受限,病情严重者可出现关节变形、皮肤感染、皮肤溃烂等;(3)生化检查时,血尿酸值超过420 μmol/L;(4)X 线检查可见受累关节周围骨质缺损、不整齐或双源CT 检查可见痛风石。
1.3 纳入标准
依据《中药新药临床指导原则》[11],并结合本研究的实际情况,制定如下纳入标准:(1)病情符合上述诊断标准;(2)有痛风病史5 ~15 年;(3)第一跖趾关节有一个明显痛风石,其他部位无明显痛风石;(4)病情未处于急性发作期;(5)年龄为20 ~60 岁;(6)性别不限;(7)自愿加入本研究,且签署知情同意书。
1.4 排除标准
依据《中药新药临床指导原则》[11],并结合本研究的实际情况,制定如下排除标准:(1)病情处于急性发作期,第一跖趾关节疼痛严重;(2)心、肝、肾等重要器官存在严重病变;(3)存在精神异常,无法配合研究;(4)处于妊娠期或哺乳期;(5)对本试验所用药物过敏;(6)正在参与其他药物试验;(7)不能完成本研究项目。
1.5 脱落标准
依据《中药新药临床指导原则》[11],并结合本研究的实际情况,制定如下脱落标准:(1)观察期内随访丢失的患者;(2)观察期内出现重要器官功能异常的患者;(3)未按时复查的患者;(4)因个人原因终止观察的患者;(5)在观察期内自行服用受试药品以外药品或自行接受其他治疗的患者;(6)观察期内出现严重不良反应需要停止观察或采取其他治疗方法的患者;(7)研究者认为因某些原因不再适合继续观察的患者。
1.6 方法
嘱患者忌食高嘌呤食物,忌烟酒,常规作息,保证饮水量≥2500 mL/d[12],治疗期间除规定药物外不使用其他药物。治疗组给予雌性红莱菔及莱菔叶浓缩原粉(生产厂家:沈阳抗风竤生物技术有限公司;生产批号:W960S211;规格:1.5 g/袋)治疗,1.5+1.5g/次,3 次/d,舌下含服;对照组给予非布司他(生产厂家:江苏万邦生化医药股份有限公司;批准文号:国药准字H20130059 ;批号:19029025 ;规格:40 mg/ 片)治疗,80 mg/ 次,1 次/d,口服;联合组先给予非布司他治疗,半小时后再给予雌性红莱菔及莱菔叶浓缩原粉治疗,二者的用法用量同上。三组患者在相同的条件下均治疗90 d。
1.7 观察指标
(1)痛风石显影体积:分别于治疗前后采用西门子FLASH 炫速双光子CT 机测定患者的痛风石显影体积,扫描的基本参数为:A 球管电压80 KV,有效电流250 mAs,B 球管电压140 KV,有效电流125 mAs,开启实时动态曝光剂量调节CARE Dose4D,准直器64 mm×0.6 mm,螺距0.7,扫描厚度2.0 mm[13],扫描部位:第一跖趾关节。通过容积显示(VR)重建图像,记录绿色标记的尿酸盐结晶显影体积。(2)血清尿酸、肌酐、尿素氮水平:分别于治疗前后采集患者的清晨(8:00)肘前静脉血,于采血前一天22:00 禁止进食直到采血后,采血时患者取坐位,手臂保持放松,顺着静脉走向确保针头与皮肤保持30°角快速刺入肘前静脉,回血后针头探入少许,采血针尾针置入真空抗凝管中采集血液5 mL,之后将血液样本混匀、贴标签。采集完成后将血液标本置于离心机内以3500 r/min 的转速离心5 min,取上清液并在2 h 内送检。选用日立7600-020 型全自动生化分析仪,以分光光度法测定血清尿酸、尿素氮水平,以酶联免疫吸附(ELISA)法测定血清肌酐水平。检测用试剂盒均购自上海酶联生物科技有限公司。(3)血清白细胞介素-1β(IL-1β)、肿瘤坏死因子-α(TNF-α)水平:分别于治疗前后采集患者的静脉血(采血方法同上),将血液标本置于离心机内以3500 r/min 的转速离心5 min,取上清液并在2 h 内送检。选用日立7600-020 型全自动生化分析仪,以ELISA 法测定IL-1β、TNF-α水平。检测用试剂盒均购自上海酶联生物科技有限公司。
1.8 统计学方法
所有统计数据均在相同条件下测量,统一处理。数据分析采用SPSS 19.0 软件,符合正态分布的计量资料采用均数± 标准差(±s)表示,三组患者治疗前后痛风石大小变化、尿酸、肌酐、尿素氮等指标的对比以配对样本t检验,组间比较以单因素方差分析,两两比较采用LSD 法(方差齐时)或Dunnett’T3 检验(方差不齐时),计数资料用%表示,以χ²检验,P<0.05 为差异有统计学意义。
2 结果
2.1 三组治疗前后痛风石显影体积的比较
三组治疗前的痛风石显影体积相当(P>0.05)。治疗后,三组的痛风石显影体积较治疗前均明显缩小(P<0.05);试验组、联合组的痛风石显影体积均小于对照组(P<0.05);试验组、联合组的痛风石显影体积相当(P>0.05)。详见表2。
表2 三组治疗前后痛风石显影体积的比较(mm3,± s)
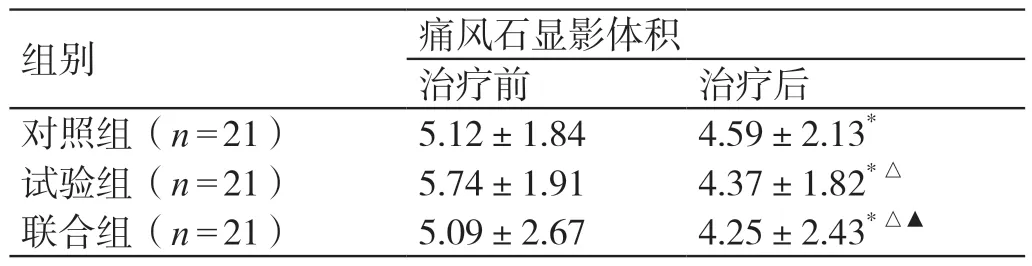
表2 三组治疗前后痛风石显影体积的比较(mm3,± s)
注:* 与本组治疗前比较,P <0.05;△与对照组治疗后比较,P <0.05;▲与试验组治疗后比较,P >0.05。
组别 痛风石显影体积治疗前 治疗后对照组(n=21)5.12±1.84 4.59±2.13*试验组(n=21)5.74±1.91 4.37±1.82*△联合组(n=21)5.09±2.67 4.25±2.43*△▲
2.2 三组治疗前后血清尿酸、肌酐、尿素氮水平的比较
三组治疗前的血清尿酸、肌酐、尿素氮水平相当(P>0.05)。治疗后,对照组、联合组的血清尿酸水平均较治疗前明显降低(P<0.05);试验组的血清尿酸水平较治疗前明显升高,且高于对照组、联合组(P<0.05)。治疗后,对照组的血清尿素氮、肌酐水平与治疗前相当(P>0.05);试验组、联合组的血清尿素氮、肌酐水平较治疗前均明显降低,且均低于对照组(P<0.05);联合组的血清尿素氮、肌酐水平较试验组均有所增高(P<0.05)。详见表3。
表3 三组治疗前后血清尿酸、肌酐、尿素氮水平的比较(± s)
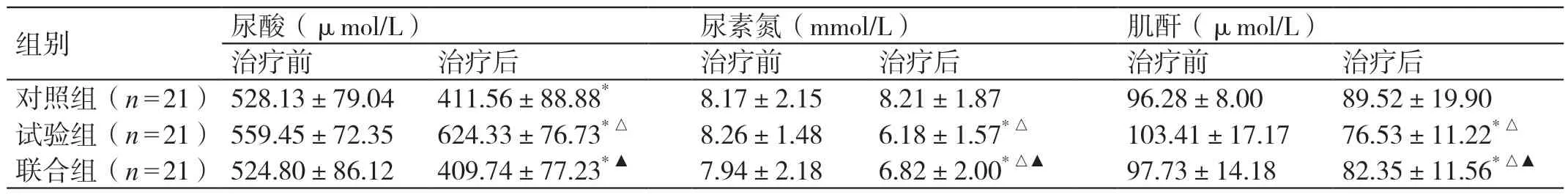
表3 三组治疗前后血清尿酸、肌酐、尿素氮水平的比较(± s)
注:*与本组治疗前比较,P <0.05;△与对照组治疗后比较,P <0.05;▲与试验组治疗后比较,P <0.05。
组别 尿酸(μL)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后对照组(n=21)528.13±79.04 411.56±88.88* 8.17±2.15 8.21±1.87 96.28±8.00 89.52±19.90试验组(n=21)559.45±72.35 624.33±76.73*△ 8.26±1.48 6.18±1.57*△ 103.41±17.17 76.53±11.22*△联合组(n=21)524.80±86.12 409.74±77.23*▲ 7.94±2.18 6.82±2.00*△▲ 97.73±14.18 82.35±11.56*△▲
2.3 三组治疗前后血清IL-1β、TNF-α 水平的比较
三组治疗前的血清IL-1β、TNF-α 水平相当(P>0.05)。治疗后,对照组的血清IL-1β、TNF-α水平与治疗前相当(P>0.05);试验组、联合组的血清IL-1β、TNF-α 水平较治疗前均明显降低,且均低于对照组(P<0.05);联合组的血清IL-1β、TNF-α水平较试验组略有升高(P>0.05)。详见表4。
表4 三组治疗前后血清IL-1β、TNF-α 水平的比较(± s)

表4 三组治疗前后血清IL-1β、TNF-α 水平的比较(± s)
注:*与本组治疗前比较,P <0.05;△与对照组治疗后比较,P <0.05;▲与试验组治疗后比较,P >0.05。
组别 IL-1β(pg/mL)TNF-α(ng/mL)治疗前 治疗后 治疗前 治疗后对照组(n=21)129.43±4.56 100.22±10.00 29.46±1.51 21.11±1.95试验组(n=21)136.51±7.32 88.75±8.86*△ 30.55±1.16 12.27±1.28*△联合组(n=21)131.21±7.83 92.15±9.23*△▲ 31.29±1.30 13.98±1.73*△▲
3 讨论
痛风石是尿酸盐结晶长期沉积在关节内形成的结石,是痛风的典型临床表现之一[14]。现阶段,关于痛风石的成分有了大致统一的研究结果。汪群力等[15]以切除的痛风石标本为实验对象,将处理后的痛风石标本通过傅里叶变换红外光谱仪、扫描电镜、热重分析仪等进行观察,分析出痛风石中尿酸钠约占56%,有机成分约占14%。痛风石形成的因素众多,高尿酸血症发病早或病程长、血尿酸水平持续升高、引起高尿酸血症的诱因持续存在等,都可能导致痛风石形成[16]。痛风石一旦形成,轻则影响关节外观,重则导致关节变形、活动受限[17]。此外,痛风石相当于一个不稳定的尿酸库,可持续向周围组织析出尿酸盐,增加肾脏排泄尿酸的负荷,进而增加了肾结石及肾功能受损的发生风险。同时,尿酸盐结晶还可以诱导诸如IL-1β、TNF-α、免疫球蛋白等炎症介质的产生,引起炎症反应[18]。目前,对于部分痛风石严重的患者,可采取手术治疗,但患者的术后并发症较多,易出现局部皮肤愈合不良、坏死等情况[19]。因此,只有当患者出现痛风石引起关节功能障碍、压迫神经、病灶皮肤破溃等情况时才考虑手术,对于痛风石的治疗核心仍是降低血尿酸水平,使其维持至目标值以下,从而促进痛风石的溶解[20]。非布司他是黄嘌呤氧化酶抑制剂,能选择性抑制黄嘌呤氧化酶的活性,不需要大剂量重复给药就能发挥降尿酸作用,同时其对肝肾功能的影响较小,不良反应的发生率较低,是临床常用的降尿酸药物[21]。但痛风石成分复杂,尿酸盐结晶只是其中的组成部分,单纯通过降低尿酸的方法来溶解痛风石不仅无法完全溶解痛风石,还会因长期服用降尿酸药物而导致机体的抗药性增加,且长期服药还易出现不良反应[22-23]。因此,通过降尿酸来溶解痛风石并非恰当的方法,但相较于手术取石来说,仍属于较为安全的方法。
雌性红莱菔是莱菔的特殊品种,基原为十字花科植物“萝卜核- 胞质雄性不育系(纯雌性系)”新品种[24]的块根。为了便于储存、运输和应用,我们将雌性红莱菔炮制成雌性红莱菔浓缩原粉。《本草纲目》记载莱菔“根叶同功”,推测雌性红莱菔叶与雌性红莱菔作用相同,所以我们也将雌性红莱菔叶炮制成浓缩原粉。在实际应用中我们发现雌性红莱菔及莱菔叶有溶解痛风石的效果[8]。田驰等[6]以尿酸钠溶液注射大鼠右踝胫跗关节制造急性痛风性关节炎大鼠模型,并用雌性红莱菔浓缩原粉进行干预,观察到大鼠的右踝关节肿胀度明显消退,其血清中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)的活性明显增加,其右踝关节滑膜中的Nrf2 平均光密度值明显增加,表明雌性红莱菔能减轻急性痛风性关节炎大鼠的关节肿胀度,且这一作用是通过上调Nrf2 的表达水平,提高抗氧化酶SOD、CAT、GSH-Px 的活性实现的。梁再赋等[7]用相同的方法制造急性痛风性关节炎大鼠模型,用雌性红莱菔浓缩原粉进行干预,观察到雌性红莱菔能降低模型大鼠的IL-1β、TNF-α 水平及滑膜部位肥大细胞数量和脱颗粒百分比,同时还能降低滑膜组织中TLR2、TLR4 和MyD88 分子的表达,表明雌性红莱菔能通过降低TLR/MyD88/IL-1β 通路分子的表达来降低IL-1β、TNF-α 水平、肥大细胞数量及脱颗粒百分比。以上两个研究均体现雌性红莱菔是通过调节相关免疫因子或抗氧化因子的水平发挥效用的,因此可以推断雌性红莱菔具有调节免疫的功能。本研究结果显示,雌性红莱菔及莱菔叶浓缩原粉能有效溶解痛风石,其效果优于非布司他,但二者联合应用并不能提高溶石效果;雌性红莱菔及莱菔叶浓缩原粉的应用能明显改善痛风患者的肾功能指标,这点是非布司他所不具备的。但雌性红莱菔及莱菔叶浓缩原粉在溶解痛风石的过程中会导致血尿酸升高,以及致炎因子IL-1β、TNF-α 降低。由此我们推测雌性红莱菔不一定是通过降低血尿酸来溶解痛风石的,可能是通过调节免疫系统来实现这一效果。
综上所述,雌性红莱菔能溶解痛风石,其效果优于非布司他,且能改善肾功能指标,值得在临床上推广。但本研究的样本量较小,观察时间短,缺乏足够的数据支撑,后续可进行深入研究。同时,雌性红莱菔是如何溶解痛风石的,在溶解痛风石的过程中为何尿酸会升高,其机理值得进一步探究。
