基于粪便激素检测的圈养赤斑羚发情周期初探
2023-05-16刘群秀蒋韦斌马硕嘉袁耀华
刘群秀,蒋韦斌,马硕嘉,袁耀华
(1.上海城建职业学院,上海,201415;2.上海师范大学生命科学学院,上海,200223;3.嘉兴凯实生物技术有限公司,嘉兴,314000;4.上海动物园,上海,200335)
野生动物体内类固醇激素的分泌对生殖和应激等生理活动具有重要的调控作用,监测各激素的变化特征是掌握动物繁殖状况及健康程度的重要途径[1]。生殖类固醇代谢物水平可以反映动物性腺的活动规律,在野生动物的生殖参数和发情周期等研究中得到广泛应用[2−3]。血液激素的测定一直被认为是测定动物生殖激素最直接有效的方法,然而对于野生动物而言,血液样品往往较难获得,或是对动物损伤较大,因此,基于尿样或粪样监测动物的内分泌指标,在不触及动物的前提下测定个体生理状态,越来越成为准确、实用的新方法[4]。研究表明,动物粪样中含有大量微生物,如果新鲜粪样未及时提取或处理,粪样内外微生物将会分解粪样中所含类固醇激素的代谢产物[5],影响检测结果的准确性。同样,采取的粪样保存方法及保存时间等因素也会影响粪样激素检测结果[2]。因此,如何科学有效地保存粪样,从而客观真实地反应动物的生理状态?是专家和学者重点关注的科学问题。
赤斑羚(Naemorhedus baileyi)又名红斑羚,为国家一级重点保护野生动物,IUCN 将其评估为易危(VU)[6]。由于栖息地资源的破坏和非法捕猎,赤斑羚种群数量极其稀少,生物学信息匮乏亟待制定保护策略和项目实施开展科学研究[7-8]。上海动物园有国内唯一的圈养赤斑羚种群,根据动物园记载,目前存活的赤斑羚数量稀少且性比严重失衡,平均增长率逐年下降[9],科学的饲养和繁育是保证种群延续的必要条件。本研究以圈养赤斑羚为研究对象,基于粪便样本测定生殖激素水平,同时探讨不同粪样保存方法对激素检测结果的影响,以期为粪便类固醇激素检测技术在野生动物中的准确应用提供借鉴,并为确定赤斑羚繁殖生物学信息以及科学繁育提供重要参考。
1 材料与方法
1.1 样本采集
2018 年1 月—2019 年12 月,采集上海动物园健康成年赤斑羚(1,1♀)的新鲜粪便样本,装入离心管中,根据试验设计分组。
1.2 样本分组
将雌、雄粪样分开,按每份5 g 装入离心管中保存。选取雌性粪样分别测定雌二醇和孕酮激素,选取雄性粪样测定睾酮,每个测试类别设置3 个重复。其余样本分为未处理组(Ⅰ)、乙醇浸泡组(Ⅱ)、干燥组(Ⅲ)、冷冻组(Ⅳ)和抗生素组(V)5 个处理组,以新鲜粪样即时处理为对照,每个测试类别设置3 个重复。除冷冻组外,其余4 组皆置于室温中通风保存(表1),环境温度为(25±5)℃。

表1 赤斑羚粪样5种不同保存方法Tab.1 Five different preservation methods for Naemorhedus baileyi fecal samples
将各处理组划分为4个时间点:15、30、90、150 d,在达到不同时间点时处理粪样,测定激素雌二醇、孕酮和睾酮水平,并与对照组比较。
1.3 生殖激素测定
1.3.1 生殖激素提取
将不同保存方式下离心管中的粪便(每份5 g)按时间点放入烘箱中完全干燥,研磨,取0.5 g 干燥粪便加入5.0 mL 95%乙醇充分震荡30 min,然后离心15 min(5 000 r/min),取上清液1.8 mL于真空干燥机中干燥3 h,待干燥完成后在样品中加入100 μL 95%乙醇和400 μL Assay Buffer(Assay Buffer∶纯水=1∶4),震荡直至充分混合后,离心4 min(1 500 r/min),取上清液用Assay Buffer进行10倍稀释[V(上清液)∶V(Assay Buffer)=9∶1],稀释完成后将样品置 于-20 ℃保存,待上机测定。
1.3.2 生殖激素水平测定
采用ELISA 法测定雌性赤斑羚的孕酮和雌二醇,以及雄性个体睾酮水平。测定仪器为迈瑞(Min⁃dray)酶标仪(MR-96A),试剂盒为北京北方生物技术研究所有限公司生产。
1.4 数据分析
分别统计、比较和分析雌二醇、孕酮和睾酮在4种粪样保存方式、4个时间梯度下所测定的数据。将各组别在不同时间梯度(15、30、90、150 d)的测定结果与参照组比较,并比较不同时间梯度各组别之间的差异性。应用Shapiro-Wilk 分析检验每种粪样保存方法的激素测定值是否符合正态分布,符合正态分布则应用单因素方差分析(one-way ANOVA test),不符合正态分布则应用卡方检验(chi-square test)[10]。数据分析应用SPSS 25.0软件完成,显著水平设定为α=0.05。
2 结果
共采集赤斑羚有效粪样410 份,其中2018 年雄性62份,雌性65份,2019年雄性137份,雌性146份。所测定的生殖激素数据值均符合正态分布(Shapiro-Wilk test,p>0.05)。
2.1 粪样保存时效性
粪样雌二醇检测结果表明,未处理组(Ⅰ)检测值随时间推移波动性较大,在15 d 和90 d 与参考值[(1.05±0.38)ng/mL]对比呈现显著差异(p<0.05),并且样本之间检测值差异很大。乙醇浸泡组(Ⅱ)检测值随保存时间延长逐渐降低,至150 d时低于参考值,但未呈现显著差异(p>0.05)。干燥组(Ⅲ)和冷冻组(Ⅳ)在各时间点的测定值均位于参考值范围内,两者的波动幅度均较小(图1A)。
孕酮检测结果表明,随时间延长,未处理组(Ⅰ)在15 d时测定值[(25.55±12.06)ng/mL]显著高于参考值[(6.30±3.94)ng/mL](p<0.05);在30 d 和90 d时,测定值均高于参考值。乙醇浸泡组(Ⅱ)和冷冻组(Ⅳ)在各保存时间点均位于参考值范围内,波动幅度小。干燥组(Ⅲ)粪样测定的孕酮水平出现不规则波动(图1B)。
睾酮检测结果表明,未处理组(Ⅰ)和冷冻组(Ⅳ)中睾酮水平始终在参考值范围内[(25.67±7.58)ng/mL]。乙醇浸泡组(Ⅱ)起伏较大,在30 d时测定值较低,为(12.78±4.29)ng/mL,与参考值间存在显著差异(p<0.05)。干燥组(Ⅲ)测定值与乙醇浸泡组呈现相似的波动趋势(图1C)。

图1 保存时间对不同保存方式粪样中激素质量浓度的影响Fig.1 Changes in testosterone at varying storage time under four storage methods
抗生素组在15 d 时粪样已全部融化,且液面表面长满絮状真菌,无法进行激素测定,视为保存失败。
2.2 发情周期判定
基于粪样保存时效性的研究结果,采用冷冻法保存赤斑羚粪便并测定生殖激素。雌二醇于2018年1 月上旬及12 月出现波峰,其余月份相对平稳。2019 年2—4 月激素水平较高,并于10 月初和11 月中下旬—12月出现高峰(图2A)。
孕酮水平在2018 年1 月初出现高峰,在2018 年11 月—12 月中旬出现多个峰值,持续时间较短;2019 年1 月初及1 月中旬出现短暂高峰,2 月保持稳定,但水平较高,2019年9月下旬—12月中旬出现波动(图2B)。
睾酮水平在2018 年1 月初出现高峰,在2018 年11 月—2019 年2 月末,以及10 月和11 月出现峰值(图2C)。
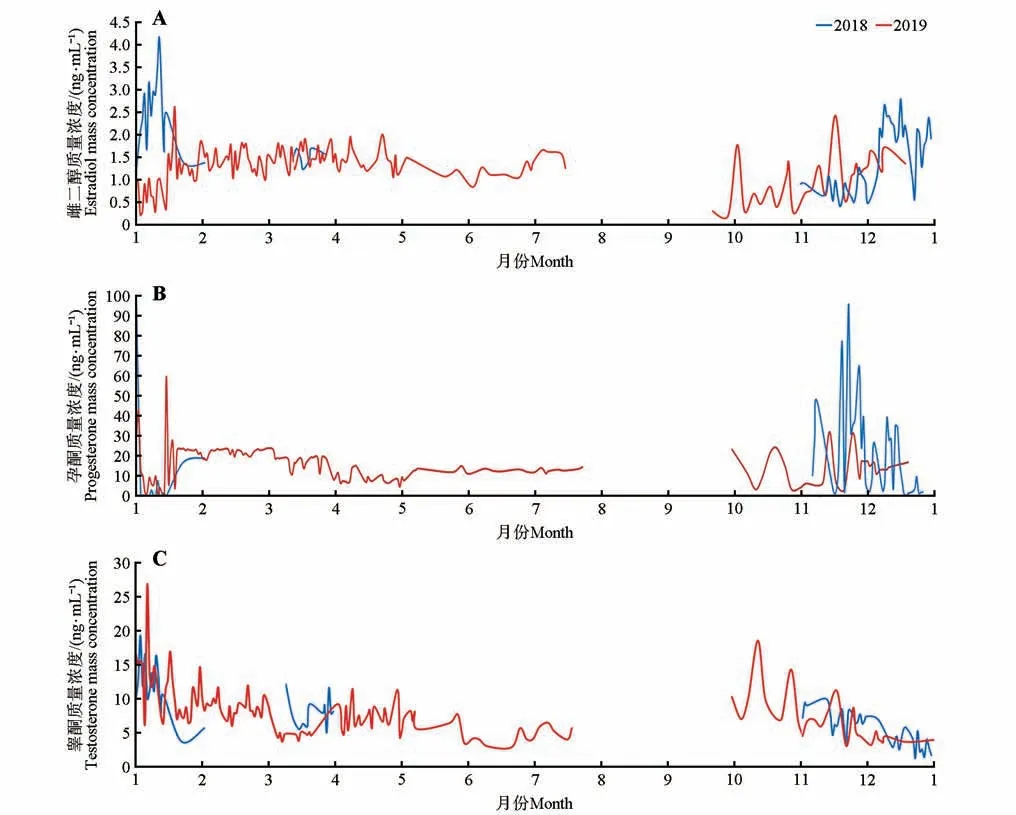
图2 赤斑羚粪便激素水平变化曲线(2018—2019年)Fig.2 Fecal testosterone level of red goral from 2018 to 2019
根据雌二醇和孕酮2 年的波动数据,初步预测雌性赤斑羚发情期为10月—翌年3月末,其中12月—翌年1月为发情高峰期,雄性赤斑羚发情期为10月—翌年2月末。
3 讨论
研究表明,类固醇激素在排出体外前会在动物消化器官内进行生物转化或灭活[5],排出后,所含的肠道细菌和外界微生物可能与粪样中类固醇激素发生反应[11],导致试验结果产生波动[12]。环境温度、样品新鲜程度、保存试剂选用,以及动物繁殖状态等多种因素均会影响激素检测的准确性[2,5,13−16]。本研究首次尝试探讨不同赤斑羚粪样保存方法(无处理、乙醇浸泡、干燥和冷冻)对生殖激素检测结果准确性的影响,其中未经处理的赤斑羚粪样在不同保存时间点激素含量起伏很大,与参考值差异显著(p<0.05)。Millspaugh等[17]尝试对麋鹿(Elaphurus davidianus)粪样不做任何处理,常温运输6 d,发现其中的糖皮质激素含量明显下降。Yamauchi等[15]研究发现,梅花鹿(Cervus nippon)粪样在20 ℃保存时,孕酮含量会在24 h 内显著上升。因此建议,新鲜动物粪样应及时提取或适当处理,以减少粪样中类固醇激素的异常波动或损失。
乙醇具有杀菌、抑制微生物代谢及分解酶活动的作用[18−19],有助于辅助类固醇激素稳定[3]。乙醇浸泡法易于操作,对于粪样保存是很好地选择。殷亚杰等[20]在对驯鹿(Rangifer tarandus)粪便类固醇激素保存时效的研究中发现,应用95%乙醇保存的粪便样本,睾酮、孕酮和雌二醇保存时长分别为20、15、45 d。黄英等[21]采用95%乙醇和低温保存川金丝猴(Rhinopithecus roxellana)的粪样,样本中睾酮和雌二醇可保存30 d,孕酮可保存10 d。需要强调的是,随着时间推移,乙醇的挥发会导致类固醇共轭键断裂,使粪样内共轭类固醇代谢物分解或重新结合成单轭或无轭代谢物,并逐渐被微生物分解[22]。本研究中,应用乙醇浸泡保存的粪样随着时间的延长,对于孕酮检测结果尚可,但对于雌二醇和睾酮检测结果并不准确,因此认为乙醇浸泡法适合短期的粪样保存(少于15 d),建议综合应用抗生素或乙醇洗脱剂等抑制粪便中微生物的增殖[15]。
本研究中,干燥保存法对雌二醇检测结果较为理想。Brockman等[23]应用干燥法保存维氏冕狐猴(Propithecus verreauxi)粪样,发现雌二醇和睾酮含量可以稳定储存3 周。然而,粪便中类固醇分布都具有不均匀性且水分含量各不相同,不同物种粪便烘干最佳时长与温度也不相同,不适当的烘干条件会导致粪便内类固醇激素流失[1],即干燥粪样保存法的时间和温度选取尚处于摸索阶段。冷冻粪样保存是最简单快速的保存方法,广泛应用于粪样类固醇激素的保存[24]。研究表明,相对于多种粪样保存方法,低温冷冻粪样中微生物稍有波动,与新鲜样本最为相似,未经冷冻的粪样中类固醇激素会升高[25−26],因此低温保存是最为理想的粪样保存方式[22]。在不具备冷冻条件情况下,干燥法为较好的替代方式,也可综合应用几种方法,如同时使用有机溶剂和冷冻保存法,以延长粪样保存时效。对于粪便样本保存,抗生素可以起到良好抑菌作用[12]。本研究亦尝试使用抗生素(乳酸左氧氟沙星)保存粪样,但出现了大量白毛状真菌,无法进行激素检测。抗生素能够抑制部分微生物生长[27−28],但对于赤斑羚粪便,乳酸左氧氟沙星不足以抑制更广谱的微生物在粪样中的生长繁殖。本研究中,试验设定的保存时间较长,抗生素并不适用,在后续研究中应对抗生素短时保存粪样效果进行评估。
动物繁殖行为的变化是其生殖生理状况的外在表现,而生殖内分泌系统的调控作用主要是通过性腺分泌性激素来实现[29]。上海动物园赤斑羚合笼主要依据行为来判断,如雌、雄个体隔栏频繁接触,雌性个体表现出邀配行为等,通常合笼时间为12 月—翌年2 月,然而行为观察主要由经验丰富的保育员在昼间工作时随机发现,缺少系统观察和记录,加之工作时间以外很多行为可能被错过,因此仅仅基于行为判定赤斑羚的发情状况存在很大误差。本研究中,依据激素水平的年度波动,发现雌性赤斑羚在10月—翌年4月都可能存在发情,发情高峰为12月和1月,因此建议在日常饲养过程中,延长雌、雄合笼时间(10 月—翌年3 月),并加强合笼期间行为观察和记录,从而提升繁殖成功率。本试验样本采集在部分月份出现缺失,有待于在后续工作中补充。在不同保存条件下,赤斑羚粪便中3种生殖激素水平呈现不同波动趋势,因此认为粪便内激素含量除了受保存方法的影响外,还需考虑其他因素。粪便中类固醇激素含量反映的是一段时间内的平均水平,应持续采集、长期监测,从而获得更加客观、准确的研究结果。
致谢:研究的开展得到上海动物园繁殖场主管周锋、保育员李海国,以及科研中心的大力支持,在此一并表示感谢。
