全身麻醉对舍饲大熊猫血液流变学的影响
2023-05-16姜瑞婕张心怡夏茂华赵素芬王运盛普天春张成林范开
姜瑞婕 ,张心怡 ,夏茂华,赵素芬,王运盛,普天春,张成林,范开
(1.中国农业大学动物医学院,北京,100193;2.北京动物园,北京,100044)
大熊猫(Ailuropoda melanoleuca)是陆地哺乳动物中最濒危的物种之一,在世界范围内具有重要的学术研究价值[1−2]。由于圈养动物管理和兽医技术的进步,许多注射麻醉剂组合已被用于固定大熊猫,其中美托咪定-替来他明-唑拉西泮(medetomidinetiletamine-zolazepam,MTZ)较常用,已有使用MTZ 对野外大熊猫麻醉的相关报道[3],但关于大熊猫血液方面各基础数据的研究有限,特别是有关大熊猫在麻醉与非麻醉状态下血液流变值的测定,以及麻醉前后血液流变值的比较分析更是鲜有报道。因此,全面系统地测定和分析大熊猫在非麻醉与麻醉状态下的血液基础数值,有重要的理论参考价值和科研价值。许多国内外兽医工作者开始把血液流变学应用在兽医临床上,特别是在外科手术与麻醉的研究中[4−9]。有研究表明,麻醉使动物血液流变学发生一定程度的变化,吸入麻醉剂或使用非挥发性麻醉剂的全身麻醉会导致动物微循环发生显著变化[8],血液流变学很大程度上影响外科手术和术后阶段,血液流变学紊乱可能直接诱发并发症[10−12]。
本试验全面系统地检测了舍饲大熊猫4 项血常规指标、10 项血液生化指标和22 项血液流变值,对所测数值进行了统计学分析,明确大熊猫在非麻醉与麻醉状态下各项指标间的差异,试验结果将为研究珍稀物种大熊猫提供必要的、较全面的参考数据,为舍饲大熊猫的合理饲养和医疗提供参考。
1 材料与方法
1.1 基本情况
表1 大熊猫基本信息Tab.1 Basic information of giant pandas
1.2 麻醉药品及剂量
将舒泰50 注射液,即替来他明-唑拉西泮(tiletamine-zolazepam,TZ;2 mg/kg,5 mg/mL;法国维克有限公司)和盐酸右美托嘧啶注射液,即右美托咪定(dexmedetomidine,dexM;8 μg/kg,0.5 mg/mL;硕腾生物制药有限公司)注射至大熊猫髋部外侧部位。
1.3 血液采样
麻醉前对大熊猫进行非麻醉体检,4只大熊猫经正向训练均可在不麻醉固定的情况下配合采集血液。采集大熊猫前肢头静脉的血液样本,血量为 5 mL,置于EDTA 抗凝管中保存,在30 min 内完成全血细胞计数、血清生化和血液流变学指标检测。
1 周后,对4 只大熊猫注射麻醉药物,在进入外科麻醉期后立即采血。采集大熊猫前肢头静脉的血液样本,血量为5 mL,置于EDTA 抗凝管中保存,在30 min内完成血液相关检测。
1.4 血样处理
血液常规检测包括4 项内容,即红细胞、白细胞、血红蛋白和红细胞压积。血细胞计数采用人工镜检的方式,由检验科人员在血细胞计数板上完成计数。血红蛋白数据由血红蛋白仪测定,在5 mL 稀释好的文齐氏液中加入20 μL 全血,摇匀后放置 5 min 后测定。红细胞压积使用温氏法测定,离心机转速为12 000 r/min,时间为5 min,使用比数板读数。
血液生化指标检测包括10 项内容,即总蛋白、白蛋白、球蛋白、总胆红素、血糖、肌酐、尿素氮、丙氨酸氨基转移酶、碱性磷酸酶和淀粉酶。用日本FUJIFILM全自动生化分析仪和对应检测试剂板测定。
血液流变学指标检测包括22 项内容,即全血低、中、高切黏度,还原低、中、高切黏度,相对低、中、高切黏度,血浆黏度,红细胞聚集、变形、刚性指数,血沉,血沉方程K值,红细胞电泳时间,卡松黏度,卡松屈服应力,纤维蛋白原以及流阻低、中、高切。以上指标使用HT-100A 型血流变黏度测试仪(淄博恒拓分析仪器有限公司)检测,全血黏度切变率为3、30、200 s-1,血浆黏度在抗凝血离心分离后测定。
1.5 统计分析
应用SPSS 软件进行统计分析,计算大熊猫血液指标和血液流变值指标的平均值和标准差,经ANOVA检验差异有统计学意义(α=0.05),使用配对t检验分析显著差异。
1.6 道德规范
根据官方指南和规则进行本试验,并获得了北京动物园的知情同意以收集相关数据。
2 结果
2.1 麻醉监测
通过对大熊猫可视黏膜颜色、毛细血管再充盈时间、呼吸频率、心率和体温的监测,发现注射麻醉剂5 min 后大熊猫行为活动明显减缓,呼吸频率升高,心率降低。在5~10 min 大熊猫平稳进入外科麻醉期,可视黏膜颜色逐渐恢复粉红色,肢体肌肉张力和眼睑反射消失,舌头可自由拉出,呼吸频率降低,心率维持在77~81次/min。麻醉固定持续时间为1 h 左右,期间大熊猫无呕吐或失禁等不良反应,过程较为平稳。对麻醉过程中大熊猫的基础指标进行检测,结果如表2所示。

表2 大熊猫麻醉过程中的基础体征Tab.2 Basic signs of giant panda during anesthesia
2.2 血细胞和生化指标
使用右美托咪定-替来他明-唑拉西泮(dexmedetomidine-tiletamine-zolazepam,dexMTZ)对大熊猫麻醉后,4 项血常规指标均上升,但无显著差异;10 项血液生化指标中,TP、GLB、Cr、BUN、ALT、ALP 和AMY 较麻醉前有所上升,ALB、TBIL 和GLU有所下降,但无论升降,变化均无显著性差异,且在正常范围内(表3)。dexMTZ麻醉方案不会对大熊猫的血细胞和生化指标造成显著影响。
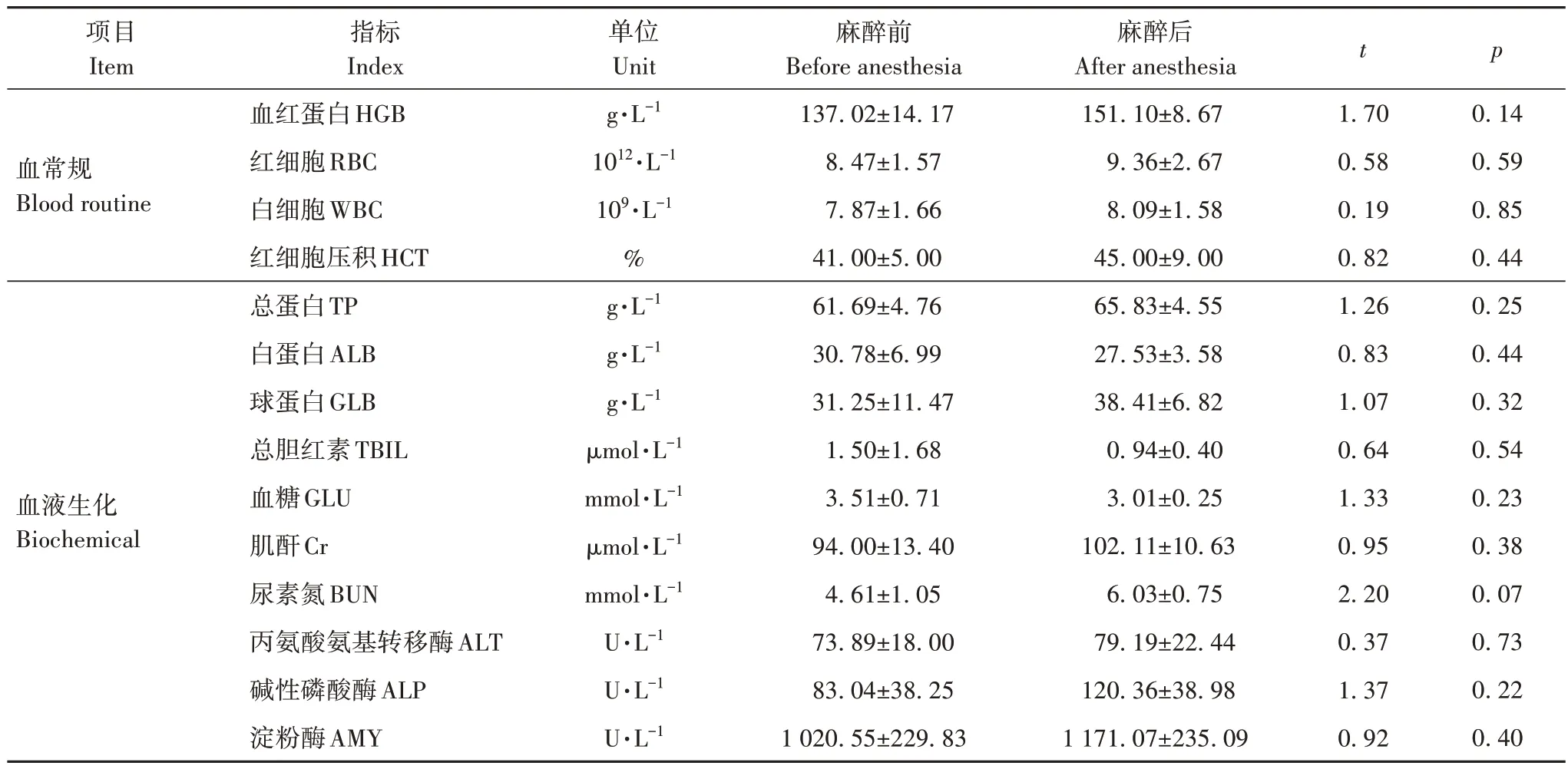
表3 麻醉前后血常规和生化指标差异Tab.3 Changes in blood routine and biochemical index before and after anesthesia
2.3 血液黏度和红细胞流变学
麻醉后的大熊猫全血黏度低、中、高切,血沉方程K值,红细胞电泳时间,卡松黏度,卡松屈服应力,纤维蛋白原,流阻低、中、高切11 项指标与麻醉前相比,呈现显著上升趋势(p<0.05,表4)。舍饲大熊猫麻醉后的血液黏度较麻醉前显著升高。
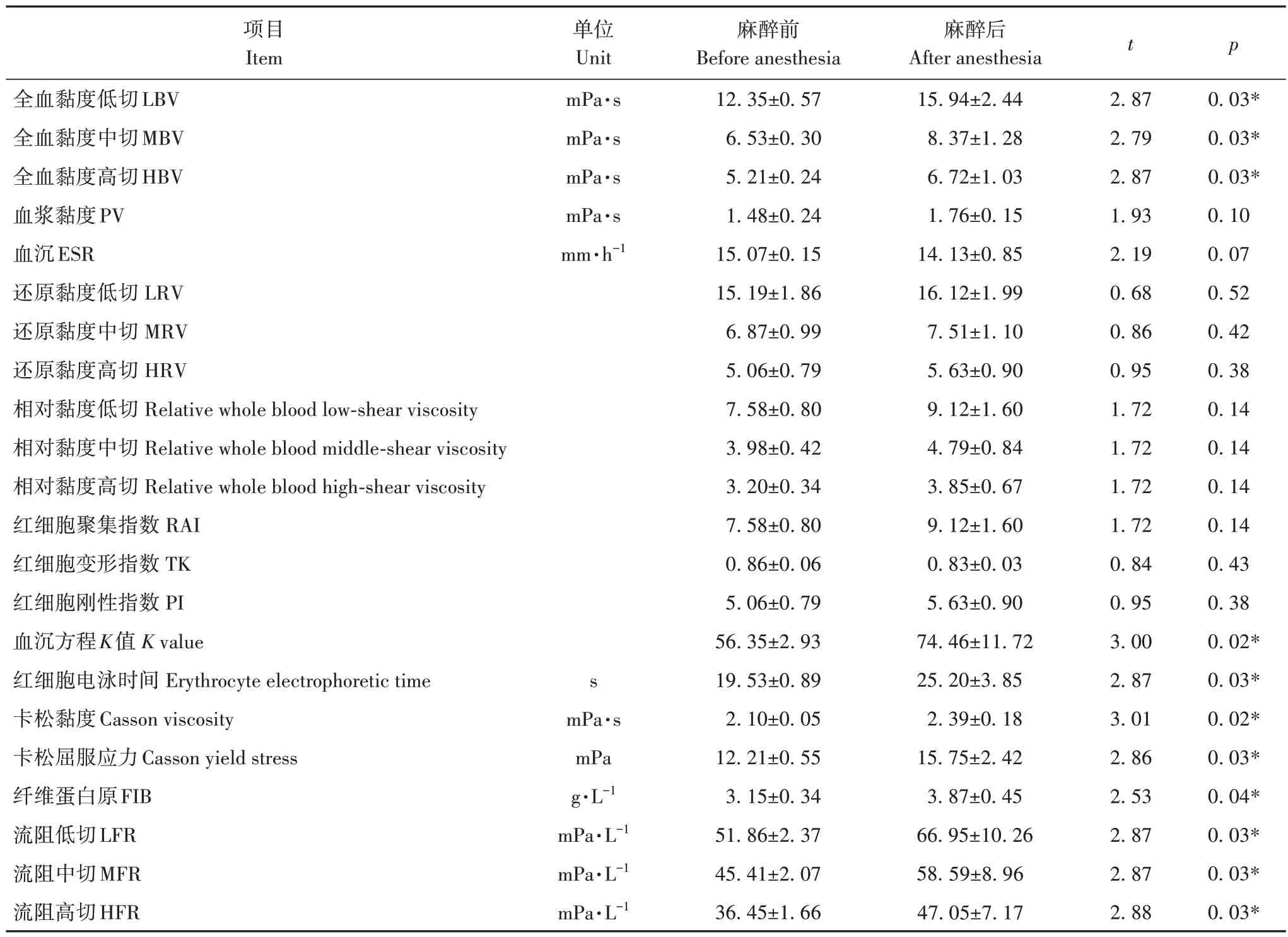
表4 麻醉前后血液流变学指标变化Tab.4 Changes in hemorheology indexes before and after anesthesia
3 分析与讨论
试验期间选择的麻醉剂量(dexM,8 μg/kg;TZ,2 mg/kg)能使大熊猫的麻醉固定时间持续1 h 左右,无呕吐或失禁等不良反应,整个麻醉过程较为平稳。舍饲大熊猫麻醉后的血常规和生化指标较麻醉前无显著差异,说明dexMTZ 麻醉组合不会对大熊猫的肝、肾等器官产生明显损害,但从血液流变学检测数据看,大熊猫麻醉后的全血黏度、血流阻力、纤维蛋白原和血沉方程K值、红细胞电泳时间、卡松黏度和卡松屈服应力较麻醉前显著升高,即血液黏度较麻醉前有明显升高,提示大熊猫在麻醉后存在循环障碍的风险。
全身麻醉可诱导内分泌、免疫和代谢反应[15]。除去特别药物的影响,出现上述结果可能是由于所有麻醉方式几乎都会影响机体肌肉的松弛程度和间歇正压呼吸,同时会改变小动脉和小静脉的直径以及对应激的反应[14](即儿茶酚胺刺激或出血),再加上动脉压和心排血量的下降,导致一般麻醉都会对机体微循环产生影响。因此,结合本试验数据,推测在红细胞压积没有降低的情况下,麻醉后的血黏度上升可能与微循环血液分配不均及纤溶系统的激活有关。同时,纤维蛋白原升高的黏度和聚集增加,有较高形成血栓的风险,提示麻醉有发生微循环障碍及动静脉血栓形成的可能[10]。今后,应进一步研究麻醉大熊猫的通气和氧合作用,并在手术开始前干预改善大熊猫的血液流变学,以提高大熊猫麻醉的安全性。
