PTX3与AECOPD患者3年死亡率的相关性研究
2023-05-16刘佳妤娄林闫小京天津市北辰医院天津300134
刘佳妤,娄林,闫小京(天津市北辰医院,天津 300134)
慢性阻塞性肺疾病目前具体致病机制尚未明确,考虑为多种因素综合作用所致,包括环境、遗传、炎性因子相关等,其临床症状主要为咳嗽、咳痰,在肺部的改变主要以结构异常以及肺功能受损为主要特征,在我国慢性阻塞性肺疾病是一种呼吸科常见的高发病[1-2]。而对于慢性阻塞性肺疾病急性加重期(Acute exacerbation of chronic obstructive pulmonary disease,AECOPD)患者而言,往往患者病情进展迅速,对于这类患者如何在临床早期找到一个适合的指标去快速判断患者的预后,是临床的一个难点也是一个热点。而正五聚蛋白3(PTX3)作为一种近些年来新发现的与COPD密切相关的炎性因子,部分研究显示其可能预测AECOPD患者的预后[3],在国内各位同仁的相关研究基础之上,为分析PTX3与AECOPD患者3年死亡率的相关性,笔者特进行本次研究,现将相关研究结果报道如下。
1 资料与方法
1.1一般资料 纳入2017年1月31日-2018年1月31日于我科住院的AECOPD患者109例进行回顾性的队列研究。本次研究中纳入的109例患者均符合中华医学会对于AECOPD的诊断标准[4],109例患者中男性有68例,女性有41例,平均年龄为(71.64±6.89)岁,BMI为(22.87±1.78)kg/m2。吸烟人数为90例,合并心力衰竭30人,冠心病20人。纳入标准:①诊断符合中华医学会关于AECOPD诊断指南的标准;②临床各项资料完整没有缺项,并且能坚持随访的患者。排除标准:①合并其他肺部疾病的患者,包括:肺结核、肺间质纤维化、肺癌等;②具有免疫抑制的患者(包括合并HIV、长期口服免疫抑制剂以及进行脾脏切除手术的患者);③合并恶性肿瘤以及血液疾病的患者;④患有精神疾病的患者。本研究经医院伦理委员会审批通过。
1.2血清PTX3在我中心的测定方法 我院目前对于血清PTX3均在患者入院后24小时内完成检测,首先在患者空腹的情况下,采集肘静脉血5ml,随后对这5ml血采用EDTA进行抗凝,将试管放置于常温下2小时后进行离心处理,离心速度设置为3000r/min,取试管内的上清液使用酶联免疫法测定PTX3的值,生物试剂测定盒由赛培生物提供。
1.3研究方法以及观察指标 回顾纳入本次研究的所有患者的基本临床资料,同时包括患者入院后常规的实验室资料,包括:C反应蛋白(CRP)、白细胞计数(WBC)、淋巴细胞计数(LC)以及肝肾功能其他常规指标。通过查阅患者的病历,以电话、网络、医院面对面复诊等方式进行随访,随访3年,通过PTX3预测AECOPD患者的全因死亡曲线的最佳截断值进行分组,分为高PTX3组(PTX3≥最佳截断值)和低PTX3组(PTX3<最佳截断值),对比并分析高PTX3组和低PTX3组的一般临床资料、相关实验室指标、并发症以及最后临床结局,分析PTX3与AECOPD患者3年死亡率的相关性。
1.4统计学处理 本次研究所涉及的数据采用SPSS22.0进行统计分析,其中计数资料的比较采用χ2检验,计量资料的比较采用t检验,利用ROC曲线确定PTX3预测AECOPD患者的全因死亡曲线的最佳截断值,同时利用Spearman相关性分析可能影响PTX3的相关影响因素和指标,利用线性回归分析可能影响PTX3的独立影响因素,其中生存曲线采用Kaplan-Meier法进行绘制,高PTX3与低PTX3组生存率的差异采用Log-Rank法进行分析,并运用COX模型分析AECOPD患者的全因死亡的危险因素,P<0.05表示具有统计学意义。
2 结果
2.1本次研究一般结果 本次研究中所有患者均随访到位,未出现丢失患者,所有患者的3年死亡率为 39.45%(43例),死亡的43例患者中男性为30例,女性为13例,吸烟患者为36例,平均年龄(68.98±4.89)岁,合并心力衰竭20例,冠心病10例。
2.2PTX3预测AECOPD患者死亡的ROC曲线 PTX3预测AECOPD患者死亡的ROC曲线下面积为0.868,灵敏度83.52%,特异度74.16%,其最佳截断值(临界值)为10.43,具体结果见表1以及图1。

表1 PTX3预测AECOPD患者死亡的ROC曲线相关数据
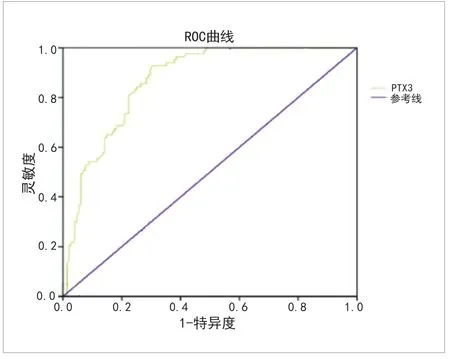
图1 PTX3预测AECOPD患者死亡的ROC曲线
2.3高PTX3组与低PTX3组的临床基线资料比较 按照PTX3的最佳截断值进行分组,其中高PTX3组为33人,低PTX3组为76人,高PTX3组与低PTX3组患者在白细胞(WBC)、C反应蛋白(CRP)、淋巴细胞计数(LC)上均存在统计学差异(P<0.05),具体结果见表2。
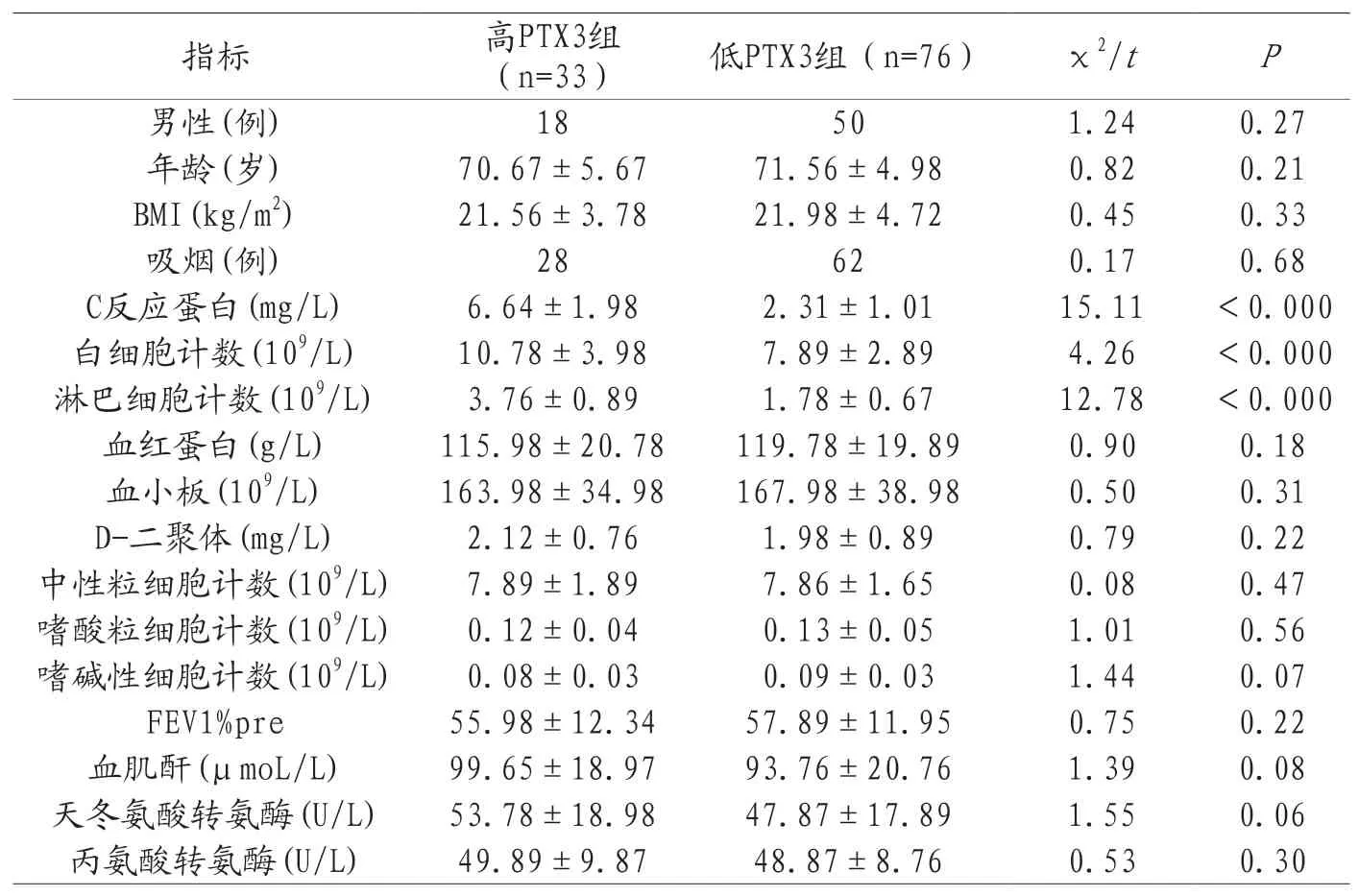
表2 高PTX3组与低PTX3组的临床基线资料比较
2.4PTX3相关影响因素的Spearman相关性分析 在进行Spearman相关性分析后得出PTX3与LC、嗜酸性细胞计数、生存时间呈负相关,PTX3与D-二聚体、WBC以及中性粒细胞呈正相关,具体结果见表3。
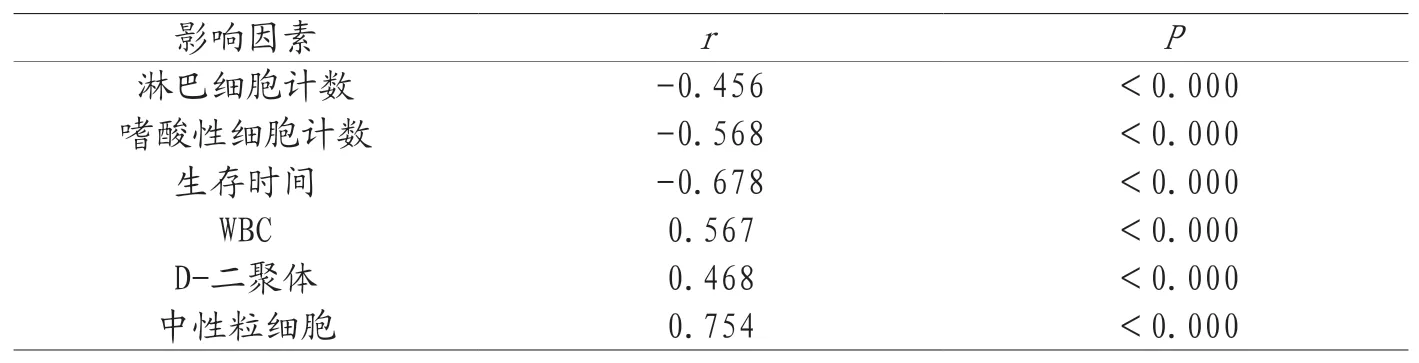
表3 相关影响因素的Spearman相关性分析
2.5多元线性回归中影响PTX3的影响因素分析 在多元线性回归分析中得出PTX3的独立影响因素为CRP、WBC和D-二聚体,具体结果见表4。
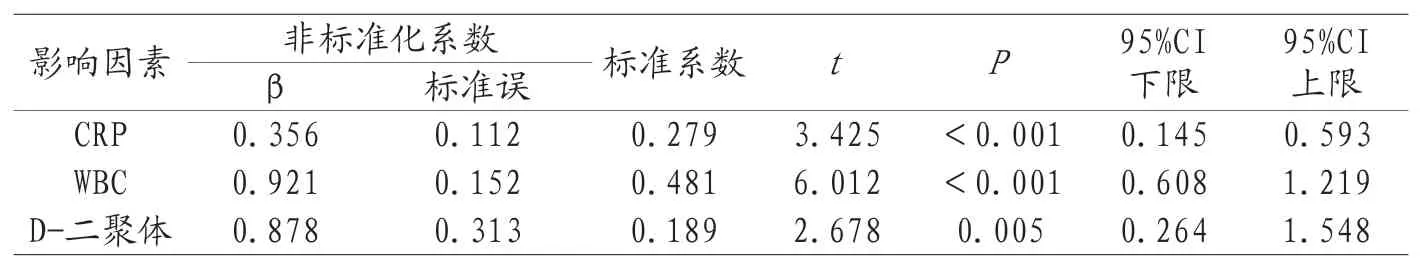
表4 多元线性回归中影响PTX3的影响因素分析
2.6高PTX3组与低PTX3组的Kaplan-Meier法生存曲线比较 所有患者的3年死亡率为39.45%(43例),其中高PTX3组有26例(60.47%),低PTX3组为17例(39.53%),患者的平均生存时间为27.08个月,ROC曲线已经证实PTX3预测AECOPD全因死亡的阈值为10.43,以10.43为临界值进行分组,比较两组生存率的差异。Kaplan-Meier法显示低PTX3组的3年生存率高于高PTX3组,具体情况见图2。
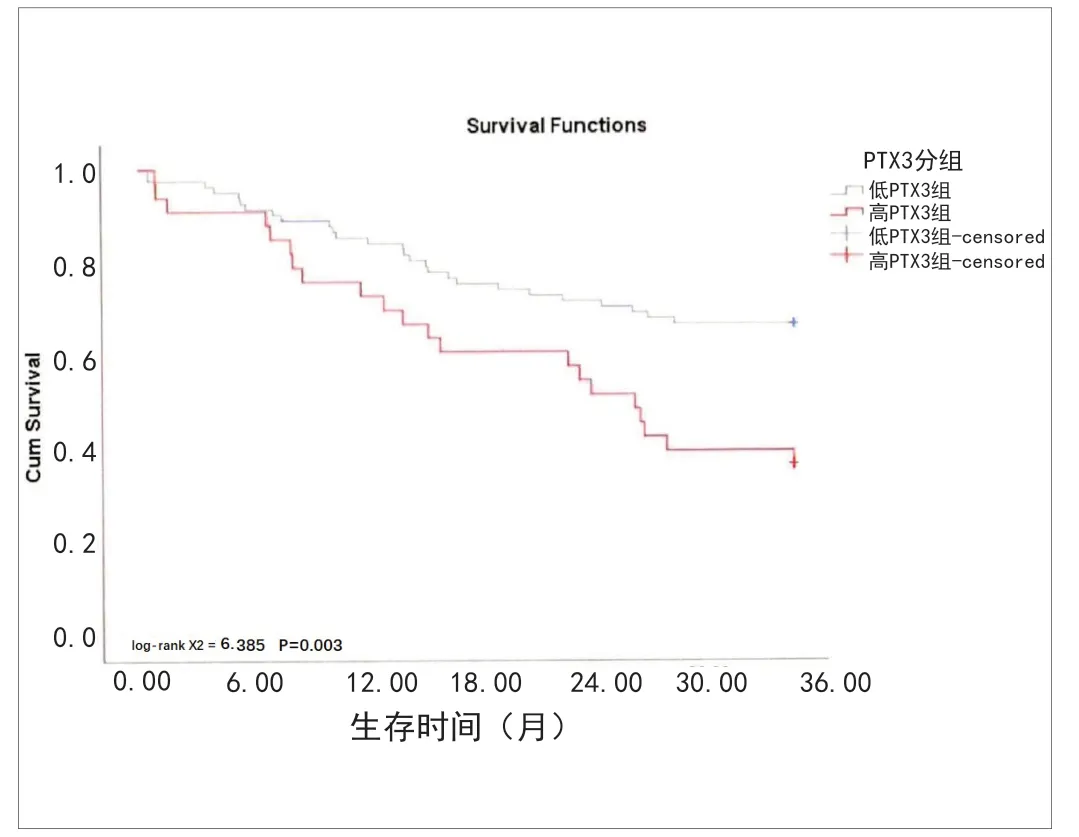
图2 高PTX3组与低PTX3组的Kaplan-Meier法生存曲线
2.7影响AECOPD患者3年死亡率的影响因素分析 将所有可能影响AECOPD患者3年死亡率的因素作为自变量进行单因素COX分析,再将其中有意义的指标纳入多因素COX分析模型中进行分析,最后单因素COX显示影响AECOPD患者3年死亡率的单因素为:合并心力衰竭、PTX3、BMI、D-二聚体;最后多因素COX模型分析显示,影响AECOPD患者3年死亡率的独立危险因素为PTX3,具体结果见表5、表6。
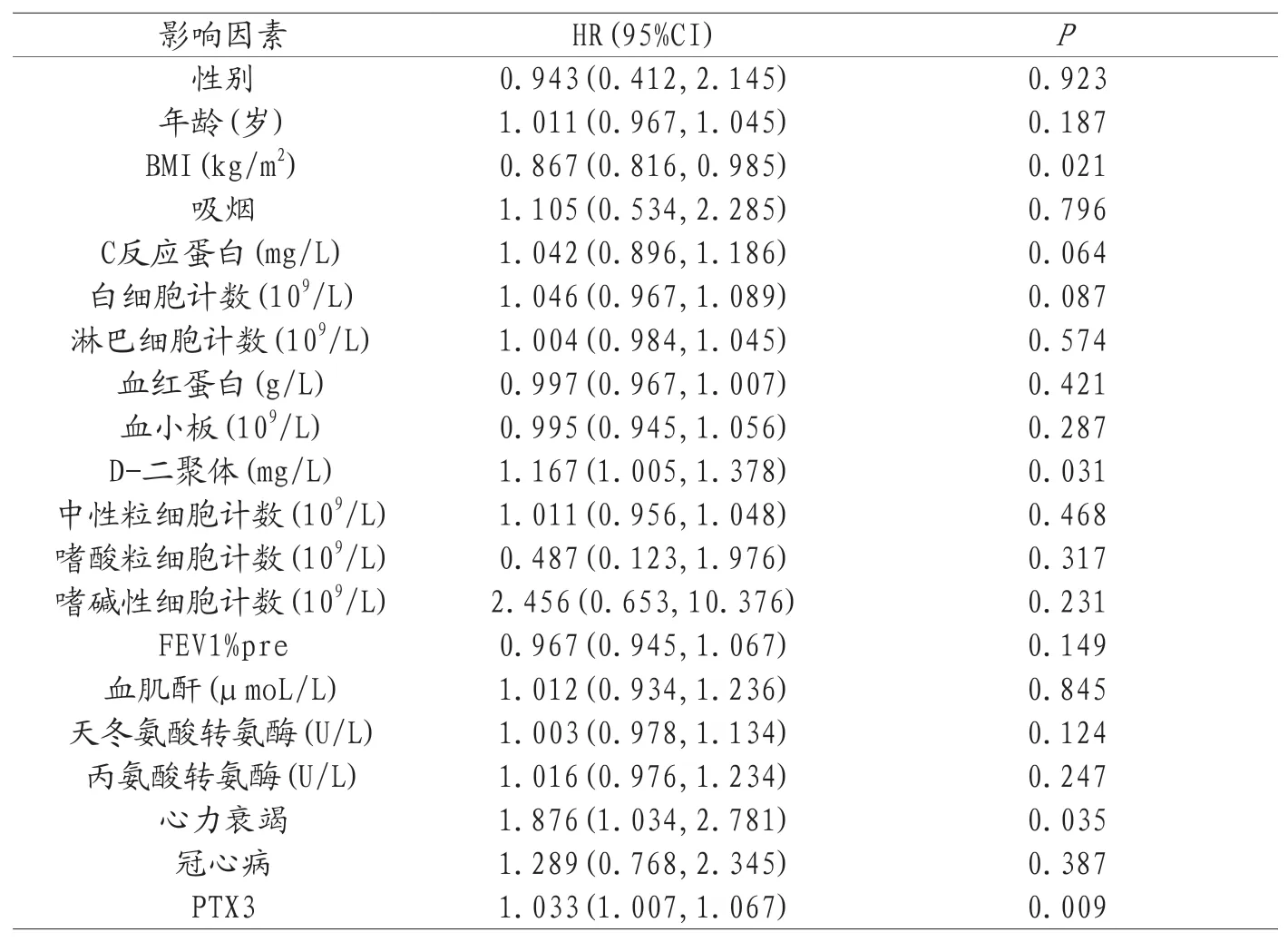
表5 影响AECOPD患者3年死亡率的单因素COX分析

表6 影响AECOPD患者3年死亡率的多因素分析
3 讨论
COPD患者的主要病理生理改变是以肺组织慢性破坏为主的炎性疾病,患者的主要临床症状表现为咳痰、咳嗽以及气短。近些年来随着我国工业化程度的不断加快,以及部分地区空气污染的加重,目前我国COPD的发病率呈现出一种逐渐升高的趋势,虽然目前考虑COPD的致病机制比较复杂,但是作为一种炎性疾病,其发病的可能原因之一为定植于气道内的细菌或者病毒诱导相应细胞释放炎性介质,从而诱发COPD[5-7]。而AECOPD患者,相对于稳定期的COPD患者而言,其整体肺功能更差,具有更为严重的呼吸道和全身炎症反应,对于这类患者,如果能寻找到一个临床可以量化的检测指标,从而判断患者的预后和近期的死亡率,则具有重大的实际意义。部分学者前几年相关的研究结果显示[3],PTX3可以预测AECOPD患者的近期预后,故笔者考虑,极有可能PTX3与AECOPD患者的3年死亡率也存在相关性,故进行本次研究,探讨两者的相关性。
PTX3于20世纪90年代由美国科学家首次发现,从构成上来说,与CPR蛋白同属于正五聚蛋白家族,为长链五聚体蛋白,其结构构成中含有放射状的1个五聚体蛋白,在生物学特征上PTX3有丰富的来源,接受多种途径的信号转换,广泛地参与体液免疫反应[8-12]。PTX3作为一种急性期的蛋白,在正常人体内呈现为低表达,而在发生炎症反应或者感染的人群中呈现为高表达,在这类人群中的敏感性和特异性均较高,既往国内部分学者的研究中显示[3],PTX3与老年AECOPD患者的严重程度密切相关,是预测该类患者死亡的独立危险因素。为此,在前期研究基础上,笔者团队首先通过PTX3预测AECOPD患者的全因死亡曲线的最佳截断值10.43进行分组,分为高PTX3组(PTX3≥10.43)和低PTX3组(PTX3<10.43),其中ROC曲线提示,对于AECOPD患者而言,PTX3具有较高的灵敏度和特异度预测这类患者的死亡情况。在对高PTX3组以及低PTX3组的各项临床资料比较中,笔者发现了与炎症反应相关的指标:高PTX3组与低PTX3组患者在白细胞(WBC)、C反应蛋白(CRP)、淋巴细胞计数(LC)上均存在统计学差异(P<0.05),其中高PTX3组的WBC、CRP以及LC显著高于低PTX3组。WBC、CRP作为一种传统的炎症反应指标,在炎症较为严重的患者中呈现出一种高表达,而LC在高PTX3组中呈现出高表达的原因笔者考虑为,淋巴细胞计数更多地代表为一种机体的免疫功能,部分学者认为在人体感染细菌或者病毒后,会引起整个机体的慢性免疫反应[13-14],笔者考虑可能是这个原因导致高PTX3组的LC高于低PTX3组。在进一步观察可能影响PTX3的因素时,笔者选择进行Spearman相关性分析。分析后得出PTX3与LC、嗜酸性细胞计数、生存时间呈负相关,PTX3与D-二聚体、WBC以及中性粒细胞呈正相关,这一结果提示PTX3与炎性反应程度呈正相关,极有可能与AECOPD患者的生存时间存在明确的关联。在更进一步的多元线性回归分析中得出PTX3的独立影响因素为CRP、WBC和D-二聚体,CRP、WBC作为炎性反应标志物,独立影响PTX3表达在意料之中,而D-二聚体相应的研究显示,对于AECOPD的患者而言,长期的缺氧伴随着CO2的潴留,AECOPD患者的血液处于一个高凝的状态[15],同时部分研究还显示D-二聚体的水平与CRP相关,故D-二聚体的水平可能也会影响到PTX3的表达,在预后不良的AECOPD患者中,CRP、WBC和D-二聚体、PTX3均呈现出高表达。为了进一步在统计学上验证PTX3是否能有效预测AECOPD患者的死亡率,Kaplan-Meier法显示低PTX3组的3年生存率高于高PTX3组,而这一结果与实际随访结果符合。最后,笔者团队将所有可能影响AECOPD患者3年死亡率的因素作为自变量进行单因素COX分析,再将其中有意义的指标纳入多因素COX分析模型中进行分析,最后单因素COX显示影响AECOPD患者3年死亡率的单因素为:合并心力衰竭、PTX3、BMI、D-二聚体;最后多因素COX模型分析显示,影响AECOPD患者3年死亡率的独立危险因素为PTX3。
综上所述,通过本次研究显示,PTX3是AECOPD患者全因死亡的独立危险因素,入院早期检测PTX3可以更好地评估患者的预后,对于入院初期血清PTX3水平呈高表达的患者,应给予更为积极的干预措施,包括进行一些延续性的医疗护理,从而能最大程度降低这类患者的3年死亡率,提高这类患者的总体生活质量。
