Li/CFx一次电池研究进展
2023-05-15蒋江民王新峰刘广发崔艳华庄全超
汤 才,蒋江民,王新峰,刘广发,崔艳华,庄全超
(1中国矿业大学材料与物理学院,江苏 徐州 221116;2中国工程物理研究院电子工程研究所,四川 绵阳 621000)
随着军事装备和航空航天的快速发展,储能领域迫切需要具有高能量密度、高功率密度和优异安全性的先进正极材料。氟化碳是一次电池中能量密度最高的转换型正极材料,因此受到了人们的广泛关注。锂/氟化碳(Li/CFx)一次电池作为目前能量密度最高的化学电源,应用于各种特定的领域,如便携式电子设备、微型医疗电子和军事装备等,特别是在军事领域中的单兵作战系统上的应用[1-3]。
氟化碳也被称为氟化石墨,Ruff等[4]于1934年首次合成出该材料,化学式为CFx,x一般可在0~1.3之间变化。20世纪70年代其作为一种石墨的深加工产品开始受到广泛的研究,是现今国际上高科技、高性能、高效益的新型碳/石墨材料研究热点之一[5]。氟化碳通常是由氟气和石墨在高温下直接反应而生成的共价键型石墨层间化合物(GIC,graphite intercalation compounds),嵌入结合能为2 kcal/mol (1 kcal=4.184 kJ),具有非常好的高温稳定性和远低于石墨的极低表面能,因而是一种优良的新型固体润滑剂[6-8]。从电池序列来看,F2和Li组合的电池是比较理想的,但F2氧化性太强,使用起来存在诸多困难。基于氟化石墨能使活泼的氟保存于固体中,Watanabe等[9]首先将氟化石墨作为一次锂电池的正极材料进行了研究。在以氟化石墨作正极、锂为负极所组成的非水系电池中,氟保存于固体石墨内,使石墨变成了活性材料,为电池的高能量密度和高电压创造了有利条件。20 世纪70 年代,松下公司率先实现了Li/CFx一次电池的工业化生产,是第一个商品化的有机电解液锂电池,可用于替代汞电池[10]。如图1 所示,相比于其他电池,Li/CFx一次电池具有以下优点[11-19]:比能量高、工作电压平稳、活性物质利用率高、使用温度范围宽、贮存寿命长、安全性好。
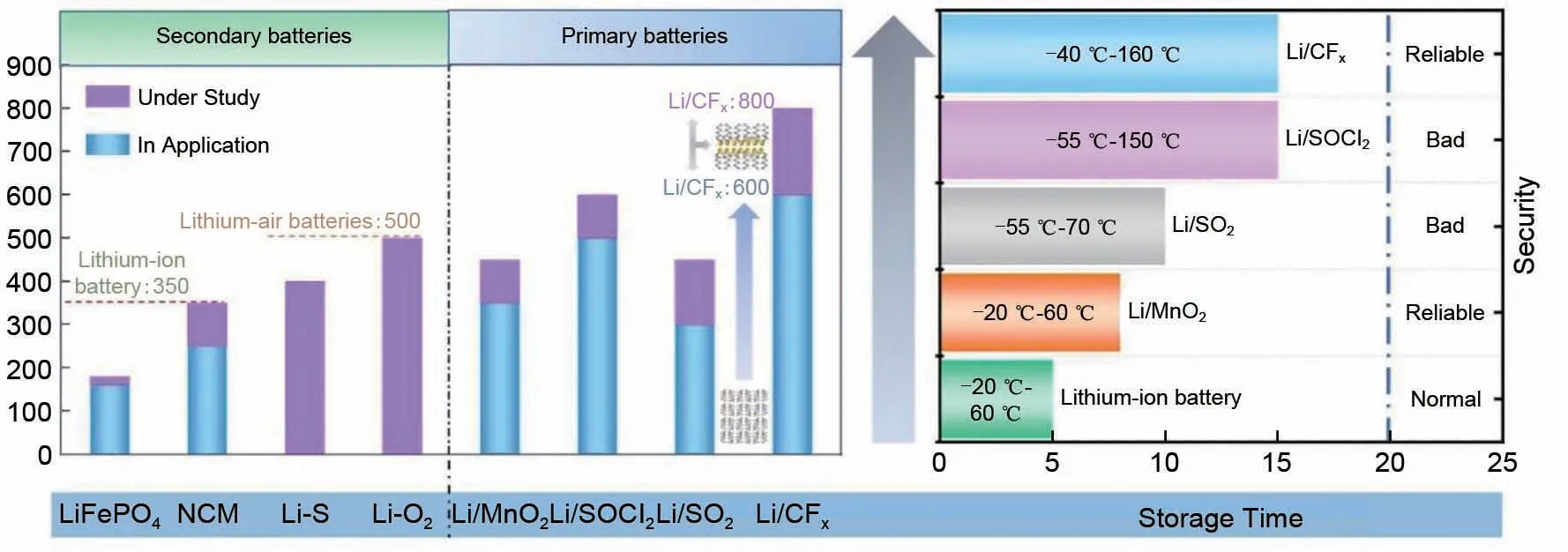
图1 电池产品性能指标比较图Fig.1 Comparison of various battery performance indicators
基于上述特点,Li/CFx一次电池在军事装备(单兵作战系统、射频发射装置、电子测试装置、导弹点火系统、信号灯、潜艇)、医疗(心脏起搏器)、太空探索(空间站)等关键领域具有重要作用[20-21]。然而,由于CFx材料电子电导性较差,使得Li/CFx一次电池倍率放电性能差和初始放电电压延迟时间长。上述问题严重制约了Li/CFx一次电池的快速发展。因此,研究与开发新型或改进型Li/CFx一次电池具有十分重要的意义和价值。本文结合近年来国内外相关研究工作,比较全面地介绍了Li/CFx一次电池的放电机制,对其合成、优化策略和存在的问题进行了综述,并展望Li/CFx一次电池未来的发展方向。
1 锂/氟化碳一次电池的工作原理
Li/CFx一次电池由氟化碳正极、金属锂负极和有机电解液组成。商品化Li/CFx一次电池的有机电解液一般由有机溶剂和溶于其中的电解质锂盐组成,电解质锂盐一般为LiBF4,这主要是由于LiBF4在热稳定性和低温下提供低电荷转移电阻方面优于LiPF6。有机溶剂可以为单一溶剂,例如γ-BL(γ-丁内酯),或有机溶剂混合物,例如DME(1,2-二甲氧乙烷)和PC(碳酸丙烯酯)的混合溶剂,其中DME则能降低电解液黏度,PC 能够提供高介电常数溶解盐,确保高离子电导性[22-23]。1970 年,Watanabe等[9]首次提出了Li/CFx一次电池的放电机理,如图2(a)所示,放电过程中金属锂被氧化,生成锂离子(Li+),释放出一个电子,电子通过外电路到达正极,并与正极活性物质反应生成LiF,这一机理通常被称为两相放电反应机制模型。Li/CFx一次电池放电反应方程式可分别表示为正极反应方程式(1)、负极反应方程式(2)以及总反应方程式(3)。从Li/CFx一次电池反应方程式可以看出,电池的理论比容量只与F/C 的比值x有关,其理论放电比容量Q与x的关系可通过公式(4)计算(其中3.6 是单位转换量,F为法拉第常数),其理论能量密度E可通过公式(5)计算。
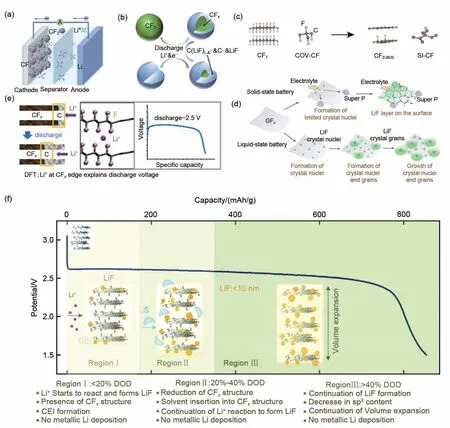
图2 (a) Li/CFx一次电池的结构及工作原理图; (b) Li/CFx一次电池放电的“核-壳”模型示意图;(c) SI-CF的形成示意图(SI-CF和COV-CF分别为半离子型和共价型C—F键);(d) 固态和液态电池中LiF晶核的形态演变过程示意图[28];(e) CFx锂化过程的Li+边缘传播机制示意图[29];(f) Li/CFx一次电池放电深度的机理示意图[30]Fig.2 (a) Structure and working principle of Li/CFx primary batteries; (b) Schematic of the "core-shell" model of Li/CFx primary battery discharge; (c) Schematics of the formation of SI-CF and thus CFL product (SI-CF and COV-CF refer to the semi-ionic and covalent CF bonds, respectively), (d) Schematics for the formation and growth processes of LiF crystal nuclei and grains in solid and liquid states batteries[28]; (e) Schematic of the Li+edge-propagation mechanism for the lithiation process of CFx[29]; (f) The schematic of the Li/CFx system mechanism through the depth of discharge[30]
两相放电反应机制模型无法解释电池实际放电电压(约2.5 V)远低于理论放电电压(>4.5 V)的原因,为此Whittingham等[24]在1975年提出了一种生成石墨层间化合物中间相的放电反应机制模型,简称为中间相放电反应机制模型,该模型认为氟化碳在放电过程中会先与锂离子反应生成一种石墨层间化合物中间相,随后石墨层间化合物中间相分解生成碳和LiF,其总反应方程式如式(6)所示。20世纪80年代初,日本京都大学Hagiwara等[25]研究发现氟化碳在不同电解液体系中的电压平台不同,此外,Li/CFx一次电池的开路电压和放电电压平台随Li+的溶剂化能增加而增加,显示溶剂分子是影响Li/CFx一次电池电化学性能的关键因素。由此修正了中间相放电反应机制模型,提出Li/CFx一次电池放电机理为:在放电过程中,溶剂化的锂离子进入氟化碳层间,生成三元中间相CFxLix: Sy(S为与锂离子共嵌入的溶剂),这种化合物随后自发分解为C、LiF 与溶剂,将溶剂释放回有机电解液中,整个过程是不可逆的,使电池开路电压从4.5 V降至3.0~3.5 V,同时在反应过程中产生大量的热,其正极反应方程式、负极反应方程式和总反方程式如式(7)~(9)所示,这一反应机理目前得到人们的广泛接受。
随后,Nakajima等[26]对氟化石墨正极在有机电解液中的放电反应动力学研究结果证实,氟化石墨电极相对较大的过电位是由于放电反应在氟化石墨电极表面产生的石墨夹层化合物,导致薄扩散层中锂离子转移延迟造成的。2009年,Zhang等[27]在上述基础上进一步提出了一种补充思想来解释电池初始放电过程中的电压滞后现象,一般称为“核-壳”放电反应机制模型,如图2(b)所示。该模型认为,氟化碳和石墨层间化合物中间相之间的放电反应是通过以氟化碳为核和由石墨层间化合物中间相、碳和LiF 组成的壳的收缩核模型进行的。虽然“核-壳”放电反应机制模型能够解释氟化碳从反应开始至完全消耗的过程,但氟化碳在整个放电过程中的形态演变过程未得到证实。
2019年,Zhong等[28]采用X射线衍射、扫描电镜、原位高分辨透射电镜、高分辨核磁共振光谱等表征技术研究了氟化碳的锂化机制以及放电产物LiF 在液态/固态电池中的形态演变过程。研究发现,Li/CFx一次电池放电过程中生成了一种低含氟量的氟化碳(CFL,L≤0.06),如图2(c)所示。此外,在固态电池中,氟化碳颗粒的锂化从较小的区域开始并逐渐扩散到电极表面形成LiF 钝化层;然而在液态电池中,C—F 键在放电过程中可同时与从负极穿梭过来的锂离子反应形成大量LiF 晶核并立即长大,随后在孔隙内大量沉积而形成SEI膜,这不仅阻挡了锂离子的传输通道,还产生了较为严重的体积膨胀效应,使得极片很容易从集流体上脱落,严重影响后续的放电性能,如图2(d)所示。最近,Leung 等[29]提出了一种基于溶剂分子参与锂化过程的边缘传播放电反应机制,该模型认为溶剂配位的Li+与处于部分放电状态氟化碳的反应是在氟化碳结构锯齿状边缘即CFx/C界面处发生的,而不是体相反应途径,如图2(e)所示。2022 年,Sayahpour等[30]根据对CFx放电机理的多尺度研究结果,提出了CFx锂化过程的三步放电反应机理模型,如图2(f)所示,该模型认为:①Li/CFx一次电池在整个放电过程中没有锂沉积层或嵌锂化合物层存在;②随着放电深度的增加,CFx结构转变为sp2含量较少的硬碳样结构;③晶态LiF颗粒均匀地覆盖在CFx结构层中,整个CFx层的LiF 尺寸范围在<10 nm。这种多尺度的放电机理研究结果对未来设计更高功率密度CFx正极的实验和计算工作将起到重要的指导作用。
2 氟化碳材料的改性与优化
石墨的氟化是碳原子之间的大π键断裂,氟原子与碳原子结合形成C—F 共价键的过程。氟化碳中的C—F共价键的键能较高且碳原子呈sp3杂化状态,因而该材料的导电性差,是导致Li/CFx一次电池存在严重的放电初期电压滞后现象以及较差的放电倍率性能等缺点的重要原因[31]。由于碳氟键的共价性,氟化碳的电导率会随着氟含量即CFx中x(即C/F 比)的增加而降低,当C/F比大于1 时,该材料几乎是绝缘体。同时氟化碳材料的放电比容量是直接由其中的氟含量即C/F比决定的,降低C/F 比虽然可以提高氟化碳材料的导电性能,但会降低氟化碳材料的放电比容量。其中,原材料的石墨化程度、材料的维数、结构有序程度等以及氟化条件如氟化时间、反应温度、容器压力以及气相反应物的组成等是影响CFx结构和性能的关键因素。因而如何优化氟化碳材料的C/F比使氟化碳材料能同时兼顾较高放电比容量和导电性能,或在C/F比不变的情况下增进氟化碳材料的导电性能,是一个极具挑战的课题。为此,研究人员分别通过选择合适的氟化碳前驱体、氟化方法的改进、氟化碳正极结构优化和电解液的调控等方面进行了探索。
2.1 前驱体的选择
目前已经商品化的氟化碳材料为氟化石墨,例如氟化石墨碳纤维。石墨碳纤维是一种含碳量在95%以上的高强度新型纤维材料,Lewis研究中心对其进行氟化,得到了氟化碳纤维材料[32]。Chamssedine等[33]通过对碳纤维表面进行氟化,而内部却能保持原有的未氟化的碳纤维结构,在保持高比容量的同时,提高了该材料的电子传导性,此方法已被美国Contour 公司推广应用到商品化Li/CFx一次电池中。但是石墨的片状结构不利于锂离子电化学反应进行,特别是高倍率放电条件下。随着碳材料科学与纳米技术的发展,研究者在材料改善方面进行了不少尝试。硬碳是指其中的石墨烯片随机堆叠并通过边缘碳原子交联,高温下不能石墨化的碳材料。相比于石墨化碳,硬碳材料在机械强度和结构稳定性方面展现出极大的优势,被认为是下一代最具应用潜力的锂/钠离子电池负极材料之一。Zhou 等[34]采用直接气相氟化法对一系列的硬碳进行了氟化,并通过改变氟化的温度来调节其电化学性能。研究发现,氟化硬碳(FHC2)的F/C比随着温度的升高而增加,放电平台随着半离子F—C 键含量的降低而降低。测试表明在约390 ℃下通过气相氟化所获得的氟化硬碳具有最高的比容量(922.6 mAh/g),其提供的能量密度为2466 Wh/kg,高于商用氟化石墨的理论值(2180 Wh/kg)。此外,氟化温度在约370 ℃下所获得的样品具有良好的倍率性能,即使在5 C的电流密度下放电,其容量保持率为74.3%[图3(a)~(d)]。此外,通过采用新式结构的碳材料,例如碳纳米管、富勒烯、石墨烯等,它们作为CFx材料的前驱体是改善Li/CFx一次电池倍率性能的普遍方法。因此,氟化碳纳米管、氟化富勒烯、氟化石墨烯等新型氟化碳材料映入眼帘[图4(a)],通过氟化新型的碳基材料可以提高和改善Li/CFx一次电池的放电倍率性能。
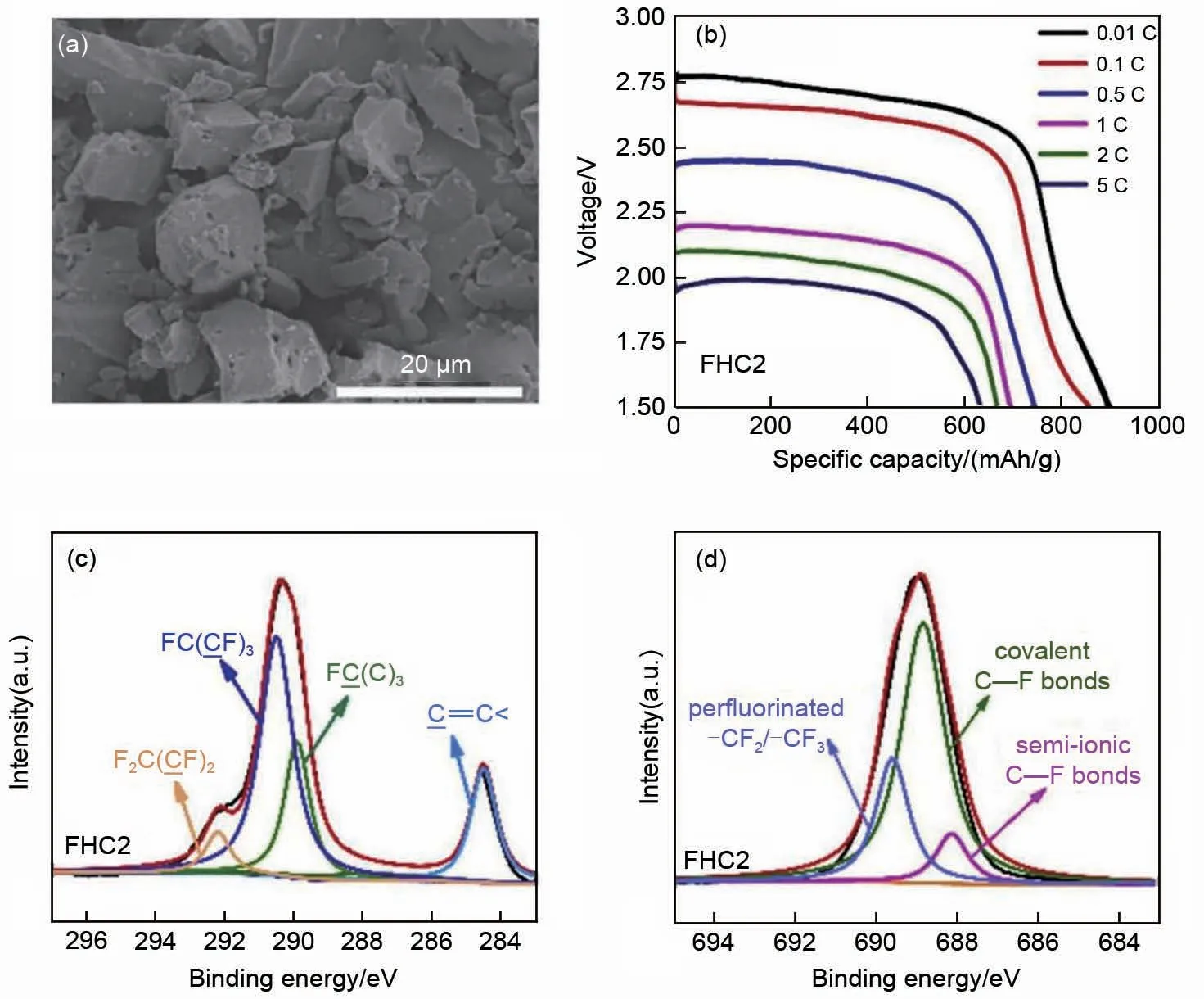
图3 (a) 氟化硬碳的SEM图像;(b) 氟化硬碳在不同电流密度下的放电曲线;氟化硬碳的高分辨 (c) C1s和 (d) F1s XPS光谱[34]Fig.3 (a) SEM image of fluorinated hard carbon, (b) Discharge curves of fluorinated hard carbon at different current densities, High-resolution (c) C1s and (d) F1s XPS spectra of fluorinated hard carbon[34]
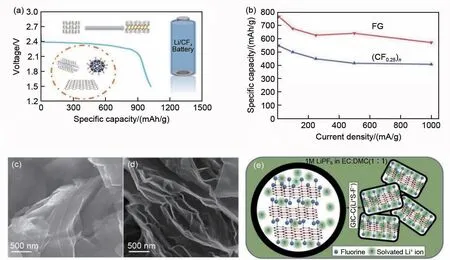
图4 (a) 氟化石墨、氟化碳纳米管、氟化富勒烯、氟化石墨烯的放电示意图;(b) (CF0.25)n和FG在不同电流密度下的比容量比较;(c) (CF0.25)n和 (d) FG的SEM照片;(e) (CF0.25)n和FG发生锂化的示意图[41]Fig.4 (a) Schematic of the discharge of fluorinated graphite,fluorinated carbon nanotubes,fluorinated fullerenes,and fluorinated graphene; (b) Comparison of specific capacities of (CF0.25)n and FG at different current rates,SEM photographs of (c) (CF0.25)n and (d) FG;(e) Schematic representation of lithiation of fluorinated graphite polymer and fluorinated graphene[41]
碳纳米管是一种重量很轻的一维纳米材料,具有诸多良好的电气、力学和化学特性。氟化碳纳米管的颗粒尺寸小,将氟化碳纳米管等材料加入到氟化石墨中,利用其对电子和锂离子快速迁移和传导的促进作用,提高电子在材料颗粒间的传递和整体材料的振实密度,减小氟化石墨的电绝缘性。Ahmad等[35]制备出低氟化的少壁碳纳米管,其实际的比容量值为900 mAh/g,超过了理论值(521 mAh/g),这种优异的电化学性能可能与少壁碳纳米管经过低氟化后中心处的缺陷有关。Jayasinghe等[36]采用流化床化学气相沉积技术合成了氟化多壁碳纳米管,研究发现氟化程度的不同对比容量具有显著的影响。全氟化多壁碳纳米管具有高达815 mAh/g 的比容量,而随着氟化程度的减弱,比容量也不断衰减。氟化程度的提高,增加了缺陷密度并减弱了电子传导能力,这使得全氟化多壁碳纳米管表现出较低的可充电容量,而轻度氟化的多壁碳纳米管在充放电循环中表现出较高的比容量和更好的稳定性,这些形成的轻度缺陷将为锂离子进入电化学反应活性位点提供额外的途径。
富勒烯(C60或C70)是碳材料的一种,值得注意的是,富勒烯与其他的碳材料相比,在室温下就可被氟气氟化形成具有高氟化度的富勒烯,如C60F46~54或C70F52~56。研究表明,C60和C70在300 ℃以下仍然可以保持笼状的结构,而一旦超过该温度后笼状结构将被破坏[37-39]。
石墨烯作为石墨的组成部分,具有优良的导电和热传导性能,其在电学、力学、材料学、微纳米加工、能源和药物传递等方面具有重要的应用前景。氟化石墨烯作为石墨烯的新型衍生物家族中的一员,不仅具有石墨烯比表面积大和导电性好的特点,还具有氟化碳材料容量大的优点。Meduri等[40]采用不同F/C比例的氟化石墨烯作为正极材料,改善了溶剂化Li+离子在石墨烯中的传输动力学,显著提高了电池的倍率性能,其性能优于传统的氟化石墨。Damien 等[41]通过化学剥离的方法对(CF0.25)n石墨聚合物进行处理,获得了超低氟含量的氟化石墨烯(FG),构建了低成本和环境影响较小的高效一次电池体系,并极大提高了电池的比容量和倍率性能[图4(b)~(d)]。通过研究分析,大幅提高性能的原因是氟化石墨聚合物形成的厚GIC层阻碍了溶剂化锂离子在(CF0.25)n基电极中的扩散,而氟化石墨烯形成的GIC层在氟化石墨烯基电极中最小,使得溶剂化锂离子的扩散更容易。得益于氟原子能很好地附着在石墨结构中,相比于(CF0.25)n,氟化石墨烯中表面氟原子密度的增加使得其锂化更容易[图4(e)]。此外,Bi等[42]以氮、氧掺杂的石墨烯气凝胶为前驱体,通过直接氟化法制备了一系列的氟化石墨烯材料,并研究了氟化温度对石墨烯结构的影响。氟化石墨烯作为石墨烯的一种新型衍生物,相信在不久的将来会成为高性能且有应用前景的电极材料。
2.2 氟化方法的选择
氟化碳材料的合成通常使用碳和氟源之间的标准化学反应来完成,其中时间、温度和反应物浓度是影响反应的关键变量。氟化碳材料中的C—F 键主要分为共价键、半离子键和离子键三种键型。其中,当C—F键为sp3杂化的共价键时,氟化石墨的导电性最差,电池的开路电压低,高倍率放电性能较差。而由C—F 半离子键和离子键构成的氟化碳材料其电化学性能较好,含有离子键时开路电压最高[43-46]。因而通过不同的氟化方法,可以得到性能不同的氟化石墨。目前,商品化CFx主要采用高温直接氟化法制备。该方法是将高纯石墨加入到石墨反应器(如管式反应炉)中,并将反应器抽空,通入氟氮混合气体;然后,在一定的原料配比、温度条件下进行反应;最后,在持续通入氮气的情况下进行冷却,从而制得不同含氟量的氟化石墨产品。高温直接氟化法反应控制条件较少,容易实现批量化生产,是氟化石墨制备使用最早的方法,也是工业制备采用的主要方法之一,在短时间内难以被其他方法取代。20世纪70年代,研究者首次合成了F/C比例高达1.3的高温氟化石墨[9]。理论上,当每个碳原子与氟成键时,CFx中x的值应等于1,即CF1。但是随着温度的不同,所合成的CFx中x的值会在一定的区间变化。实验验证表明,在500~650 ℃的高温下进行氟化,合成的氟化碳材料具有较高的F/C 比,而且氟化温度越高,结晶度越高[47]。但是高温直接氟化法制备的CFx产品中的游离氟含量低,C—C 键多为sp3杂化,C—F 键多为共价键。虽然高温直接氟化法制备的CFx产品中氟含量较高,但产品导电性能较差,致使电池放电过程中产生很大的极化,即使在低电流密度下放电,仍无法接近理论容量,而在大电流密度下,电池的放电平台与容量均迅速下降,限制其在高功率密度电源中的应用。在高温直接氟化法制备CFx材料过程中,如果在石墨与氟气的反应系统中加入微量金属氟化物(LiF、MgF2、AlF3和CuF2)作为催化剂,不仅可以加快合成速度和降低氟化温度(合成可在300 ℃以下进行),而且由于微量金属氟化物的加入,使氟化石墨性质有所改变,电导率可提高一个数量级,但对反应原材料和催化剂纯度均要求较高。
低温间接氟化法是一种不太常见的电化学氟化方法,一般是采用BF3、IF5、IF7、WF6等作为氟化剂在室温下对碳材料进行氟化,碳源可在低温下被Lewis 酸氧化形成氟化石墨[48-50],石墨片层之间夹杂着F原子,形成GIC[51]。Read等[52]通过在室温下用CoF3对石墨或炭黑进行高能量研磨,实现了电化学活性氟化碳的合成。使用该工艺制备的材料的最大组成为C1.6F,并具有共价和半离子型C—F键。XPS和电化学放电结果表明,氟化碳粉末的半离子性质较大,且该材料具有3.2 V 的高放电电位,放电比容量范围为450~500 mAh/g(放电至2.0 V)。低温间接氟化法制备的CFx材料中,C—F键含有部分离子键和半离子键,C—C键仍然保持了部分sp2杂化[53],因石墨结构受到破坏较少而保持了较好的导电性,材料放电平台较高,具有优异大倍率放电性能。通常高温直接氟化法制备的氟化石墨一般只能在3 C倍率下放电,而低温间接氟化法制备的氟化石墨可在5 C的高倍率下放电,并且其放电电压平台高于高温直接氟化法制备的氟化石墨[53]。低温间接氟化法虽然成本相对较低,但是其工艺过程繁琐,反应时间长,且催化剂残留会阻碍Li+在石墨层间的扩散,并导致较大的自放电,导致容量下降[54]。无论是高温直接氟化法还是低温间接氟化法,碳源的选择不同,其所需的氟化温度也不尽相同。当碳质原材料表现出高比表面积和低晶序时,氟化反应在较低温度下即可发生[55-58]。
无论是高温直接氟化法还是低温间接氟化法,原材料中均需使用到强氧化性、强腐蚀性物质,对高温直接氟化法而言,反应还需在高温下进行,生产很不安全。固相法合成工艺是用含氟固体聚合物(如四氟乙烯、六氟丙烯、聚乙酸乙烯树脂萤石和乙烯基萤石等制成的聚合物)与石墨混合,在氦、氖、氩、氮等惰性气氛下,在管式电炉中的石英管内加热至320~600 ℃,制得氟化石墨。例如夏金童等[59]采用固相合成法,通过固态聚四氟乙烯与石墨在450 ℃的氮气气氛下合成出了氟化石墨材料。该方法相对于高温直接氟化法和低温间接氟化法具有工艺简单、安全、成本低的优点,为安全生产氟化石墨提供了良好的条件。此外,电解法合成工艺是在循环式电解装置中(在镍板制的阳极和阴极之间使石墨和氢氟酸悬浮液循环),将碳素或石墨材料在无水氢氟酸中电解,生成氟化石墨,近年来也受到一定重视。
2.3 亚氟化方法的改性
研究表明,通过使用未完全氟化的氟化碳材料来获得颗粒中的导电路径,即在氟化部分之外保留一部分的导电碳,是改善氟化碳材料导电性能的重要方法。通过控制氟化条件、氟气流量和反应时间,可以实现材料的亚氟化过程,以此获得含有非氟化碳原子纳米结构层的氟化碳材料。亚氟化工艺已应用于各种类型的碳材料,如碳纳米纤维(CNFs)[60]、少壁和多壁碳纳米管[35-36]、石墨烯[40]和多孔电极,即模板化的中孔碳[55,61-62]。研究发现,氟含量越多,导电性越差,因而控制氟含量是提高电化学性能的关键。为此,Chen等[63]运用低温等离子体技术改变CFx的表面形态、化学成分和微观结构,以增加C—F离子键,实现高效物理脱氟,可以实现在10 C下放电[图5(a)~(b)]。此外,Dai等[64]在温和水热条件下对CFx表面去氟,通过在绝缘的CFx表面原位生成低氟化石墨烯壳层,提高了材料的电子电导率和锂离子传输速率,所组装的电池能在30 C下实现高容量和高功率放电[图5(c)~(d)]。基于上述两种脱氟机制,分别构建了氟化碳表面导电网络,增强了氟化碳的导电性,实现电池的高倍率放电。
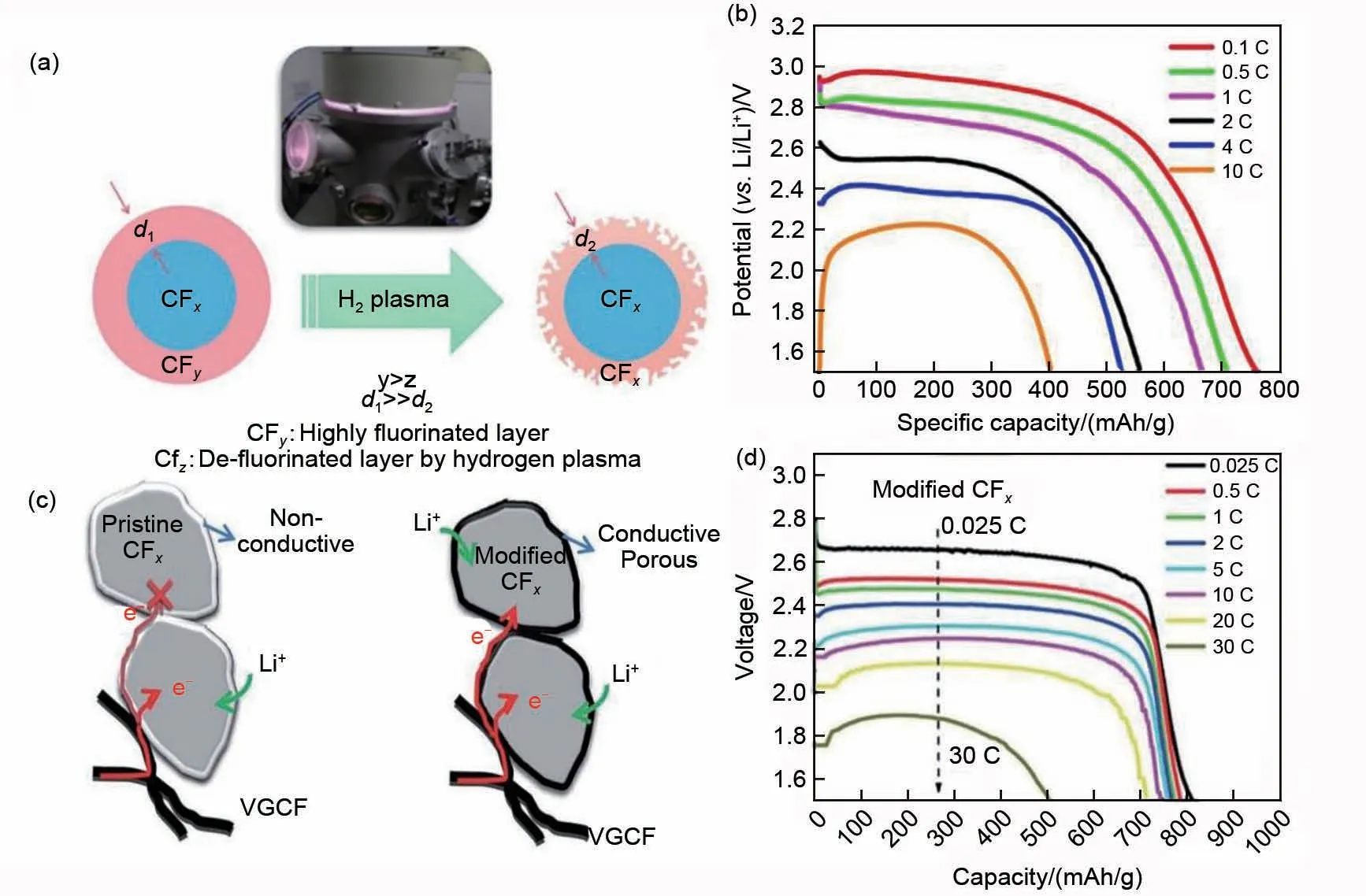
图5 (a) CFx粉末等离子体处理的示意图;(b) 等离子体改性后CFy放电曲线[63];(c) 原始和改性后CFx的电子传输路径示意图;(d) 改性后CFx的放电曲线[64]Fig.5 (a) Schematic drawing of the plasma treatment on CFx powders (CFy denotes the highly fluorinated layer formed in the high-temperature fluorination process); (b) CFy discharge curve after modification by plasma[63];(c) Schematic diagram of electronic paths for pristine and modified CFx during discharge; (d) Discharge curve of CFx after modification[64]
2.4 复合材料的构建
2.4.1 氟化碳与导电聚合物的复合正极
在CFx表面包覆一层超薄导电材料也是提高Li/CFx一次电池电化学性能的常用策略之一。Groult 等[65]首次提出运用电催化的方法在氟化碳材料上包覆导电聚合物,他们以乙腈和吡咯为单体,在氟化碳上电沉积聚吡咯(PPy)[图6(a)]。CFx/PPy 复合材料在制备的过程中,氟化碳材料本身不受影响,电极中晶粒之间的电导率显著提高,可实现电池的4 C放电,最大功率密度可达1364 W/kg。Li 等[66]采用聚苯胺(PANi)包覆氟化碳[图6(a)],以复合材料为正极所组装电池的阻抗值明显降低,可在8 C 下放电。同样的,Yin等[67]通过噻吩单体在氟化石墨表面的原位聚合,合成了一系列聚噻吩/氟化石墨(PTh/CFx)复合材料。TEM图像显示了PTh很好地包覆在CFx的表面,形成的PTh涂层既可以作为导电剂又可以充当多孔吸附剂。电化学阻抗谱(EIS)证实了该涂层有效降低了电极的电荷转移电阻,所组装的电池可以在4 C下高倍率放电[图6(a)~(f)]。
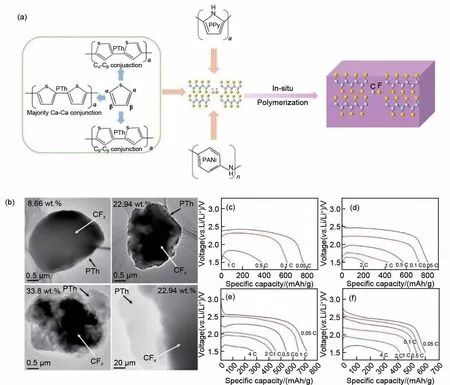
图6 (a) 典型导电聚合物和CFx复合阴极材料的合成示意图;(b) 不同PTh含量(8.66%、22.94%和33.80%质量分数,下同)的CFx@PTh复合材料的TEM和HRTEM图像;(c) CFx;(d) 质量分数8.66% PTh/CFx,(e) 质量分数22.94% PTh/CFx和 (f) 质量分数33.8 % PTh/CFx在不同倍率下的恒流放电曲线[67]Fig.6 (a) Schematic representation of the synthesis of a typical conducting polymer and CFx composite cathode material; (b) TEM and HRTEM images of CFx@PTh composites with various PTh content (8.66%,22.94%, and 33.80 %); Galvanostatic discharge curves at different rates of (c) CFx, (d) 8.66% PTh/CFx, (e) 22.94%PTh/CFx, and (f) 33.8% PTh/CFx[67]
2.4.2 氟化碳与金属单质材料的复合正极
相比于导电聚合物,高导电性金属单质构建的表面导电网络具有一定优势。研究发现,银(Ag)[68]、铜(Cu)[69]、铂(Pt)[70]和钌(Ru)[71]等高导电性金属与氟化碳进行复合可以获得优异的电化学性能[图7(a)]。其中,Zhang等[70]首次制得Pt纳米颗粒/CFx复合材料,所组装的一次电池可以在5 C的倍率下进行放电,且放电比容量相比于纯氟化碳材料有着明显的提升,可能归因于在铂纳米颗粒均匀地分散在CFx材料表面时,出现了半离子C—F 键,并降低了电荷转移电阻[图7(b)~(e)]。
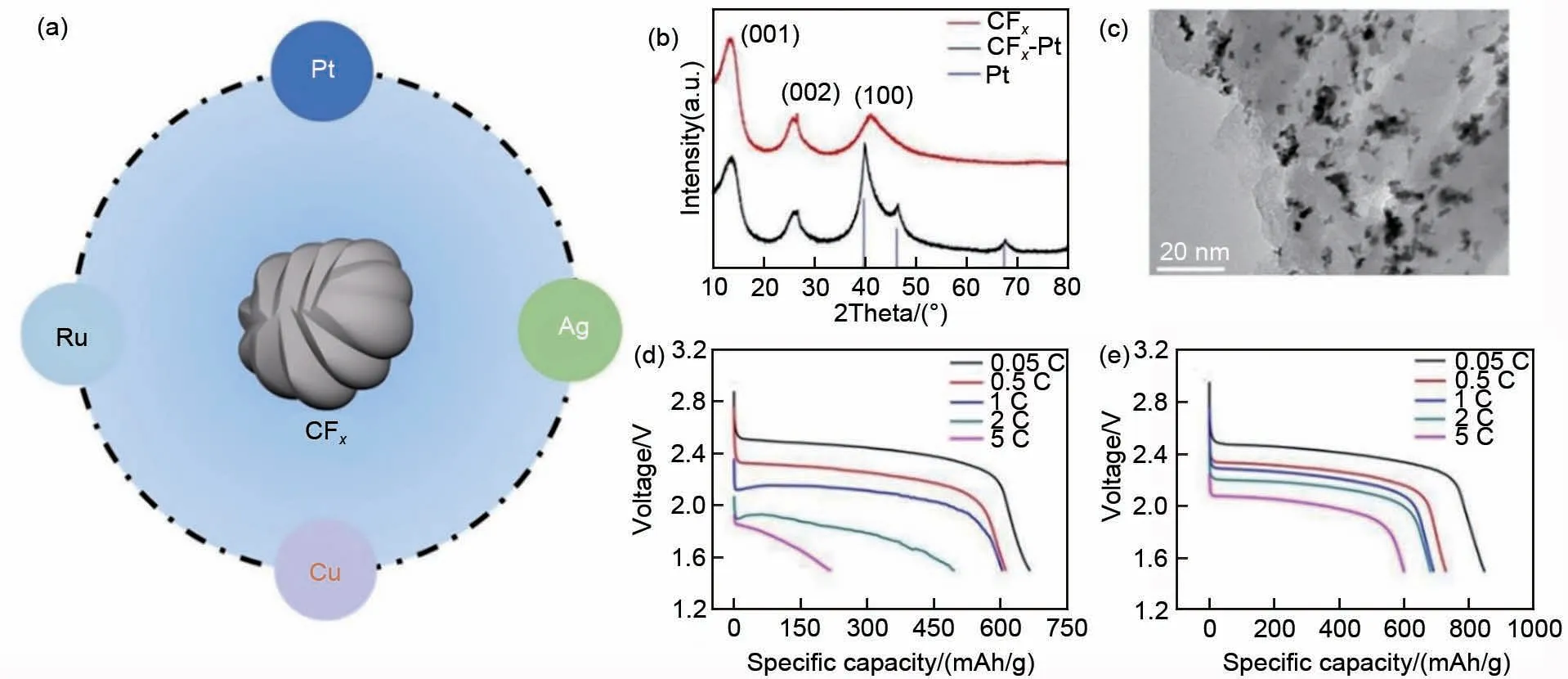
图7 (a) 几种导电金属与CFx的复合示意图;(b) CFx和CFx-Pt的XRD谱图;(c) CFx-Pt的TEM图像;(d) CFx和(e)CFx-Pt的恒流放电曲线[70]Fig.7 (a) Schematic of several conductive metals compounded with CFx; (b) XRD patterns of CFx and CFx-Pt;(c) TEM images of CFx-Pt; The galvanostatic discharge curves of (d) CFx and (e) CFx-Pt[70]
2.4.3 氟化碳与氧化物材料的复合正极
除了高导电性金属单质外,将氟化碳与氧化物进行复合,也能够显著改善氟化碳的电化学性能。二氧化锰(MnO2)被认为是能降低电池电压滞后性的廉价有效材料。为此,Li 等[72]采用平行排列的CFx/MnO2复合正极,发现电荷转移发生在MnO2和CFx的界面处,其中,CFx和MnO2平行的排列结构,使得锂离子的传输速率明显增加,提升了电池的能量密度和功率密度[图8(a)]。Chang 等[73]也采用CFx/MnO2作为复合正极材料,通过对电池测试分析,发现电池的电压平台显著提升,且自放电率明显降低,从而使其具有超长的贮存寿命。同样的,Luo 等[74]将二氧化锰纳米线作为三维导电框架缠绕和包覆在CFx材料表面,提高了CFx材料的导电性,所组装的一次电池可在6 C的高倍率进行放电,能量密度和功率密度均有明显提升,并且在0.1 C 的放电倍率下具有宽温域(-30~100 ℃)[图8(b)~(d)]。除了金属氧化物,纳米级二氧化硅因具有高储锂能力、丰富的储量和易于制备的技术而被广泛应用。Zhu等[75]采用不同二氧化硅(SiO2)源和氟化碳复合,应用于锂一次电池。采用SiO2改性后的复合材料所组装的一次电池,明显地提高了电池的比容量和电压平台,改善了器件的能量密度和功率密度。同时,运用XPS分析表明,SiO2会和—CF2基团反应产生SiF4[图8(e)],从而使改性复合材料中存在C—F 半离子键,导致F/C 比例降低。因此,这是一种通过硅化物打破CFx表面的—CF2的有效方法。此外,该反应还增加了CFx的表面积,促进其与电解液的接触,从而进一步提高了锂离子的流动性,增强了复合正极的电化学性能[图8(f)~(i)]。
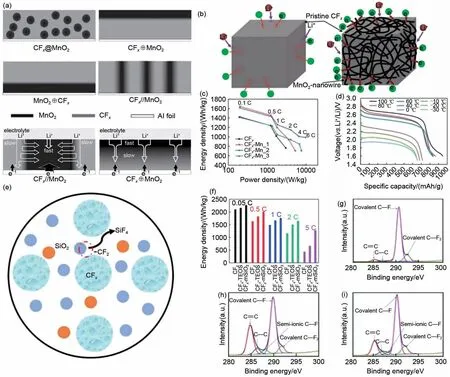
图8 (a) 四种不同构型的CFx-MnO2复合阴极(CFx@MnO2、CFx⊕MnO2、CFx⊕MnO2和CFx//MnO2)的排列示意图,以及CFx//MnO2的电荷转移机制[72];(b) CFx和CFx@MnO2纳米线复合材料的电子和锂离子路径示意图;(c) 原始CFx和CFx@MnO2-纳米线复合材料的Ragone图;(d) CFx/MnO2-纳米线复合材料在0.1 C时的高低温放电曲线[74];(e) CFx与SiO2反应机理示意图;(f) 不同电流密度下的各种基于CFx正极的质量能量密度;(g) CFx、(h) CFx-TEOS和 (i) CFx-mSiO2的高分辨率C1s光谱[75]Fig.8 (a) The schematic arrangement diagrams of four kinds of CFx-MnO2 composite cathodes with different configurations (CFx@MnO2, CFx⊕MnO2, CFx⊕MnO2, and CFx//MnO2), accompanied with the charge transfer mechanism in CFx//MnO2[72]; (b) Schematic of electron and lithium ion pathways for CFx and CFx@MnO2-nanowire composites; (c) Ragone plots and of pristine CFx and CFx@MnO2-nanowire composites; (d) High and low temperature discharge curves of CFx/MnO2-nanowire composites at 0.1 C[74]; (e) Schematic of the reaction mechanism between CFx and SiO2; (f) Gravimetric energy densities of various CFx- based cathodes at different current densities,and high-resolution C 1s XPS spectra of (g) CFx, (h) CFx-TEOS and (i) CFx-mSiO2[75]
3 电解液的改性与优化
Li/CFx一次电池在放电过程中,放电产物中会生成LiF,LiF不溶于电解液,将沉积在活性材料表面。随着电池放电深度增大,更大尺寸的LiF 晶体将覆盖活性材料的表面,不仅会造成电极体积膨胀,也会堵塞多孔电极内部锂离子液相扩散的通道,增大电极极化。因此,通过优化电解液组分控制LiF 生长,减小LiF 的晶体尺寸可以有效地降低电极极化,这是改善Li/CFx一次电池电化学性能的一种重要方法。
氟离子结合剂可以溶解放电反应中产生的LiF,是改善Li/CFx一次电池电化学性能的一种有效方法。Nagasubramanian等[76]通过向电解液中加入硼酸三酯氟离子结合剂(1,1,1,3,3,3-六氟-2-丙基)来溶解放电过程产生的LiF,从而改善电池在高倍率下的放电性能,含添加剂的氟化碳电池的能量密度(正极的单位重量)比商用纽扣电池高80%。如图9(a)~(c)所示,Li等[77]在电解液中引入BF3添加剂,以溶解氟化碳放电产生的边缘堵塞的LiF。结果显示,当BF3浓度为0.01 mol/L时,氟化碳能够在15 C放电倍率下表现出23040 W/kg 的卓越功率密度和722.8 Wh/kg的能量密度。进一步的XPS分析表明,BF3可以与LiF反应生成可溶性物质LiBF4,释放锂离子通道,从而提高锂/氟化碳电池的性能,使得电池在具有超高功率密度条件下,同时保持较高的能量密度。Ignatova 等[78]使用15-冠醚-5(15-crown-5)作为Li/CFx一次电池的电解液添加剂,所组装的电池在-50 ℃的低温下仍然具有较高的比容量。
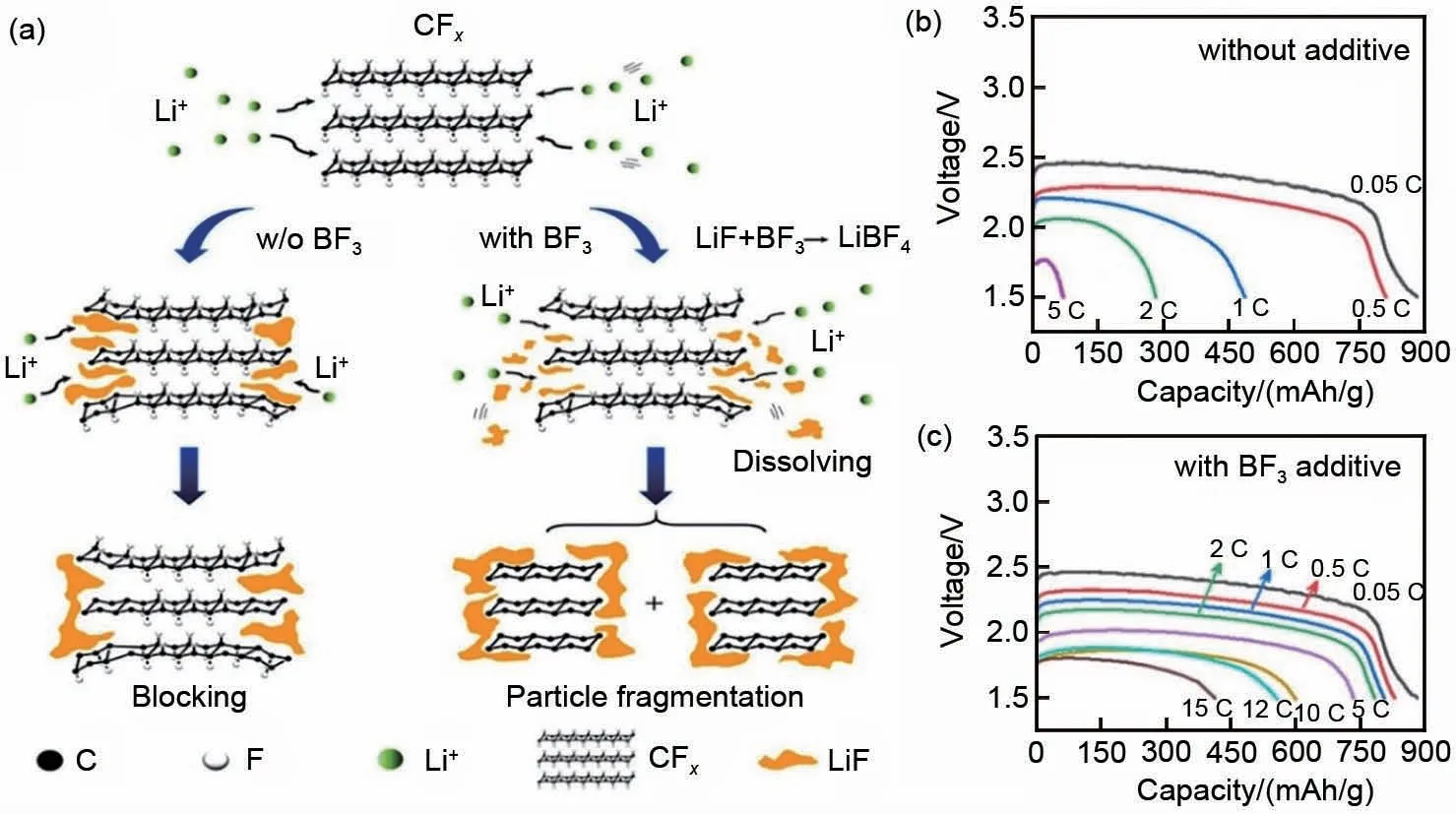
图9 (a)BF3添加剂对CFx正极作用机理的示意图;无BF3(b)和有BF3(c)添加剂时的放电曲线[77]Fig.9 (a) Schematic of the mechanism of action of BF3 additive on CFx positive electrode; Discharge curves(b) without BF3 and (c) with BF3 additive[77]
虽然氟离子受体溶剂可以溶解LiF,但是其溶解能力往往十分有限,目前尚未见到使得放电产物中LiF完全溶解的氟离子受体溶剂相关报道。因此,通过调控LiF 晶粒生长过程,改善Li/CFx一次电池的电化学性能,也是一种可行的办法。如图10 所示,Long 等[79]利用晶体生长动力学模型研究了LiF晶体在二甲亚砜/1,3-二氧环烷(DMSO/1,3-DO)电解液中随放电过程进行的生长动力学。计算结果表明,LiF 晶体在该电解液中的生长动力学最适合于形核和晶核生长机制,而不同于LiF 晶体在碳酸丙烯酯(PC)/乙二醇二甲醚(DME)电解液中的二维扩散机制。LiF 晶体取向动力学的量子化学计算方法研究结果表明,二甲亚砜和1,3-二氧环烷溶剂分子在LiF 晶面上的总化学吸附能随二甲亚砜与1,3-二氧环烷比值的变化而变化。放电过程中LiF 晶粒择优取向生长主要取决于LiF各晶面上总化学吸附能,这是由于二甲亚砜与1,3-二氧环烷分子在不同晶面上的选择性吸附引起的。因此,可通过调控电解液组分控制放电副产物LiF 的生长,从而提高Li/CFx一次电池的性能。
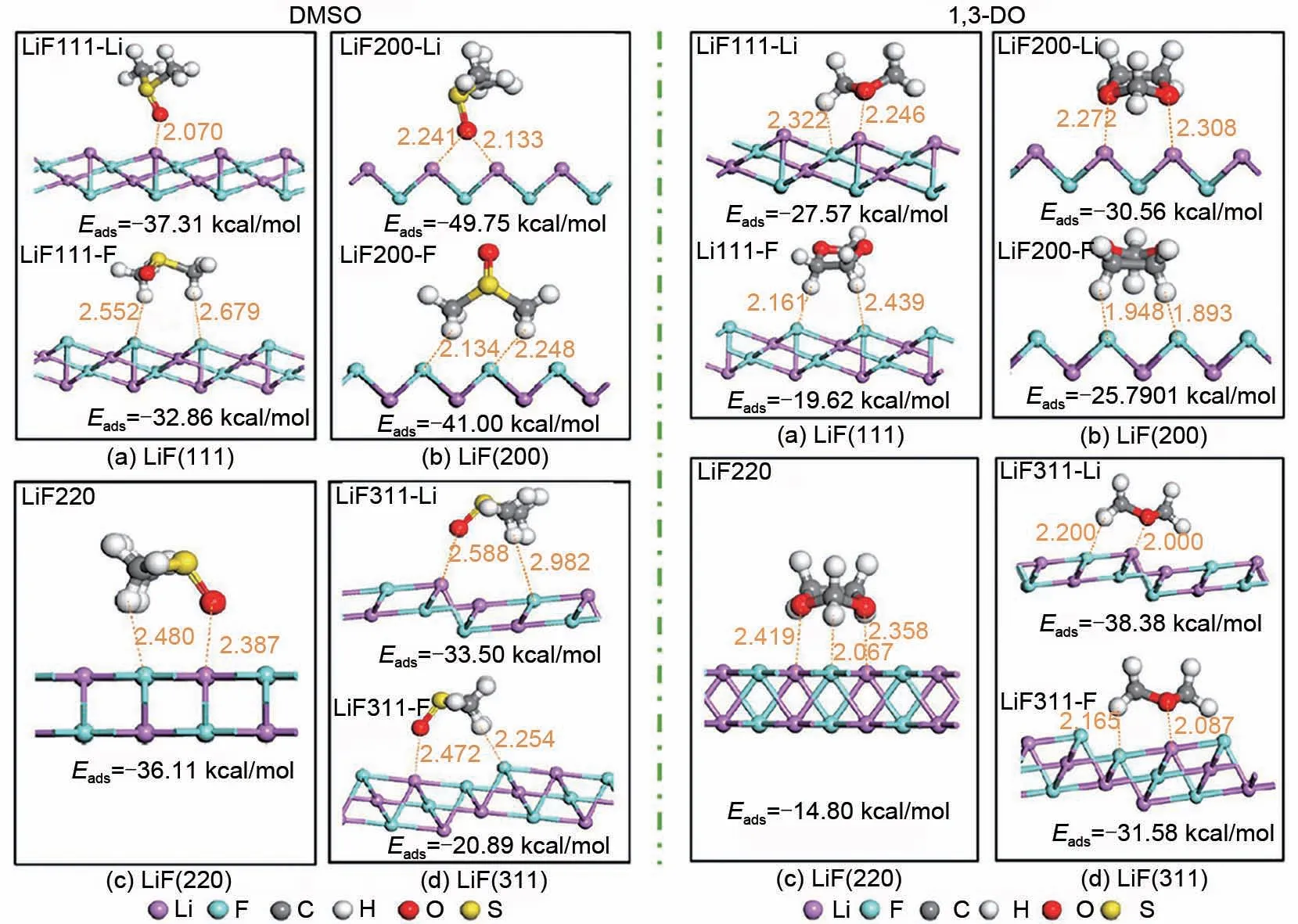
图10 DMSO和1, 3 DO分子在不同LiF晶体平面上的稳定吸附构型和吸附能[79]Fig.10 Stable adsorption configurations and adsorption energies of DMSO/1, 3 DO molecules on different LiF crystal planes[79]
考虑到放电过程中溶剂会参与反应,即放电过程中,氟化碳首先与溶剂化的锂离子结合,形成一种中间体(碳-氟-锂离子-溶剂),然后,该中间体转化成放电产物碳和LiF,释放出溶剂,溶剂回本体电解液中。这个理论已被广泛接受,并被各种研究重新验证。基于溶剂参与机理,以降低Li+脱溶能促进中间相动力学的思路为指导,Fang 等[80]设计了以丁酸甲酯(MB)和PC为共溶剂的新型电解液,该电解液在超低温(<-100 ℃)下仍可保持液态。理论计算表明,MB分子与Li+的亲和力较弱,可降低锂离子去溶剂化的势垒,提升溶剂分子从中间体中脱除的能力,优化后的电解液使Li/CFx一次电池不仅在室温下具有优异的倍率性能,而且在宽广的工作温度窗口(-70~95 ℃)内都具有较高的放电容量。在-70 ℃的超低温度下,电池容量保持率可达28%(能量保持率为15%)。
此外,特别是氟化石墨具有很强的疏水疏油性,电解液对其润湿性能很差,在电解液中适当添加一些能够改善电解液润湿性能的共溶剂或添加剂,也是改善Li/CFx一次电池电化学性能的一种方法。Ban等[3]将与氟化碳具有较好亲和性且低黏度、低熔点的1,1,2,2-四氟乙基-2,2,3,3-四氟丙基醚作为共溶剂,所组装的电池在55 ℃高温下以3000 mA/g的高电流密度放电,仍然具有高达6673 W/kg的功率密度和1475 Wh/kg的能量密度。从电解液方面改进Li/CFx一次电池的电化学性能,具有提高Li+动力学、降低过电位、减小LiF晶粒、拓展使用温度范围等诸多优点。相对于材料的改性,从电解液调控角度出发,是一种更加简便易行的改进方法。
4 结论与展望
在本文中,首先介绍了Li/CFx一次电池的工作原理。其中,两相放电反应机理模型、石墨层间化合物中间相的放电反应机理模型、“核-壳”模型和边缘传播放电反应机理以及最近刚被提出的三步放电反应机理等有效地解释了Li/CFx一次电池的内部反应机制,为后续研究出高性能Li/CFx一次电池奠定了基础。
其次,详细讨论了合成技术和原材料的改性以及复合优化策略对CFx正极电化学性能的影响。基于间接氟化和室温氟化的安全性,在未来的发展中,开发出有效的间接氟化和室温氟化方法对于提升Li/CFx一次电池的性能具有重要意义。在复合材料的选择方面具有多样性,例如有机聚合物材料(PPy、PTh、PANi)、金属单质材料(Cu、Pt、Ag)和氧化物材料(MnO2、SiO2)。氧化物材料对于改善电压滞后现象和提升倍率性能具有重要的作用,因此,在未来的复合材料的选择中可以多考虑新型氧化物材料。在兼顾高比能和高功率上,一方面可以选择与本身具备一定容量且具有高导电性的新型材料进行复合,另一方面也可以选择与本身具有催化LiF溶解特性的高导电性材料进行复合,从而实现高比能和高功率。
最后,重点介绍了Li/CFx一次电池电解液的优化方法。众所周知,电解液也是影响Li/CFx一次电池高低温性能和倍率性能的一个关键因素。相比上述其他优化方法,使用电解液添加剂更加简单易行。宽温电解液的设计和性能研究涉及到电解液的溶剂化结构、电解液与负极以及电解液与正极的表面化学反应这三方面的问题。低温方面的研究侧重低温共溶剂和锂盐对电池低温性能的影响,高温方面的研究侧重于高温添加剂对电解液的稳定性和电池高温循环性能的影响。要想实现Li/CFx一次电池在高温和低温下都具有优异的电化学性能,可以从电解质锂盐、共溶剂和功能性添加剂三个方面对锂电池宽温电解液研究。目前,尚有很多新型电解液添加剂还未被发掘,考虑合成新型电解液添加剂是未来研究的一个重要方向。
对于Li/CFx一次电池在放电过程中发热量大的问题,有如下建议和解决方案。氟化碳材料的放电电位与材料中C—F 键的类型(键能)有关,进而影响电池放电过程中的产热量,所以一方面可以通过优化C—F 键的类型和数量,改善氟化碳电池发热量大的问题。另一方面可以考虑建立电池组发热模型。通过使用有限元软件进行分析验证,进而得到整个电池组工作产热结果,从而对电池组热设计进行改善和优化。当然也可以通过增加电池组风扇散热设计、提供辅助传热措施(导热胶)和控制传热方向来解决电池发热严重的问题。以上相信对于解决Li/CFx一次电池的发热问题具有重要的借鉴意义。
综上所述,本文归纳并总结了Li/CFx一次电池在放电机理、正极材料的合成和优化、电解液的调控方面的研究进展(图11)。其中,正极材料的优化和电解液的调控是提高Li/CFx一次电池电化学性能的关键点。Li/CFx一次电池是一次电池中的佼佼者,在单兵作战、侦察装置、远程无人监测等应用上具有重要的战略意义。伴随着Li/CFx一次电池综合性能的进一步提升,未来在国防军事、深空探测和载人航天领域等特定应用场景下将发挥越来越重要的作用。
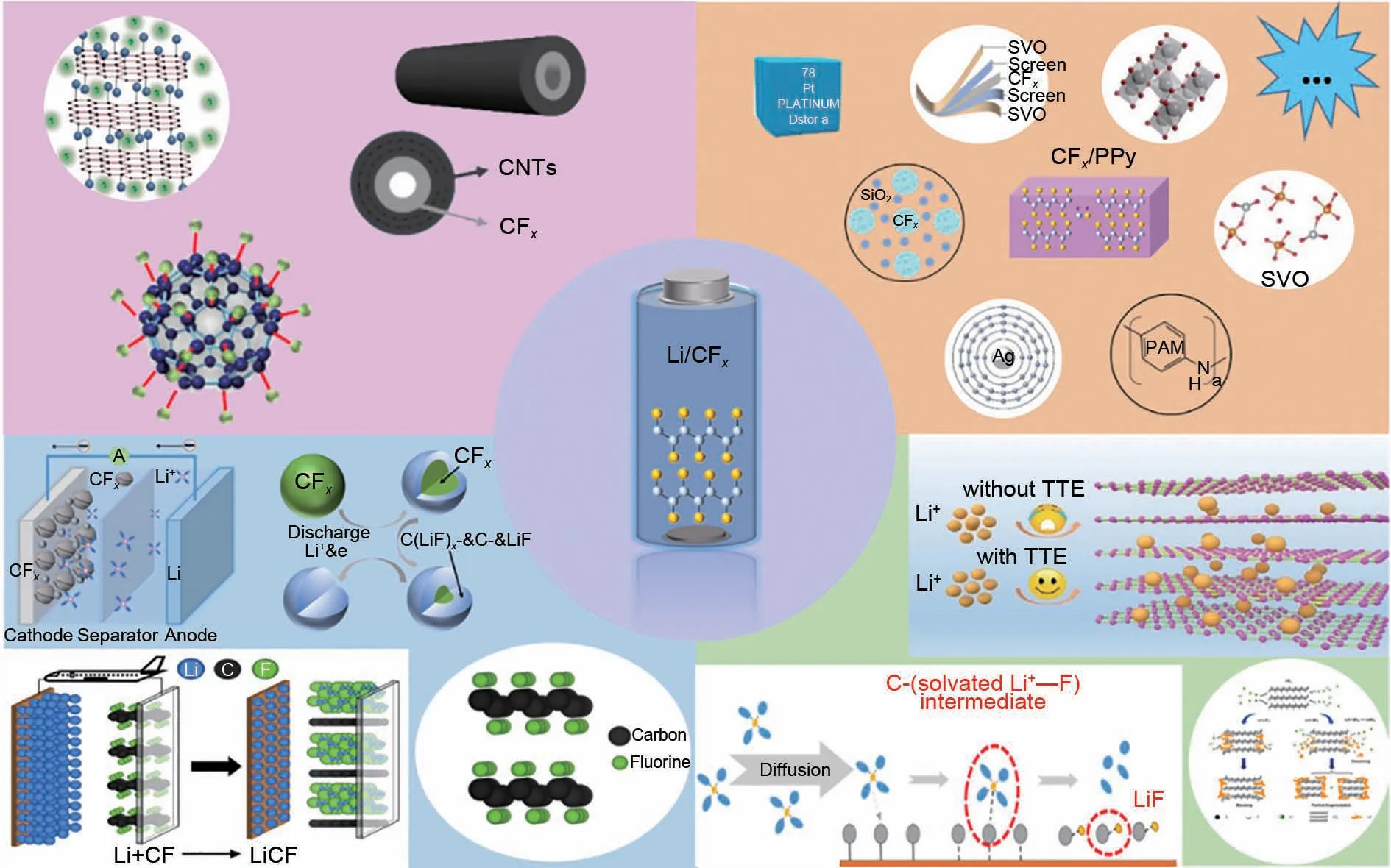
图11 Li/CFx一次电池的放电机制与主要优化策略Fig.11 Li/CFx primary batteries discharge mechanism and main optimization strategies
