碳还原法制备棒状硅基材料及其在锂浆料电池中的应用
2023-05-15阮晶晶刘福园李珅珅高桂红刘艳侠
阮晶晶,刘福园,李珅珅,高桂红,刘艳侠,2
(1郑州中科新兴产业技术研究院,河南省储能材料与过程重点实验室,河南 郑州 450003;2中国科学院过程工程研究所,离子液体清洁过程北京重点实验室,北京 100190)
锂浆料电池是一种新型储能技术,以电极活性固体颗粒和导电颗粒分散在电解液中的悬浮液作为电极,电极悬浮液在电池反应器和外部储液容器之间循环流动,具有输出功率与储能容量独立、能量密度高、成本低、循环性好、电池系统安全性高等优点[1-2],成为储能领域研发热点,2019 年入选国家重点研发计划“变革性技术关键科学问题”重点专项。经美国24 M 公司、日本京瓷公司(Kyocera)、中国科学院电工研究所、中国科学院大连化学物理研究所、中国科学院过程工程研究所等多个科研单位长期攻关和放大试制,锂浆料电池成为极具应用前景的新型规模储能技术。对锂浆料电池而言,电极浆料直接决定锂浆料电池的电化学性能,其中的活性物质决定电池的能量密度,电极浆料颗粒分布不均、易沉降、导电性差直接影响电池效率的发挥[3-4]。在保证浆料流动性的前提下,选择高比容量的电极材料,提高浆料的颗粒悬浮稳定性和导电性是提高电极浆料性能的关键。因此,寻找一种高比容量的电极材料对提高锂浆料电池的储能性能至关重要。硅基材料在比容量方面具有突出优势,硅的理论比容量高达4200 mAh/g[5],是一种理想的高比容量负极材料,将硅基负极材料用于锂浆料电池负极浆料具有重要意义。
本工作针对锂浆料电池体系稳定悬浮液构筑至关重要的特点和硅碳材料本身体积膨胀大、导电性差等问题,开发一种适用于锂浆料体系的硅碳材料,增强锂浆料体系悬浮稳定性和硅碳材料在浆料体系的稳定性。
首先以正硅酸乙酯(TEOS)为硅源,通过调整表面活性剂的种类合成出棒状和球状有序介孔二氧化硅,考察形貌对锂浆料悬浮稳定性的影响,得出相比球状,棒状材料有利于锂浆料悬浮液稳定性。在此基础上,以棒状硅基材料合成为重点研究方向,文献中通常用P123 结构导向剂先制备出棒状二氧化硅,然后用镁热还原二氧化硅制备出介孔硅,再用碳包覆得到棒状硅碳材料。在Jia等[6]的一项研究中,首先以P123 为结构导向剂、TEOS 为硅源制备出棒状的SBA-15,随后将其作为模板和硅源,通过镁热还原制备出了一种莲藕状的三维介孔硅,材料内部的介孔分布均匀,可以为嵌锂时的体积膨胀提供有效缓冲。在此基础上通过CVD 法沉积碳层,大大提升了硅基材料的电化学性能,在1 C 下循环100 次,比容量可稳定在1500 mAh/g。Tang 等[7]以SBA-15 为前驱体,在660 ℃下通过镁热还原反应得到介孔硅材料,并对其进行碳包覆处理,制备了有序介孔Si/C(OMP-Si/C)复合材料。此过程涉及模板剂去除、镁热高温还原、酸洗涤刻蚀、干燥、碳包覆,工艺流程繁琐,易导致材料利用率低,而且通过镁热还原的方式合成多孔硅也面临两大挑战,一是使二氧化硅模板的结构形貌在产物中得到保留;二是控制反应的程度,主要体现在一方面尽可能还原全部的二氧化硅,提高产率,另一方面还要避免反应过度,生成硅化镁。
本工作以P123 为结构导向剂,正硅酸乙酯为硅源,柠檬酸为碳源,采用水热法得到凝胶状二氧化硅/碳前驱体,通过高温热处理,得到棒状硅氧基碳负极活性材料。细致研究了碳源对合成棒状硅基材料影响,结合工艺参数的控制,对不同碳源和工艺参数得到的实验现象进行细致观察和研究,对一步法碳还原制备棒状硅基负极材料进行了一系列的探索工作。
1 实 验
1.1 试剂与仪器
本工作所用的主要化学试剂为正硅酸乙酯(TEOS)(分析纯,99%,麦克林)、聚环氧乙烷-聚环氧丙烷-聚环氧乙烷三嵌段共聚物(P123)(分析纯,Mn约5800,Sigma-Aldrich 试剂)、丙基三乙基硅烷(分析纯,98%,Adamas)、浓盐酸(分析纯,36%~37%,国药集团)、十六烷基三甲基溴化铵(CTAB)(分析纯,99%,Adamas)、氨水(分析纯,25%~28%,国药集团)、蔗糖(分析纯,99%,Adamas)、柠檬酸(分析纯,国药集团)、壳聚糖(生化试剂,国药集团)、酚醛树脂(分子量为122.12,西亚试剂)、单壁碳纳米管[900 m2/g,TUBALL™ BATT(Russia)]。
所用的主要仪器包括:电子天平(ME204E,瑞士,Mettler-Toledo)、恒温磁力搅拌器(85-2,上海司乐)、离心机(TD4TD5 TD6 TG16.5,卢湘仪)、抽滤设备、旋转蒸发仪(RE-201D,秋佐科技)、真空干燥箱(DZF-6020,上海一恒科学仪器有限公司)、脱泡机(KK250SE-0769,KURABO INDUSTRIES LTD)、手套箱(PRS1626,布劳恩惰性气体系统上海有限公司)、管式炉(STG-100-12,河南三特炉业科技有限公司)。
1.2 材料制备
1.2.1 棒状和球状有序介孔二氧化硅的制备
以正硅酸乙酯为硅源,P123 为模板,盐酸为催化剂,水热法合成棒状二氧化硅材料;以正硅酸乙酯为硅源,CTAB为模板,氨水为催化剂,合成球状二氧化硅。
1.2.2 碳还原法制备棒状硅基材料
以P123 为结构导向剂,有机硅为硅源,有机碳为碳源,采用水热-煅烧得到棒状硅基材料,具体步骤为:将P123加入到去离子水和HCl(2 mol/L)中,35 ℃下磁力搅拌至P123完全溶解,随后逐滴加入正硅酸乙酯,搅拌一段时间,继续加入碳源,混合液在35 ℃下继续搅拌24 h 后转移至聚四氟乙烯内衬中,在不锈钢反应釜中105 ℃下水热反应24 h,得到凝胶状二氧化硅/碳前驱体,对水热反应后产物洗涤干燥,获得二氧化硅/碳前驱体聚合物,最后在氩气气氛下850 ℃煅烧2 h,得到具有棒状结构的硅基负极材料。
1.3 材料表征
样品粉末的结构采用测试日本理学Rigaku 的SmartLab SE 型X射线衍射仪,广角XRD 的角度范围是5°~90°,扫描速度为5 °/min主要用于表征样品的物相组成,小角XRD 的角度范围为0.5°~5°,扫描速度为0.5 °/min,主要用于表征样品介孔结构的有序性;分别采用日本Horiba Jobin Yvon的EMIA 830 和EMIA 20P 测定材料中氧元素和碳元素的含量,差量法计算得到硅元素的含量,再换算得到各元素组成之间原子之比;比表面积及孔隙度分析仪BET选用美国Micromeritics的ASAP 2460;扫描电子显微镜分析仪SEM 选用德国Zeiss 的Zeiss Auriga FIB SEM。
1.4 电化学测试
浆料电极的制备流程如下:将15%棒状硅基活性物质和0.5%导电剂单壁碳纳米管放入脱泡机的罐中,将罐转移到手套箱中,在手套箱中加入84.5%电解液。将罐放入脱泡机中,脱泡15 min,得到浆料。浆料制备好后,在手套箱中用小滴管将适量(滴入量与O型圈向平)的浆料滴入世伟洛克测试电池模具(图1)中装配电池,装配顺序为锂片-隔膜-滴入浆料,O型圈厚度选用0.5 mm,在集流体表面进行涂覆碳纳米管降低集流体/浆料界面阻抗,用蓝电电池测试系统(CT2001A)进行电化学测试,电池充放电范围为0.005~2 V。

图1 世伟洛克电池示意图Fig.1 Schematic diagram of swagelok battery
2 结果与讨论
2.1 棒状和球状有序介孔二氧化硅浆料沉降性能比较
将合成的棒状和球状有序介孔二氧化硅分别与碳纳米管和电解液混合,制备成浆料,保持活性物质、导电剂和电解液含量相同。将浆料置于有刻度的10 mL 试管中,于手套箱中密闭静置15 天,发现球形浆料沉淀大于棒形,棒状浆料未出现沉降,流动性好。这可能是因为对于锂浆料电池,活性颗粒之间以及活性颗粒与集流体间的粘结固定的取消,活性材料处于一种无束缚的不稳定状态,体系中含有大量电解液,容易造成浆料沉降分层。棒状材料和导电剂碳纳米管协同作用,构建长程、短程互补的多级网络,分散于电解液中,有利于保持浆料悬浮稳定性。
2.2 碳源对合成棒状硅基材料的影响
实验最开始使用蔗糖为碳源,水热前溶液为乳白色,但水热后发现反应釜内溶液为深褐色,且溶液上层为可流淌的溶液,下层为黏稠物。采用离心或抽滤方式洗涤溶液,发现离心或抽滤所得溶液为酸醋色,产物颜色偏暗黄,煅烧后产物颜色偏黑灰色,进行电化学性能测试,其比容量只有100~200 mAh/g,如图2所示。

图2 蔗糖为碳源合成棒状硅基材料的实验现象Fig.2 Experimental phenomenon of rod-like silicon-based material synthesized from sucrose as carbon source
为探索原因,在用蔗糖做为碳源合成棒状硅基材料时,进行2个实验(记作实验1和实验2),实验1 是不加入蔗糖,其余实验条件保持不变;实验2是不加入盐酸,其余实验条件保持不变,发现实验1 和实验2 水热前后溶液都是乳白色。猜想是因为盐酸的存在,导致蔗糖在水热时部分发生碳化,为进一步验证猜想,排除其他因素影响,又进行2个对比实验(记作实验3和实验4)。实验3是只有蔗糖和去离子水,其用量和水热条件保持不变,发现水热后颜色基本是澄清透明,对溶液进行离心或抽滤,均得不到任何物质;实验4是只有蔗糖、去离子水和盐酸,其用量和水热条件保持不变,发现水热后颜色为深褐色,进行离心或抽滤处理,烘干后得到黑色粉末。这说明盐酸和蔗糖共存时,水热时导致蔗糖部分发生碳化,以致影响后续碳包覆和还原能力。而用P123为结构导向剂制备棒状二氧化硅时,其合成产物是在酸性条件下通过水热反应得到的,为此需要寻找在酸性条件下水热不发生碳化的碳源。
选择柠檬酸、壳聚糖、酚醛树脂为碳源,在酸性条件下,水热24 h,如图3所示,从左到右碳源依次为柠檬酸、壳聚糖、酚醛树脂和蔗糖。发现只有柠檬酸水热后未碳化,溶液还是澄清透明,后三种碳源水热后,溶液均变色,从左到右颜色越来越深,说明不同碳源在酸性条件下水热被碳化的程度不同,其中柠檬酸在酸性条件下水热不被碳化,蔗糖在此条件下碳化最为严重。为此采用含有羧基的有机碳源,可以解决上述问题。

图3 不同碳源在酸性条件下水热后的溶液Fig.3 Solution after hydrothermal treatment with different carbon sources under acidic conditions
2.3 溶剂去除方式对合成棒状硅基材料的影响
采用柠檬酸为碳源水热后产物上层为液体,下层为稀凝胶状二氧化硅/碳前驱体,搅拌均匀后,采用抽滤方式去除多余溶剂,然后高温煅烧,发现煅烧后产物不是黑色,而是灰白色,如图4(a)和(b)所示。说明采用抽滤方式去除溶剂时碳源被抽滤掉,采用离心方式去除溶剂,得到相同的结果,说明碳还原未进行,推测抽滤或离心时碳源被洗涤掉,导致后续无法碳包覆和碳还原。从而选用旋转蒸发去除溶剂,如图4(c)和(d)所示,旋干温度80 ℃,旋干5 h后,圆底烧瓶里物质未完全干,有黏稠物附着在壁上,后续100 ℃真空干燥24 h,圆底烧瓶物质仍然未干燥,又150 ℃继续干燥,干燥后所得产物较黏稠,最后在氩气气氛下850 ℃煅烧2 h,发现煅烧产物为黑色,说明通过旋转蒸发方式,碳源未被水冲洗掉。干燥后所得黏稠物经过文献[8]查阅是柠檬酸和硅源生成的缩聚物,有机碳源表面羧基和硅源表面的硅氧发生酯化反应,形成Si{[COH(COOH)][CH2(COO)]2}2络合物,水热条件下,进一步聚酯化,故即使150 ℃真空干燥,干燥产物仍为黏稠物,无法研磨成粉末。最终得到酯化反应接枝的碳包覆硅氧材料,提高材料的表面结合力和界面兼容性。

图4 不同溶剂去除方式的干燥后产物和煅烧产物Fig.4 Dried and calcined products with different solvent removal methods
2.4 硅源种类对合成棒状硅基材料的影响
将硅氧烷类有机硅-丙基三乙基硅烷代替硅酸酯类有机硅-正硅酸乙酯,其余实验条件保持不变,发现水热前后,溶液颜色均为乳白色,水热后没有凝胶出现,所得溶液颗粒太细,无法抽滤和离心得到产物,采用相同条件旋转蒸发干燥时发现,即使150 ℃真空干燥后,圆底烧瓶内仍为能流动的黏稠液体。
2.5 棒状硅基材料的XRD分析
图5为棒状硅基材料的XRD谱图,其中内嵌小图为其小角XRD 图。在20°~30°区域存在一个大漫包峰,对应于材料的Si—O结构(SiOx)[9],以石墨类型存在的碳在26°的主峰与SiOx峰发生重叠。为了对孔的排列方式进行表征,采用小角度XRD 对棒状硅基材料测试,小角度的衍射峰是有序孔道产生的,因此是证明介孔材料的有力证据,如果材料表面的孔按照周期有规则地排列,则X射线只要以小角度经过这些规则排列的孔结构时,会因为样品内部电子密度不均匀,在射线周围出现散射X 射线,散射强度与样品微观结构有关,衍射峰越强、数目越多,说明材料的有序性越好,衍射峰位置越偏向左边(2θ角度越小),有序介孔材料的孔越大。棒状硅基材料的小角XRD 图有两个峰,证明有序介孔结构的存在[10]。

图5 棒状硅基材料的XRD谱图Fig.5 XRD spectra of rod like silicon based material
2.6 棒状硅基材料的元素组成分析
表1为棒状硅基材料的元素分析测试结果,O、C、Si 三种元素的含量分别为41.89%、11.06%、47.05%,原子比Si/O 为1.56,说明高温热处理过程中,二氧化硅/碳前驱体发生碳热还原。
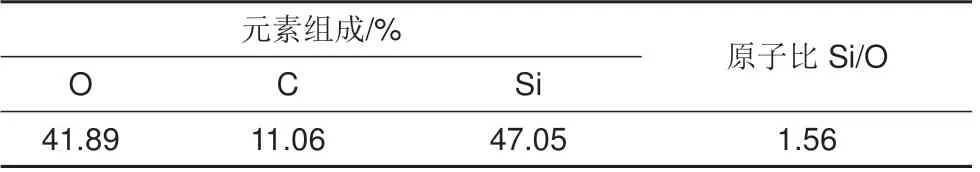
表1 棒状硅基材料的元素组成Table 1 Elemental composition of rod like silicon based material
2.7 棒状硅基材料的比表面积及孔径分析
对棒状硅基材料进行氮气等温吸脱附测试,测定材料的比表面积及孔径分布。图6(a)和(b)分别是棒状硅基材料的等温吸脱附曲线和孔径分布图,图6(a)具有Ⅳ型等温线的特征,在P/P0处于0.6~0.8 间的滞后环说明有序介孔的存在[11],在吸脱附曲线中滞回线重叠处对应的压力越高说明介孔尺寸越大,正好和小角XRD 衍射峰位置相反。图6(b)是基于BJH 模型得到的孔尺寸分布图,具有较窄的孔径分布,平均孔径为6.9 nm,按照BET 多点法计算的棒状硅基材料比表面积为282 m²/g。大量介孔的存在可以为硅的嵌锂膨胀预留空间,提高浆料的悬浮性能,起到维护结构稳定性的作用。
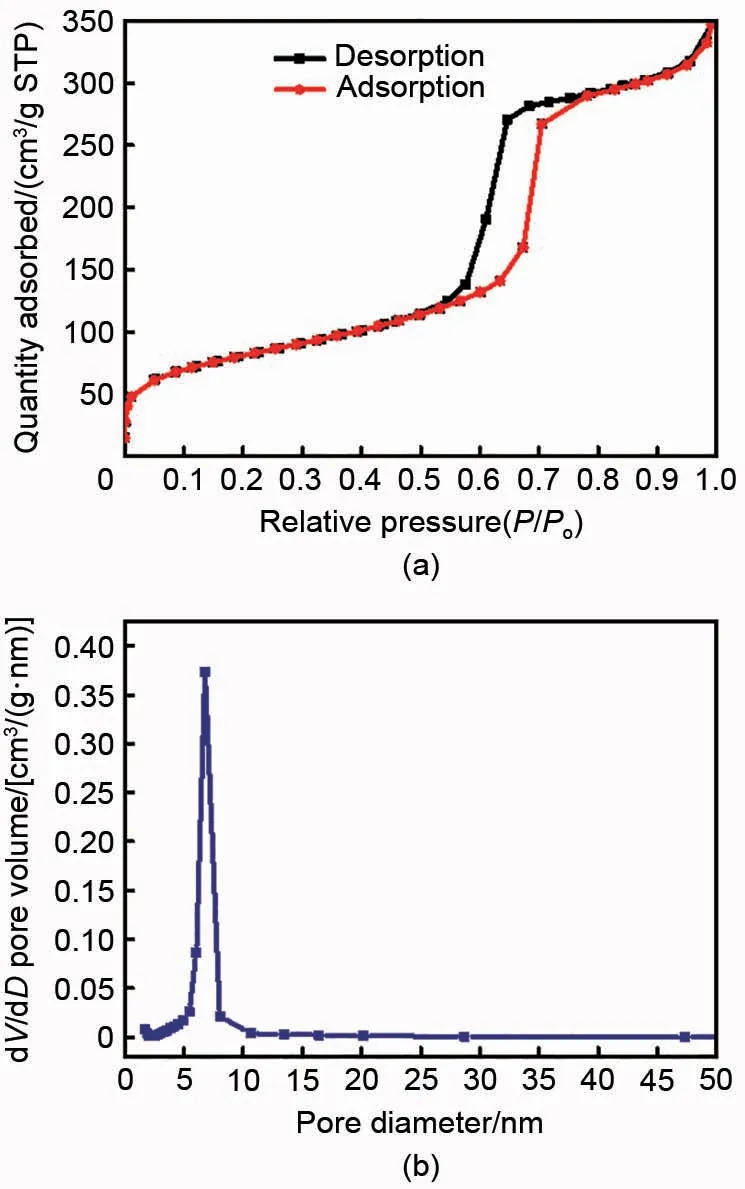
图6 (a) 棒状硅基材料的等温吸脱附曲线和 (b) 孔径分布图Fig.6 (a) Isothermal adsorption desorption curves and (b) pore size distribution diagram of rod like silicon based material
2.8 棒状硅基材料的形貌分析
图7 为棒状硅基材料前驱体(a)和烧结后(b)的SEM 图,所制备的材料颗粒尺寸均匀,烧结时溶剂挥发后柠檬酸发生固化,均匀包覆在硅基材料表面。棒状硅基材料外形上呈现规则的棒状形貌,首尾相连,形成莲藕链束,长度约为1~3 μm,直径约为200 nm。棒状硅基材料与单壁碳纳米管和电解液混合均匀得到浆料,所用单壁碳纳米管管长>5 μm,比表面积900 m2/g,直径1~2 nm,能够实现长程导电,和长度约为1~3 μm,直径约为200 nm的棒状硅基材料在电解液体系中形成长程、短程互补的多级网络,加上大量介孔的存在,有利于保持浆料悬浮稳定性。

图7 (a) 棒状硅基材料前驱体SEM照片和 (b) 烧结后SEM照片Fig.7 (a) SEM photographs of precursor and (b)SEM after sintering of rod like silicon based material
2.9 棒状硅基材料的电化学性能分析
将棒状硅基材料制备成浆料电极,组装成世伟洛克电池,对其进行电化学测试,图8(a)为棒状硅基材料的首次充放电曲线,具有良好的充放电平台,首次放电比容量为1300 mAh/g,充电比容量为726 mAh/g,首效为55.8%,首次不可逆容量较大,这是由于在锂浆料电池中大量电解液的引入增加了固液接触面积,导致副反应增多,固体电解质(SEI)膜增加,影响到电池库仑效率和循环性能。通过电解液中加入成膜添加剂和电池反应过程中进行补锂操作等措施可能使该问题得以解决。图8(b)为棒状硅基材料在0.05 C、0.1 C 和0.2 C 下前50次的循环性能,在0.05 C下,循环50次充电比容量从726 mAh/g变为557 mAh/g,比容量保持率为76.7%;在0.1 C 下,循环50 次充电比容量从738 mAh/g变为533 mAh/g,比容量保持率为72.2%;在0.2 C下,循环50次充电比容量从695 mAh/g变为457 mAh/g,比容量保持率为65.7%。这是因为活性颗粒之间以及活性颗粒与集流体间的粘结固定的取消,活性材料处于一种无束缚的不稳定状态,容易造成电极浆料本身以及与集流体界面之间内阻偏高、电池极化大和倍率性能差的问题,因此在浆料电池中不宜选用大电流充放电。
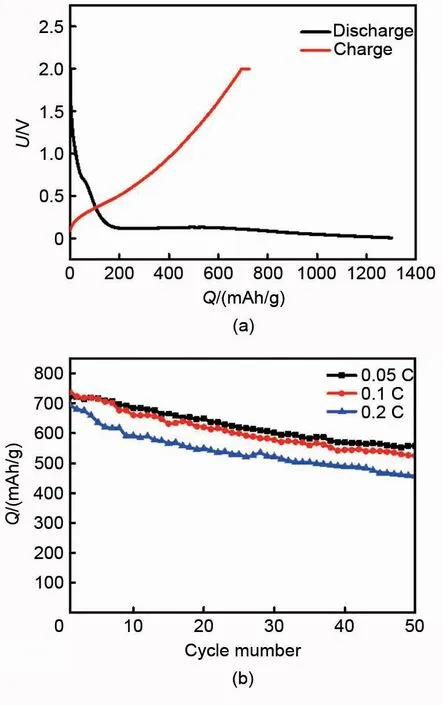
图8 (a) 棒状硅基材料的首次充放电曲线和(b) 倍率循环性能Fig.8 (a) Initial charge-discharge curves and (b) rate cycle performance of rod like silicon based material
3 结论
本工作以P123 为结构导向剂,正硅酸乙酯为硅源,柠檬酸为碳源,采用水热法得到凝胶状二氧化硅/碳前驱体,水热后产物采用旋转蒸发干燥去除溶剂,通过高温热处理,得到棒状硅氧基碳负极活性材料。对不同碳源和工艺参数得到的实验现象进行细致观察和研究,对一步法碳还原制备棒状硅基负极材料进行了一系列的探索工作。
(1)文献报道中通常用P123 为结构导向剂先制备出棒状二氧化硅,然后用镁热还原二氧化硅制备介孔硅,再用碳包覆得到棒状硅碳材料。本工作直接在用以P123 为结构导向剂制备二氧化硅的过程中,引入碳源,得到同时具有碳包覆和碳还原二氧化硅的硅氧材料,避免使用镁热还原二氧化硅,再碳包覆带来的复杂工艺流程。
(2)由于用P123 为结构导向剂制备二氧化硅时,其合成条件是强酸条件下水热,大部分碳源在强酸下水热后会部分碳化,严重影响后续碳还原和碳包覆效果,本工作采用含有羧基的有机碳源柠檬酸,可以解决此问题。此外柠檬酸表面羧基和硅源表面发生酯化反应,水热条件下,进一步聚酯化,最终得到酯化反应接枝的碳包覆硅基材料,提高碳表面和硅表面结合力和界面兼容性。
(3)水热后产物采用旋转蒸发干燥,可保护水热后产物凝胶状二氧化硅/碳前驱体的结构和成分完整性,进而提高后续煅烧过程中碳包覆和还原能力。
