速灭威对花翅摇蚊幼虫的毒性效应
2023-05-12王宏伟袁善奎侯玉霞宋伟华
王宏伟,袁善奎,侯玉霞,宋伟华
(1.农业农村部农药检定所,北京 100125;2.农业农村部农药评价重点实验室,北京 100125;3.中国农业大学理学院,北京 100193)
摇蚊是一类重要的水生昆虫,目前发现的种类超过5 000种,其在水生生态环境中的重要作用已被大量研究证实[1-2]。摇蚊幼虫又称红虫,是种类最多,分布最广,密度和生物量最大的淡水底栖动物类群,其生物量约占底栖生物量的70%~80%[3]。摇蚊幼虫是水生食物链中重要的营养层级,是鱼类和水鸟的重要食物来源,也是污染物在营养层级间传递的重要媒介[4]。由于摇蚊具有对污染物敏感、生命周期短、易于实验室培养等诸多优势,使其成为水环境监测的优良指示生物[5]。
速灭威是我国使用较多的氨基甲酸酯类杀虫剂之一,具有触杀、熏蒸作用和一定的内吸活性,主要用于防治水稻上的飞虱、叶蝉[6]。速灭威微溶于水,如果施用不当或者施药后管理不善,极易导致周边水体污染,从而对水生生态系统造成影响。目前,有关速灭威的研究主要围绕检测方法、生物活性、残留和降解特性等方面,但在速灭威对水生生物毒理效应方面的研究报道甚少[7]。本文以我国南方地区优势物种花翅摇蚊为受试生物[8],研究速灭威对底栖生物摇蚊幼虫的急慢性毒性,旨在为系统评价速灭威的生态环境风险提供参考。
1 材料和方法
1.1 试验材料
1.1.1 供试昆虫 花翅摇蚊(Chironomuskiiensis)引种于北京市疾病预防与控制中心,用曝气除氯3 d以上的自来水(pH 8.24,溶解氧8.16 mg/L,总硬度290 mg/L)饲养于玻璃缸中,水温(24±1)℃,每7 d换1次水,每2 d投喂0.5~1 g热带鱼饲料,自然光照,并用氧气泵供氧,使用50目纱布罩住玻璃缸防止摇蚊成虫逃逸。
1.1.2 供试农药 93%速灭威原药。
1.1.3 沉积物 依据《化学品 沉积物-水系统中摇蚊毒性试验加标于水法》[9](GB/T 27858-2011)中附录B配制均匀的沉积物,其中石英砂干重占比75%,高岭石粘土(高岭石含量≥30%)干重占比20%,泥炭(颗粒尺寸≤1 mm)干重占比5%。
1.2 急性毒性试验 参照OECD方法测定速灭威对摇蚊幼虫的急性毒性[10]。根据预试验结果,设置1龄幼虫组和4龄幼虫组,分别将速灭威用曝气水配成2.50、3.00、3.60、4.32、5.18 mg/L和5.00、6.50、8.45、10.99、14.28 mg/L 2个系列浓度梯度,以曝气水为空白对照,分别选取生理活动能力正常且一致的1龄期和4龄期摇蚊幼虫置于盛有75 mL药液的小烧杯中,每个处理5头幼虫,4个重复。试验期间不投喂食物,温度(24±1)℃,光暗时间比=16 h∶8 h,于试验开始后的24和48 h统计摇蚊幼虫生存状况,轻晃烧杯,幼虫在15 s内无法改变姿势(爬行或者“8”字摆动)视为活动抑制。
1.3 慢性毒性试验
1.3.1 加标于上覆水法 参照《化学品 沉积物-水系统中摇蚊毒性试验加标于水法》(GB/T 27858-2011)[9]的方法,在每个试验容器中加入250 g沉积物(湿重)和700 mL蒸馏水配制成水-沉积物系统,调节pH至7.4。待水-沉积物系统沉降完全后,选取1龄摇蚊幼虫(摇蚊卵孵化后3 d,体长约0.2 cm)加入试验容器中,每个处理20头,4个重复。加入摇蚊幼虫后,关停曝气泵24 h,待幼虫全部沉入容器底部沉积物后继续曝气。加入摇蚊幼虫48 h后,使用吸管取出相应体积的上覆水,并轻微加入新配制的相应浓度药液。试验期间,控制环境中温度为(24±1)℃,湿度≥60%,光暗时间比16 h∶8 h。每2 d喂食1次,每只幼虫每次的饲喂量为0.5 mg,3龄期后可适当增加喂食量。
1.3.2 加标于沉积物法 参照《化学品 沉积物-水系统中摇蚊毒性试验加标于沉积物法》(GB/T 27859-2011)[11]的方法,将速灭威溶于少量丙酮中制备成储备液,吸取相应量的储备液加入10 g石英砂混匀,待丙酮从石英砂中挥发后,再与190 g沉积物(干重)混匀,并加入700 mL蒸馏水配制成水-沉积物系统。摇蚊的引入和试验条件的控制同1.3.1。
1.3.3 结果调查 摇蚊染毒时记为第0 d,随后每24 h观察1次,记录摇蚊的羽化个数和性别,在连续7 d未观察到新的摇蚊羽化时为试验终点。
1.4 数据处理 利用SPSS22.0中概率回归法求得速灭威对摇蚊幼虫急性毒性试验和慢性毒性试验的毒力回归方程y=a+bx,计算半数效应浓度EC50,决定系数R2及95%置信区间;利用SPSS22.0对慢性毒性试验组间各指标进行单因素分析,数据用平均值±标准偏差(Mean±SD)表示,采用Bonferroni方法分析组间显著性差异(P<0.05);运用SigmaPlot14.0软件作图。
2 结果与分析
2.1 速灭威对花翅摇蚊幼虫的急性毒性 花翅摇蚊幼虫在低浓度速灭威处理下,与对照组在试验初期相似,无明显中毒症状,但在染毒12 h后开始少量出现中毒症状和死亡;高浓度处理组花翅摇蚊幼虫在暴露2 h后就开始出现剧烈反应,身躯呈“C”字型不停的翻动,并随着暴露时间的延长,幼虫活动逐渐减缓,体色变淡,死亡数不断增加。
速灭威对花翅摇蚊幼虫的急性毒性试验结果(表1、2)。由两表可知,试验48 h内,速灭威对花翅摇蚊幼虫的毒性作用随着处理浓度的增加和暴露时间的延长会逐渐增强;四龄摇蚊幼虫的24 h EC50、48 h EC50是一龄摇蚊幼虫的2.5倍以上,一龄幼虫的敏感性高于四龄幼虫。
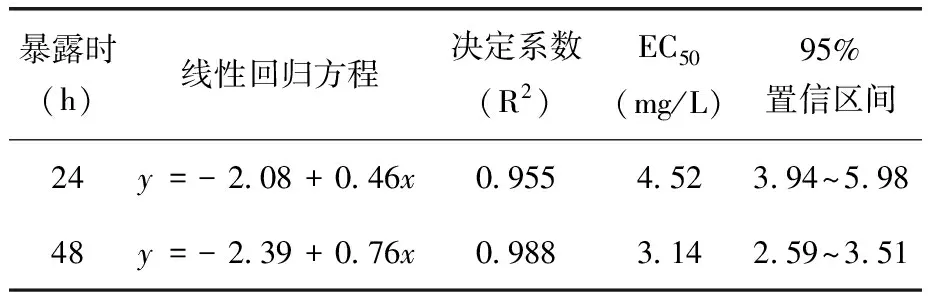
表1 速灭威对花翅摇蚊一龄幼虫的急性毒性
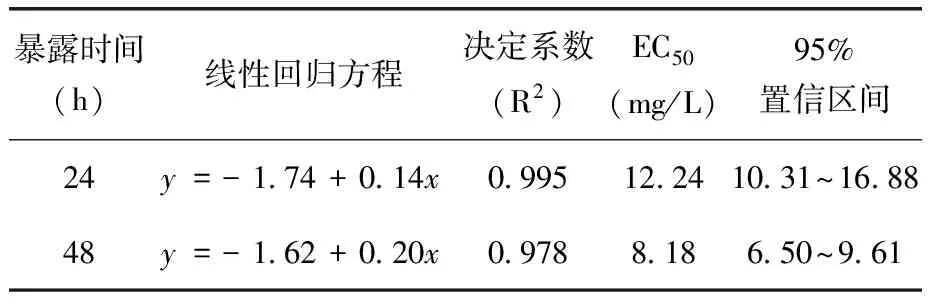
表2 速灭威对花翅摇蚊四龄幼虫的急性毒性
2.2 速灭威对花翅摇蚊幼虫的慢性毒性
2.2.1 速灭威对花翅摇蚊羽化的影响 慢性毒性试验中摇蚊幼虫存活个数为发生羽化的摇蚊数量与试验结束后沉积物中存活的幼虫数量之和。试验结束后,在所有试验容器的沉积物中均未发现存活的摇蚊幼虫,这表明存活的摇蚊幼虫都羽化为成蚊,所以摇蚊存活率等于其羽化率。由图1、图2可以看出,幼虫的羽化普遍在初次出现羽化2 d后出现高峰期,持续2 d左右。在高浓度处理组中,初次出现羽化时间比对照组推迟1~3 d。这表明随着速灭威浓度的增高,摇蚊幼虫的羽化率降低,羽化时间延后,平均发育时间延长。
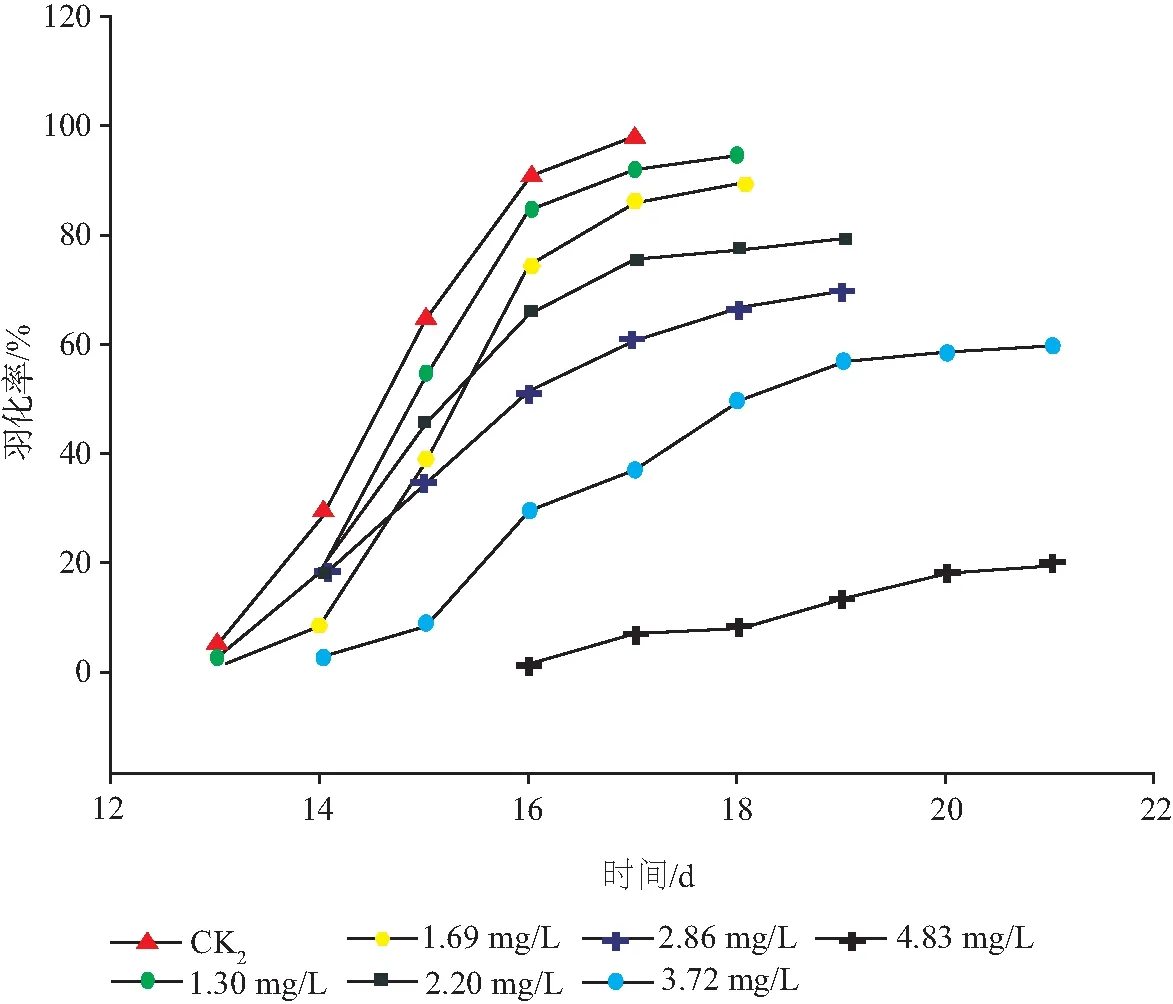
图1 速灭威对花翅摇蚊幼虫羽化率的影响(加标于上覆水法)
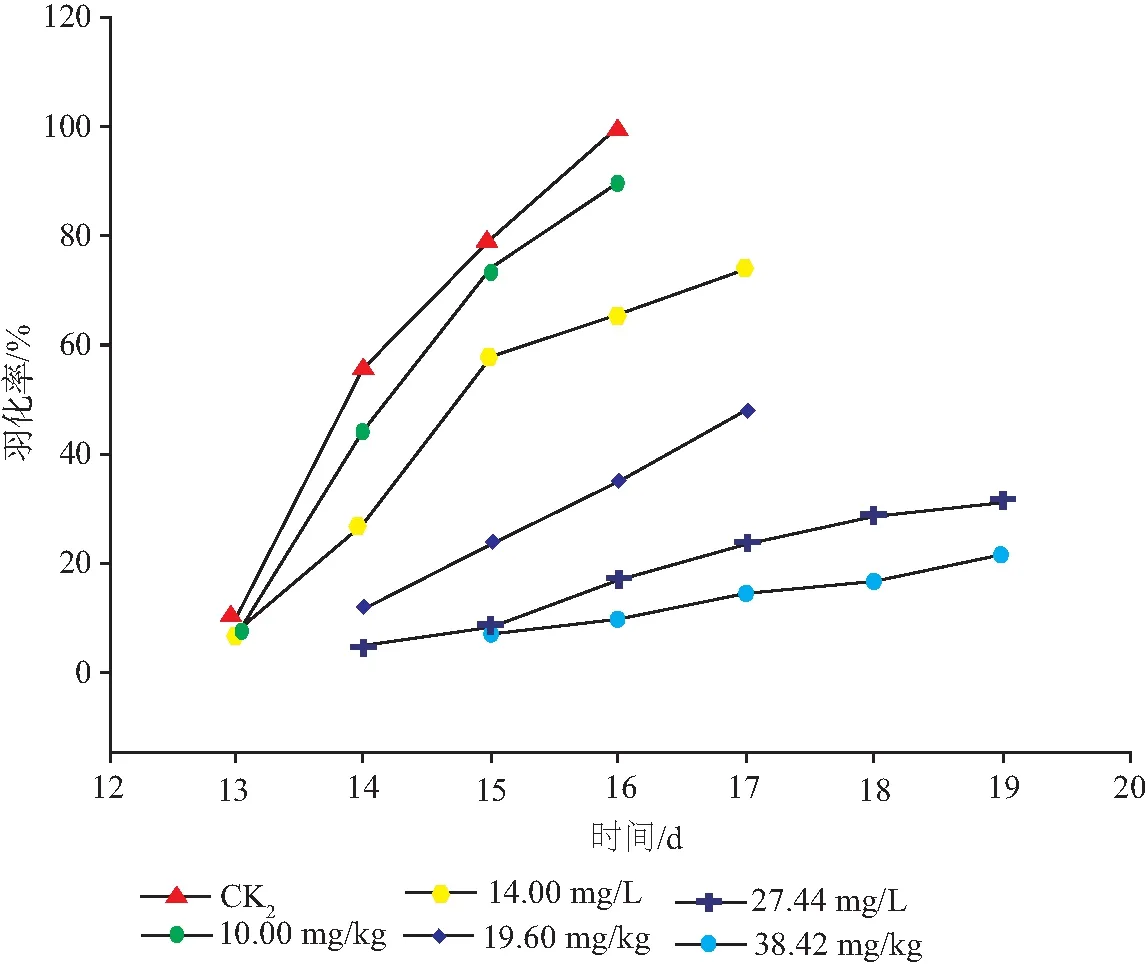
图2 速灭威对花翅摇蚊幼虫羽化率的影响(加标于沉积物法)
由表3、表4可知,在加标于上覆水法中,当速灭威浓度高于3.72 mg/L时,试验组摇蚊幼虫的羽化率和化蛹率与对照组存在显著差异(P<0.05)。当速灭威浓度低于3.72 mg/L时,试验组间摇蚊幼虫的羽化率和化蛹率无显著差异(P<0.05);在加标于沉积物法中,当速灭威浓度高于10.00 mg/kg时,试验组摇蚊幼虫的羽化率和化蛹率与对照组存在显著差异(P<0.05)。中等浓度处理组中的羽化率要略高于化蛹率,但无显著性差异。推测这可能是中等浓度处理组中部分摇蚊幼虫羽化失败造成的。根据慢性毒性实验结束后的化蛹数量和羽化数量计算不同浓度处理摇蚊幼虫化蛹率和羽化率,最终得到加标于上覆水法中速灭威对摇蚊幼虫的化蛹率半数效应浓度(EC50)值为3.72 mg/L,对摇蚊幼虫的羽化率半数效应浓度(EC50)值为3.63 mg/L;加标于沉积物法中速灭威对摇蚊幼虫的化蛹率半数效应浓度(EC50)值为23.71 mg/kg,对摇蚊幼虫的羽化率半数效应浓度(EC50)值为20.60 mg/kg。
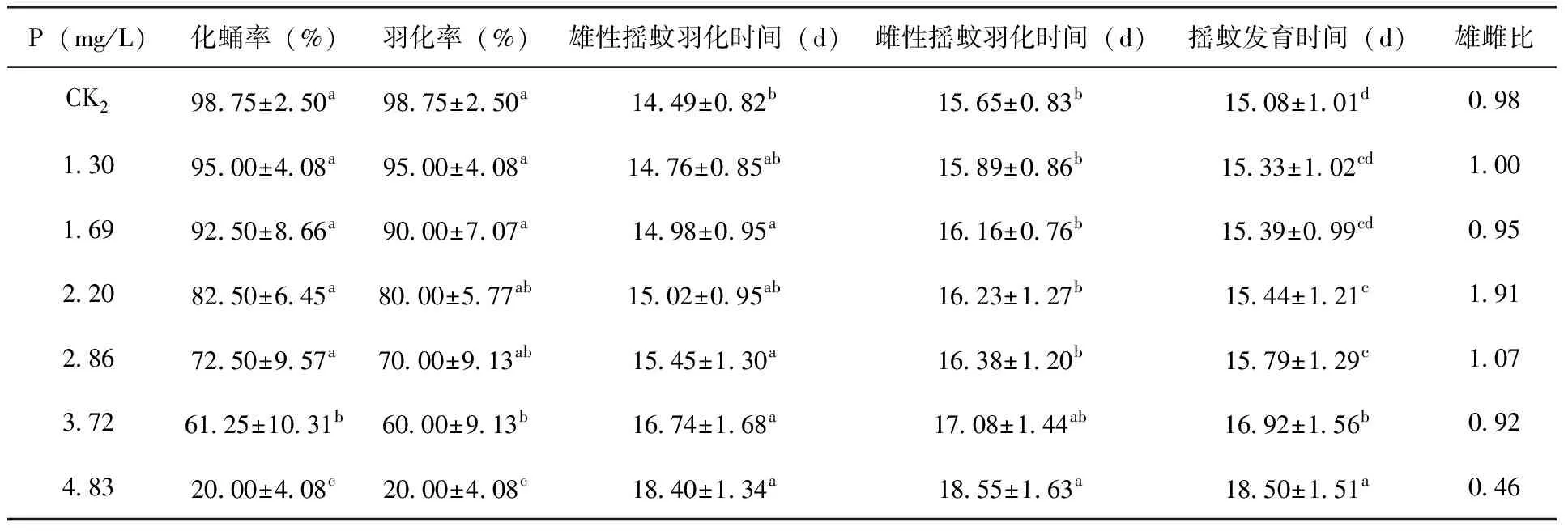
表3 不同速灭威浓度处理组花翅摇蚊的存活及羽化状况(加标于上覆水法)
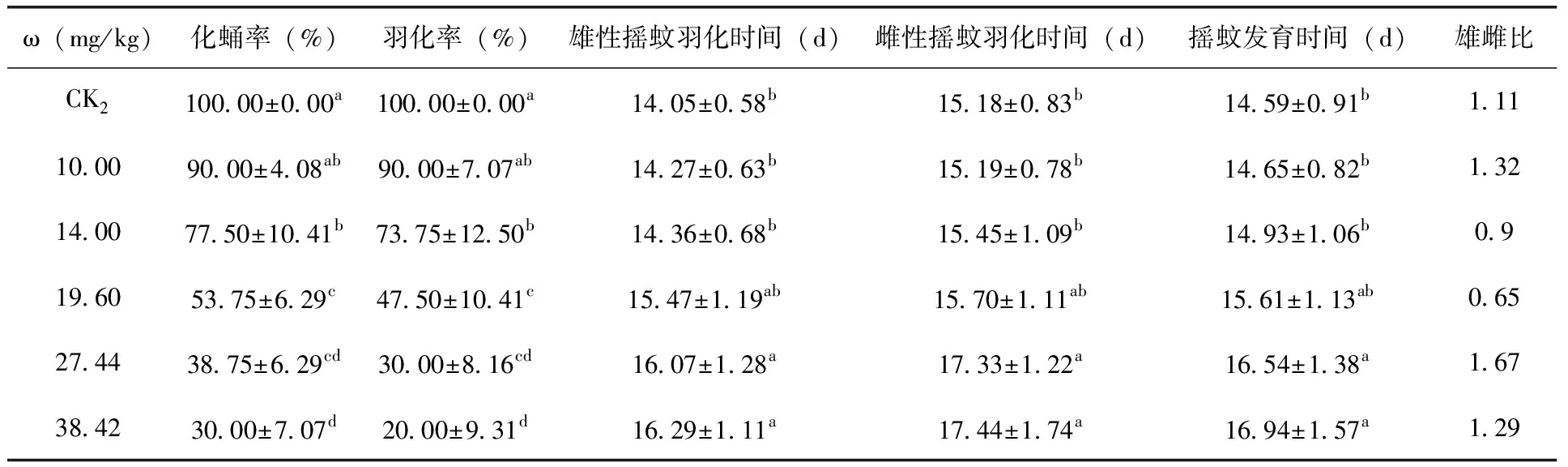
表4 不同速灭威浓度处理组花翅摇蚊的存活及羽化状况(加标于沉积物法)
除化蛹率和羽化率之外,本研究还对不同浓度速灭威对摇蚊羽化时间的影响进行了记录(表3、4)。整体来看,速灭威在一定程度上抑制了摇蚊幼虫的羽化,使其羽化时间有了不同程度的延滞,延滞时间与速灭威浓度成正比。影响摇蚊幼虫羽化时间的因素很多,除不同的污染物通过促进或者抑制摇蚊幼虫体内的激素分泌影响摇蚊幼虫的羽化时间之外,营养物质含量、饲料、摄食习惯、生存环境[12,13,14]等外界因素的差异都可影响摇蚊幼虫的羽化时间。因此还需要进一步深入的研究。
在记录羽化时间和羽化率的同时,通过观察速灭威对羽化摇蚊性别的影响。结果发现对照组及低浓度组羽化的摇蚊个体比例接近为1∶1,而当速灭威浓度达到2.20 mg/L或19.60 mg/kg时,速灭威对羽化摇蚊的性别比产生严重影响,但是其影响无明显规律可循。之前也有一些关于污染物对羽化摇蚊性别影响的研究,但是结果各不相同。比如刘丽等曾研究了六氯苯乙烯对摇蚊幼虫(Chironomuskiiensis)羽化性别比的影响,发现六氯苯使得羽化摇蚊雄性数量明显减少[15]。钟文珏等研究发现沉积物中五氯酚对雌性摇蚊的羽化抑制作用要显著大于雄性摇蚊[16]。由此可见,速灭威对羽化摇蚊性别比影响的机制还需要更深入探讨。
试验过程中观察到,摇蚊幼虫在蛹期即将羽化为成蚊时容易发生死亡,部分个体羽化中途时死亡。同时还发现,中高浓度速灭威处理组与对照组以及低浓度速灭威处理组相比,多出现翅膀畸形摇蚊,羽化成蚊的个体出现身体和翅膀疲软,飞行无力等特征。试验过程中存活的摇蚊都成功羽化为成蚊,但中高浓度速灭威处理组对蛹期摇蚊致死作用更明显。速灭威属于速效性氨基甲酸酯类杀虫剂,推测其可能在加标早期对摇蚊幼虫的身体机能造成不可逆的损伤,最终干扰其羽化。
2.2.2 速灭威对花翅摇蚊活动行为的影响 大多数摇蚊有筑巢的习性。巢是摇蚊幼虫利用唾液腺分泌物粘附的淤泥或砂粒筑建的,多筑于沉积物表面或埋于淤泥中。摇蚊幼虫栖居在巢中,头部伸出取食,随着摇蚊幼虫体长增长,所筑的巢也会增长。比较几个不同处理组中摇蚊幼虫在沉积物表面的筑巢数量发现,沉积物中速灭威加标浓度为10.00、14.00和19.60 mg/kg时,摇蚊幼虫的筑巢行为较溶剂对照(图3K)明显增强(图3),这表明速灭威对摇蚊幼虫的筑巢行为有促进作用。
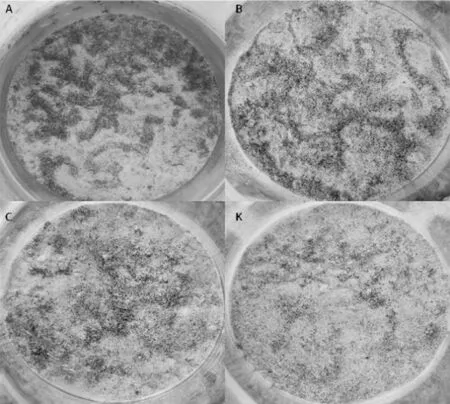
图3 花翅摇蚊幼虫在沉积物表面筑巢行为变化情况
3 结论与讨论
本研究结果表明,速灭威对花翅摇蚊一龄幼虫24、48 h的EC50分别为4.52、3.14 mg/L,与IUPAC数据中速灭威对鱼的急性毒性结果相比,花翅摇蚊对速灭威的敏感性比鱼更高。试验中发现一龄幼虫对速灭威的敏感性远高于四龄幼虫,因此在测定水环境中外源污染物对摇蚊幼虫半数效应浓度时,选用一龄摇蚊幼虫作为受试生物更为严谨。
慢性毒性实验中,加标上覆水中速灭威对摇蚊幼虫的羽化率半数效应浓度EC50及化蛹率半数效应浓度EC50分别为3.63和3.72 mg/L,加标沉积物中速灭威对摇蚊幼虫的羽化率半数效应浓度EC50及化蛹率半数效应浓度EC50分别为20.60和23.71 mg/kg。2种慢性毒性试验方法均显示出,随着处理组速灭威浓度的增加,摇蚊幼虫的化蛹率、羽化率及存活率降低,羽化时间延滞。这与多数污染物影响效果一致,但也存在少数污染物促进摇蚊的羽化,例如一些内分泌干扰物如六氯苯[15]、三氯苯酚[12]、多杀霉素[17]等。本研究中并没有发现处理组速灭威浓度与羽化摇蚊雄雌比之间存在相关性,这可能是因为速灭威对摇蚊性别分化相关的激素影响较小。
本研究发现与多数污染物抑制摇蚊幼虫筑巢行为不同,在速灭威处理组羽化摇蚊数量少于对照组羽化摇蚊数量时,速灭威处理组沉积物表面的筑巢数量反而多于对照组,这表明速灭威对摇蚊幼虫的筑巢行为可能存在促进作用。目前研究中发现多数污染物对摇蚊幼虫的筑巢行为有抑制作用,Taylor等发现摇蚊幼虫(Chironomusriparius)暴露于林丹后,其筑巢行为明显受到抑制[18]。Macdonald等发现全氟辛烷磺酸(PFOS)对摇蚊幼虫(Chironomustentans)筑巢行为有明显的抑制作用,并且发现摇蚊幼虫多聚集在沉积物表面[19]。关于污染物对摇蚊幼虫筑巢行为活动有促进作用的报道甚少,具体的机理还需进一步研究确认。
