免疫检查点抑制剂致免疫性肌炎及周围神经病1例
2023-05-11徐添姿王腾飞刘艺欣魏永长
徐添姿,王腾飞,刘艺欣,魏永长
武汉大学中南医院胃肠肿瘤放化疗科(武汉 430071)
肝门部胆管癌(perihilar cholangiocarcinoma,pCCA)起源于胆道上皮,是临床上最常见的胆道恶性肿瘤,占其50%以上[1]。根治性切除术是目前治愈pCCA 的唯一手段[2],但其术后5 年生存率仅约30%[3]。此外,由于pCCA 对放化疗的敏感性均低,总体预后极差,中位生存期仅约为13~37 个月[4]。免疫检查点抑制剂(immune checkpoint inhibitor,ICIs),如靶向细胞毒性 T淋巴细胞相关蛋白4(CTLA-4)、程序性细胞死亡蛋白-1(PD-1)及程序性细胞死亡配体-1(PD-L1)抑制剂,在肿瘤治疗领域取得重大进展,其通过激活宿主的免疫系统来发挥抗肿瘤作用,但也可能诱发免疫相关不良事件(immune-related adverse events, irAEs)[5]。irAEs 可累及全身各器官系统,症状具有明显的异质性,近年来有关其致死的病例屡有报道[6]。特瑞普利单抗是中国首个批准上市的以PD-1 为靶点的单抗药物,已被批准用于黑色素瘤、鼻咽癌、尿路上皮癌等多种肿瘤的治疗。目前,联合特瑞普利单抗的治疗方案也被推荐用于晚期胆道恶性肿瘤患者的一线治疗选择[7]。本研究介绍了1 例晚期肝内胆管癌患者发生免疫相关性肌炎及周围神经病的病例,旨在提醒临床医师警惕免疫相关性神经肌病的发生,为临床诊治提供参考。
1 病例资料
患者,男,51 岁,2021 年4 月因“胆管占位性病变”行“肝胆管病损切除术+胆总管病损切除术+肝门淋巴结清扫术+腹腔淋巴结清扫术+胆管肝管空肠吻合术+胆管成形术”,术后病理提示胆管混合性神经内分泌-非神经性内分泌肿瘤(小细胞神经内分泌癌约占40%、胆管细胞癌约占60%),诊断为肝门胆管恶性肿瘤(T2bN2M0)。患者既往有1 级高血压病史及2型糖尿病史,控制可;否认乙肝、结核等传染病史;否认外伤史;个人史及家族史无特殊。患者于2021 年7 月至2022 年8 月共行12 次选择性肝动脉化疗(奥沙利铂+吉西他滨)栓塞术。期间,患者复查腹部CT 提示新出现肝内及腹腔淋巴结转移。考虑患者病情进展,遂先后于2022 年4 月、8 月共行2 次粒子植入术,并于2022 年4 月至8月共行4 周期特瑞普利单抗(200 mg,每3 周1 次)免疫治疗。同时,患者于2022 年8 月上旬开始口服仑伐替尼(8 mg,每日1 次)靶向治疗。
2022 年8 月下旬,患者逐渐出现纳差,双上肢无力伴水肿,双侧指间及肘关节肿痛,双下肢时有酸胀感,未行特殊治疗。9 月中旬于武汉大学中南医院复查血生化提示天门冬氨酸氨基转移酶(AST,178 U/L)、血钾(K+,3.20 mmol/L)、血钠(Na+,132.5 mmol/L)异常,血常规及其余肝肾功能指标未见明显异常。于当日行第5 周期特瑞普利单抗免疫治疗,次日出现上肢及颜面部水肿加重,伴有明显肘关节疼痛及吞咽疼痛。肌酶及心肌酶谱提示肌酸激酶(CK,2 039 U/L)、肌红蛋白(MYO,>1 200 ng/mL)、肌酸激酶同工酶(CK-MB,11.3 ng/mL)异常升高,而高敏肌钙蛋白I(hs-cTnI)及B 型钠尿肽(BNP)均在正常范围内。复查心脏彩超及心电图均未见明显异常。进一步完善胸腹部CT 提示患者病情稳定,排除肿瘤进展。考虑到患者表现为持续性乏力、无波动性疲劳、无明显晨轻暮重,结合患者重复电频刺激未见异常,此时排除重症肌无力的诊断。同时,脑MRI、垂体增强MRI、自身免疫性相关抗体检测、甲状腺功能、垂体激素检测等检查也均未见异常,炎症指标(PCT+IL6)也无显著升高,故暂不考虑感染、自身免疫性疾病、垂体炎等诊断。排除以上相关病因后,综合周围神经病抗体抗硫脑苷脂抗体IgG 阳性、肌电图结果(双上肢尺神经、右上肢正中神经运动传导波幅降低伴右正中神经传导速度减慢,上、下肢肌源性损害)及患者免疫治疗用药前后症状变化,考虑诊断为免疫相关性肌炎、免疫相关性周围神经病。遂立即停用特瑞普利单抗,予以甲强龙(200 mg,每日1 次)冲击治疗。治疗次日患者出现声嘶、吞咽无力及饮水呛咳,随后出现双下肢无力伴水肿。结合患者吞咽硬软食均困难,伴四肢乏力,喉镜检查(-),考虑患者吞咽困难为咽喉肌肌肉无力可能性大。进一步完善消化道碘水造影示对比剂通过会厌欠佳,考虑会厌功能障碍(图1)。综合肌电图结果、脑MRI(-)及纯频电刺激(-),考虑诊断为免疫性神经肌病所致会厌运动障碍。
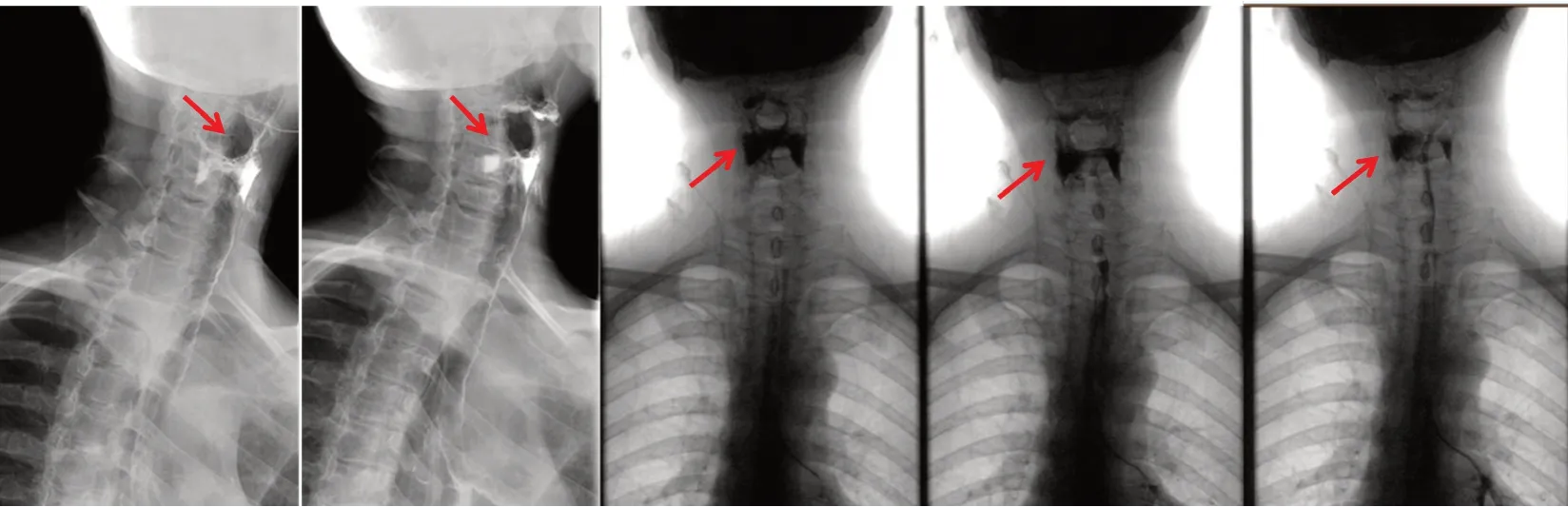
图1 患者消化道碘水造影Figure 1. Gastrointestinal iodine water contrast
由于患者激素冲击治疗4 天后症状缓解不明显,且存在加重倾向,遂调整激素用量(甲强龙500 mg,每日1 次),同时联合丙种球蛋白(20 g,每日1 次,共5 次)、他克莫司(1 mg,每日2 次)、麦考酚钠(540 mg,每日2 次)免疫抑制治疗,以及3 次英夫利息单抗针治疗(300 mg)。还给予预防性抗感染、纠正电解质紊乱、利尿以减轻水肿,行三腔喂养管置入术以解决进食问题。治疗半月余后,患者复查肺部CT 提示出现双肺实性结节伴部分空洞形成,考虑感染性病变,遂加强抗生素抗感染治疗。经治疗后患者CK、MYO及转氨酶等多项指标降至正常基线水平左右,四肢水肿逐渐消退,患者可自主进食,无明显吞咽困难(图2)。2022 年11 月上旬患者出院时,甲强龙已降至200 mg,院外继续口服强的松片并逐渐减量(起始剂量180 mg,每5 天减量10%);继续口服麦考酚钠(360 mg,每日2 次)、他克莫司(1 mg,每日2 次)。随访3 月余,患者未再使用ICIs 治疗,停用免疫抑制治疗药物后,肌炎及周围神经病变症状未再发。
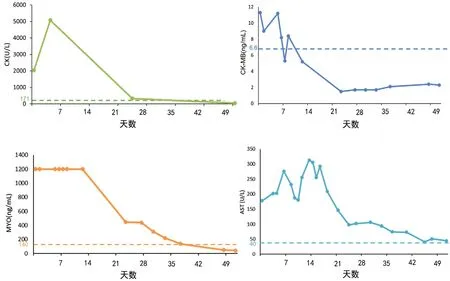
图2 病程中患者肌酸激酶(CK)、肌红蛋白(MYO)、肌酸激酶同工酶(CK-MB)及天门冬氨酸氨基转移酶变化情况Figure 2. Changes of creatine kinase (CK), myoglobin (MYO), creatine kinase isoenzyme (CK-MB)and aspartate aminotransferase (AST) during the course of the disease
2 讨论
作为抗癌治疗的一项重大突破,免疫检查点抑制剂可通过和相应的免疫检查点特异性结合,阻遏免疫检查点的抑制作用,从而激活机体的抗肿瘤免疫[8]。然而,激活的T 细胞也可能破坏正常细胞而导致irAEs 的发生。尽管大多数irAEs的严重程度仅为轻至中度,但若不及时干预,仍可能出现严重危及生命的情况。一项纳入112项试验的Meta 分析显示,irAEs 在单独接受抗PD-1、抗PD-L1、抗CTLA-4 治疗患者中的致死率分别为0.36%、0.38%和1.08%,联合ICIs 治疗引起的irAEs 致死率最高,约为1.23%[9]。
累及神经肌肉系统的irAEs 被称为ICIs 相关神经肌病,较为少见,发生率仅占所有irAEs 的3%不到,主要包括肌炎、周围神经病、重症肌无力[10]。据一项回顾性研究统计,免疫性肌炎的发生率仅为0.04%,通常发生在初次接受ICIs 治疗后1~2个月左右[6,11],半数以上患者的首发症状表现为肌痛和近端肢体无力,几乎所有病例均发生CK升高[6]。值得注意的是,免疫性肌炎患者还可能表现出其他肌肉消耗的征象,如转氨酶和肌钙蛋白-T 水平升高[10]。由于目前缺乏用于识别免疫性肌炎患者的特异性生物标志物,建议结合临床症状、实验室检查、肌电图,甚至肌肉活检对其进行识别。此外,免疫相关性周围神经损害患者多表现为以运动神经损害为主的神经损害症状,其主要病变基础为周围神经脱髓鞘[12],电生理检查可表现为F 波潜伏期延长、周围神经传导速度降低和传导阻滞等改变[13]。抗硫脑苷脂抗体是一种抗周围神经膜表面糖脂抗体,已被广泛认为是筛查周围神经损害的指标之一[14]。考虑到本例患者有糖尿病史,其周围神经病变需与糖尿病性周围神经病变相鉴别。糖尿病性周围神经病变前期主要表现为远端肢体对称性感觉异常、神经性疼痛等,疾病后期可出现运动神经损害相关症状,该病进展缓慢但不可逆,治疗上侧重于控制血糖及对症处理[15]。尽管本例患者存在糖尿病病史,但其血糖长期控制尚可,不存在其他明显的微血管并发症,且患者的运动神经损害症状经激素及免疫调节治疗后可恢复,故初步排除此诊断。此外,周围神经病变也是奥沙利铂全身化疗最常诱导的毒性之一,与累积剂量相关,患者常在输注药物后数小时内就出现对寒冷刺激过敏、四肢末端感觉异常等表现,相当一部分患者在停药后仅部分恢复且症状长期持续存在[16]。在本例患者中应用的选择性肝动脉化疗栓塞术的化疗相关不良反应较全身化疗轻,通常对症处理即可好转,结合患者症状后考虑此诊断也不充分。本例患者在使用特瑞普利单抗治疗后出现以运动神经损害为主的周围神经症状及肌炎表现,存在合理的时间相关性,在停药处理及使用激素、免疫抑制剂治疗后症状和检查指标逐渐好转,且停用免疫检查点抑制剂后症状未再发,用其余病因解释患者症状证据不足,最终诊断为免疫相关性肌炎及周围神经病。
irAEs 可涉及全身各器官系统,最常出现在皮肤、胃肠道、内分泌腺和肺。部分irAEs 患者甚至可能依次或同时经历多个器官毒性。据统计,当免疫性肌炎合并心肌炎时致死率可高达56.7%[17]。因此,当临床医生怀疑肌炎诊断时,也需动态监测肌钙蛋白、心肌酶、超声心动图及心电图等心脏相关指标以进一步排查合并心肌炎的可能。此外,由于免疫相关神经肌病患者常出现不同程度的乏力,因此重症肌无力也是免疫性神经肌肉损害患者需重点鉴别的合并症。除上述外,本例患者还出现明显低钾、低钠、低钙等电解质紊乱及四肢水肿情况,需考虑到有无合并免疫性垂体炎等免疫相关内分泌毒性可能。在完善各项内分泌相关检查后,初步排除该可能性。结合患者营养状况差及病程中多次利尿治疗,考虑其病因可能来自外源性(如营养、医源性)因素。总之,在考虑出现ICIs 相关神经肌病时,临床医生应警惕合并其它irAEs 的可能,密切关注患者疾病演变过程,以期尽早发现、诊断及治疗,避免严重后果的发生。
一旦诊断出irAEs,应立即停用ICIs。大剂量应用糖皮质激素是目前应对irAEs 的一线疗法,通常以1~2 mg/(kg·d)为起始剂量开始冲击治疗后缓慢减量并改为口服。在使用糖皮质激素仍无法控制病情的情况下,可考虑额外使用免疫球蛋白、血浆置换、英夫利昔单抗等其他免疫抑制治疗[18]。总之,在对可疑irAEs 患者进行及时检查的同时,不应延迟糖皮质激素或其他免疫调节疗法的使用。需要注意的是,一项单中心的研究表明使用糖皮质激素和英夫利昔单抗治疗与irAEs 患者的严重感染有关[19],而严重感染为ICI 肌炎患者死亡的重要原因[9,17]。因此,考虑到irAEs 患者需使用长疗程的糖皮质激素和免疫抑制剂治疗,临床医生应结合实际考虑行经验性抗感染治疗。
综上,ICIs 相关性神经肌病是一类罕见、存在潜在致命风险的irAEs,其症状多变且广泛,诊断及管理相对复杂。因此,临床医师需严密监测接受ICIs 治疗患者的症状、体征及相关指标的变化,高度警惕其发生发展,并在疑诊时及时进行多学科讨论,以期早期识别和治疗,以最大限度地降低其后遗症和死亡风险。
