基于TCGA等数据库分析TMEM88在肝细胞中的表达水平及其与预后的关系
2023-05-11AndrewLiman
Andrew Liman,朱 倩
武汉中南医院肝胆胰外科(武汉 430071)
肝细胞肝癌(hepatocellular carcinoma,HCC)是消化系统最常见和最致命的恶性肿瘤之一,在世界范围内造成了巨大的经济和健康负担,特别是在南亚和其他低收入国家[1-2]。虽然在过去10 年中免疫治疗和靶向分子治疗的进展改善了HCC 的治疗,但患者的五年总体存活率仍不到20%[3-4]。HCC 患者存活率低主要是由于早期HCC发现率低,术后早期复发所致[5]。尽管近年来已经发现了有关肝癌诊断和预后的生物标志物,但其较低的敏感性和特异性限制了临床应用[6-7]。因此,迫切需要寻找新的诊断和预后分子标志物及其相关的分子机制和信号通路,以改善HCC 患者的预后。
跨膜蛋白88(transmembrane protein 88,TMEM88)是一种新发现的跨膜蛋白,在胚胎发育过程中与disheveled-1 蛋白相互作用[8]。已有研究证明TMEM88 是Wnt/β-catenin 信号传导的关键调节因子,在调节胚胎心肌细胞分化和心脏发育中发挥重要作用[9]。TMEM88 的失调与多种病理过程有关,包括瘢痕组织的形成、炎症和肝纤维化等[10-12]。它也作为癌基因或肿瘤抑制因子发挥作用[13]。TMEM88 表达在肺癌和乳腺癌中升高,这与晚期肿瘤分期、淋巴结转移和较差的总生存率相关[14-15]。此外,TMEM88 的高表达增强了癌细胞在体外的侵袭和转移[14-15],相比之下,由于其启动子的低甲基化,TMEM88 在非小细胞肺癌中的表达较低,其高表达限制了癌细胞的增殖和侵袭[16]。这些发现表明TMEM88 在癌症中的重要作用,但其在正常肝细胞和肝肿瘤细胞中的表达模式及其与HCC 患者预后的关系尚不明确。因此,本研究主要探究TMEM88 在HCC 中的表达水平及其与患者预后的关系。
1 资料与方法
1.1 数据来源
本研究中的所有数据均来自公共数据库癌症基因组图谱(The Cancer Genome Atlas,TCGA)(cancer.gov/about-nci/organization/ccg/research/structural-genomics/tcga)和基因表达综合数据库(Gene Expression Omnibus,GEO)(https://www.ncbi.nlm.nih.gov/geo/)。本研究基于公开数据库,不存在伦理问题或其他利益冲突。TCGA 由美国癌症研究所和国家人类基因组研究所资助,包括超过20 000 种原发性癌症的分子特征数据和超33 种癌症类型的匹配正常样本,产生了超过2.5 PB 的基因组、表观基因组、转录组和蛋白质组数据。GEO 是一个国际公共资料库,用于存档和免费分发微阵列、下一代测序和研究界提交的其他形式的高通量功能基因组学数据。GEO 的三个主要目标是:①提供一个强大的、多功能的数据库,可以在其中有效地存储高通量功能基因组数据;②提供简单的提交程序和格式,以支持来自研究社区的完整且注释良好的数据存储;③提供用户友好的机制,允许用户查询、定位、审查和下载感兴趣的研究和基因表达谱。
Kaplan-Meier(http://kmplot.com/analysis/)生存曲线分析平台用来分析TMEM88 基因表达与基于风险比(hazard ratios,HR)和对数秩P 值[17]。
肿瘤免疫估计资源数据库(Tumor Immune Estimation Resource,TIMER)(https://cistrome.shinyapps.io/timer/)用于使用来自TCGA 数据库的10 000 多个样本系统分析32 种癌症类型中的肿瘤浸润免疫细胞(TIIC)[18]。TIMER 根据基因表达谱的统计分析确定肿瘤浸润免疫细胞的丰度[19]。本文分析了TMEM88 基因表达水平与浸润免疫细胞丰度之间的关联,包括CD4+ T 细胞、CD8+ T细胞、B 细胞、中性粒细胞、树突状细胞和巨噬细胞基于特定标记基因在包括HCC 在内的不同癌症中的表达。用于分析肿瘤浸润性免疫细胞的标记基因,包括T 细胞、B 细胞、TAM、单核细胞、M1 巨噬细胞、M2 巨噬细胞、自然杀伤(NK)细胞、中性粒细胞、树突状细胞(DC)、T 辅助(Th)细胞、T 辅助17(Th17)细胞、滤泡辅助T(Tfh)细胞、耗尽的T 细胞和Tregs 均基于先前研究的数据[20-21]。TMEM88 基因位于x 轴上,相关标记基因位于y 轴。
基因表达谱交互分析(gene expression profiling enrichment analysis,GEPIA)数据库(http://gepia.cancer-pku.cn/index.html)用于分析来自TCGA 和GTEx 项目的8 587 个正常和9 736 个肿瘤组织样本的RNA 测序表达数据[22]。
UALCAN 是一个全面的、用户友好的、交互式的网络资源,用于分析癌症OMICS 数据。它基于Perl-CGI 构建,使用高质量的图形、javascrip技术和css。UALCAN 的设计目的是:①提供公开的癌症OMICS 数据(TCGA、MET500、CPTAC和CBTTC);②允许用户识别生物标志物或对潜在的感兴趣基因进行电子验证;③提供描绘蛋白质编码、miRNA 编码和lincRNA 编码基因的表达谱、患者生存信息的图表和曲线图;④评估启动子甲基化对基因表达的表观遗传调节;⑤进行泛癌基因表达分析;⑥通过链接检索到HPRD、GeneCards、Pubmed、TargetScan、人类蛋白质图谱、DrugBank、Open Target 和GTEx 提供有关选定基因/靶点的更多信息。这些资源使研究人员能够收集其感兴趣的基因/靶点的有价值的信息和数据;⑦提供临床蛋白质组联盟数据分析,包括总/磷酸蛋白质;⑧提供儿童脑肿瘤基因表达和蛋白质表达分析[23-24]。
STRING 是已知和预测的蛋白质-蛋白质相互作用的数据库。相互作用包括直接(物理)和间接(功能)联系;它们源于计算预测、生物体之间的知识转移以及从其他(主要)数据库汇总的相互作用。STRING 中的数据相互作用主要来自:基因组上下文预测、高通量实验室实验、(保守的)共表达、自动文本挖掘和数据库中的先前知识。STRING 数据库目前涵盖来自5 090 个生物体的24 584 628 个蛋白质[25]。
cBioPortal 是一个开放访问、开放源码的资源,用于交互式探索多维癌症基因组数据集。cBioPortal 的目标是通过提供对大规模癌症基因组学项目的分子图谱和临床属性的快速、直观和高质量的访问,显著降低复杂基因组数据和癌症研究人员之间的障碍,从而使研究人员能够将这些丰富的数据集转化为生物学见解和临床应用[26-27]。
1.2 研究方法
1.2.1 TMEM88在不同癌症中的表达情况
使用TIMER 数据库分析TCGA 数据库中不同肿瘤类型中TMEM88 的表达水平。使用cBioPortal 工具研究不同肿瘤类型中TMEM88 的遗传变异情况。
1.2.2 TMEM88在肝脏组织中的表达情况
使用CPTAC 数据库分析TCGA 数据库中TMEM88 在肝脏正常组织与肝脏肿瘤组织中的表达情况。使用STRING 工具研究肝脏组织中与TMEM88 表达相关的基因。使用GEPIA 工具分析TMEM88 基因在不同HCC 病理分期中的表达情况,分析DVL1、DVL2、DVL3 和VRK2 与TMEM88表达相关性和分析TMEM88 与免疫细胞标记基因的相关性。利用TIMER 数据库分析TMEM88 与DVL1、DVL2、DVL3 和VRK2 的 相关性,分 析TMEM88 表达与 HCC 组织中免疫细胞、成纤维细胞浸润水平的相关性;使用UALCAN 工具分析TMEM88 在肝脏正常组织与肝脏肿瘤组织不同临床病理因素中的磷酸化水平的变化。
1.2.3 TMEM88的表达情况与患者预后的关系
使用Kaplan-Meier 绘图仪数据库分析HCC中高和低TMEM88 表达的预后生存曲线,分析HCC 患者不同临床病理因素中TMEM88 mRNA 表达与患者预后的相关性。
2 结果
2.1 TMEM88 mRNA的表达情况分析
使用TIMER 数据库对TCGA RNA-seq 数据进行分析表明,TMEM88 mRNA 在肝脏肿瘤组织中的表达高于相对应的正常组织(图1-a)。使用GEPIA 数据分析时也得到相同的结果,且差异有统计学意义(P<0.001)(图1-b)。继续使用GEPIA 数据分析TCGA 数据库中TMEM88 在肝脏肿瘤不同病理分期(I 期、II 期、III 期和IV期)中的表达情况,结果显示在各个分期的表达情况跟正常肝脏组织的表达水平差异有统计学意义(P=0.003)(图1-c)。使用cBioPortal 工具研究不同肿瘤类型中TMEM88 的遗传变异情况,结果显示在肝脏肿瘤组织中TMEM88 以深度缺失的形式影响肝脏组织的正常遗传功能,异变或扩增的遗传变异情况并没有在肝脏肿瘤组织中被检测到(图1-d)。
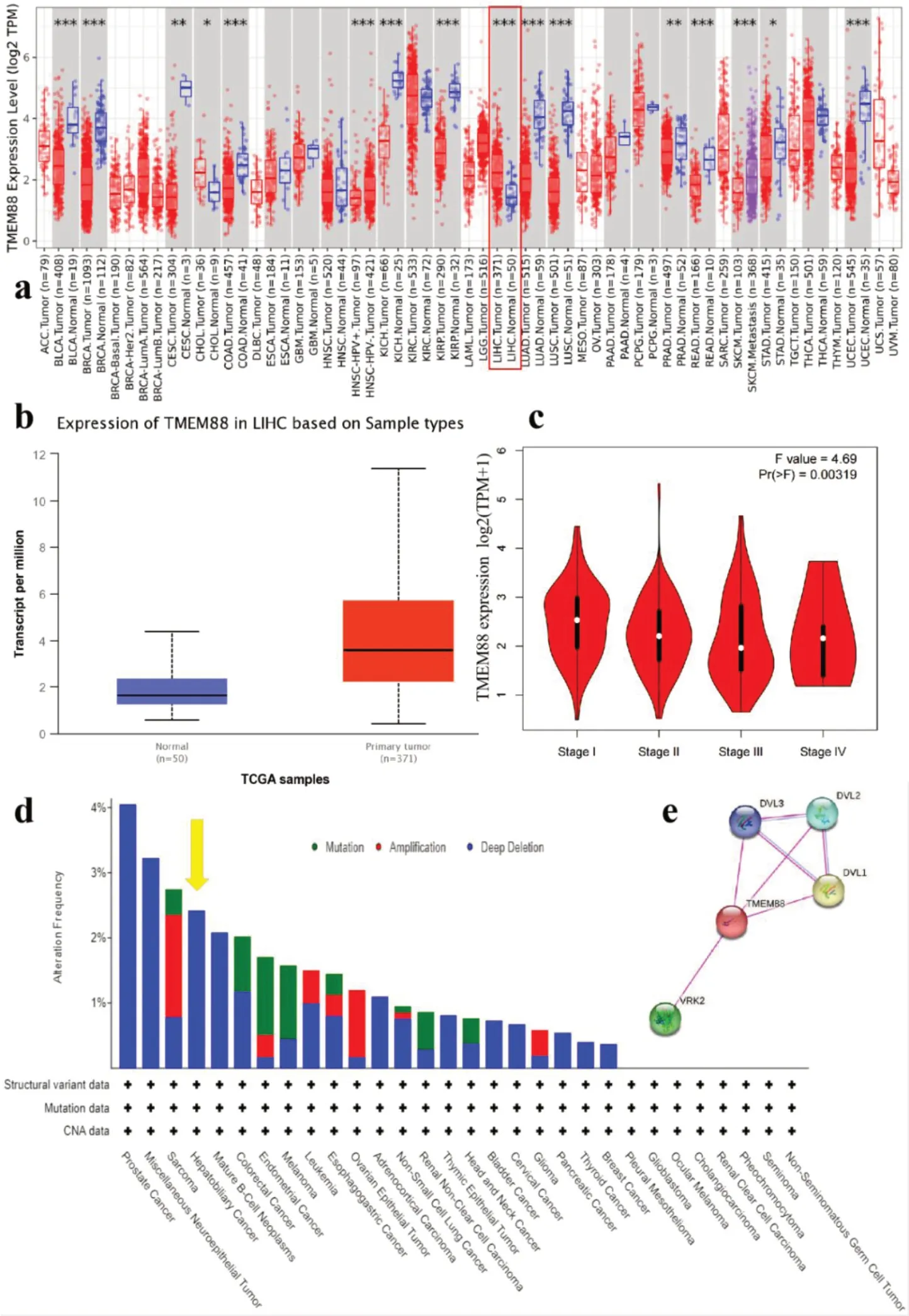
图1 TMEM88在肝脏组织中的表达情况Figure 1. Expression of TMEM88 in liver tissue
利用STRING 工具分析在肝脏组织中和TMEM88 表达相关的基因,得到DVL1、DVL2、DVL3 和VRK2 共4 个基因(图1-e)。进一步使用TIMER 数据库分析TMEM88 与这几个基因在肝脏组织表达之间的潜在关系,发现其与DVL1 的关系无统计学意义(P>0.05),与DVL2、DVL3和VRK2 均呈负相关(图2-a)。但在使用GEPIA分析这几个基因与TMEM88 表达的相关性时发现只有与VRK2 的负相关性有统计学意义(R=-0.14;P=0.005),与DVL2(P=0.26)和DVL3(P=0.37)的相关性均无统计学意义(图2-b)。
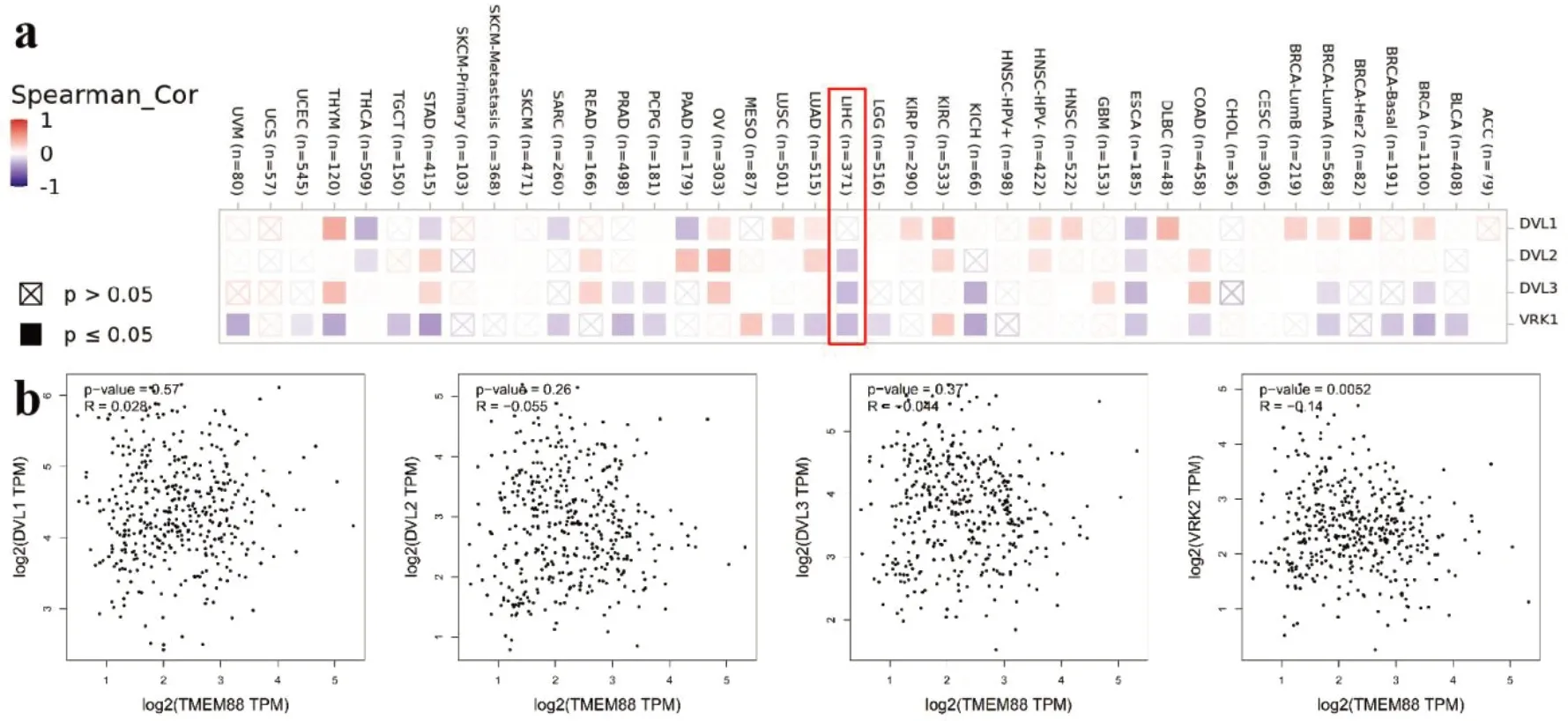
图2 TMEM88与相关基因在肝癌组织中的相关性Figure 2. Correlation between TMEM88 and related genes in hepatocellular carcinoma
2.2 TMEM88表达与HCC组织中免疫细胞浸润水平的相关性
本研究使用来自TIMER 数据库中371 例HCC 患者的数据来研究TMEM88 表达与HCC 组织中免疫细胞浸润水平的相关性。HCC 组织中的TMEM88 表达与CD8+ T 细胞的浸润水平呈正相关(partial.cor=0.004),但没有统计学意义(P=0.94)。与肿瘤纯度(partial.cor=-0.178;P<0.001)、B细胞(partial.cor=-0.207;P<0.001)、巨噬细胞(partial.cor=-0.2;P<0.001)和中性粒细胞(partial.cor=-0.145;P=0.007)的浸润水平呈负相关且均有统计学意义。虽然与CD4+T 细胞(partial.cor=-0.065)和树突细胞(partial.cor=-0.05)的浸润水平呈负相关,但均没有统计学意义(图3-a)。

图3 TMEM88 表达与肝癌组织中免疫细胞浸润水平的相关性Figure 3. Correlation between TMEM88 expression and immune infiltration in hepatocellular carcinoma
此外,TMEM88 在HCC组织中的表达与患者生存结果显著相关,HCC 患者中较高的TMEM88 表达与更好的预后相关。B 细胞(P=0.489)、CD8+ 细胞(P=0.551)、CD4+ 细胞(P=0.454)、巨噬细胞(P=0.153)、中性粒细胞(P=0.2)和树突细胞(P=0.288)标志物的表达水平与患者生存结果无明显相关性(图3-b)。
使用TIMER 数据库分析TMEM88 基因的表达水平与不同肿瘤组织中的成纤维细胞浸润水平之间的潜在相关性(图3-c)。结果显示,TMEM88在肝脏肿瘤细胞中的MCPCOUNTER 浸润情况(P=0.007)、XCELL 浸润情况(P<0.001)及TIDE 浸润情况(P<0.001)均呈正相关且均有统计学意义,而EPIC 浸润情况几乎为零(图3-d)。
2.3 TMEM88在HCC中的表达情况
使用Kaplan-Meier 生存曲线分析平台分析了TMEM88 表达在各种人类癌症中的预后价值。高TMEM88 表达与HCC 队列中更好的总生存期(OS)、无进展生存期(PFS)、无复发生存期(RFS)和疾病特异性生存期(DSS)相关。TMEM88 低表达与HCC 预后较差相关,其中OS[HR=0.58,95%CI(0.41,0.82),P<0.005]、PFS[HR=0.59,95%CI(0.44,0.8),P<0.005]、RFS[HR=0.69,95%CI(0.49,0.96),P=0.026]、DSS[HR=0.49,95%CI(0.31,0.78),P=0.49]。虽然HCC 中的TMEM88 mRNA 表达高于相应的正常组织,但高TMEM88 表达与HCC 的更好预后相关(图4)。

图4 肝癌患者TMEM88 表达的预后生存曲线Figure 4. Prognostic survival curve of TMEM88 expression in liver cancer patients
使用UALCAN 工具分析TMEM88 在肝脏正常组织与肝脏肿瘤组织不同临床病理因素中的磷酸化水平的变化,结果显示在肝脏正常组织中的TMEM88 磷酸化水平与肝脏肿瘤中无论是平均值还是数值范围均有明显的差异。在分析HCC 患者不同临床病理分期因素中,共收录了50 个正常肝脏组织、168 个I 期肝癌组织、84 个II 期肝癌组织、82 个肝癌组织和6 个IV 期肝癌组织。结果显示,正常肝脏组织与I 期肝癌组织(P<0.001)、正常肝脏组织与II 期肝癌组织(P<0.001)、正常肝脏组织与III 期肝癌组织(P<0.001)、
正常肝脏组织与IV 期肝癌组织(P=0.012)和I期肝癌组织与II 期肝癌组织(P=0.050)的数值差异均有统计学意义。而在I 期肝癌组织与III 期肝癌组织(P=0.171)、I 期肝癌组织与IV 期肝癌组织(P=0.439)、II 期肝癌组织与III 期肝癌组织(P=0.755)、II 期肝癌组织与IV 期肝癌组织(P=0.899)和III 期肝癌组织与IV 期肝癌组织(P=0.828)的数值差异均无统计学意义(图5-a)。

图5 不同临床病理因素中TMEM88的磷酸化水平Figure 5. Phosphorylation levels of TMEM88 in different clinicopathological factors
TMEM88 表达水平与病人种族有密切关系。共收录了50 个正常肝脏组织、177 个白种人HCC患者组织、17 个非裔美籍HCC 患者组织和157个亚裔HCC 患者组织。结果显示,正常肝脏组织与白种人患者组织(P<0.001)、正常肝脏组织与非裔美籍患者组织(P=0.012)、正常肝脏组织与亚裔患者组织(P<0.001)和白种人患者组织与亚裔患者组织(P=0.008)的数值差异均有统计学意义。而白种人患者组织与非裔美籍患者组织(P=0.577)和非裔美籍组织与亚裔患者组织(P=0.526)的数值差异均无统计学意义(图5-b)。
对50 个正常肝脏组织、245 个男性患者组织和117 个女性患者组织分析,结果显示,正常肝脏组织与男性患者组织(P<0.001)和正常肝脏组织与女性患者组织(P<0.001)的数值差异均有统计学意义。而男性患者组织与女性患者组织(P=0.68)的数值差异无统计学意义(图5-c)。
80 岁以下HCC 患者组织中都检测到高TMEM88 表达水平。共收录了50 个正常肝脏组织、27 个21 至40 岁患者的组织、140 个41 岁至60 岁患者的组织、181 个61 岁 至80 岁 患者的组织和10 个大于80 岁患者的组织。结果显示,正常肝脏组织与21 岁至40 岁患者组织(P=0.001)、正常肝脏组织与41 岁至60 岁患者组织(P<0.001)和正常肝脏组织与61 岁至80岁患者组织(P<0.001)的数值差异均有统计学意义。而正常肝脏组织与大于80 岁患者组织(P=0.091)、21 岁至40 岁患者组织与41 岁至60 岁患者组织(P=0.178)、21 岁至40 岁患者组织与61 岁至80 岁患者组织(P=0.277)、21 岁至40 岁患者组织与大于80 岁患者组织(P=0.61)、41 岁至60 岁患者组织与61 岁至80 岁患者组织(P=0.224)、41 岁至60 岁患者组织与大于80岁患者组织(P=0.309)和61 岁至80 岁患者组织与大于80 岁患者组织(P=0.388)的数值差异均无统计学意义(图5-d)。
TMEM88 表达水平与患者体重不呈正相关。共收录了50 个正常肝脏组织、154 个正常体重患者组织(18.5 ≤BMI <25)、88 个超重患者组织(25≤BMI<30)、57个肥胖患者组织(30≤BMI<40)和11 个极度肥胖患者组织(BMI ≥40)。结果显示,正常肝脏组织与正常体重患者组织(P<0.001)、正常肝脏组织与超重患者组织(P<0.001)、正常肝脏组织与肥胖患者组织(P<0.001)和正常肝脏组织与极度肥胖患者组织(P=0.019)的数值差异均有统计学意义。而正常体重患者组织与超重患者组织(P=0.52)、正常体重患者组织与肥胖患者组织(P=0.427)、正常体重患者组织与极度肥胖患者组织(P=0.694)、超重患者组织与肥胖患者组织(P=0.947)、超重患者组织与极度肥胖患者组织(P=0.985)和肥胖患者组织与极度肥胖患者组织(P=0.985)的数值差异均无统计学意义(图5-e)。
在分析与患者肝癌评级的因素中,共收录了50 个正常肝脏组织、54 个1 级患者组织(分化良好,低等级)、173 个2 级患者组织(中度分化,中等级)、118 个3 级患者(低分化,高等级)和12 个4 级患者(未分化,高等级)。结果显示正常肝脏组织与1 级患者组织(P<0.001)、正常肝脏组织与2 级患者组织(P<0.001)、正常肝脏组织与3 级患者组织(P<0.001)、1 级患者组织与3 级患者组织(P=0.022)、1级患者组织与4 级患者组织(P=0.009)和2 级患者组织与4 级患者组织(P=0.009)的数值差异均有统计学意义。而正常肝脏组织与4 级患者组织(P=0.126)、1 级患者组织与2 级患者组织(P=0.304)、2 级患者组织与3 级患者组织(P=0.090)和3 级患者组织与4 级患者组织(P=0.099)的数值差异均无统计学意义(图5-f)。
无淋巴结转移患者组织中的TMEM88 表达水平数据差异有统计学意义。共收录了50 个正常肝脏组织、252 个N0 患者组织(无区域淋巴结转移)和4 个N1 患者组织(1 至3 个腋窝淋巴结转移)。结果显示,正常肝脏组织与N0 患者组织(P<0.001)的数值差异有统计学意义。而正常肝脏组织与N1 患者组织(P=0.43)和N0 患者组织与N1 患者组织(P=0.934)的数值差异均无统计学意义(图5-g)。
无论是否有TP53 突变,患者组织中TMEM88均为高表达。共收录了50 个正常肝脏组织、105个有TP53 突变的组织和255 个没有TP53 突变的组织。结果显示,正常肝脏组织与有TP53 突变的组织(P<0.001)、正常肝脏组织与没有TP53 突变的组织(P<0.001)和有TP53 突变与没有TP53 突变组织(P<0.001)的数值差异均有统计学意义(图5-h)。
在分析与肝癌亚型的因素中,共收录了50个正常肝脏组织、361 个HCC 患者组织,3 个肝脏纤维板层癌(fibrolamellar hepatocellular carcinoma,FL-HCC)患者组织和 7个混合肝胆管癌(hepatocholangiocarcinoma,HCC-CC)患者组织。结果显示,正常肝脏组织与HCC 患者组织(P<0.001)和HCC 患者组织与FLHCC 患者组织(P=0.012)的数值差异均有统计学意义。而正常肝脏组织与FL-HCC 患者组织(P=0.108)、正常肝脏组织与混合HCC-CC 患者组 织(P=0.179)、HCC 与混合HCC-CC 患者组织(P=0.266)和FL-HCC 患者组织与混合HCC-CC 患者组织(P=0.207)的数值差异均无统计学意义(图5-i)。
2.4 临床病理因素与患者预后的相关性
使用Kaplan-Meier生存曲线分析平台分析了TMEM88表达与HCC不同临床特征之间的关系,结果如表1所示。低TMEM88表达与男性(OS:HR=0.58,P=0.0160;PFS:HR=0.65,P=0.0173)、HCC2级患者(OS:HR=0.53,P=0.0150;PFS:HR=0.61,P=0.0234)、3级患者(OS:HR=0.39,P=0.0030;PFS:HR=0.55,P=0.0172)、黄种人患者(OS:HR=0.43,P=0.0059;PFS:HR=0.60,P=0.0346)和不酗酒的患者(OS:HR=0.50,P=0.0037;PFS:HR=0.66,P=0.0456)较差的OS、PFS相关。低TMEM88mRNA表达与女性(HR=0.44,P=0.0050)、2+3期患者(HR=0.49,P=0.0032)、3期患者(HR=0.44,P=0.0064)、3+4期患者(HR=0.50,P=0.0158)、AJCC_T2级患者(HR=0.47,P=0.0466)、AJCC_T3级患者(HR=0.47,P=0.0123)和微血管侵犯患者(HR=0.46,P=0.0452)较差的OS相关。TMEM88mRNA低表达与1期患者(HR=0.58,P=0.0313)、1+2期患者(HR=0.57,P=0.0036)、白种人患者(HR=0.65,P=0.0325)、有酗酒的患者(HR=0.60,P=0.0088)、肝炎病毒患者(HR=0.63,P=0.0459)和无肝炎病毒患者(HR=0.63,P=0.0369)的PFS较差相关。然而,TMEM88表达与2期患者(OS:HR=0.59,P=0.1886;PFS:HR=0.65,P=0.1561)和1级患者(OS:HR=0.59,P=0.2734);PFS:HR=0.72,P=0.4078)或AJCC_T1级患者(OS:HR=0.79,P=0.4186;PFS:HR=0.62,P=0.0557)的OS或PFS无关。
2.5 TMEM88 mRNA水平与免疫细胞不同亚群标志物的相关性
使用GEPIA 数据库根据HCC 组织中的免疫标记基因的表达水平,研究TMEM88 表达与II型T 细胞状态之间的相关性。在HCC 组织中分析的免疫细胞包括单核细胞、中性粒细胞、肿瘤相关巨噬细胞(TAM)、T 辅助细胞1(Th1)、T 辅助细胞2(Th2)、调节性T(Tregs)和耗竭性T 细胞。GEPIA 数据库分析显示,HCC 组织中TMEM88 的表达与肿瘤相关巨噬细胞(TAM)、中性粒细胞、T 辅助细胞、Tregs 和耗竭性T 细胞的标记基因表达显著相关(表2)。
具体而言,TMEM88 表达与特定免疫细胞标志物如单核细胞标志物CD86(正常:r=0.57,P<0.001)和CD11b(肿瘤:r=-0.23,P<0.001;正常:r=0.43,P=0.0019);中性粒细胞标志物CCR7 ( 肿 瘤:r=0.15,P=0.0035; 正 常:r=0.49,P<0.001);肿瘤相关巨噬细胞标志物CD68(正常:r=0.48,P≤0.001);T 辅助细胞1 标志物IFN-γ(肿瘤:r=-0.14,P=0.0064;正常:99r=0.33,P=0.02),STAT1(肿瘤:r=-0.17,P=0.0012;正常:r=0.45,P<0.001),T-bet(肿瘤:r=0.17,P<0.001,正常:r= 0.48,P<0.001)和TNF-α(肿瘤:r=-0.11,P=0.031,正常:r=0.3,P=0.034);T 辅助细胞2 标志物STAT6(正常:r=0.48,P<0.001);调节性T 细胞标志物CCR8(肿瘤:r=-0.12,P=0.018)和TGF-β(正常:r=0.7,P<0.001);耗竭性T 细胞CTLA4(肿瘤:r=-0.2,P<0.001,正常:r=0.43,P=0.0016),PD-1(PDCD1)(肿瘤:r=-0.13,P=0.016;正常:r=0.46,P<0.001)和TIM-3(HAVCR2)(肿瘤:r=-0.18,P<0.001;正常:r=0.57,P<0.001)有密切的相关性。
3 讨论
本次研究使用TIMER 数据库中对癌组织和正常组织中TMEM88 mRNA 水平的分析表明,TMEM88 在大多数癌组织中的表达显著低于相应的正常组织,但在HCC 组织中的表达显著高于相应的正常组织。然而,TMEM88 在不同类型癌症中的表达存在差异,这可能反映了数据收集方法和潜在致病机制的差异。虽然如此,TMEM88在HCC 组织中的表达水平在不同的数据库中是一致的。使用GEPIA 数据研究TMEM88 在肝脏肿瘤不同病理分期中的表达情况的分析表明,TMEM88 的表达贯穿所有分期,且跟正常肝脏组织的表达水平差异明显。使用cBioPortal 工具研究不同肿瘤类型中TMEM88 的遗传变异情况的分析表明,TMEM88 以完全深度缺失的形式影响肝脏组织的正常遗传功能,在肝脏肿瘤组织中未检测到任何异变或扩增的遗传变异情况。在使用STRING 工具分析肝脏组织中和TMEM88 表达相关的基因,得到DVL1、DVL2、DVL3 和VRK2四个基因,但进一步使用TIMER 数据库分析在肝脏组织表达之间的潜在关系时发现其与DVL2、DVL3 和VRK2 均呈负相关。使用GEPIA 分析这几个基因与TMEM88 表达的相关性时发现只有与VRK2 的负相关性有意义。TMEM88 在肝脏肿瘤细胞中的MCPCOUNTER 浸润情况、XCELL浸润情况及TIDE 浸润情况均呈正相关,说明了TMEM88 在HCC 组织中有促进免疫逃逸的功能。
除此之外,研究发现HCC 患者中较高的TMEM88 表达与更好的预后相关。经过Kaplan-Meier 绘图仪数据分析发现,高TMEM88 表达与HCC 患者更好的OS、PFS 和RFS 相关。这些结果表示,TMEM88 在HCC 组织中具有保护的功能。使用UALCAN 工具分析结果发现,TMEM88在肝脏正常组织与肝脏肿瘤组织不同临床病理因素中的磷酸化水平平均值和数值范围均有明显的差异。HCC 患者不同临床病理分期因素结果显示,正常肝脏组织与I 期肝癌组织、正常肝脏组织与II 期肝癌组织、正常肝脏组织与III 期肝癌组织、正常肝脏组织与IV 期肝癌组织和I 期肝癌组织与II 期肝癌组织的差异表达水平有意义。患者不同人种因素显示,正常肝脏组织与白种人患者组织、正常肝脏组织与非裔美籍患者组织、正常肝脏组织与亚裔患者组织和白种人患者组织与亚裔患者组织的差异表达水平有意义。分析患者性别的因素,结果显示,正常肝脏组织与男性患者组织和正常肝脏组织与女性患者组织的差异有意义。分析患者年龄因素,结果显示,正常肝脏组织与21 岁至40 岁患者组织、正常肝脏组织与41 岁至60 岁患者组织和正常肝脏组织与61 岁至80 岁患者组织的数值差异均有统计学意义。分析患者体重因素,结果显示,正常肝脏组织与正常体重患者组织、正常肝脏组织与超重患者组织、正常肝脏组织与肥胖患者组织和正常肝脏组织与极度肥胖患者组织的数值差异均有统计学意义。分析患者肝癌评级因素,结果显示,正常肝脏组织与1 级患者组织、正常肝脏组织与2 级患者组织、正常肝脏组织与3 级患者组织、1 级患者组织与3 级患者组织、1 级患者组织与4 级患者组织和2 级患者组织与4 级患者组织的差异有意义。分析淋巴结转移因素,结果显示,正常肝脏组织与NO 患者组织的差异有意义。分析TP53 的突变状态因素,结果显示,正常肝脏组织与有TP53突变的组织、正常肝脏组织与没有TP53 突变的组织和有TP53 突变与没有TP53 突变组织的差异均有意义。分析肝癌亚型因素,结果显示,正常肝脏组织与HCC 患者组织和HCC 患者组织与FL-HCC 患者组织的差异有意义。这些结果表示TMEM88 的表达水平在HCC 患者的所有临床病理因素中均有影响且发挥作用。
低TMEM88 表达与男性、2 级患者、3 级患者、黄种人种和不酗酒的患者较差的OS 和较差的PFS 相关,与女性、2+3 期患者、3 期患者、3+4 期患者、AJCC_T 2 级患者、AJCC_T 3 级患者和有微血管侵犯患者较差的OS 相关,与 1 期患者、1+2 期患者、白人患者、酗酒的患者、肝炎病毒患者和无肝炎病毒患者的PFS 较差相关。然而,TMEM88 表达情况与2 期患者、1 级患者或AJCC_T 1 级患者的OS 或PFS 无任何相关性。
GEPIA 数据库的基因表达分析显示,低TMEM88 表达与HCC 较差的预后相关。此外,TMEM88 表达与特定免疫细胞标志物如单核细胞标志物(CD86 和CD11b)、中性粒细胞标志物(CCR7)、肿瘤相关巨噬细胞标志物(CD68)、T 辅助细胞1 标志物(IFN-γ,STAT1,T-bet 和TNF-α)、T 辅助细胞2 标志物(STAT6)、调节性T 细胞标志物(CCR8 和TGF-β)、耗竭性T细胞(CTLA4,PD-1 和TIM-3)有密切的相关性。调节性T 细胞标志物CCR8 只在HCC 组织中表达,并未在正常组织中被发现。
TMEM88 的肿瘤抑制作用在非小细胞肺癌中得到验证[16]。由于其启动子的高度甲基化,该疾病中出现低TMEM88 表达,而高TMEM88 甲基化预示着患者的总体存活率较短[16]。此外,通过去甲基化处理,TMEM88 在非小细胞肺癌细胞中的上调显著降低了细胞增殖和侵袭[16]。在从不吸烟的患者肺腺癌细胞中也发现了低TMEM88 表达,并且TMEM88 有助于肺腺癌细胞的抗肿瘤作用[28]。
另一方面,TMEM88 也具有致癌功能。在乳腺癌、结肠癌、胃癌和肝细胞HCC 患者的肿瘤组织中检测到高TMEM88 表达[14]。TMEM88 通过促进 Snail 转录因子的表达水平加速三阴性乳腺癌的侵袭和转移[15]。TMEM88 的高表达也通过抑制紧密连接相关蛋白的表达来促进非小细胞肺癌的增殖和转移[14]。这些发现表明,TMEM88 具有加速肿瘤发展的作用。TMEM88 在肿瘤发生中的这些相反作用表明,这种蛋白质的确切功能可能是视情况而立的。因此,TMEM88 在肿瘤进展中的表达和确切作用需使用不同的肿瘤类型进一步研究。
Geng 等人的研究首次揭示了TMEM88 在甲状腺癌中的关键作用[29]。其数据表明TMEM88 在甲状腺癌中的表达较低,而TMEM88 的高表达在甲状腺癌细胞中发挥了相当大的抗肿瘤作用[29]。TMEM88 介导的抗肿瘤作用的潜在分子机制与其对甲状腺癌细胞中Wnt/β-catenin 信号传导的负调控有关[29]。其研究也证实了TMEM88 是调节Wnt/β-catenin 信号传导的关键成分,在甲状腺癌的进展中发挥重要作用[29]。TMEM88 是Wnt/β-catenin 信号传导的关键调节因子。
在肝脏组织中,有研究发现TMEM88 可以通过阻断Wnt/β-catenin 信号通路中肝星状细胞(hepatic stellate cell,HSC)的增殖和炎症抑制肝纤维化的过程[11-12]。Manka 等人的研究发现也证实了细胞外基质过度积累会导致肝纤维化[30-32],β-catenin 是一种关键的促纤维化因子,并且与多种组织纤维化的发病机制有关[33-34]。TMEM88 通过TGF-β1 刺激HSC LX-2 中的Wnt/β-catenin 信号通路来调节肝纤维化和HSC 的活跃程度[35]。不仅如此,TMEM88 通过在瘢痕组织形成过程中下调Wnt/β-catenin 信号传导来抑制瘢痕组织成纤维细胞增殖和细胞外基质表达[10]。
相关研究阐明了TMEM88 在非酒精性脂肪肝中的调节作用及其内在机制。Zhou 等的研究发现,与正常组织相比,TMEM88 在脂肪肝组织中的表达明显降低[36]。TMEM88 可能在游离脂肪酸(free fatty acid,FFA)诱导的小鼠正常肝细胞(alpha mouse liver 12,AML-12)细胞中发挥不可或缺的作用[36]。在游离脂肪酸诱导的AML-12 细胞和蛋氨酸/胆碱缺乏饮食(methionine/choline deficient diet,MCD)喂养的小鼠中,非酒精性脂肪肝中固醇调节元件结合蛋白-1c(sterol regulatory element binding protein-1c,SREBP-1c)和脂肪酸合酶(fatty acid synthase,FASN)的表达水平较高,而酰基辅酶A 氧化酶1(acyl-CoA oxidase 1,ACOX-1)和过氧化物酶体增殖物活化受体-α(peroxisome proliferator-activated receptor-α,PPAR-α)的表达水平较低[36]。体内脂质代谢细胞因子SREBP-1c、PPAR-α、脂肪酸合酶和ACOX-1 的分泌受TMEM88 的调节。此外,通过用pEGFP-C1-TMEM88 转染游离脂肪酸诱导的AML-12 细胞,脂肪酸合酶和SREBP-1c 下调,而PPAR-α 和ACOX-1 上调[36]。游离脂肪酸诱导的TMEM88 siRNA 细胞内转染可导致脂肪酸合酶和SREBP-1c 过表达,而PPAR-α 和ACOX-1 的表达降低[36]。因此,TMEM88 的基线水平细胞脂质代谢细胞因子基因的表达有相关性,它可以增加AML-12 细胞中脂质氧化细胞因子的水平,并负调节脂质合成[36]。在游离脂肪酸诱导的AML-12 细胞中,TMEM88 跨膜蛋白和Wnt/β-catenin信号通路可以相互调节细胞脂质代谢细胞因子的分泌[36]。
近年来,Gu 等人的研究发现,CC 趋化因子配体14(CCL14)基因表达水平与肝细胞癌不良预后相关[37]。CCL14 在肝癌组织中的表达水平比在正常肝组织中低,CCL14 高表达与患者较好的OS 和PFS 有关[37]。在男性、黄种人、酗酒者、无酗酒者和无肝炎病毒感染的患者中,CCL14 低表达与较差的OS 和PFS 相关[37]。在1+2 期或2级HCC 患者中,CCL14 的低表达与OS 和PFS 的恶化相关[37]。而在女性、1 级患者、血管侵犯患者和肝炎患者中,CCL14 的表达与OS 和PFS 无关[37]。此外,在观察CCL14 表达水平与免疫细胞的关系中发现,其与B 细胞、CD4+和CD8+T 细胞、巨噬细胞、中性粒细胞和树突细胞的浸润呈显著负相关[37]。CCL14 的表达还与辅助性T 细胞不同亚群标志物的表达有关,包括Th1(T-bet、STAT-1、干扰素-γ 和肿瘤坏死因子-α)、Th2(STAT6)、Tfh(IL-21) 和Tregs(CCR8、STAT5B 和转化生长因子-β)[37]。耗竭T 细胞标志物PD-1、CTLA-4 和TIM-3 表 达 与CCL14 的表达呈负相关[37]。
原发性和继发性肿瘤部位的免疫反应取决于浸润到肿瘤微环境中的不同类型的免疫细胞。不同类型免疫细胞的浸润受到各种趋化因子的严格调控,这些趋化因子调节肿瘤免疫和肿瘤的生物学表型,也影响肿瘤进展、治疗反应和预后[19-21]。
本研究结果受以下几个因素影响:首先,本研究基于从已发表文章、公共数据存储库以及与研究作者的交流中检索到的数据。因此,数据的质量会影响研究结果。其次,数据库中的样本数量不断受到监督和扩展,这可能会影响本研究的结果。第三,用于评估的数据库统计方法的准确性和选择可能会影响研究结果的解释说明。然而,本研究通过分析多个数据库获得了相似的结果,支持了本研究结论。
本研究也存在一定的局限性。首先,对TMEM88 在肿瘤中作用的研究基于Kaplan-Meier绘图仪、GEPIA 和TIMER 数据库中收录的数据。然而,本研究没有通过测试临床样本来验证这些结果。其次,数据库中一些个体肿瘤的样本量很小。第三,没有进行动物实验来证实TMEM88 在HCC 生长和进展中的作用,以及它与免疫细胞浸润到肿瘤微环境中的关系。因此,需要进一步研究验证TMEM88 在HCC 中的作用。
本研究表明TMEM88 mRNA 水平与HCC 患者的预后相关。即使肝癌细胞中的TMEM88 表达高于正常肝细胞,高TMEM88 mRNA 水平与HCC患者更好的OS、PFS 和RFS 相关。TMEM88 的表达水平,在HCC 患者的临床分期、人种、性别、年龄、体重、肝癌评级、是否有淋巴结转移、是否有TP53 突变或肝癌亚型等因素中均高于其在肝脏正常组织的表达水平。TMEM88 的下调与临床特征相关的患者预后较差有关,例如男性、黄种人、不酗酒的患者、肝癌评级2 级和3 级患者。TMEM88 是一种有潜力的独立预后生物标志物,可用于评估肿瘤组织中免疫细胞浸润的水平。HCC 中相对高水平的TMEM88 可能表明治疗后肿瘤复发的风险更大,此类患者需进行密切的医疗监督。
TMEM88 的表达贯穿所有HCC 病理分期,且在肿瘤组织跟正常肝脏组织的表达水平差异明显。此外,TMEM88 深度缺失影响肝脏组织的正常遗传功能, 没有任何异变或扩增的遗传变异情况。再者,TMEM88 在肝脏肿瘤细胞中的MCPCOUNTER 浸润情况、XCELL 浸润情况及TIDE 浸润情况均呈正相关。研究表明TMEM88在HCC 里是一种起保护作用的基因,具有能促进免疫逃逸的功能。
