HER-2低表达乳腺癌的病理特征及其对新辅助化疗的影响
2023-05-11邱献华
王 晶,王 楠,邱献华
1. 安阳市肿瘤医院外三科(河南安阳 4550001)
2. 郑州大学第一附属医院乳腺外科(郑州 450052)
乳腺癌的发病率逐渐升高,2020 年发布的全球癌症登记数据显示,乳腺癌已经成为全球发病率最高的恶性肿瘤[1]。2000 年Perou 等教授就根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、人表皮生长因子受体-2(human epidermal growth factor receptor-2,HER-2)表达情况将乳腺癌分为不同亚型,研究人员认识到,不同分子亚型对不同治疗的反应性不同[2]。近10 年来,依据不同分子亚型给予乳腺癌患者个体化治疗,乳腺癌患者的生存率也逐渐提高[1]。特别是HER-2 阳性乳腺癌,随着曲妥珠单抗逐渐应用于临床,HER-2 阳性乳腺癌患者的疾病复发风险降低40%,死亡风险降低34%[3]。既往对于HER-2 的治疗,主要聚焦在HER-2 高表达上,随着DB04 研究结果的公布,HER-2低表达患者也可以从ADC类药物中获益,这也激发了研究人员对HER-2 低表达患者的研究兴趣[4]。但关于HER-2 低表达目前研究较少,针对性治疗也较少。本文就HER-2 不同状态的临床病理特征,及其对新辅助化疗的影响进行探讨,希望能够为临床工作提供参考。
1 资料与方法
1.1 研究对象
纳入2019 年1 月至2022 年1 月安阳市肿瘤医院收治的572 例HER-2 阴性乳腺癌患者为研究对象。收集患者临床资料,包括年龄、病理特征(TNM 分期、组织学分级、Ki-67)、新辅助化疗后病理学完全缓解(pathologic complete response,pCR)率。纳入标准:①确诊为乳腺癌;②可获得完整的病理信息;③在我院完成标准治疗。排除标准:①导管内癌;②首诊IV 期乳腺癌;③同时患有其他原发恶性肿瘤;④双侧乳腺癌;⑤特殊类型的乳腺癌(如化生性癌、神经内分泌癌等)。
1.2 分组标准
穿刺确诊乳腺癌组织行免疫组化染色,根据2010 年《ASCO/CAP 乳腺癌激素受体IHC 检测指南》[5],肿瘤细胞核染色≥1%为ER/PR 阳性,肿瘤细胞核染色<1%为阴性。ER 或(和)PR 阳性记为HR 阳性,ER 和PR 均为阴性记为HR 阴性。根据《乳腺癌HER-2 检测指南(2019 版)》[6]中CerB2 蛋白在细胞膜上的染色比例和着色强度,将HER-2 表达水平定义为,0:无着色或≤10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;1+:>10%的浸润癌细胞呈现不完整的、微弱的细胞膜染色;2+:有2 种情况,第1 种为>10%的浸润癌细胞呈现弱-中等强度的完整细胞膜染色;第2 种为≤10%的浸润癌细胞呈现强而完整的细胞膜染色;3+:>10%的浸润癌细胞呈现强、完整且均匀的细胞膜染色。
HER-2 2+患者需行FISH 检测,明确HER-2基因有无扩增。HER-2 阴性定义为:HER-2 0。HER-2 低表达定义为HER-2 1+以及HER-2 2+但FISH 结果HER-2 无扩增。pCR 定义为乳腺原发灶未见癌细胞残留或仅存有导管原位癌,且淋巴结未见癌细胞浸润,即ypT0/isypN0。
1.3 统计分析
使用SPSS 26.0 软件对数据进行分析。对于定量资料,符合正态分布采用均数和标准差(±s)进行描述,组间比较采用独立样本t检验,不符合正态分布则采用中位数M[P25,P75]进行描述,组间比较采用秩和检验;对于计数资料,采用频数和百分比(n,%)进行描述,采用χ2检验或Fisher 精确概率法比较组间差异。所有检验均为双侧,以P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况
572 例HER-2 阴性患者年龄范围(27~75)岁、中位年龄为49 岁。其中,HER-2 0 患者276例(48.25%)、HER-2 1+患者179 例(31.29%)、HER-2 2+患者117 例(20.45%)。HR 阴性187 例,HER-2 低表达68 例(36.36%);HR 阳性384 例,HER-2 低表达共228 例(59.83%)。相较于三阴性乳腺癌,HR 阳性患者HER-2 低表达比例更高(59.38% vs. 36.36%,P<0.001),见表1。

表1 不同HR状态中HER-2低表达的比例(n, %)Table 1. The proportion of low HER-2 expression in different HR status (n, %)
2.2 HER-2状态与临床病理特征
HER-2 低表达组患者T3+4 比例(12.50% vs.2.54%,P<0.001)、N3 比例(12.84% vs.3.62%,P<0.001)显著高于HER-2 0 组患者,但Ki-67的高表达率较低 (31.08% vs. 52.90%,P<0.001),见表2。
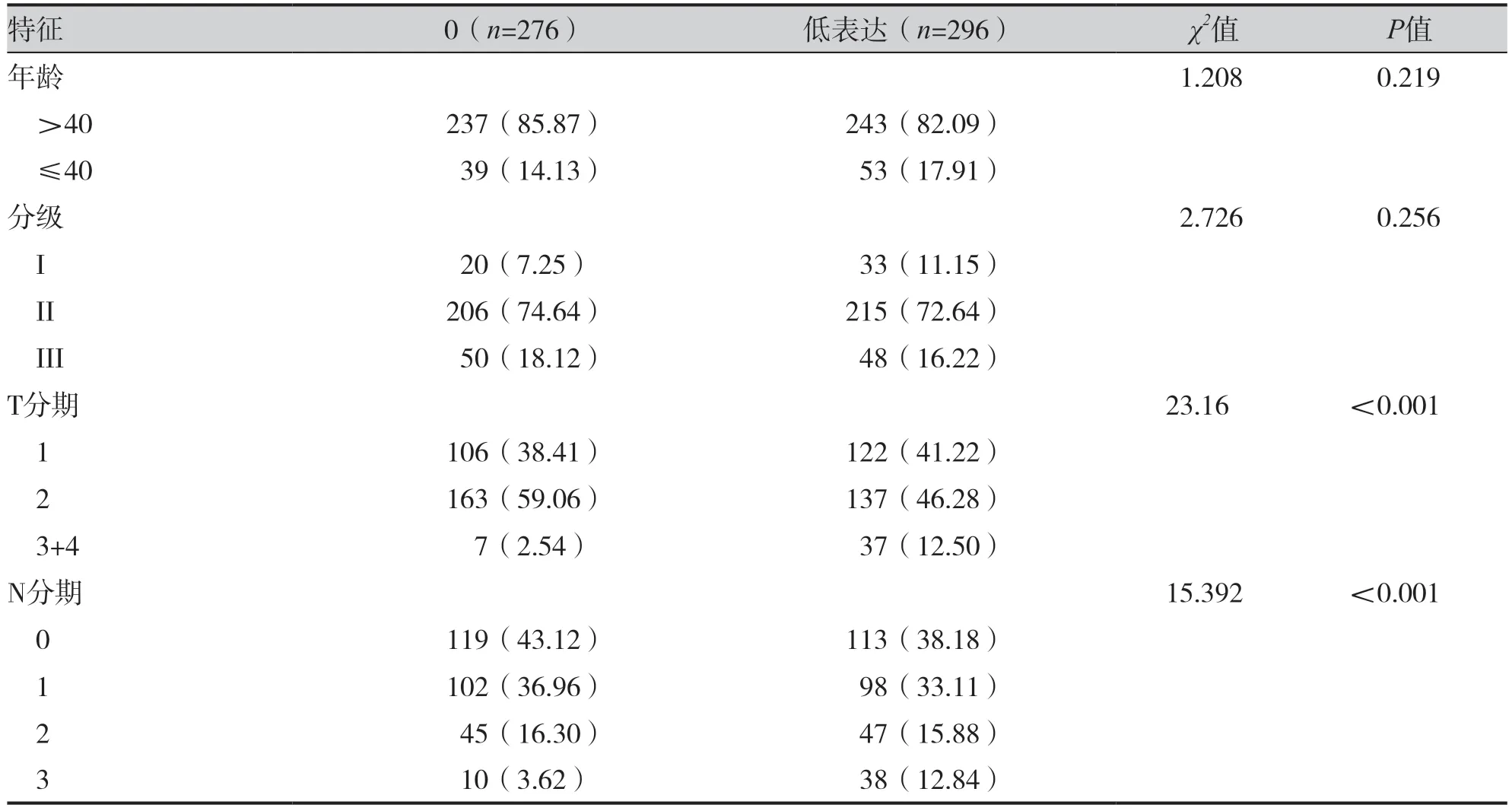
表2 HER-2状态与临床病理特征的关系(n, %)Table 2. Association between HER-2 status and clinicopathological features (n, %)

续表2
2.3 HER-2状态对新辅助化疗的影响
572 例患者中,252 例患者进行了新辅助化疗。其中,HR 阴性104 例,达到pCR 的35 例,pCR率为33.65%;HR 阳性148 例,达到pCR 的15 例,pCR 率为10.14%。
HR 阴性组pCR 的影响因素为组织学分级和Ki-67 表达值,组织学分级高、Ki-67 高表达患者新辅助化疗获得pCR 率高。HR 阳性组pCR 的影响因素为组织学分级和淋巴结转移状态,组织学分级高、临床分期早的患者新辅助化疗pCR 率高,见表3。

表3 HR-患者新辅助pCR单因素分析(n, %)Table 3. Univariate analysis of neoadjuvant pCR in HR-patients (n, %)
3 讨论
HER-2 可以形成同源二聚体,或与HER 家族其他受体形成异源二聚体,激活下游酪氨酸激酶级联信号,导致细胞的增殖、侵袭、转移。以往HER-2 的表达往往为二分法,即HER-2 阳性和HER-2 阴性。既往曲妥珠单抗在HER-2 低表达患者人群中的治疗结果显示,HER-2 低表达患者未从靶向治疗(曲妥珠单抗)中获益[7]。既往研究表明,HER-2 低表达在所有乳腺癌患者中占40%~60%[8-11],与本文研究数据一致。而 Schettini F 等统计的在HER-2 阴性患者中,HER-2 0、HER-2 1+、Her-2 2+ 的 比 例 分 别 为40.3%、40.4%、19.3%[9],与本研究的统计略有差异。这可能与每个研究中HER-2 表达判定的偏差有关,且在此之前,HER-2 0 与HER-2 1+之间没有给予严格的界定,导致分类上存在差异。Schettini F等研究结果显示,HR+患者中HER-2 低表达的比例明显高于HR-患者[9],与本文的统计一致。同时文中也提到HER-2 低表达患者有更高的T分期及更多的淋巴结受累,与Ki-67 之间无差异,与本研究略有差异。考虑本研究以穿刺病理为统计标准,临床分期做统计,但Schettini F 等统计数据中有术后病理分期。临床分期与病理分期可能存在一定差异,而且穿刺标本病理中Ki-67 与术后大体标本病理有一定差异[12]。
也有学者关注HER-2 低表达对于乳腺癌预后的影响。研究提示,HER-2 低表达可能与预后相关,但是目前结论不一致。于宏等研究显示,HER-2 低表达是三阴性乳腺癌患者术后复发或转移的危险因素,无病生存率较低[13]。Horisawal N等则发现,不管HR 状态如何,HER-2 低表达患者与HER-2 0 患者之间的预后没有明显差异[8]。张启航等研究显示,在 TNBC 患者中,HER-2 蛋白表达强度越低,预后结果越好,同时该研究也指出,HER-2 状态可能是影响三阴性乳腺癌新辅助疗效的一个指标,在TNBC 患者中,HER-2 蛋白表达强度越低,NAC 后越容易达到pCR[14]。本研究结果显示,HER-2 状态可能是新辅助化疗pCR 的一个影响因素。但由于样本量小,差异并没有统计学意义。
综上所述,HER-2 低表达状态可能是不同于HER-2 0 的一个临床病理特征,HER-2 不同的表达状态可能是影响乳腺癌新辅助化疗效果的一个因素。但本研究为回顾性分析,且样本量较小,存在局限性。未来,研究需扩大样本量,进一步探究HER-2 不同表达状态对乳腺癌治疗的影响。
